È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Protocollo per isolare il circolo di Willis mouse
In questo articolo
Riepilogo
We describe here a reproducible protocol for isolating the mouse circle of Willis.
Abstract
Il circolo cerebrale arteriosa (Circulus arterioso cerebrale) o un cerchio di Willis (COW) è una anastomosi circolatorio che circonda il chiasma ottico e l'ipotalamo che fornisce sangue al cervello e le strutture circostanti. E 'stato coinvolto in diverse malattie cerebrovascolari, tra cui angiopathy cerebrale amiloide (CAA) vasculopatie -associated, aterosclerosi intracranica e aneurismi intracranici. Gli studi dei meccanismi molecolari alla base di queste malattie per l'identificazione di nuovi bersagli farmacologici per la loro prevenzione richiedono modelli animali. Alcuni di questi modelli possono essere transgenico, mentre altri coinvolgeranno isolamento del cerebro-vascolare, compreso il metodo CoW.The qui descritto è adatto per l'isolamento mucca in qualsiasi lignaggio del mouse e ha un notevole potenziale per lo screening (espressione dei geni, produzione di proteine, modifiche delle proteine post-traduzionali, analisi secretoma, ecc) studi sui grandi vasi del cerebro del mousevascolarizzazione. Può essere utilizzato anche per studi ex vivo, adattando il sistema bagno per organi sviluppato per arterie del mouse olfattivi isolati.
Introduzione
Il circolo cerebrale arteriosa (Circulus arterioso cerebrale), noto anche come il circolo di Willis (vacca), ciclo di Willisor Willis poligono) è stato descritto da Thomas Willis nel 1664. Si tratta di una anastomosi circolatorio situata intorno al chiasma ottico e l'ipotalamo che possono essere considerato come un mozzo centrale fornitura di sangue al cervello e strutture circostanti. Il sangue entra in questa struttura tramite carotide interna e arterie vertebrali e scorre fuori dal cerchio tramite mezzo interni e arterie cerebrali posteriori. Ognuna di queste arterie è a sinistra ea destra rami su entrambi i lati del cerchio. La basilare, posta comunicare, e comunicante anteriore arterie completa il cerchio (Figura 1 e Figura 2). Il rischio di flusso di sangue alterata in qualsiasi delle arterie deflusso è minimizzato dalla fusione di sangue che entra nel cerchio dalla carotide e arterie cerebrali, garantendo così che il sangue sufficiente viene fornito al bpioggia. Tale struttura serve anche come la via principale per il flusso di sangue collaterale in gravi malattie occlusive dell'arteria carotide interna.
Diversi tipi di disturbi cerebrovascolari hanno la loro origine nella mucca. I più comuni sono angiopatia amiloide (CAA) vasculopatie -associated, aterosclerosi intracranica e aneurismi intracranici. 1, 2, 3 Questi disturbi possono portare a ipoperfusione a causa della vasodilatazione, e intracerebrali e / o subaracnoidea emorragie in ultima analisi, si traduce in ictus ischemici o emorragici o , nella migliore delle ipotesi, un attacco ischemico transitorio. I recenti progressi nelle procedure diagnostiche, tra neuroimaging, eventualmente combinato con angiografia, hanno permesso di diagnosticare tali principali malattie cerebrovascolari clinicamente, senza la necessità di una biopsia cerebrale. Tuttavia, trattamenti efficaci e specifici (farmacologici o endovascolare) sono attualmente mancano e non vi è quindi la necessità di definire nuovibersagli molecolari.
L'identificazione di nuovi bersagli farmacologici per la prevenzione di queste malattie negli esseri umani richiederà modelli animali e modi di isolare il cerebro-vascolare compresa la mucca. Tali modelli dovrebbero fornire la prova di indizi e ai cambiamenti specifici, tra cui alterazioni infiammatorie, che si verificano nelle pareti dei grandi vasi in modelli animali di aneurisma dell'arteria intracranica, CAA o aterosclerosi intracranica. 4, 5, 6
Abbiamo stabilito un metodo per l'isolamento del mouse mucca per facilitare gli studi di infiammazione dei vasi nella malattia di Alzheimer (AD) e relative patologie, come la CAA. Questo metodo per isolare la mucca mouse è stato sviluppato per la valutazione dell'espressione genica cerebrovascolare infiammatoria durante la progressione della malattia. Insieme con il rilevamento di deposizione di beta amiloide all'interno delle pareti delle arterie piale leptomeningee e, questo metodo potrebbe rendere più facile per scoraggiaremia la possibile relazione tra l'espressione genica infiammatoria nella parete cerebro-vascolare e l'accumulo A?-peptide. La rete vascolare del cervello, compreso il leptomeningeo e pial nello spazio subaracnoideo, è un'estensione delle grandi arterie che formano il cerchio di Willis. Il metodo qui descritto potrebbe essere utilizzato per isolare la mucca di qualsiasi lignaggio mouse e potrebbe essere utilizzato per tutti i tipi di controlli (ad esempio, l'espressione genica, la produzione di proteine e le modifiche delle proteine posttranslational) sui grandi vasi del mouse cerebro-vascolare.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure sono state eseguite in conformità con le normative della Comunità Europea per la cura e l'uso di animali da laboratorio, con l'approvazione del comitato etico locale per la sperimentazione animale (Ile de France-Paris-Comitato, Autorizzazione 4270).
1. Anestesia
- Infondere una dose letale di pentobarbital (fino a 1 mg / 10 g di peso corporeo) (ago calibro 27 e la siringa da 1 ml) per via intraperitoneale in topi adulti prima dell'intervento chirurgico.
2. Vessel Perfusione
NOTA: Non vi è alcuna necessità di applicare veterinario pomata per gli occhi durante la perfusione del vaso. Questa procedura è rapida (5-10 minuti) e si conclude con la morte dell'animale. Confermare la mancanza di risposta con un pizzico punta.
- Utilizzando forbici iris, fare un'incisione, lungo circa 4 cm, nella parete addominale e del peritoneo, appena sotto la gabbia toracica.
- Effettuare una piccola incisione (lunga pochi millimetri) nel diaframma e poi continue l'incisione della membrana lungo l'intera lunghezza della gabbia toracica per esporre la cavità pleurica.
- Sollevare lo sterno distanza e bloccare la punta dello sterno con il hemostat; posizionare la pinza emostatica sul collo. Rifilare con cura il tessuto adiposo che collega lo sterno al cuore.
- Passare il perfusione ago 15-gauge attraverso il ventricolo sinistro nella punta del cuore.
- Infine, usare le forbici per tagliare uno dei lobi epatici per creare una presa.
NOTA: uno sbocco alternativo può essere creato utilizzando forbici iris per creare un'incisione per l'atrio destro. - Profumato l'animale con da 25 a 50 ml di soluzione salina tamponata con fosfato (PBS) con una pompa funzionante a una velocità di 2,5 ml / min. Il fegato deve scottare come il sangue viene sostituito con PBS.
- Dopo circa cinque minuti, una volta che il fluido dal fegato è completamente chiaro, interrompere la perfusione.
- Se è prevista immunocolorazione o colorazione normale, profumato l'animale con 50 ml di paraformaldeide(PFA, 4% in PBS) per 15 min.
NOTA: Attenzione, fumi PFA sono tossici. Perfusione dell'animale con PFA deve essere eseguita in una cappa aspirante ventilata.
3. Isolamento del cervello e il circolo di Willis
- Isolamento del cervello
- Rimuovere la testa con un paio di forbici chirurgiche.
- Effettuare una incisione sulla linea mediana con forbici iris, lungo la pelle dal collo al naso.
- Tagliare la pelle per esporre il cranio e rimuovere eventuali residui dei muscoli e dei tessuti adiposi con le forbici iris.
- Posizionare la punta delle forbici iris nel foro occipitale su un lato e con cura scorrere lungo la superficie interna del cranio al meato uditivo esterno (noto anche come il canale uditivo).
- Riprodurre l'incisione descritto in 3.1.4 sul lato controlaterale e fare una linea mediana tagliare lungo la superficie interna dell'osso inter-parietale all'inizio della sutura sagittale.
- Piantare l'irideforbici in l'osso frontale, in mezzo agli occhi, nella sutura sagittale e poi aprire per dividere il cranio in due.
- Estrarre il cervello, afferrando i bulbi olfattivi e utilizzando le iris forbici per tagliare le connessioni nervose sulla sua superficie ventrale.
- Rimuovere il cervello e collocarlo in una 60 mm piastra di Petri contenente ghiacciata PBS per l'isolamento mucca. Completamente immergere il cervello in PBS. Se il cervello è stato fissato con 4% PFA (per il successivo sezionamento e immunocolorazione o colorazione normale), mantenerlo in un bagno di 4% PFA a 4 ° C per 24 ore.
- Isolamento del circolo di Willis
NOTA: è necessario un microscopio da dissezione per l'isolamento mucca. Il cervello deve essere conservato a 4 ° C durante tutta la procedura.- Mettere il cervello a testa in giù (vale a dire, sulla sua superficie dorsale) per visualizzare la mucca.
- Utilizzare una piccola pinza per afferrare le arterie cerebrali anteriori (ACA) alla base dei lobi olfattivi ( a, figura 1) ed esercitare una pressione dissociare loro dal continuum recipiente. Utilizzare la stessa procedura per tagliare le arterie cerebrale media (MCA) a B (figura 1).
- Utilizzare le estremità taglienti delle pinze per sollevare e rimuovere le principali arterie che formano la mucca dalla corteccia.
- Sollevare l'inizio delle arterie comunicante posteriore (PCA) per staccarli dal cervello, afferrando le arterie cerebrali medie (MCA) con le pinze. Raccogliete le arterie anteriore (ACA e MCA) e tirare delicatamente sopra il chiasma ottico in senso antero-dorsale. Per evitare di disturbare la mucca, interrompere la procedura per affrontare le altre arterie.
- Ripetere i punti 3.2.2 e 3.2.3 per le arterie cerebellare superiore e posteriore (SCA) / (PCA) (c, Figura 1) e per l'arteria basilare (BA) (d, Figura 1), tirando in un dorso- direzione anteriore. Arresto al termine della procedura descritta in 3.2.4.
- Rimuovere la mucca intera tirando delicatamente con le pinze. Posizionare la mucca in un 60 mm piastra di Petri pieno di ghiaccio PBS freddo e rimuovere qualsiasi tessuto cerebrale collegata rimanendo con due pinze, tenendo la mucca in posizione con piccoli perni.
- Mantenere la mucca raccolto a -80 ° C per la successiva elaborazione di purificazione dell'RNA (rese di estrazione RNA grandi quantità di RNA - circa 500 ng) o estrazione delle proteine.
Nota: la mucca può essere mantenuta ex vivo per 24 ore, adattando il sistema bagno per organi sviluppato per isolato mouse arteria olfattiva 7.

Figura 1: Schema di una ventrale Vista del cervello di topo Evidenziando la mucca La mucca è formato da due arterie carotidi interne (MCA), che sono derivati da due arterie cerebrali anteriori (ACA);. il basilaredelle arterie (BA) filiali nel posteriore (PCA) e superiore (SCA) arterie cerebrali, e due arterie vertebrali (VA).
Access restricted. Please log in or start a trial to view this content.
Risultati
Il mouse PBS-perfuso viene ucciso e la mucca è isolato come descritto nella sezione 3.2 del protocollo. Quando la dissezione viene eseguita correttamente, il vaccino deve uscire in un unico pezzo e dovrebbe essere leggermente trasparente per l'assenza di sangue residuo nel sistema vascolare.
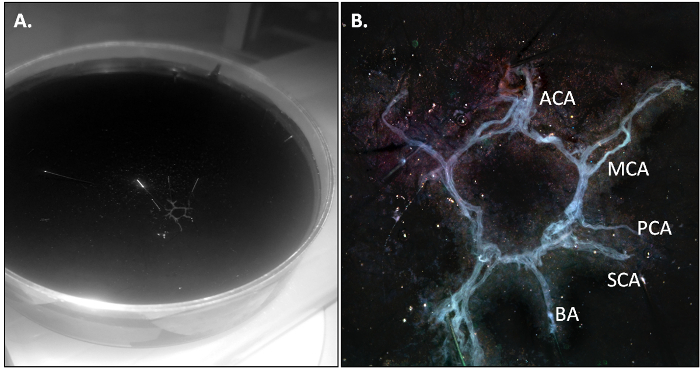
Figura 2: La mucca mouse dopo...
Access restricted. Please log in or start a trial to view this content.
Discussione
Descriviamo qui un protocollo riproducibile per l'isolamento del circolo di Willis. I disturbi cerebrovascolari più comuni che coinvolgono la mucca sono vasculopatie CAA-associata, aterosclerosi intracranica e aneurisma intracranico, i quali incidono le pareti dei vasi arteriosi. I fattori di rischio sono ben noti, ma la patogenesi molecolare di questi disturbi cerebrali rimane poco compresa e marcatori biologici specifici per predire il loro verificarsi sono carenti. Vi è un notevole interesse per i metodi per is...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Questo lavoro è stato sostenuto da Parigi VI University e una borsa di Pierre Fabre innovazione.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| Dumont #55 Forceps | Fine Science Tools | 11295-51 | |
| Hardened Fine Iris Scissors | Fine Science Tools | 14090-11 | |
| Scissors - Straight / Sharp / Sharp 16.5 cm | Fine Science Tools | 14002-16 | |
| Dumont #7b Forceps | Fine Science Tools | 11270-20 | |
| Stereoscopic Zoom Microscope | Nikon | SMZ745T | |
| CellBIND Surface 60mm Culture Dish | Corning | #3295 | |
| Peristaltic Pump - MINIPULS 3 | Gilson | M312 | |
| Pentobarbital Sodique | Ceva Santé Animale | FR/V/2770465 3/1992 |
Riferimenti
- Beckmann, N., et al. Age-dependent cerebrovascular abnormalities and blood flow disturbances in APP23 mice modeling Alzheimer's disease. J Neurosci. 23 (24), 8453-8459 (2003).
- Sadasivan, C., Fiorella, D. J., Woo, H. H., Lieber, B. B. Physical factors effecting cerebral aneurysm pathophysiology. Ann Biomed Eng. 41 (7), 1347-1365 (2013).
- Ritz, K., Denswil, N., Stam, O., van Lieshout, J., Daemen, M. Cause and mechanisms of intracranial atherosclerosis. Circulation. 130 (16), 1407-1414 (2014).
- Tulamo, R., Frösen, J., Hernesniemi, J., Niemelä, M. Inflammatory changes in the aneurysm wall: a review. J Neurointerv Surg. 2 (2), 120-130 (2009).
- Yamada, M. Cerebral amyloid angiopathy: emerging concepts. J Stroke. 17 (1), 17-30 (2015).
- Oy, B. Intracranial atherosclerotic stroke: specific focus on the metabolic syndrome and inflammation. Curr Atheroscler Rep. 8 (4), 330-336 (2006).
- Lee, H. J., Dietrich, H. H., Han, B. H., Zipfel, G. J. Development of an ex vivo model for the study of cerebrovascular function utilizing isolated mouse olfactory artery. J Korean Neurosurg Soc. 57 (1), 1-5 (2015).
- Hosaka, K., Downes, D. P., Nowicki, K. W., Hoh, B. L. Modified murine intracranial aneurysm model: aneurysm formation and rupture by elastase and hypertension. J Neurointerv Surg. 6 (6), 474-479 (2013).
- Gauthier, S. A., Sahoo, S., Jung, S. S., Levy, E. Murine cerebrovascular cells as a cell culture model for cerebral amyloid angiopathy: isolation of smooth muscle and endothelial cells from mouse brain. Methods Mol Biol. 849, 261-274 (2012).
- Choi, S., Kim, J., Kim, K., Suh, S. Isolation and in vitro culture of vascular endothelial cells from mice. Korean J Physiol Pharmacol. 19 (1), 35-42 (2015).
- Peters, D. G., Kassam, A. B., Yonas, H., O'Hare, E. H., Ferrell, R. E., Brufsky, A. M. Comprehensive transcript analysis in small quantitiesof mRNA by SAGE-Lite. Nucleic Acids Res. 27 (24), (1999).
- Badhwar, A. Stanimirovic, Hamel, & Haqqani The proteome of mouse cerebral arteries. J Cereb Blood Flow Metab. 34 (6), 1033-1046 (2014).
- Castro, L., Brito, M., et al. Striatal neurones have a specific ability to respond to phasic dopamine release. J Physiol. 591 (13), 3197-3214 (2013).
- Hübscher, D., Nikolaev, V. Generation of transgenic mice expressing FRET biosensors. Methods Mol Biol. 1294, 117-129 (2015).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon