Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Protocole pour Isoler le Cercle de souris de Willis
Dans cet article
Résumé
We describe here a reproducible protocol for isolating the mouse circle of Willis.
Résumé
Le cercle cérébral artériel (circulus artériel cérébral) ou d'un cercle de Willis (GC) est une anastomose circulatoire entourant le chiasma optique et de l'hypothalamus qui fournit le sang vers le cerveau et les structures environnantes. Il a été impliqué dans plusieurs troubles cérébro-vasculaires, y compris l'angiopathie cérébrale amyloïde (CAA) vasculopathies -Associated, l'athérosclérose et intracrânienne anévrismes intracrâniens. Les études sur les mécanismes moléculaires qui sous-tendent ces maladies pour l'identification de nouvelles cibles thérapeutiques pour leur prévention nécessitent des modèles animaux. Certains de ces modèles peuvent être transgéniques, alors que d'autres nécessiteront l'isolement du cérébro-vasculaire, y compris la méthode de CoW.The décrit ici est approprié pour l'isolement de vache dans toute lignée de souris et a un potentiel considérable pour le criblage (expression des gènes, la production de protéines, modifications des protéines post - traductionnelles, analyse sécrétome, etc.) des études sur les grands navires de la cérébro de la sourisvasculature. Il peut également être utilisé pour des études ex vivo, en adaptant le système de bain d'organe isolé développé pour les artères olfactives de la souris.
Introduction
Le cercle cérébral artériel (circulus artériel cérébral), également connu sous le cercle de Willis (GC), boucle de Willisor Willis polygone) a été décrite par Thomas Willis en 1664. Il est une anastomose circulatoire située autour du chiasma optique et de l'hypothalamus qui peut être considéré comme un moyeu central d'alimentation sanguine vers le cerveau et les structures environnantes. Le sang entre dans la structure par l'intermédiaire de la carotide interne et des artères vertébrales et il sort du cercle par le milieu intérieur et les artères cérébrales postérieures. Chacune de ces artères branches a gauche et à droite de chaque côté du cercle. Le basilaire, après communication, et communicante antérieure artères complète le cercle (figure 1 et figure 2). Le risque d'une altération de la circulation sanguine dans l'une des artères d'écoulement est minimisée par la fusion du sang entrant dans le cercle de la carotide et des artères cérébrales, garantissant ainsi que suffisamment de sang est fourni au bpluie. Cette structure est aussi la principale voie pour la circulation sanguine collatérale dans les maladies occlusives sévères de l'artère carotide interne.
Plusieurs types de troubles cérébro-vasculaires ont leur origine dans la vache. Les plus courants sont l' angiopathie cérébrale amyloïde (CAA) de vasculopathies -Associated, l' athérosclérose intracrânienne et des anévrismes intracrâniens. 1, 2, 3 Ces troubles peuvent conduire à une hypoperfusion due à la vasodilatation, et intracérébrales et / ou subarachnoïdiens hémorragies finalement traduire en accidents vasculaires cérébraux ischémiques ou hémorragiques ou , au mieux, une attaque ischémique transitoire. Des progrès récents dans les procédures de diagnostic, y compris la neuro-imagerie, éventuellement associée à une angiographie, ont permis de diagnostiquer cliniquement ces grandes maladies vasculaires cérébrales, sans la nécessité d'une biopsie du cerveau. Néanmoins, des traitements efficaces et spécifiques (pharmacologiques ou endovasculaires) font actuellement défaut et il est donc nécessaire de définir de nouvellesles cibles moléculaires.
L'identification de nouvelles cibles thérapeutiques pour la prévention de ces maladies chez les humains, il faudra des modèles animaux et les moyens de l'isolement de la cérébro-vasculaire, y compris la vache. Ces modèles devraient fournir des preuves et des indices de changements aux particuliers, y compris les changements inflammatoires, se produisant dans les parois des gros vaisseaux dans des modèles animaux de l' anévrisme de l' artère intracrânienne, CAA ou l' athérosclérose intracrânienne. 4, 5, 6
Nous avons établi une méthode d'isolement de CoW de la souris pour faciliter les études de l'inflammation des vaisseaux dans la maladie d'Alzheimer (AD) et les maladies connexes, tels que CAA. Cette méthode d'isolement de la vache souris a été mis au point pour l'évaluation de l'expression du gène vasculaire cérébral inflammatoire lors de la progression de la maladie. Avec la détection des dépôts bêta-amyloïde dans les parois des artères leptoméningés et piales, cette méthode pourrait rendre plus facile à découragermine de la relation possible entre l'expression des gènes inflammatoires dans la paroi cérébro-vasculaire et de l'accumulation peptide Aß. Le réseau vasculaire du cerveau, y compris le leptoméningée et la pie-mère dans l'espace sous-arachnoïdien est une extension des grosses artères formant le cercle de Willis. La méthode décrite ici pourrait être utilisé pour isoler la vache d'une lignée de souris et pourrait être utilisé pour tous les types de dépistage (par exemple, l' expression des gènes, la production de protéines et de modifications de protéines post - traductionnelles) sur les grands navires de la souris cérébro-vasculaire.
Protocole
Toutes les procédures ont été effectuées conformément aux normes de la Communauté européenne pour les soins et l'utilisation des animaux de laboratoire, avec l'approbation du comité d'éthique local pour l'expérimentation animale (Ile de France-Paris-Comité, Autorisation 4270).
1. Anesthésie
- Perfuser une dose létale de pentobarbital (jusqu'à 1 mg / 10 g de poids corporel) (aiguille de calibre 27 et une seringue de 1 ml) par voie intrapéritonéale à des souris adultes avant la chirurgie.
Perfusion 2. Navire
NOTE: Il n'y a pas besoin d'appliquer une pommade vétérinaire pour les yeux pendant navire perfusion. Cette procédure est rapide (5-10 minutes) et se termine à la mort de l'animal. Confirmez l'absence de réponse avec une pincée d'orteil.
- Utilisation de l'iris de ciseaux, faire une incision, d'environ 4 cm de long, dans la paroi abdominale et du péritoine, juste au-dessous de la cage thoracique.
- Faire une petite incision (quelques millimètres de long) dans le diaphragme et continue de l'incision de la membrane sur toute la longueur de la cage thoracique afin d'exposer la cavité pleurale.
- Soulevez le sternum loin et serrer la pointe du sternum avec le hémostatique; placer le hémostatique sur le cou. couper délicatement le tissu adipeux reliant le sternum au cœur.
- Passer l'aiguille de perfusion de calibre 15 à travers le ventricule gauche dans l'apex du cœur.
- Enfin, utiliser des ciseaux pour couper l'un des lobes du foie pour créer une prise.
NOTE: Une sortie alternative peut être créée en utilisant l'iris de ciseaux pour créer une incision à l'oreillette droite. - Perfuser l'animal avec 25 à 50 ml de solution saline tamponnée au phosphate (PBS) avec une pompe fonctionnant à un débit de 2,5 ml / min. Le foie doit blanch que le sang est remplacé par PBS.
- Après environ cinq minutes, une fois que le fluide à partir du foie est tout à fait clair, arrêter la perfusion.
- Si immunocoloration ou coloration régulière est prévue, perfuser l'animal avec 50 ml de paraformaldehyde(PFA; 4% dans du PBS) pendant 15 min.
NOTE: Attention, les fumées PFA sont toxiques. La perfusion de l'animal avec le PFA doit être effectuée dans une hotte ventilée.
3. Isolement du cerveau et le Cercle de Willis
- L' isolement du cerveau
- Retirez la tête avec une paire de ciseaux chirurgicaux.
- Faire une incision médiane avec iris ciseaux, le long de la peau du cou pour le nez.
- Coupez la peau pour exposer le crâne et supprimer tous les muscles résiduels et les tissus adipeux avec des ciseaux de l'iris.
- Placer l'extrémité pointue de l'iris ciseaux dans le trou occipital d'un côté et les faire glisser soigneusement le long de la surface interne du crâne du conduit auditif externe (également connu sous le canal auditif).
- Reproduire l'incision décrite dans 3.1.4 sur le côté controlatéral et de faire une ligne médiane coupe le long de la surface interne de l'os inter-pariétal au début de la suture sagittale.
- Plantez les irisciseaux dans l'os frontal, entre les deux yeux, dans la suture sagittale, puis les ouvrir à diviser le crâne en deux.
- Soulever le cerveau, en saisissant les bulbes olfactifs et en utilisant les iris ciseaux pour couper les connexions nerveuses sur sa surface ventrale.
- Retirez le cerveau et le placer dans une boîte de Pétri de 60 mm contenant du PBS glacé pour l'isolement de vache. Immerger complètement le cerveau dans le PBS. Si le cerveau a été fixé à 4% PFA (pour la coupe ultérieure et immunocoloration ou coloration régulière), gardez-le dans un bain de 4% PFA à 4 ° C pendant 24 heures.
- L' isolement du cercle de Willis
REMARQUE: Un microscope à dissection est nécessaire pour l'isolement de vache. Le cerveau doit être conservé à 4 ° C pendant toute la procédure.- Mettez le cerveau à l' envers (ie, sur sa surface dorsale) pour visualiser la vache.
- Utilisez une petite pince pour saisir les artères cérébrales antérieures (ACA) à la base des lobes olfactifs ( a, Figure 1) et exercer une pression pour les dissocier du continuum des navires. Utilisez la même procédure pour couper les artères cérébrales moyennes (MCA) dans b (figure 1).
- Utilisez les extrémités pointues de la pince pour soulever et retirer les artères principales qui forment le CoW du cortex.
- Soulevez le début des postérieurs artères communicantes (PCA) afin de les déconnecter du cerveau, en saisissant les artères cérébrales moyennes (MCA) avec la pince. Ramassez les artères antérieures (ACA et MCA) et tirez-les doucement sur le chiasma optique dans une direction antéro-dorsale. Pour éviter la perturbation de la vache, interrompre le la procédure de traitement avec les autres artères.
- Répéter les étapes 3.2.2 et 3.2.3 pour les artères cérébelleuses supérieure et postérieure (SCA) / (APC) (c, figure 1) et de l'artère basilaire (BA) (d, figure 1), en les tirant dans une dorso direction antérieure. S'arrêter à la fin de la procédure décrite in 3.2.4.
- Retirer l'ensemble CoW en tirant doucement avec la pince. Placez la vache dans un plat de 60 mm de Pétri remplie de PBS glacé et enlever tout tissu cérébral fixé restant avec deux pinces, tenant la vache en place avec de petites épingles.
- Maintenir la CoW récoltées à -80 ° C pour un traitement ultérieur pour la purification de l'ARN (des rendements d'extraction de l'ARN des grandes quantités d'ARN - environ 500 ng) ou de l'extraction des protéines.
Remarque: La vache peut être maintenue ex vivo pendant 24 heures, en adaptant le système de bain d'organe développé pour la souris isolée artère olfactive 7.

Figure 1: Diagramme schématique d'une vue ventrale du cerveau de souris Soulignant la vache La vache est formée à partir des deux artères carotides internes (MCA), qui sont dérivés des deux artères cérébrales antérieures (ACA);. basilaireartère (BA) branches dans la partie postérieure (PCA) et supérieur (SCA) artères cérébrales, et deux artères vertébrales (VA).
Résultats
La souris PBS-perfusé est tué et la vache est isolé comme décrit dans la section 3.2 du protocole. Lorsque la dissection est effectuée correctement, la vache doit sortir en un seul morceau et devrait être légèrement transparent en raison de l'absence de sang résiduel dans le système vasculaire.
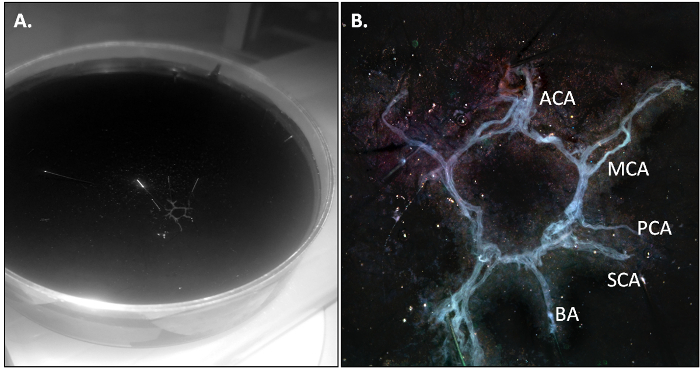
Figure 2: La vach...
Discussion
Nous décrivons ici un protocole reproductible pour l'isolement du cercle de Willis. Les troubles cérébro-vasculaires les plus courantes impliquant la vache sont vasculopathies CAA-associée, l'athérosclérose intracrânienne et anévrisme intracrânien, tous qui affectent les parois des vaisseaux artériels. Les facteurs de risque sont bien connus, mais la pathogenèse moléculaire de ces troubles cérébraux reste mal comprise et des marqueurs biologiques spécifiques pour prédire leur occurrence font déf...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Ce travail a été soutenu par l'Université Paris VI et une subvention Pierre Fabre Innovation.
matériels
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| Dumont #55 Forceps | Fine Science Tools | 11295-51 | |
| Hardened Fine Iris Scissors | Fine Science Tools | 14090-11 | |
| Scissors - Straight / Sharp / Sharp 16.5 cm | Fine Science Tools | 14002-16 | |
| Dumont #7b Forceps | Fine Science Tools | 11270-20 | |
| Stereoscopic Zoom Microscope | Nikon | SMZ745T | |
| CellBIND Surface 60mm Culture Dish | Corning | #3295 | |
| Peristaltic Pump - MINIPULS 3 | Gilson | M312 | |
| Pentobarbital Sodique | Ceva Santé Animale | FR/V/2770465 3/1992 |
Références
- Beckmann, N., et al. Age-dependent cerebrovascular abnormalities and blood flow disturbances in APP23 mice modeling Alzheimer's disease. J Neurosci. 23 (24), 8453-8459 (2003).
- Sadasivan, C., Fiorella, D. J., Woo, H. H., Lieber, B. B. Physical factors effecting cerebral aneurysm pathophysiology. Ann Biomed Eng. 41 (7), 1347-1365 (2013).
- Ritz, K., Denswil, N., Stam, O., van Lieshout, J., Daemen, M. Cause and mechanisms of intracranial atherosclerosis. Circulation. 130 (16), 1407-1414 (2014).
- Tulamo, R., Frösen, J., Hernesniemi, J., Niemelä, M. Inflammatory changes in the aneurysm wall: a review. J Neurointerv Surg. 2 (2), 120-130 (2009).
- Yamada, M. Cerebral amyloid angiopathy: emerging concepts. J Stroke. 17 (1), 17-30 (2015).
- Oy, B. Intracranial atherosclerotic stroke: specific focus on the metabolic syndrome and inflammation. Curr Atheroscler Rep. 8 (4), 330-336 (2006).
- Lee, H. J., Dietrich, H. H., Han, B. H., Zipfel, G. J. Development of an ex vivo model for the study of cerebrovascular function utilizing isolated mouse olfactory artery. J Korean Neurosurg Soc. 57 (1), 1-5 (2015).
- Hosaka, K., Downes, D. P., Nowicki, K. W., Hoh, B. L. Modified murine intracranial aneurysm model: aneurysm formation and rupture by elastase and hypertension. J Neurointerv Surg. 6 (6), 474-479 (2013).
- Gauthier, S. A., Sahoo, S., Jung, S. S., Levy, E. Murine cerebrovascular cells as a cell culture model for cerebral amyloid angiopathy: isolation of smooth muscle and endothelial cells from mouse brain. Methods Mol Biol. 849, 261-274 (2012).
- Choi, S., Kim, J., Kim, K., Suh, S. Isolation and in vitro culture of vascular endothelial cells from mice. Korean J Physiol Pharmacol. 19 (1), 35-42 (2015).
- Peters, D. G., Kassam, A. B., Yonas, H., O'Hare, E. H., Ferrell, R. E., Brufsky, A. M. Comprehensive transcript analysis in small quantitiesof mRNA by SAGE-Lite. Nucleic Acids Res. 27 (24), (1999).
- Badhwar, A. Stanimirovic, Hamel, & Haqqani The proteome of mouse cerebral arteries. J Cereb Blood Flow Metab. 34 (6), 1033-1046 (2014).
- Castro, L., Brito, M., et al. Striatal neurones have a specific ability to respond to phasic dopamine release. J Physiol. 591 (13), 3197-3214 (2013).
- Hübscher, D., Nikolaev, V. Generation of transgenic mice expressing FRET biosensors. Methods Mol Biol. 1294, 117-129 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon