É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Protocolo para isolar o mouse Círculo de Willis
Neste Artigo
Resumo
We describe here a reproducible protocol for isolating the mouse circle of Willis.
Resumo
O círculo arterial cerebral (circulus arterial cerebral) ou círculo de Willis (vaca) é uma anastomose circulatório em torno do quiasma óptico e no hipotálamo que fornece sangue para o cérebro e estruturas adjacentes. Ele tem sido implicada em várias doenças cerebrovasculares, incluindo angiopatia amilóide cerebral (CAA) -associated vasculopatias, aterosclerose intracraniana e aneurismas intracranianos. Estudos de mecanismos moleculares subjacentes a estas doenças para a identificação de novos alvos de drogas para a sua prevenção requerem modelos animais. Alguns destes modelos podem ser transgénico, enquanto que outros envolvem o isolamento do cerebro-vascular, incluindo o método CoW.The aqui descrito é adequado para o isolamento de vaca em qualquer linhagem do rato e tem um potencial considerável para o rastreio (a expressão de genes, a produção de proteína, modificações pós-traducionais de proteínas, análise secretome, etc.) estudos sobre os grandes vasos do cerebrospinal do ratovasculatura. Ele também pode ser usado para estudos ex vivo, mediante a adaptação do sistema de banho do órgão desenvolvido para artérias rato isolados olfactivos.
Introdução
O círculo arterial cerebral (circulus arterial cerebral), também conhecido como o círculo de Willis (vaca), alça de Willisor Willis polígono) foi descrita pela primeira vez por Thomas Willis em 1664. É uma anastomose circulatório localizados ao redor do quiasma óptico e no hipotálamo que pode ser considerado como um hub central fornecimento de sangue para o cérebro e estruturas circundantes. Sangue entra esta estrutura através da carótida interna e artérias vertebrais e flui para fora do círculo através do meio interior e as artérias cerebrais posteriores. Cada um destes ramos tem artérias esquerda e direita de cada lado do circulo. O basilar, pós comunicação, e comunicante anterior artérias completa o círculo (Figura 1 e Figura 2). O risco de fluxo de sangue deficiente em qualquer das artérias de escoamento é minimizado pela fusão de sangue que entra no círculo da carótida e artérias cerebrais, garantindo assim que o sangue suficiente seja fornecido ao bchuva. Essa estrutura também serve como a principal via para o fluxo sanguíneo colateral em doenças oclusivas graves da artéria carótida interna.
Vários tipos de doenças cerebrovasculares têm a sua origem na vaca. Os mais comuns são angiopatia amilóide cerebral (CAA) vasculopatias -associated, aterosclerose intracraniana e aneurismas intracranianos. 1, 2, 3 Esses distúrbios podem levar a hipoperfusão devido à vasodilatação e intracerebrais e / ou subaracnóidea hemorragias em última análise, traduzindo-se em acidente vascular cerebral isquêmico ou hemorrágico ou , na melhor das hipóteses, um ataque isquêmico transitório. Recentes avanços em procedimentos de diagnóstico, incluindo neuroimagem, possivelmente combinado com angiografia, tornaram possível para diagnosticar estas importantes doenças cerebrovasculares clinicamente, sem a necessidade de uma biópsia do cérebro. No entanto, os tratamentos eficazes e específicos (farmacológicas ou endovasculares) são actualmente não existe e não existe, portanto, uma necessidade de definir novosalvos moleculares.
A identificação de novos alvos de drogas para a prevenção dessas doenças em seres humanos vai exigir modelos animais e modos de isolamento do cerebro-vascular incluindo a vaca. Tais modelos devem fornecer provas de e pistas para as mudanças específicas, incluindo alterações inflamatórias, que ocorrem nas paredes dos vasos grandes em modelos animais de aneurisma da artéria intracraniana, CAA ou aterosclerose intracraniana. 4, 5, 6
Nós estabelecemos um método para o isolamento do mouse vaca para facilitar os estudos de inflamação dos vasos na doença de Alzheimer (DA) e doenças relacionadas, tais como CAA. Este método para isolar a vaca rato foi desenvolvida para a avaliação da expressão do gene vascular cerebral durante a progressão da doença inflamatória. Juntamente com a detecção da deposição de amilóide beta dentro das paredes das artérias e leptomeníngeas piais, este método pode tornar mais fácil para dissuadirmina a possível relação entre a expressão do gene inflamatório na parede do cerebro-vascular e acumulação de Ap-péptido. A rede vascular do cérebro, incluindo o leptomeníngea e pial no espaço subaracnóide, é uma extensão das grandes artérias que formam o polígono de Willis. O método aqui descrito pode ser utilizado para isolar a vaca de qualquer linhagem do rato e poderia ser utilizado para todos os tipos de rastreio (por exemplo, a expressão do gene, a produção de proteínas e modificações pós-tradução de proteínas) sobre os grandes vasos do rato cerebro-vascular.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os procedimentos foram realizados de acordo com as normas da Comunidade Europeia para o cuidado e uso de animais de laboratório, com a aprovação do comitê de ética local para experimentação animal (Ile de France-Paris-Comitê, Autorização 4270).
1. Anestesia
- Infundir uma dose letal de pentobarbital (até 1 mg / 10 g de peso corporal) (agulha de calibre 27 e seringa de 1 ml) por via intraperitoneal em ratinhos adultos antes da cirurgia.
Perfusão 2. Vessel
NOTA: Não há necessidade de aplicar vet pomada para os olhos durante a perfusão navio. Este procedimento é rápido (5-10 minutos) e termina na morte do animal. Confirmar a falta de resposta com uma pitada dedo do pé.
- Usando íris tesouras, fazer uma incisão, de cerca de 4 cm de comprimento, na parede abdominal e peritônio, logo abaixo da caixa torácica.
- Fazer uma pequena incisão (alguns milímetros de comprimento) no diafragma e, em seguida, continue a incisão do diafragma ao longo de todo o comprimento da caixa torácica para expor a cavidade pleural.
- Levante o esterno de distância e apertar a ponta do esterno com a pinça hemostática; colocar a pinça hemostática no pescoço. Cuidadosamente cortar o tecido adiposo que liga o esterno para o coração.
- Passar a perfusão agulha de calibre 15 através do ventrículo esquerdo para o vértice do coração.
- Finalmente, utilize uma tesoura para cortar um dos lóbulos do fígado para criar uma saída.
NOTA: Uma tomada alternativa pode ser criado usando íris tesouras para criar uma incisão no átrio direito. - Perfundir o animal com 25 a 50 ml de solução salina tamponada com fosfato (PBS) com uma bomba que opera a uma velocidade de 2,5 ml / min. O fígado deve blanch como o sangue é substituído por PBS.
- Depois de aproximadamente cinco minutos, uma vez que o fluido a partir do fígado é completamente claro, parar a perfusão.
- Se imunocoloração ou coloração regular é planejado, perfundir o animal com 50 ml de paraformaldeído(PFA; 4% em PBS) durante 15 min.
NOTA: Cuidado, fumos PFA são tóxicos. Perfusão do animal com PFA deve ser levada a cabo numa hotte ventilada.
3. O isolamento do cérebro e do Círculo de Willis
- O isolamento do cérebro
- Retire a cabeça com um par de tesouras cirúrgicas.
- Faça uma incisão na linha média com íris tesouras, ao longo da pele do pescoço até o nariz.
- Aparar a pele para expor o crânio e remova todos os músculos residuais e tecidos adiposos com tesoura de íris.
- Colocar a ponta da íris tesouras para o buraco occipital de um lado e deslize-as cuidadosamente ao longo da superfície interna do crânio para o meato auditivo externo (também conhecida como o canal do ouvido).
- Reproduzir a incisão descrito em 3.1.4 no lado contralateral e fazer um corte na linha média ao longo da superfície interna do osso inter-parietal para o início da sutura sagital.
- Plantar a íristesouras no osso frontal, bem entre os olhos, na sutura sagital e, em seguida, abri-los para dividir o crânio em dois.
- Levante o cérebro, agarrando os bulbos olfatórios e usando as íris tesoura para cortar as conexões nervosas em sua superfície ventral.
- Remover o cérebro e colocá-lo em um prato de 60 mm de Petri contendo PBS gelado para o isolamento de vaca. Mergulhe completamente o cérebro na PBS. Se o cérebro foi fixada com PFA a 4% (para corte subsequente e imunocoloração ou coloração normal), mantê-lo em um banho de PFA a 4% a 4 ° C durante 24 h.
- O isolamento do círculo de Willis
NOTA: Um microscópio de dissecação é necessária para o isolamento de vaca. O cérebro deve ser mantida a 4 ° C ao longo de todo o procedimento.- Coloque o cérebro de cabeça para baixo (ou seja, em sua superfície dorsal) para visualizar a vaca.
- Use uma pequena pinça para agarrar as artérias cerebrais anteriores (ACA) na base dos lobos olfativos ( A, Figura 1) e exercer pressão para dissociar-los a partir do vaso contínuo. Use o mesmo procedimento para cortar as artérias cerebral média (MCA) em b (Figura 1).
- Use as pontas afiadas das pinças para levantar e remover as principais artérias que formam a vaca do córtex.
- Levante-se o início das artérias comunicantes posteriores (PCA) para desligá-los a partir do cérebro, segurando nas artérias cerebrais médias (MCA) com a pinça. Pegar as artérias anteriores (ACA e MCA) e puxe-os delicadamente sobre o quiasma no sentido ântero-dorsal. Para evitar a interrupção da vaca, interromper o procedimento a lidar com as outras artérias.
- Repita os passos 3.2.2 e 3.2.3 para as artérias cerebelar superior e posterior (SCA) / (APC) (C, figura 1) e para a artéria basilar (BA) (d, Figura 1), puxando-os em um dorso- direcção anterior. Parar no final do procedimento descrito In 3.2.4.
- Remova toda a vaca puxando suavemente com a pinça. Coloque a vaca em um 60-mm placa de Petri com PBS gelado e remover qualquer tecido cerebral ligada restante com duas pinças, segurando a vaca no lugar com pequenos pinos.
- Mantenha a vaca colhida a -80 ° C para posterior processamento para purificação de RNA (rendimentos de extração de RNA grandes quantidades de RNA - cerca de 500 ng) ou extração de proteínas.
Nota: A vaca pode ser mantida ex vivo, durante 24 horas, através da adaptação do sistema de banho de órgãos desenvolvido para artéria olfativa isolado do rato 7.

Figura 1: Diagrama esquemático de um Ventral View of the Mouse Cérebro Destacando a vaca a vaca é formada a partir das duas artérias carótidas internas (MCA), que são derivadas das duas artérias cerebrais anteriores (ACA);. o basilararteriais (BA) ramifica na posterior (PCA) e superior (SCA) artérias cerebrais, e duas artérias vertebrais (VA).
Access restricted. Please log in or start a trial to view this content.
Resultados
O mouse PBS-perfusão é morto ea vaca é isolada como descrito no ponto 3.2 do protocolo. Quando a dissecção é realizada corretamente, a vaca deve sair em uma parte e deve ser ligeiramente transparente, devido à ausência de sangue residual na vasculatura.
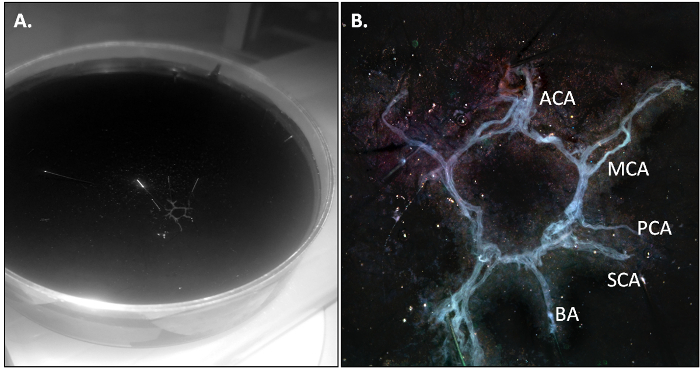
Figura 2: A vaca mouse após o isolamento. (A) Resumo da...
Access restricted. Please log in or start a trial to view this content.
Discussão
Descrevemos aqui um protocolo reprodutível para o isolamento do círculo de Willis. As doenças cerebrovasculares mais comuns que envolvem a vaca são vasculopatias associadas à CAA, aterosclerose intracraniana e aneurisma intracraniano, todos os quais afectam as paredes dos vasos arteriais. Os fatores de risco são bem conhecidos, mas a patogênese molecular desses distúrbios cerebrais permanece mal compreendido e marcadores biológicos específicos para prever sua ocorrência faltam. Há um grande interesse em mét...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors have nothing to disclose.
Agradecimentos
Este trabalho foi apoiado pelo VI Universidade Paris e uma bolsa Pierre Fabre Inovação.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| Dumont #55 Forceps | Fine Science Tools | 11295-51 | |
| Hardened Fine Iris Scissors | Fine Science Tools | 14090-11 | |
| Scissors - Straight / Sharp / Sharp 16.5 cm | Fine Science Tools | 14002-16 | |
| Dumont #7b Forceps | Fine Science Tools | 11270-20 | |
| Stereoscopic Zoom Microscope | Nikon | SMZ745T | |
| CellBIND Surface 60mm Culture Dish | Corning | #3295 | |
| Peristaltic Pump - MINIPULS 3 | Gilson | M312 | |
| Pentobarbital Sodique | Ceva Santé Animale | FR/V/2770465 3/1992 |
Referências
- Beckmann, N., et al. Age-dependent cerebrovascular abnormalities and blood flow disturbances in APP23 mice modeling Alzheimer's disease. J Neurosci. 23 (24), 8453-8459 (2003).
- Sadasivan, C., Fiorella, D. J., Woo, H. H., Lieber, B. B. Physical factors effecting cerebral aneurysm pathophysiology. Ann Biomed Eng. 41 (7), 1347-1365 (2013).
- Ritz, K., Denswil, N., Stam, O., van Lieshout, J., Daemen, M. Cause and mechanisms of intracranial atherosclerosis. Circulation. 130 (16), 1407-1414 (2014).
- Tulamo, R., Frösen, J., Hernesniemi, J., Niemelä, M. Inflammatory changes in the aneurysm wall: a review. J Neurointerv Surg. 2 (2), 120-130 (2009).
- Yamada, M. Cerebral amyloid angiopathy: emerging concepts. J Stroke. 17 (1), 17-30 (2015).
- Oy, B. Intracranial atherosclerotic stroke: specific focus on the metabolic syndrome and inflammation. Curr Atheroscler Rep. 8 (4), 330-336 (2006).
- Lee, H. J., Dietrich, H. H., Han, B. H., Zipfel, G. J. Development of an ex vivo model for the study of cerebrovascular function utilizing isolated mouse olfactory artery. J Korean Neurosurg Soc. 57 (1), 1-5 (2015).
- Hosaka, K., Downes, D. P., Nowicki, K. W., Hoh, B. L. Modified murine intracranial aneurysm model: aneurysm formation and rupture by elastase and hypertension. J Neurointerv Surg. 6 (6), 474-479 (2013).
- Gauthier, S. A., Sahoo, S., Jung, S. S., Levy, E. Murine cerebrovascular cells as a cell culture model for cerebral amyloid angiopathy: isolation of smooth muscle and endothelial cells from mouse brain. Methods Mol Biol. 849, 261-274 (2012).
- Choi, S., Kim, J., Kim, K., Suh, S. Isolation and in vitro culture of vascular endothelial cells from mice. Korean J Physiol Pharmacol. 19 (1), 35-42 (2015).
- Peters, D. G., Kassam, A. B., Yonas, H., O'Hare, E. H., Ferrell, R. E., Brufsky, A. M. Comprehensive transcript analysis in small quantitiesof mRNA by SAGE-Lite. Nucleic Acids Res. 27 (24), (1999).
- Badhwar, A. Stanimirovic, Hamel, & Haqqani The proteome of mouse cerebral arteries. J Cereb Blood Flow Metab. 34 (6), 1033-1046 (2014).
- Castro, L., Brito, M., et al. Striatal neurones have a specific ability to respond to phasic dopamine release. J Physiol. 591 (13), 3197-3214 (2013).
- Hübscher, D., Nikolaev, V. Generation of transgenic mice expressing FRET biosensors. Methods Mol Biol. 1294, 117-129 (2015).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados