Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un mecanismo basado en la rueda de funcionamiento innovador para mejorar el rendimiento de formación de la rata
En este artículo
Resumen
Este estudio presenta un innovador sistema de movilidad de los animales a base de rueda para correr para cuantificar una actividad de ejercicio efectivo en ratas. Un banco de pruebas de rata está construido, utilizando una curva de aceleración predefinida de adaptación, y una alta correlación entre el tipo de ejercicio efectivo y el volumen del infarto sugiere el potencial del protocolo para los experimentos de prevención del accidente cerebrovascular.
Resumen
Este estudio presenta un sistema de movilidad animal, equipado con una rueda de posicionamiento de rodadura (PRW), como una manera de cuantificar la eficacia de una actividad de ejercicio para reducir la gravedad de los efectos de la apoplejía en ratas. Este sistema proporciona el entrenamiento físico de los animales más eficaz que los sistemas disponibles comercialmente, tales como cintas de correr y ruedas de rodadura motorizados (MRWs). En contraste con un MRW que sólo pueden alcanzar velocidades por debajo de 20 m / min, las ratas se les permite funcionar a una velocidad estable de 30 m / min en una pista más amplia y caucho en marcha de alta densidad con el apoyo de un 15 cm de ancho rueda de acrílico con un diámetro de 55 cm de este trabajo. Usando una curva de aceleración predefinida de adaptación, el sistema no sólo reduce el error del operador, sino también entrena a las ratas para ejecutar persistentemente hasta que se alcanza una intensidad especificada. Como una manera de evaluar la eficacia del ejercicio, posición en tiempo real de una rata es detectada por cuatro pares de sensores infrarrojos desplegados en la rueda en marcha. una vez que unacurva de aceleración adaptable se inicia utilizando un microcontrolador, los datos obtenidos por los sensores de infrarrojos se registran y analizan de forma automática en un ordenador. A efectos de comparación, la formación 3 semanas se lleva a cabo en ratas utilizando una cinta de correr, una MRW y un PRW. Después de inducir quirúrgicamente oclusión de la arteria cerebral media (MCAO), se llevaron a cabo las puntuaciones de gravedad modificados neurológicos (MNSS) y una prueba de plano inclinado para evaluar los daños neurológicos a las ratas. PRW se valida experimentalmente como el más eficaz entre dichos sistemas de movilidad de los animales. Además, una medida de la eficacia del ejercicio, sobre la base de análisis de posición rata, mostró que hay una alta correlación negativa entre el ejercicio efectivo y el volumen del infarto, y se puede emplear para cuantificar una formación de rata en cualquier tipo de experimentos de reducción de daños cerebrales.
Introducción
Existen trazos de forma continua como una carga financiera a los países a nivel mundial, dejando un sinnúmero de pacientes discapacitados físicos y psíquicos 1, 2. Existe evidencia clínica que sugiera que el ejercicio regular puede mejorar la regeneración nerviosa y fortalecer las conexiones neuronales 3, 4, y también se muestra que el ejercicio puede disminuir el riesgo de sufrir accidentes cerebrovasculares isquémicos 5. Ya sea con una cinta rodante o una rueda para correr como un sistema de entrenamiento físico, roedores, tales como ratas, servir como un proxy para los seres humanos para probar la eficacia de los ejercicios en una gran mayoría de los experimentos clínicos 6 - 8. Un sistema de formación implica normalmente la formación de una rata durante un cierto período de tiempo, durante el cual una rata funciona a una cierta velocidad. Por lo tanto, la intensidad del entrenamiento generalmente se calcula en función de la velocidad y duración del ejercicio 6 - 8. El mismo enfoque se aplica aestimar la cantidad de ejercicio necesario para la protección neurofisiológica. Sin embargo, los ejercicios experimentales se encuentran a veces ser ineficaces, tales como cuando un traspiés de rata, caídas o agarra los carriles una vez que son capaces de ponerse al día con la velocidad de rueda de rodadura 9-11. Huelga decir que los incidentes de ejercicio ineficaces reducen significativamente el beneficio del ejercicio. A pesar de que no existe ningún método universalmente aceptado actualmente para cuantificar los ejercicios eficaces para reducir el daño cerebral, el nivel de ejercicios eficaces sigue en pie como una valoración objetiva de los investigadores clínicos para ilustrar los beneficios del ejercicio en la disciplina de la neurofisiología.
Existe una serie de limitaciones en los sistemas de movilidad animales disponibles comercialmente utilizados en los experimentos de reducción de daño cerebral de hoy 12. En un caso cinta de correr, las ratas se ven obligados a ejecutar por medio de descargas eléctricas, induciendo tremenda psicológicade sufrimiento del animal y por lo tanto la interferencia en la prueba neurofisiológica los resultados finales 8, 13, 14. ruedas de rodadura se pueden clasificar en dos tipos, a saber voluntarios y forzosos. Con ruedas de rodamiento voluntarias permiten que las ratas se ejecuten de forma natural, creando excesiva variabilidad debida a las diferencias en las características físicas y capacidades 15 de las ratas, mientras que las ruedas que funcionan con motor (MRWs) emplean un motor para girar el volante, obligando a las ratas para correr. A pesar de ser también una forma de entrenamiento forzado, MRWs impone menos estrés psicológico en ratas que cintas de correr 13, 16, 17. Sin embargo, los experimentos utilizando MRWs han informado de que las ratas a veces interrumpen el ejercicio por el acaparamiento de los carriles en la pista de la rueda y se niega a funcionar a velocidades superiores a 20 m / min 9. Estos ejemplos muestran que los sistemas de movilidad de los animales disponibles en la actualidad tienen una desventaja inherente que inhibe el ejercicio efectivo. porcon fines de formación de rata objetivos, el desarrollo de un sistema de entrenamiento muy eficaz pero con baja interferencia es, por tanto, considerarse como un tema urgente para los experimentos neurofisiológicos de ejercicio.
Este estudio presenta un sistema de rueda de funcionamiento altamente eficaz para los experimentos en la reducción de la gravedad de los efectos de la carrera 11. Además de un número reducido de factores de interferencia durante un proceso de formación, este sistema detecta la posición de funcionamiento de una rata usando sensores infrarrojos incorporados en la rueda, lo que se consigue una estimación más fiable de la actividad de ejercicio efectivo. El estrés psicológico impuesto por cintas tradicionales y las interrupciones frecuentes de ejercicio en MRWs tanto sesgar la objetividad de las estimaciones resultantes de ejercicio. Un sistema de rueda de posicionamiento de rodadura (PRW) presentado en este estudio se desarrolló en un intento de reducir al mínimo la interferencia no deseada al tiempo que proporciona un modelo de formación fiable para cuantificar exe eficazrcise.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Declaración de Ética: Los procedimientos experimentales fueron aprobados por el comité de ética animal de la Universidad del Sur de Taiwán de Ciencia y Tecnología de Laboratorio Animal Center, Consejo Nacional de Ciencia, República de China (Tainan, Taiwan).
1. La construcción de la estructura de la rueda de reproducción
Nota: Todas las acrílico debe ser transparente. Lavar la rueda desmontada con agua, a continuación, utilizar alcohol para limpiar la pista de goma y hojas de acrílico después de cada uso.
- Obtener una rueda para correr acrílico para tener 55 cm de diámetro y 15 cm de ancho.
NOTA: Esta rueda es mayor que una rueda tradicional de funcionamiento (diámetro = 35 cm; anchura = 12 cm) (F igura 1A). - El uso de un cortador, cortar una abertura de cuarto de círculo en un lado de la rueda de rodadura para actuar como una entrada y una salida, así como para las ratas (Figura 1B). Coloque una capa de cadenas de caucho de alta fricción en el interior de la acrrueda ílico (Figura 1B).
- Coloque una barra de hierro con rodamientos para conectar la rueda de funcionamiento (Figura 1B). Coloque dos columnas triangulares acrílico en ambos lados de la rueda de rodadura para actuar como el bastidor de soporte (Figura 1B).
- Adjuntar una hoja semicircular de espesor 1 mm, transparente acrílico a los lados externos de las dos columnas triangulares utilizando tornillos. Use esta hoja para implementar los sensores infrarrojos. Asegúrese de que las hojas de acrílico son de aproximadamente 3 cm de cada lado de la rueda para correr.
2. Implementación de los sensores infrarrojos y Definición del área Ejercicio Efectivo
NOTA: Tener en cuenta el tamaño de la rueda en marcha y la longitud de la rata en el diseño de un sistema de infrarrojos. Una rata solamente desencadena un único sensor a la vez. En este experimento, las ratas son entre 20 y 23 cm de largo.
- Perforar un agujero en las hojas de acrílico todas (intervalo de arco = 21 cm) 45 °, con la distanciaentre dos orificios ser aproximadamente equivalente a la longitud de una rata de ensayo. Hacer los agujeros del mismo tamaño que los sensores de infrarrojos (Figura 2A).
NOTA: Para MRWs tradicionales, perforar un agujero cada (intervalo de arco = 21 cm, Figura 2 B) 70 °. - Durante un experimento de PRW, mantener las ratas a un estado estacionario de funcionamiento de entre 0 ° a 135 °.
NOTA: Por lo tanto definir esta zona como la zona de ejercicio efectivo, mientras que ver el resto de secciones como las áreas de ejercicios ineficaces. Para MRWs tradicionales, definir el área de ejercicio eficaz como la parte comprendida entre 0 ° y 140 ° (Figura 2B).
3. Conducción de la rueda para correr
- Use un motor CC sin escobillas y un controlador de motor para accionar la rueda en marcha.
- Montar un disco de caucho 10 cm de diámetro en el eje central del motor (Figura 1B).
- Utilizando el marco de hierro y resortes para soportar el motor, conectar el disco de goma deel eje central del motor en el lado exterior de la rueda en marcha.
NOTA: Los resortes deben cooperar con los tornillos para permitir ajustes de altura de motor dinámico y para evitar que el disco de caucho se desconecte de la pista rueda de funcionamiento debido a los resortes sueltos. - Hacer funcionar el motor para accionar el disco de caucho 10 cm de diámetro usando un microcontrolador, y observar la rueda gire debido a la fricción entre el disco de goma y de la pista de aterrizaje de la rueda, la creación de una plataforma de rueda de funcionamiento motorizado.
- Monte cuatro sensores infrarrojos secuencia entre 0 ° a 135 ° (Figura 2A).
NOTA: Para MRWs tradicionales, montar sensores de entre 0 ° y 140 ° (Figura 2B). - Conectar cuatro pares de sensores infrarrojos montados en las dos láminas de acrílico a los pines generales del microcontrolador utilizando cables de un solo núcleo, formando de este modo un sistema de posicionamiento de la rueda en marcha.
4. La construcción de un Accelerati adaptativoen la curva
- Tres días antes del comienzo de la formación oficial el ejercicio 3 por semana, entrenar ratas accionando manualmente la rueda de funcionamiento.
NOTA: El objetivo es permitir que las ratas se familiaricen con el entorno de ejecución, y es para probar si cada rata puede soportar funcionando a 20 m / min.- Durante el entrenamiento de accionamiento manual, acelerar gradualmente la velocidad de carrera hasta que una rata no es capaz de mantener el ritmo. Cuando esto ocurre, disminuir la velocidad hasta que la rata recupera un ritmo funcionamiento constante, y luego aumentar gradualmente la velocidad de nuevo hasta que la rata alcanza los 20 m / min (líneas discontinuas en la Figura 3). La formación implica manual de siete ratas para trazar las curvas de formación.
- El uso de una ecuación numérica para ajustar los datos medidos en el día 3 de la prueba manual, calcular las curvas de aceleración más cercanos a la formación manual (la curva con los círculos, Figura 3). Ecuación 1 ajuste a los datos en bruto, donde C ini = 8, C aleta = 20 y τ = 30 representan la velocidad inicial, la velocidad final y la constante, respectivamente el tiempo).
NOTA: Esta ecuación se adapta a la condición corporal de una rata. Por lo tanto, se refieren a la curva calculada como un modelo de entrenamiento de aceleración adaptativo.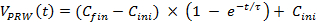 (1)
(1) - Utilice la ecuación 1 para la Semana 1 de la capacitación formal.
- Para las semanas 2 y 3 de la formación, ajustar los parámetros de la ecuación 1, es decir, el cambio A de 12 a 22, para permitir que la velocidad para llegar a 30 m / min.
5. Control de la Aplicación de software
NOTA: Exclusivamente desarrollar un código para el funcionamiento del motor basado en microcontrolador y para la transmisión de señales de los sensores de infrarrojos a un ordenador para el análisis de datos posterior.
- Use un lenguaje de programación C para escribir un programa de control de software que contiene un programa principal y dos rutinas de interrupción de servicio para el temporizador enel microcontrolador 18.
- Asegúrese de que el programa principal inicializa el registro del microcontrolador y construye un modelo de curva de aceleración adaptable en la memoria del microcontrolador.
- Utilice la rutina de interrupción de servicio del temporizador 0 para activar la curva de aceleración adaptativo y calcular toda la duración de la formación.
- Utilice la rutina de interrupción de servicio de temporizador 1 para extraer los datos de las señales de los sensores infrarrojos y transferir los datos al ordenador.
- Utilice el programa principal para registrar la posición de 0 ° para ajustar la velocidad de la rueda para correr.
- Una vez que el sensor IR de recepción a 0 ° se activa, interpretar como una incidencia caída, que se acumula por el programa principal. En el momento en los tiempos de ocurrencia de incidentes de caídas golpea el umbral del 10% del número de las detecciones de posición rata, deaccelerate la rueda para correr automáticamente como medida de seguridad para las ratas entrenadas. NOTA: La velocidad of rueda corriente se reduce hasta que la rata puede volver a la zona segura (0 o a 135 o) y mantener un estado de funcionamiento estable para la medida de seguridad.
6. Funcionamiento del Sistema de Posicionamiento rueda para correr
- Encienda el microcontrolador y esperar a que un operador presione el botón para iniciar el modelo de formación de cada semana.
- Presione el botón "Inicio" para iniciar el modelo de formación para la Semana 1.
NOTA: El motor acelera automáticamente en función de la curva de aceleración adaptativo hasta que llega a 20 m / min, y se detiene automáticamente después de 30 minutos. - Presione el botón "Inicio" para iniciar el modelo de formación para la Semana 2.
NOTA: El motor acelera automáticamente en función de la curva de aceleración adaptativo hasta que llega a 30 m / min, y se detiene automáticamente después de 30 minutos. - Presione el botón "Inicio" para iniciar el modelo de formación para la Semana 3.
NOTA: El motor de forma automática aceletes en base a la curva de aceleración de adaptación hasta que llega a 30 m / min, y automáticamente se detiene después de 60 min.
NOTA: A lo largo de todo el proceso de formación, transmitir los datos de señales recibidas de los sensores de infrarrojos a un ordenador de forma inalámbrica.
- Presione el botón "Inicio" para iniciar el modelo de formación para la Semana 1.
- El uso de un ordenador, analizar los datos de posición para obtener una medida ejercicio efectivo para todo el proceso de ejercicio (
 ). Véase la Ecuación 2.
). Véase la Ecuación 2. 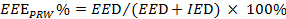 (2)
(2)
NOTA: EEE, EED y el IED representan la medida ejercicio efectivo, las duraciones eficaces e ineficaces de ejercicio, respectivamente.
7. El entrenamiento de las Ratas
- Dividir aleatoriamente ratas macho adultas Sprague-Dawley en cinco grupos (n = 9 para cada grupo): la farsa, control, cinta de correr, grupos MRW y PRW.
- Llevar a cabo un entrenamiento de ejercicio 3 semanas para los tres grupos de ejercicio, es decir, el trgrupos eadmill, MRW y PRW, mientras que no lo hacen para la farsa y los grupos de control.
NOTA: La práctica de ejercicio 3 semana para cada grupo de ejercicio es de 20 m / min durante 30 minutos durante la Semana 1, 30 m / min durante 30 minutos durante la Semana 2 y 30 m / min durante 60 minutos durante la semana 3.
8. Animal y Carrera Modelo
- Como se indica en Sec. 7.1, dividen al azar todas las ratas macho adultas Sprague-Dawley involucradas, con un peso entre 250-280 g, en 5 grupos.
- Pesar todos los animales para garantizar que los cálculos de dosis de drogas precisos. Anestesiar las ratas con pentobarbital sódico (25 mg / kg, por vía intraperitoneal [IP]) y una mezcla que contiene ketamina (4,4 mg / kg, por vía intramuscular [im]), atropina (0,02633 mg / kg, [im]) y xilazina (6,77 mg / kg, [im]).
- Evaluar la profundidad de la anestesia mediante el control de la tasa de respiración (respiraciones normales 70-115 / min), el ritmo, la profundidad de la respiración, color de las mucosas y las inspecciones periódicas de los reflejos, por ejemplo pizca dedo del pie, pizca de cola, los párpados / pestañasy palpebral.
- Inserte sondas de temperatura en el recto, y mantener las temperaturas rectales entre 37 a la 37,5 ° C utilizando lámparas de calentamiento separadas.
- Inducir la isquemia focal transitoria oclusión de la arteria cerebral media (MCAO) mediante la inserción de un filamento en la arteria carótida interna para ocluir el orificio de la arteria cerebral media por medio de enfoque de la arteria carótida externa 19.
- Realice los mismos procedimientos operativos en los animales con operación simulada, mientras que no introduzca un filamento en la arteria carótida interna. Mantener la isquemia cerebral focal durante 1 hora, retirar el filamento, cerrar la incisión, y luego se van de 1 cm de la sutura de nylon que sobresalen, lo que podría ser retirado para permitir la reperfusión.
- Administrar por vía subcutánea (sc) inyecciones de un analgésico (buprenorfina (0,05 mg / kg, sc)), en los animales para la analgesia dos veces al día durante 3 días.
9. La evaluación de daño neural
- evalluar las funciones neurológicas y motoras, respectivamente, por la puntuación de la gravedad neurológica (MNSS) 20 y una prueba de plano inclinado 21.
NOTA: MNSS es un compuesto de la motor (estado muscular, movimiento anormal), sensoriales (visual, táctil y propioceptiva) y pruebas de reflejos. Dar un punto por falta de realizar una tarea. Tasa de la función neurológica en una escala de 0-18 (puntuación normal = 0; puntuación máxima déficit = 18). - Evaluar todas las ratas en términos de rendimiento de comportamiento del día anterior y al día durante un período de tiempo de 7 días después de la cirugía.
- Medir la fuerza de agarre del miembro posterior de la rata usando un plano inclinado.
- Coloque ratas en el aparato de escalada inclinado sobre una base diaria, y aclimatarse a las ratas al aparato y las condiciones de ensayo 1 semana antes de la prueba.
- Colocar cada rata en el aparato y animar a la rata para subir la plataforma hasta que la parte superior del aparato durante el periodo de aclimatación.
- Coloque la rata ala parte superior del aparato con la cabeza hacia abajo durante la prueba. Asegúrese de que el eje del cuerpo de las estancias de rata a lo largo de una superficie acanalada 2 de goma 20 x 20 cm sobre el plano inclinado a partir de un ángulo de 25 °.
- Aumentar el ángulo de forma dinámica mediante un tornillo de bola conectada con un motor paso a paso para determinar el ángulo máximo en el que un animal pudo contener al plano. Aumentar el ángulo del plano inclinado gradualmente hasta que el ratón no logró mantenerse sobre el plano inclinado, y después de detectar un evento de deslizamiento hacia abajo. El grado de la línea de base plano inclinado es de 25 ° en el principio.
- Pide a dos observadores (sin darse cuenta de lo que el tratamiento de las ratas habían dado), para examinar de manera independiente y anotar todas las pruebas de comportamiento, es decir, la media de los ángulos máximos del lado izquierdo y derecho.
- Sacrificio de todos los animales en el día 7 después de la MCAO. Perfundir los corazones de los animales bajo anestesia profunda (pentobarbital sódico 100 mg / kg, ip) con solución salina 22 . Retire y luego sumergir el tejido cerebral en solución salina fría durante 5 min, que se corta entonces en 2,0 mm secciones coronales utilizando una máquina de cortar tejido 22.
- Sumergir las secciones de cerebro fresco en 2, 3, cloruro de 5-trifeniltetrazolio (TTC) a 37 ° C durante 30 minutos, a continuación, transferir las rebanadas a una solución de formaldehído al 5% para la fi jación a 4 ° C durante 24 horas. Coloque las rodajas de cerebro teñidas en un soporte de plexiglás.
- Fotografiar las rebanadas teñidas con TTC con una escala calibrada utilizando una cámara CCD conectada a una computadora personal equipada con el software de procesamiento de imágenes. Utilice un sistema de análisis de imagen semi-automatizado también para estimar el área infartada (mm 2) de cada corte de cerebro teñidas con TTC 23.
- Calcular el volumen total de infarto para cada sector mediante la suma de las áreas infartadas de todas las secciones de cerebro. Delimitar la zona sin teñir (cerebral isquémico) por separado en cada lado de las rebanadas de 2 mm de espesor, a continuación, calcular el volumen del infarto y el valor medio.
- calcutarde el volumen del infarto corregido (CIV) como
CIV = {LT (RT-RI)}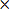 d (3)
d (3)
NOTA: En caso de LT y RT denotan las áreas de los hemisferios izquierdo y derecho en mm 2, respectivamente, RI es el área infartada en mm 2, y d = 2 mm es el grosor del corte.
Access restricted. Please log in or start a trial to view this content.
Resultados
Esta sección está dedicada a las comparaciones, hace 1 semana después de la cirugía, en los volúmenes de infarto anota MNSS, resultados de pruebas de plano inclinado y cerebrales entre los cinco grupos. Figura 4A y 4B presentan las puntuaciones medias MNSS y el promedio de los resultados de las pruebas plano inclinado, respectivamente. El grupo PRW aparece como el mejor en términos de mejora MNSS. Las diferencias significativas entre PRW y MRW y en...
Access restricted. Please log in or start a trial to view this content.
Discusión
Este protocolo describe un sistema de rueda de funcionamiento altamente eficaz para reducir la gravedad de los efectos de la carrera en los animales. Como banco de pruebas de rata con niños, esta plataforma está diseñada así de tal manera que una velocidad de funcionamiento estable puede ser mantenido por las ratas a través de un proceso en ejecución por medio de una curva de aceleración adaptativa predeterminada. En los sistemas de formación típicas, velocidades y duraciones de formación predefinidos se ajust...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The authors would like to thank Dr. Jhi-Joung Wang, who is the Vice Superintendent of Education at Chi-Mei Medical Center, and Dr. Chih-Chan Lin from the Laboratory Animal Center, Department of Medical Research, Chi-Mei Medical Center, 901 Zhonghua, Yongkang Dist., Tainan City 701, Taiwan, for providing the shooting venue. They would also like to thank Miss Ling-Yu Tang and Mr. Chung-Ham Wang from the Department of Medical Research, Chi-Mei Medical Center, Tainan, Taiwan, for their valuable assistance in demonstrating the prototype system in real experiments with rats. The author gratefully acknowledges the support provided for this study by the Ministry of Science and Technology (MOST 104- 2218-E-167-001-) of Taiwan.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Brushless DC motor | Oriental Motor | BLEM512-GFS | |
| Motor driver | Oriental Motor | BLED12A | |
| Motor reducer | Oriental Motor | GFS5G20 | |
| Speedometer | Oriental Motor | OPX-2A | |
| Treadmill | Columbus Instruments | Exer-6M | |
| Infrared transmitter | Seeed Studio | TSAL6200 | |
| Infrared Receiver | Seeed Studio | TSOP382 | |
| Microcontroller | Silicon Labs | C8051F330 | |
| CCD camera | Canon Inc. | EOS 450D | |
| Image processing software | Adobe Systems Incorporated | ADOBE Photoshop CS5 12.0 | |
| Image analysis | Media Cybernetics | Pro Plus 4.50.29 | |
| Sodium pentobarbital | Sigma-Aldrich (Saint Louis, MO, USA) | SIGMA P-3761 | |
| Ketamine | Pfizer (Kent, UK) | 1867-66-9 | |
| Atropine | Taiwan Biotech Co., Ltd. (Taoyuan, Taiwan) | A03BA01 | |
| Xylazine | Sigma-Aldrich (Saint Louis, MO, USA) | SIGMA X1126 | |
| Buprenorphine | Sigma-Aldrich (Saint Louis, MO, USA) | B9275 |
Referencias
- Mayo, N. E., Wood-Dauphinee, S., Cote, R., Durcan, L., Carlton, J. Activity, participation, and quality of life 6 months poststroke. Arch Phys Med Rehabil. 83 (8), 1035-1042 (2002).
- Duncan, P. W., Goldstein, L. B., Horner, R. D., Landsman, P. B., Samsa, G. P., Matchar, D. B. Similar motor recovery of upper and lower-extremities after stroke. Stroke. 25 (6), 1181-1188 (1994).
- Raichlen, D. A., Gordon, A. D. Relationship between exercise capacity and brain size in mammals. PLoS One. 6 (6), (2011).
- Trejo, J. L., Carro, E., Torres-Aleman, I. Circulating insulin-like growth factor I mediates exercise-induced increases in the number of new neurons in the adult hippocampus. J Neurosci. 21 (5), 1628-1634 (2001).
- Zhang, F., Wu, Y., Jia, J. Exercise preconditioning and brain ischemic tolerance. Neuroscience. 177, 170-176 (2011).
- Wang, R. Y., Yang, Y. R., Yu, S. M. Protective effects of treadmill training on infarction in rats. Brain Res. 922 (1), 140-143 (2001).
- Ding, Y., et al. Exercise pre-conditioning reduces brain damage in ischemic rats that may be associated with regional angiogenesis and cellular overexpression of neurotrophin. Neuroscience. 124 (3), 583-591 (2004).
- Li, J., Luan, X. D., Clark, J. C., Rafols, J. A., Ding, Y. C. Neuroprotection against transient cerebral ischemia by exercise pre-conditioning in rats. Brain Res. 26 (4), 404-408 (2004).
- Leasure, J. L., Jones, M. Forced and voluntary exercise differentially affect brain and behavior. Neuroscience. 156 (3), 456-465 (2008).
- Chen, C. C., et al. A Forced running wheel system with a microcontroller that provides high-intensity exercise training in an animal ischemic stroke model. Braz J Med Biol Res. 47 (10), 858-868 (2014).
- Chen, C. -C., et al. Improved infrared-sensing running wheel systems with an effective exercise activity indicator. PLoS One. 10 (4), (2015).
- Fantegrossi, W. E., Xiao, W. R., Zimmerman, S. M. Novel technology for modulating locomotor activity as an operant response in the mouse: Implications for neuroscience studies involving "exercise" in rodents. J Neurosci Methods. 212 (2), 338-343 (2013).
- Hayes, K., et al. Forced, not voluntary, exercise effectively induces neuroprotection in stroke. Acta Neuropathol. 115 (3), 289-296 (2008).
- Arida, R. M., Scorza, C. A., da Silva, A. V., Scorza, F. A., Cavalheiro, E. A. Differential effects of spontaneous versus forced exercise in rats on the staining of parvalbumin-positive neurons in the hippocampal formation. Neurosci Lett. 364 (3), 135-138 (2004).
- Waters, R. P., et al. Selection for aerobic capacity affects corticosterone, monoamines and wheel-running activity. Physiol Behav. (4-5), 1044-1054 (2008).
- Ke, Z., Yip, S. P., Li, L., Zheng, X. -X., Tong, K. -Y. The effects of voluntary, involuntary, and forced exercises on brain-derived neurotrophic factor and motor function recovery: A rat brain ischemia model. PLoS One. 6 (2), (2011).
- Caton, S. J., et al. Low-carbohydrate high-fat diets in combination with daily exercise in rats: Effects on body weight regulation, body composition and exercise capacity. Physiol Behav. 106 (2), 185-192 (2012).
- C8051F330/1/2/3/4/5 datasheet. , Silicon Laboratories Inc. Available from: https://www.silabs.com/Support%20Documents/TechnicalDocs/C8051F33x.pdf (2006).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Chen, J. L., et al. Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats. Stroke. 32 (4), 1005-1011 (2001).
- Chang, M. -W., Young, M. -S., Lin, M. -T. An inclined plane system with microcontroller to determine limb motor function of laboratory animals. J Neurosci Methods. 168 (1), 186-194 (2008).
- Gartshore, G., Patterson, J., Macrae, I. M. Influence of ischemia and reperfusion on the course of brain tissue swelling and blood-brain barrier permeability in a rodent model of transient focal cerebral ischemia. Exp Neurol. 147 (2), 353-360 (1997).
- Chen, F., et al. Rodent stroke induced by photochemical occlusion of proximal middle cerebral artery: Evolution monitored with MR imaging and histopathology. Eur J Radiol. 63 (1), 68-75 (2007).
- Almenning, I., Rieber-Mohn, A., Lundgren, K. M., Lovvik, T. S., Garnaes, K. K., Moholdt, T. Effects of high intensity interval training and strength training on metabolic, cardiovascular and hormonal outcomes in women with polycystic ovary syndrome: a pilot study. PLoS One. 10 (9), (2015).
- Costigan, S. A., Eather, N., Plotnikoff, R. C., Taaffe, D. R., Lubans, D. R. High-intensity interval training for improving health-related fitness in adolescents: a systematic review and meta-analysis. Br J Sports Med. 49 (19), (2015).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados