A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מנגנון גלגלים מבוססי ריצה חדשני עבור ביצועי הדרכת עכברוש משופרים
In This Article
Summary
מחקר זה מציג ריצה חדשנית מערכת ניידות חית גלגל מבוססת לכמת פעילות גופנית יעילה אצל חולדות. Testbed עכברוש ידידותי בנוי, באמצעות עקומת תאוצה אדפטיבית מוגדר מראש, ואת מתאם גבוה בין שיעור המימוש היעיל ואת נפח האוטם מצביע על הפוטנציאל של הפרוטוקול לניסויים למניעת שבץ.
Abstract
מחקר זה מציג מערכת ניידות חיה, מצויד גלגל ריצת מיצוב (PRW), כדרך לכמת את היעילות של פעילות גופנית להפחתת חומרת התופעות של השבץ אצל חולדות. מערכת זו מספקת באימונים בעלי חיים יעילים יותר במערכות זמינות מסחרי כגון הליכונים וגלגלי ריצה ממונעים (MRWs). בניגוד ל MRW שיכול להגיע למהירויות רק מתחת ל -20 מ '/ דקה, חולדות רשאיות לפעול במהירות יציבה של 30 מ' / דקה על מסלול ריצה גומי מרווח יותר בצפיפות גבוהה על ידי גלגל 15 ס"מ רוחב אקרילי עם בקוטר של 55 ס"מ בעבודה זו. באמצעות עקומת תאוצה אדפטיבית מוגדר מראש, המערכת לא רק מפחיתה את לטעויות המפעילות אלא גם רכבות החולדות לרוץ בהתמדה עד בעצמה שצוינה הוא הגיע. כדרך להעריך את יעילות התרגיל, מיקום בזמן האמת של עכברוש הוא זוהה על ידי ארבעה זוגות של חיישני אינפרא אדומים פרוסים על גלגל הריצה. ברגעעקומת תאוצה אדפטיבית היא יזמה באמצעות מיקרו, הנתונים שהתקבלו על ידי חיישני אינפרא אדום נרשמים אוטומטית וניתח מחשב. לשם השוואה, אימון בשבוע 3 מתנהל על חולדות באמצעות הליכון, MRW וכן PRW. לאחר בניתוח גרימת חסימת עורק המוח אמצעי (MCAo), עשרות חומרת נוירולוגיות שונות (mNSS) וכן בדיקת מישור משופעת נערכו במדידת ניזקי הנוירולוגי החולדות. PRW הוא תוקף באופן ניסיוני כמו היעיל ביותר בקרב מערכות ניידות חיה כזו. יתר על כן, מדד יעילות פעילות גופנית, על סמך ניתוח העמדה חולדה, הראה כי קיים מתאם שלילי גבוה בין פעילות גופנית יעילה ואת נפח האוטם, והוא יכול להיות מועסק על מנת לכמת אימון עכברוש כל סוג של ניסויים הפחתת נזק מוחי.
Introduction
הסטרוקס להתקיים ברציפות כנטל כספי מדינות ברחבי העולם, עוזב חולים אינספור נכה ומפגר 1, 2. ישנן ראיות קליניות המצביעות על כך פעילות גופנית סדירה יכולה לשפר התחדשות עצבה ולחזק קשרים עצביים 3, 4, והוא גם הראה שאימון גופני יכול להקטין את הסיכון של שסבל משבץ איסכמי 5. עם או הליכון או גלגל ריצה כמערכת באימונים, מכרסמים, כגון חולדות, לשמש פרוקסי עבור בני אדם לבדיקת היעילות של תרגילים בתוך רוב מכריע של ניסויים קליניים 6 - 8. מערכת הדרכה בדרך כלל כרוכה אימוני עכברוש לתקופה מסוימת של זמן, שבמהלכו חולדה חולפת במהירות מסוימת. לכן, עצימות האימון מחושבת בדרך כלל על פי מהירות התרגיל ומשך 6 - 8. אותה הגישה מוחלתלהעריך את כמות הפעילות הגופנית הנדרשת להגנה נוירופיזיולוגיים. עם זאת, את התרגילים הניסיוניים לפעמים הם מצאו להיות יעילים, כגון כאשר מועדת חולדה, נופלת, או תופסת את המסילות פעם הם אינם מסוגלים להדביק את מהירות גלגל ריצת 9 - 11. למותר לציין, תקריות של פעילות גופנית יעילה להפחית את יתרון התרגיל משמעותי. למרות שאין כל גישה מקובלת כיום לכמת את התרגילים היעילים לצמצום נזק מוחי, רמת התרגילים היעילים עדיין עומדת בתור הערכה אובייקטיבית לחוקרים קליניים כדי להמחיש את היתרונות של פעילות גופנית בדיסציפלינה של לנוירופיזיולוגיה.
קיים מספר המגבלות על מערכות ניידות חיה זמינות מסחרי השתמשו בניסויי הפחתת הניזק המוחי של היום 12. במקרה הליכון, חולדות נאלצות לרוץ באמצעות שוקים חשמליים, גרימה עצומה פסיכולוגילחץ על בעלי החיים והפרעה ובכך במבחן הנוירופיזיולוגיים הסופי תוצאות 8, 13, 14. גלגלי ריצה יכולים להיות מסווגים לשני סוגים, כלומר בהתנדבות וללא כפייה. גלגלי ריצה מרצון לאפשר עכברים שירוצו באופן טבעי, יצירת השתנות יתר בשל ההבדלים תכונות ויכולות פיזיות החולדות 15, בעוד גלגלי ריצה ממונע (MRWs) להעסיק מנוע לסובב את הגלגל, מה שאילץ חולדות לרוץ. למרות גם להיות סוג של אימון בכפייה, MRWs מטיל לחץ פסיכולוגי פחות על חולדות מאשר הליכונים 13, 16, 17. עם זאת, ניסויים באמצעות MRWs דיווחו כי חולדות לפעמים להפריע פעילות גופנית על ידי גרירה של מסילות על המסלול גלגל ומסרב לרוץ במהירויות מעל 20 מ '/ דקה 9. דוגמאות אלו מראות כי מערכות ניידות חיה שזמינות כעת חסרון טמון מעכבת פעילות גופני יעיל. לאימון עכברוש מטרה ועניין, פיתוח מערכת הדרכה אפקטיבית מאוד אבל עם התערבות נמוכה ולכן נתפס כסוגיה דחופה ניסויי תרגיל נוירופיזיולוגיים.
מחקר זה מציג מערכת גלגל ריצה יעילה מאוד עבור ניסויים על הפחתת חומרת התופעות של השבץ 11. בנוסף מספר מופחת של גורמים להפרעה במהלך תהליך הכשרה, מערכת זו מזהה את מיקום הריצה של עכברוש באמצעות חיישני אינפרא אדומים מוטבעים ההגה, ובכך להשיג אומדן מהימן יותר של פעילות גופנית יעילה. הלחץ הפסיכולוגי שהטיל הליכונים מסורתי ואת הפרעות תרגיל התכופות MRWs הוא מעקם את האובייקטיביות של אומדני התרגיל שהתקבלו. גלגל ריצת מיצוב (PRW) מערכת המתוארת בעבודה זו מפותחת בניסיון להקטין למינימום את ההפרעה הרצויה תוך מתן מודל אימון אמין לכימות exe היעילrcise.
Access restricted. Please log in or start a trial to view this content.
Protocol
הצהרת אתיקה: ההליכים הניסוי אושרו על ידי ועדת האתיקה של בעלי חיים בדרום טייוואן אוניברסיטת המדע והטכנולוגיה מעבדה בבעלי חיים מרכז, הלאומית למדע המועצה, הרפובליקה של סין (Tainan, טייוואן).
1. בניית מבנה גלגל ריצה
הערה: כל אקריליק צריך להיות שקוף. שטוף את הגלגל המפורק עם מים, ולאחר מכן להשתמש באלכוהול כדי לנגב את מסלול גומי גיליונות אקריליק לאחר כל שימוש.
- קבל גלגל ריצה אקריליק להיות 55 ס"מ קוטר ו -15 ס"מ רוחב.
הערה: גלגל זה הינו גדול יותר גלגל ריצה המסורתית (קוטר = 35 ס"מ; רוחב = 12 ס"מ) (F igure 1A). - בעזרת סכין, לחתוך פתח רבע עיגול לתוך צד אחד של גלגל ריצה לפעול בתור כניסה ויציאה כמו גם לחולדות (איור 1B). מניח שכבה של מסלול גומי גבוה חיכוך על החלק הפנימי של ACRגלגל ylic (איור 1B).
- מניחים מוט ברזל עם מיסבים לחבר את גלגל ריצה (איור 1B). מניח שתי עמודות משולשות אקרילי משני צדי ההגה ריצה לפעול כמסגרת התמיכה (האיור 1B).
- צרף גיליון אקריליק חצי עגול, שקוף בעובי 1 מ"מ לצדדים החיצוניים של שני הטורים המשולשים באמצעות ברגים. השתמש גיליון לפרוס את חיישני אינפרא אדום. ודא כי הסדינים אקריליק הם כ 3 ס"מ הרחק מכל צד של גלגל ריצה.
2. פריסת חיישנים אינפרא אדום והגדרת אזור תרגיל אפקטיבי
הערה: קח בחשבון את גודל ריצת הגלגל ואורך עכברוש בעיצוב של מערכת אינפרא אדומה. עכברוש רק מפעיל חיישן בודד בכל פעם. בניסוי זה, חולדות הן בין 20 ל 23 סנטימטר.
- לקדוח חור הסדינים אקריליק כל 45 ° (מרווח קשת = 21 ס"מ), עם המרחקבין שני חורים להיות שווה בערך באורך של עכברוש בדיקה. לעשות את החורים באותו גודל כמו (איור 2 א) חיישני אינפרא אדום.
הערה: לקבלת MRWs המסורתית, לקדוח חור בכל 70 ° (מרווח קשת = 21 ס"מ, איור 2B). - במהלך הניסוי PRW, לשמור על חולדות בכל מצב יציב של ריצה בין 0 ° ל -135 °.
הערה: כך מגדיר אזור זה כאזור התרגיל היעיל, בעוד צג הכל בסעיפים האחרים כמו שטחי אימון היעילים. לקבלת MRWs המסורתית, להגדיר את אזור התרגיל היעיל כמו החלק בין 0 ° עד 140 ° (תרשים 2B).
3. נהיגת גלגל הריצה
- השתמש מנוע brushless DC ונהג רכב לנהוג גלגל ריצה.
- הר דיסק גומי בקוטר 10 ס"מ על הציר המרכזי של המנוע (איור 1B).
- באמצעות מסגרת ברזל וקפיצים לתמוך את המנוע, לחבר את הדיסק גומיהציר המרכזי של המנוע אל הצד החיצוני של גלגל הריצה.
הערה: המעיינות חייבות לשתף פעולה עם ברגים כדי לאפשר התאמות בגובה מנוע דינמי ולמנוע דיסק גומי מלהיות מנותק למסלול ריצת הגלגל בגלל מעיינות רופפות. - להפעיל את המנוע כדי להסיע את הדיסק גומי בקוטר 10 ס"מ באמצעות מיקרו, ולבחון את הגלגל סובב בשל החיכוך בין הדיסק גומי המסלול של הגלגל, ויצירת פלטפורמה גלגל ריצה ממונע.
- הר ארבעה ברצף חיישני אינפרא אדום בין 0 ° עד 135 ° (איור 2 א).
הערה: לקבלת MRWs המסורתית, הר חיישנים בין 0 ° עד 140 ° (תרשים 2B). - חבר ארבעה זוגות של חיישני אינפרא אדום רכוב בשני גליונות אקריליק על סיכות הכללית של מיקרו באמצעות כבלי ליבה אחת, וכך נוצרת מערכת גלגל ריצה מיצוב.
4. בנייה מסתגלת Acceleratiעל עיקול
- שלושה ימים לפני תחילת אימון גופני רשמי 3 בשבוע, לאמן חולדות באופן ידני על ידי הפעלת גלגל הריצה.
הערה: המטרה היא לאפשר את החולדות ולהכיר את הסביבה פועל, והוא כדי לבדוק אם בכל עכברוש יכול לסבול לפעול בשעה 20 מ '/ דקה.- במהלך האימון פעל באופן ידני, בהדרגה להאיץ את מהירות הריצה עד חולדה אינה מסוגלת לעמוד בקצב. כאשר זה קורה, להקטין את המהירות עד העכברוש חוזר בקצב תפעול שוטף, ולאחר מכן בהדרגה להגדיל את המהירות שוב עד העכברוש מגיע 20 מ '/ דקה (קווים מקווקווים באיור 3). אימון המדריך כרוך שבע חולדות לבן עקומות האימון.
- באמצעות משוואה מספרית כדי להתאים את הנתונים הנמדדים על יום 3 של הבדיקה הידנית, לחשב את עקומות האצה הקרובות ביותר אימון הידני (עקום עם עיגולים, איור 3). משוואת Fit 1 עד נתונים גולמיים, כאשר C ini = 8, סנפיר C = 20 ו τ = 30 מייצגים את המהירות ההתחלתית, את המהירות הסופית ואת זמן קבוע, בהתאמה).
הערה: משוואה זו מתאימה למצב הגוף של חולדה. לכן, עיין העקומה מחושבת כמודל אימון האצת אדפטיבית.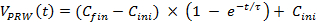 (1)
(1) - השתמש משוואה 1 עבור שבוע 1 של הכשרה פורמלית.
- במשך שבועות 2 ו -3 של אימונים, להתאים את הפרמטרים של משוואת 1, כלומר, שינוי א 12 עד 22, כדי לאפשר המהיר להגיע 30 מ '/ דקה.
5. שליטה בתוכנה
הערה: בלעדי לפתח קוד עבור פעולת המנוע מבוססי מיקרו ועבור אות השידור מן חיישני אינפרא אדום למחשב לניתוח נתונים עוקבות.
- שימוש בשפת תכנות C לכתוב תכנית שליטה בתוכנות המכילה תכנית אחת עיקרית ושתי שגרות פסיקה-שירות עבור טיימרהמיקרו-בקר 18.
- ודא כי התוכנית הראשית מאתחלת את הקופה הרושמת של מיקרו ובונה מודל עקומת תאוצה אדפטיבית בזיכרון של המיקרו-בקר.
- השתמש שגרת פסיקה-שירות של טיימר 0 כדי להפעיל את עקומת תאוצה אדפטיבית ולחשב את משך האימון כולו.
- השתמש שגרת פסיקה-שירות של 1 טיימר כדי לחלץ את הנתונים אות מן חיישני אינפרא אדום וכדי להעביר את הנתונים למחשב.
- השתמש בתוכנית הראשית להקליט את המיקום של 0 o כדי להתאים את מהירות גלגל ריצה.
- לאחר החיישן המקבל IR ב 0 ° מופעל, לפרש את זה בתור שכיחות בסתיו, אשר נצברה על ידי התכנית הראשית. ברגע פעמי התרחשות מקרי נפילה מגיע לסכום סף 10% במספר של לתגליות מיקום עכברוש, deaccelerate הגה הריצה אוטומטית כאמצעי בטיחות לחולדות מאומנות. הערה: o המהירהf גלגל ריצה מצטמצם עד העכברוש יכול לחזור האזור הבטוח (0 o ל -135 o) ולקיים מדינה פועלת יציבה עבור אמצעי הבטיחות.
6. הפעלת מערכת גלגל ריצת המיצוב
- הפעל המיקרו ולחכות מפעיל ללחוץ על הכפתור כדי להפעיל כל דגם אימונים בשבוע.
- לחצו על כפתור "התחל" כדי להתחיל את מודל אימון לקראת שבוע 1.
הערה: המנוע באופן אוטומטי מאיץ מבוסס על עקומת התאוצה אדפטיבית עד שהוא מגיע 20 מ '/ דקה, ומפסיק באופן אוטומטי לאחר 30 דקות. - לחצו על כפתור "התחל" כדי להתחיל את מודל אימון עבור שבוע 2.
הערה: המנוע באופן אוטומטי מאיץ מבוסס על עקומת התאוצה אדפטיבית עד שהוא מגיע 30 מ '/ דקה, ומפסיק באופן אוטומטי לאחר 30 דקות. - לחצו על כפתור "התחל" כדי להתחיל את מודל אימון עבור שבוע 3.
הערה: המנוע באופן אוטומטי accelerates המבוססת על עקומת התאוצה אדפטיבית עד שהוא מגיע 30 מ '/ דקה, ומפסיקה באופן אוטומטי לאחר 60 דקות.
הערה: לכל אורך תהליך אימון שלם, ולהעביר את הנתונים האות המתקבל חיישני אינפרא אדום למחשב באופן אלחוטי.
- לחצו על כפתור "התחל" כדי להתחיל את מודל אימון לקראת שבוע 1.
- שימוש במחשב, לנתח את נתוני המיקום להשיג מידת תרגיל יעילה לתהליך התרגיל כולו (
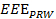 ). ראה משוואה 2.
). ראה משוואה 2. 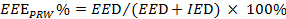 (2)
(2)
הערה: EEE, EED ו IED לייצג את מדד תרגיל יעיל, משכי זמן הפעלתן היעילה ולא יעיל, בהתאמה.
7. אימון חולדות
- אקראי לחלק זכר בוגר חולדות Sprague-Dawley לחמש קבוצות (n = 9 עבור כל קבוצה): העמדת פנים, שליטה, הליכון, קבוצות MRW ו PRW.
- לערוך אימון תרגיל 3 בשבוע במשך שלוש קבוצות התרגיל, כלומר TReadmill, קבוצות MRW ו PRW, בעוד לא עבור דמה והן בקבוצת הביקורת.
הערה: הכשרת התרגיל 3 בשבוע לכל קבוצת פעילות גופנית היא 20 מ '/ דקה במשך 30 דקות בשבוע 1, 30 מ' / דקה במשך 30 דקות במהלך השבוע 2 ו -30 מ '/ דקה במשך 60 דקות בשבוע 3.
במודל חיה ושבץ 8.
- כאמור Sec. 7.1, אקראיים לחלק את כל החולדות ספראג-Dawley זכר בוגר המעורבות, במשקל שבין 250-280 גרם, לתוך 5 קבוצות.
- לשקול את כל החיות כדי להבטיח חישובי מינון תרופה מדויקים. להרדים את חולדות עם pentobarbital נתרן (25 מ"ג / ק"ג, intraperitoneally [ip]) ו קטמין המכיל תערובת (4.4 מ"ג / ק"ג, לשריר [im]), אטרופין (0.02633 מ"ג / ק"ג, [im]) ו xylazine (6.77 מ"ג / ק"ג, [im]).
- להעריך את עומק ההרדמה על ידי ניטור קצב הנשימה (רגילות 70-115 נשימות / דקה), קצב, עומק הנשימה, צבע קרום רירי ובדיקה שוטפת של רפלקסים, קמצוץ בוהן למשל, קמצוץ זנב, עפעף / ריסו palpebral.
- הכנס בדיקות טמפרטורה לתוך פי הטבעת, ולשמור על טמפרטורות רקטלית בין 37 כדי 37.5 מעלות צלזיוס באמצעות מנורות חימום נפרדות.
- להשרות מוקדי איסכמיה, חסימה בעורק מוח אמצעית חולפת (MCAo) על ידי החדרת נימה לעורק התרדמה הפנימי כדי לחסום את הפתח של עורק המוח האמצעי באמצעות גישת עורק הראשי חיצוני 19.
- בצע אותם הליכי ההפעלה על חיות הדמה מופעל, ואילו לא להכניס נימה לעורק התרדמה הפנימי. לשמור על מוקדי איסכמיה מוחית עבור שעה 1, להסיר את חוט להט, לסגור את החתך, ולאחר מכן לעזוב 1 ס"מ של תפר ניילון בולטות, אשר ניתן היה למשוך לאפשר reperfusion.
- נהל תת עורית (SC) זריקות של משכך כאבים (עצירות (0.05 מ"ג / ק"ג, SC)), אל החיות על שיכוך כאבים פעמיים ביום למשך 3 ימים.
9. הערכת נזק עצבית
- הערכהתפקודים נוירולוגיים ומוטוריים uate, בהתאמה, על ידי ציון חומרת נוירולוגיות (mNSS) 20 וכן בדיקה מישור משופע 21.
הערה: mNSS הוא צירוף של המנוע (מצב שריר, תנועה חריגה), חושי (חזותי, מישוש ו הפרופריוצפטיבית) ובדיקות רפלקס. תן נקודה אחת עבור אי ביצוע משימה. פונקצית דרג נוירולוגיות בסולם של 0-18 (ציון נורמלי = 0; ציון גירעון מקסימאלי = 18). - להעריך את כל החולדות מבחינת ביצועים התנהגותיים יום לפני ויומיומי במהלך פרק זמן של 7 ימים לאחר הניתוח.
- למדוד את עוצמת אחיזת גפיים האחורית של העכברוש באמצעות מישור משופע.
- מניחים חולדות על מנגנון טיפוס נוטה על בסיס יומי, ואת להתאקלם החולדות למנגנון ואת תנאי הבדיקה 1 שבוע לפני הבדיקה.
- מניח כל חולדה על המנגנון ולעודד החולדה לטפס על הפלטפורמה עד שהחלק העליון של המנגנון בתקופת ההתאקלמות.
- מניחים את החולדה עלבראש המנגנון עם ראש מטה במהלך הבדיקה. ודא כי ציר הגוף של שהיית העכברוש יחד על משטח מצולע 20 x 20 סנטימטרים 2 גומי על המישור המשופע החל בזווית של 25 מעלות.
- להגדיל את הזווית באופן דינמי באמצעות בורג כדור מחובר עם מנוע צעד כדי לקבוע את זווית מקסימלית שבה חיה יכולה להחזיק למישור. הגדל את הזווית של המישור המשופע בהדרגה עד העכבר הצליח להחזיק על המישור המשופע, ולאחר מכן לזהות אירוע מחליק במורד. מידת הבסיס של מישור משופע היא 25 ° בהתחלה.
- שאל שני משקיפים (מודע למה טיפול החולדות קיבלו), כדי לבחון באופן עצמאי את התוצאה כל בדיקות התנהגותיות, כלומר ממוצע של זוויות מקסימלי והשמאלי בצד הימני.
- להקריב את כל החיות ביום 7 לאחר MCAo. Perfuse את ליבם של בעלי חיים תחת הרדמה עמוקה (pentobarbital נתרן 100 מ"ג / ק"ג, IP) עם מי מלח 22 . סר ולאחר מכן לטבול את רקמת המוח מלוח קר למשך 5 דק ', אשר הוא פרוס ואז למקטעי עטרה 2.0 מ"מימ באמצעות מבצעה רקמה 22.
- להטביע את החלקים במוח הטריים לתוך 2, 3, כלוריד 5-triphenyltetrazolium (TTC) על 37 מעלות צלזיוס למשך 30 דקות, ולאחר מכן להעביר את הפרוסות בתמיסת פורמלדהיד 5% עבור xation fi ב 4 מעלות צלזיוס למשך 24 שעות. מניחים את פרוסות המוח מוכתם על בעל פרספקס.
- צלם את הפרוסות מוכתמות TTC עם סולם מכויל באמצעות מצלמת CCD המקושר למחשב אישי עמוסים בתוכנות עיבוד תמונה. השתמש במערכת ניתוח תמונה חצי אוטומטי וכן להעריך את האזור האוטם (2 מ"מ) מכל פרוסת מוח מוכתם TTC 23.
- חשבתי את נפח האוטם סך כל פרוסה על ידי סיכום של אזורים האוטמים של כל פרוסות המוח. וסמן את שטח בלא כתם (מוח איסכמי) בנפרד בכל צד של פרוסות בעובי 2 מ"מ, ואז לחשב את נפח האוטם ואת הערך הממוצע.
- Calcuמאוחר נפח האוטם המתוקן (CIV) כמו
CIV = {LT- (RT- RI)}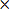 ד (3)
ד (3)
הערה: איפה LT ו RT לציין את תחומי ההמיספרות על ימין ועל שמאל במ"מ 2, בהתאמה, RI הוא האזור אוטם במ"מ 2, ו- D = 2 מ"מ העובי הפרוס.
Access restricted. Please log in or start a trial to view this content.
תוצאות
סעיף זה מוקדש כולו להשוואה, עושה 1 שבוע לאחר ניתוח, על עשרות mNSS, תוצאות בדיקת מישור משופעות ומוח הכרכים האוטמים בין חמש קבוצות. איור 4 א ו -4 מציג את ניקוד mNSS הממוצע וממוצע תוצאות בדיקת מישור משופע, בהתאמה. קבוצת PRW מופיעה כמקום הטוב בי?...
Access restricted. Please log in or start a trial to view this content.
Discussion
פרוטוקול זה מתאר מערכת גלגל ריצה יעילה מאוד להפחתת חומרת התופעות של השבץ בבעלי חיים. כתוצאת testbed עכברוש ידידותי, פלטפורמה זו נועדה גם בצורה כזאת כי מהירות ריצה יציבה יכולה להיות מתוחזק על ידי חולדות לאורך תהליך רץ באמצעות עקומת תאוצה אדפטיבית שנקבעה מראש. במערכות אימ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Dr. Jhi-Joung Wang, who is the Vice Superintendent of Education at Chi-Mei Medical Center, and Dr. Chih-Chan Lin from the Laboratory Animal Center, Department of Medical Research, Chi-Mei Medical Center, 901 Zhonghua, Yongkang Dist., Tainan City 701, Taiwan, for providing the shooting venue. They would also like to thank Miss Ling-Yu Tang and Mr. Chung-Ham Wang from the Department of Medical Research, Chi-Mei Medical Center, Tainan, Taiwan, for their valuable assistance in demonstrating the prototype system in real experiments with rats. The author gratefully acknowledges the support provided for this study by the Ministry of Science and Technology (MOST 104- 2218-E-167-001-) of Taiwan.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Brushless DC motor | Oriental Motor | BLEM512-GFS | |
| Motor driver | Oriental Motor | BLED12A | |
| Motor reducer | Oriental Motor | GFS5G20 | |
| Speedometer | Oriental Motor | OPX-2A | |
| Treadmill | Columbus Instruments | Exer-6M | |
| Infrared transmitter | Seeed Studio | TSAL6200 | |
| Infrared Receiver | Seeed Studio | TSOP382 | |
| Microcontroller | Silicon Labs | C8051F330 | |
| CCD camera | Canon Inc. | EOS 450D | |
| Image processing software | Adobe Systems Incorporated | ADOBE Photoshop CS5 12.0 | |
| Image analysis | Media Cybernetics | Pro Plus 4.50.29 | |
| Sodium pentobarbital | Sigma-Aldrich (Saint Louis, MO, USA) | SIGMA P-3761 | |
| Ketamine | Pfizer (Kent, UK) | 1867-66-9 | |
| Atropine | Taiwan Biotech Co., Ltd. (Taoyuan, Taiwan) | A03BA01 | |
| Xylazine | Sigma-Aldrich (Saint Louis, MO, USA) | SIGMA X1126 | |
| Buprenorphine | Sigma-Aldrich (Saint Louis, MO, USA) | B9275 |
References
- Mayo, N. E., Wood-Dauphinee, S., Cote, R., Durcan, L., Carlton, J. Activity, participation, and quality of life 6 months poststroke. Arch Phys Med Rehabil. 83 (8), 1035-1042 (2002).
- Duncan, P. W., Goldstein, L. B., Horner, R. D., Landsman, P. B., Samsa, G. P., Matchar, D. B. Similar motor recovery of upper and lower-extremities after stroke. Stroke. 25 (6), 1181-1188 (1994).
- Raichlen, D. A., Gordon, A. D. Relationship between exercise capacity and brain size in mammals. PLoS One. 6 (6), (2011).
- Trejo, J. L., Carro, E., Torres-Aleman, I. Circulating insulin-like growth factor I mediates exercise-induced increases in the number of new neurons in the adult hippocampus. J Neurosci. 21 (5), 1628-1634 (2001).
- Zhang, F., Wu, Y., Jia, J. Exercise preconditioning and brain ischemic tolerance. Neuroscience. 177, 170-176 (2011).
- Wang, R. Y., Yang, Y. R., Yu, S. M. Protective effects of treadmill training on infarction in rats. Brain Res. 922 (1), 140-143 (2001).
- Ding, Y., et al. Exercise pre-conditioning reduces brain damage in ischemic rats that may be associated with regional angiogenesis and cellular overexpression of neurotrophin. Neuroscience. 124 (3), 583-591 (2004).
- Li, J., Luan, X. D., Clark, J. C., Rafols, J. A., Ding, Y. C. Neuroprotection against transient cerebral ischemia by exercise pre-conditioning in rats. Brain Res. 26 (4), 404-408 (2004).
- Leasure, J. L., Jones, M. Forced and voluntary exercise differentially affect brain and behavior. Neuroscience. 156 (3), 456-465 (2008).
- Chen, C. C., et al. A Forced running wheel system with a microcontroller that provides high-intensity exercise training in an animal ischemic stroke model. Braz J Med Biol Res. 47 (10), 858-868 (2014).
- Chen, C. -C., et al. Improved infrared-sensing running wheel systems with an effective exercise activity indicator. PLoS One. 10 (4), (2015).
- Fantegrossi, W. E., Xiao, W. R., Zimmerman, S. M. Novel technology for modulating locomotor activity as an operant response in the mouse: Implications for neuroscience studies involving "exercise" in rodents. J Neurosci Methods. 212 (2), 338-343 (2013).
- Hayes, K., et al. Forced, not voluntary, exercise effectively induces neuroprotection in stroke. Acta Neuropathol. 115 (3), 289-296 (2008).
- Arida, R. M., Scorza, C. A., da Silva, A. V., Scorza, F. A., Cavalheiro, E. A. Differential effects of spontaneous versus forced exercise in rats on the staining of parvalbumin-positive neurons in the hippocampal formation. Neurosci Lett. 364 (3), 135-138 (2004).
- Waters, R. P., et al. Selection for aerobic capacity affects corticosterone, monoamines and wheel-running activity. Physiol Behav. (4-5), 1044-1054 (2008).
- Ke, Z., Yip, S. P., Li, L., Zheng, X. -X., Tong, K. -Y. The effects of voluntary, involuntary, and forced exercises on brain-derived neurotrophic factor and motor function recovery: A rat brain ischemia model. PLoS One. 6 (2), (2011).
- Caton, S. J., et al. Low-carbohydrate high-fat diets in combination with daily exercise in rats: Effects on body weight regulation, body composition and exercise capacity. Physiol Behav. 106 (2), 185-192 (2012).
- C8051F330/1/2/3/4/5 datasheet. , Silicon Laboratories Inc. Available from: https://www.silabs.com/Support%20Documents/TechnicalDocs/C8051F33x.pdf (2006).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Chen, J. L., et al. Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats. Stroke. 32 (4), 1005-1011 (2001).
- Chang, M. -W., Young, M. -S., Lin, M. -T. An inclined plane system with microcontroller to determine limb motor function of laboratory animals. J Neurosci Methods. 168 (1), 186-194 (2008).
- Gartshore, G., Patterson, J., Macrae, I. M. Influence of ischemia and reperfusion on the course of brain tissue swelling and blood-brain barrier permeability in a rodent model of transient focal cerebral ischemia. Exp Neurol. 147 (2), 353-360 (1997).
- Chen, F., et al. Rodent stroke induced by photochemical occlusion of proximal middle cerebral artery: Evolution monitored with MR imaging and histopathology. Eur J Radiol. 63 (1), 68-75 (2007).
- Almenning, I., Rieber-Mohn, A., Lundgren, K. M., Lovvik, T. S., Garnaes, K. K., Moholdt, T. Effects of high intensity interval training and strength training on metabolic, cardiovascular and hormonal outcomes in women with polycystic ovary syndrome: a pilot study. PLoS One. 10 (9), (2015).
- Costigan, S. A., Eather, N., Plotnikoff, R. C., Taaffe, D. R., Lubans, D. R. High-intensity interval training for improving health-related fitness in adolescents: a systematic review and meta-analysis. Br J Sports Med. 49 (19), (2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved