É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um mecanismo baseado em roda de corrida inovadora para melhorar o desempenho Rat Formação
Neste Artigo
Resumo
Este estudo apresenta um sistema de mobilidade animais inovadora à base de roda de corrida para quantificar uma atividade efetivo exercício em ratos. Um testbed ideal para rato é construído, usando uma curva de aceleração adaptativa predefinido, e uma alta correlação entre a taxa de efetivo exercício eo volume de infarto sugere o potencial do protocolo para experiências de prevenção de acidente vascular cerebral.
Resumo
Este estudo apresenta um sistema de mobilidade dos animais, equipada com uma roda de corrida posicionamento (PRW), como uma maneira de quantificar a eficácia de uma actividade de exercício para reduzir a gravidade dos efeitos do acidente vascular cerebral em ratos. Este sistema fornece o treinamento físico dos animais mais eficaz do que os sistemas disponíveis no mercado, tais como esteiras e rodas de funcionamento motorizados (MRWs). Em contraste com a MRW que só podem atingir velocidades abaixo de 20 m / min, os ratos são autorizados a circular a uma velocidade estável de 30 m / min em uma faixa mais espaçoso e borracha running de alta densidade suportado por uma roda de acrílico de 15 cm de largura, com um diâmetro de 55 cm neste trabalho. Utilizando uma curva de aceleração adaptativa predefinido, o sistema não só reduz o erro do operador, mas também treina os ratos para executar persistentemente até uma intensidade especificado for atingido. Como uma maneira de avaliar a eficácia de exercício, posição em tempo real de uma ratazana é detectada por quatro pares de sensores de infravermelhos implantados na roda de funcionamento. uma vez que umcurva de aceleração adaptativa é iniciada usando um microcontrolador, os dados obtidos pelos sensores de infravermelhos são automaticamente registados e analisados num computador. Para fins de comparação, três semanas de treinamento é realizado em ratos usando uma escada rolante, um MRW e uma PRW. Depois de induzir cirurgicamente oclusão da artéria cerebral média (MCAo), as pontuações modificados neurológicos severidade (MNSS) e um teste de plano inclinado foram conduzidos para avaliar os danos neurológicos aos ratos. PRW é validada experimentalmente como o mais eficaz entre tais sistemas de mobilidade animal. Além disso, uma medida de eficácia exercício, com base na análise posição de rato, mostrou que existe uma alta correlação negativa entre o exercício eficaz e o volume de enfarte, e podem ser utilizados para quantificar a formação de um rato em qualquer tipo de danos cerebrais experiências de redução.
Introdução
Strokes existe continuamente como um encargo financeiro para os países em todo o mundo, deixando inúmeros pacientes deficientes físicos e mentais 1, 2. Há evidências clínicas que sugerem que o exercício regular pode melhorar a regeneração do nervo e fortalecer conexões neurais 3, 4, e também é mostrado que o exercício pode diminuir o risco de sofrer acidentes vasculares cerebrais isquêmicos 5. Com qualquer uma esteira ou uma roda de corrida como um sistema de treinamento físico, roedores, tais como ratos, servir como um proxy para os seres humanos para testar a eficácia de exercícios de uma grande maioria dos experimentos clínicos 6 - 8. Um sistema de formação normalmente envolve a formação de um rato por um determinado período de tempo, durante o qual um rato corre a uma determinada velocidade. Portanto, a intensidade de treinamento é geralmente calculado de acordo com a velocidade e duração de exercício 6-8. A mesma abordagem é aplicada aosestimar a quantidade de exercício necessária para a proteção neurofisiológica. No entanto, os exercícios experimentais às vezes são considerados ineficazes, tais como quando um esbarra rato, quedas, ou agarra os trilhos uma vez que eles são incapazes de acompanhar a corrida de velocidade da roda 9-11. Escusado será dizer que os incidentes de exercícios ineficazes reduzir significativamente o benefício do exercício. Mesmo que não há qualquer abordagem universalmente aceito atualmente para quantificar os exercícios eficazes para reduzir os danos cerebrais, o nível de exercícios eficazes ainda permanece como uma avaliação objetiva para os investigadores clínicos para ilustrar os benefícios do exercício na disciplina de neurofisiologia.
Existem uma série de limitações em sistemas de mobilidade em animais disponíveis comercialmente usados em danos cerebrais experimentos de redução de hoje 12. Num caso tapete rolante, os ratos são forçados a rodar por meio de descargas eléctricas, induzindo tremenda psicológicastress nos animais e, assim, a interferência no teste neurofisiológico os resultados finais 8, 13, 14. rodas em execução podem ser classificados em dois tipos, ou seja, voluntários e forçados. Rodas de corrida voluntária permitir que os ratos a correr naturalmente, criando variabilidade excessiva devido às diferenças de características e habilidades 15 físicas dos ratos, enquanto motorizados rodas em execução (MRWs) empregam um motor para girar a roda, forçando os ratos para ser executado. Apesar de ser também uma forma de treinamento forçado, MRWs impõe menos stress psicológico em ratos do que escadas rolantes 13, 16, 17. No entanto, experimentos usando MRWs relataram que ratos às vezes interromper o exercício, agarrando os trilhos na pista roda e recusando-se a correr a velocidades superiores a 20 m / min 9. Estes exemplos mostram que os sistemas de mobilidade dos animais actualmente disponíveis têm uma desvantagem inerente que inibe eficaz exercício. Parafins de treinamento rato objectivos, o desenvolvimento de um sistema de formação altamente eficaz, mas com baixa interferência é, portanto, vista como uma questão urgente para experimentos exercício neurofisiológicos.
Este estudo apresenta um sistema de roda de funcionamento altamente eficaz para experiências em reduzir a gravidade dos efeitos do acidente vascular cerebral 11. Além de um número reduzido de fatores de interferência durante um processo de formação, este sistema detecta a posição de marcha de um rato usando sensores infravermelhos embutidos no volante, conseguindo assim uma estimativa mais confiável da atividade de exercício eficaz. O estresse psicológico imposto pela esteiras tradicionais e as interrupções de exercícios frequentes na MRWs tanto distorcer a objetividade das estimativas de exercício resultantes. Um sistema de roda de posicionamento em execução (PRW) apresentada neste estudo é desenvolvido em uma tentativa de minimizar a interferência indesejada, proporcionando um modelo de formação confiável para quantificar exe eficazrcise.
Protocolo
Declaração de Ética: Os procedimentos experimentais foram aprovados pelo comitê de ética animal of Southern Taiwan University of Science and Technology Laboratory Animal Center, Conselho Nacional de Ciência, República da China (Tainan, Taiwan).
1. Construção da Estrutura roda de corrida
Nota: Todos os acrílico deve ser transparente. Lave a roda desmontada com água, em seguida, usar álcool para limpar a faixa de borracha e chapas acrílicas após cada utilização.
- Obter uma roda de corrida acrílico a ser de 55 cm de diâmetro e 15 cm de largura.
NOTA: Esta roda é maior do que a tradicional roda de corrida (diâmetro = 35 cm; width = 12 cm) (F igura 1A). - Utilizando um cortador, cortar uma abertura de quarto de círculo em um lado da roda de corrida para actuar como uma entrada e uma saída, bem como para os ratos (Figura 1B). Coloque uma camada de esteira de borracha de alta fricção no interior do ACRroda ylic (Figura 1B).
- Colocar uma barra de ferro com rolamentos para ligar a roda de rolamento (Figura 1B). Colocar duas colunas triangulares acrílico em ambos os lados da roda de corrida para actuar como a estrutura de suporte (Figura 1B).
- Junte uma folha semicircular espessura de 1 mm, transparente acrílico para os lados externos das duas colunas triangulares usando parafusos. Use esta folha para implantar os sensores infravermelhos. Certifique-se de que as folhas de acrílico são de aproximadamente 3 cm de distância de cada lado da roda de funcionamento.
2. Implantar os sensores infravermelhos e definir a área de exercício da efectiva
NOTA: Leve em conta o tamanho da roda de corrida eo comprimento do rato no desenho de um sistema infravermelho. Um rato única desencadeia um único sensor de cada vez. Nesta experiência, os ratos são entre 20 e 23 cm de comprimento.
- Faça um furo nas placas de acrílico cada (intervalo de arco = 21 cm) 45 °, com a distânciaentre dois furos que é aproximadamente equivalente ao comprimento de um rato de teste. Fazer os furos do mesmo tamanho que os sensores de infravermelho (Figura 2A).
NOTA: Para MRWs tradicionais, perfurar um buraco a cada 70 ° (intervalo de arco = 21 cm, Figura 2B). - Durante uma experiência PRW, manter os ratos a um estado estacionário de correr entre 0 ° a 135 °.
NOTA: Assim definir esta área como a área efetivo exercício, enquanto a vista todas as outras secções como as áreas de exercício ineficazes. Para MRWs tradicionais, definem a área de exercício eficaz como a fracção entre 0 ° a 140 ° (Figura 2B).
3. Condução A roda de correr
- Use um motor DC sem escovas e um motorista do motor para conduzir a roda de corrida.
- Montar um disco de borracha 10 cm de diâmetro no eixo central do motor (Figura 1B).
- Usando a estrutura de ferro e as molas para apoiar o motor, ligar o disco de borracha deeixo central do motor para o lado exterior da roda de funcionamento.
NOTA: As molas devem cooperar com os parafusos para permitir ajustes de altura do motor dinâmico e para evitar disco de borracha seja desligado para a pista roda de corrida por causa de molas soltas. - Operar o motor para conduzir o disco de borracha diâmetro de 10 cm, usando um microcontrolador, e observar a roda girar devido ao atrito entre o disco de borracha e da pista da roda, criando uma plataforma roda de corrida motorizada.
- Montagem quatro sensores infravermelhos sequencialmente entre 0 ° a 135 ° (Figura 2A).
NOTA: Para MRWs tradicionais, sensores de montagem entre 0 ° a 140 ° (Figura 2B). - Conectar quatro pares de sensores de infravermelhos montadas em ambas as folhas de acrílico para pinos gerais do microcontrolador utilizando cabos de núcleo único, formando assim um sistema de posicionamento roda de funcionamento.
4. Construção de uma Adaptive Acceleratiem Curva
- Três dias antes do início da formação oficial exercício três semanas, treinar ratos, operando manualmente a roda de corrida.
NOTA: O objetivo é permitir que os ratos para se familiarizar com o ambiente de funcionamento, e é para testar se cada rato pode suportar rodando a 20 m / min.- Durante o treinamento operada manualmente, gradualmente acelerar a velocidade de corrida até que um rato é incapaz de manter o ritmo. Quando isto ocorre, diminuir a velocidade até o rato recupera a um ritmo constante de corrida, e em seguida aumentar progressivamente a velocidade de novo até que o rato atinge 20 m / min (linhas a tracejado na Figura 3). O treinamento manual envolve sete ratos para construir as curvas de treinamento.
- Usando uma equação numérica para ajustar os dados medidos no Dia 3 do teste manual, calcular as curvas de aceleração mais próximas da formação manual (a curva com círculos, Figura 3). Equation Fit 1 a dados brutos, onde C ini = 8, C fin = 20 e τ = 30 representam a velocidade inicial, a velocidade final e constante, respectivamente, o tempo).
NOTA: Esta equação se adapta à condição do corpo de um rato. Portanto, consulte a curva calculada como um modelo de formação de aceleração adaptativo.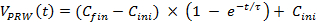 (1)
(1) - Use a Equação 1 para a Semana 1 do treinamento formal.
- Por semanas 2 e 3 da formação, ajustar os parâmetros de uma equação, isto é, mudança de A a partir de 12 a 22, para permitir que a velocidade para atingir 30 m / min.
5. Controlar o Programa de Software
NOTA: Exclusivamente desenvolver um código para a operação do motor com base em microcontrolador e para transmissão de sinais a partir dos sensores de infravermelhos para um computador para análise de dados subsequente.
- Use uma linguagem de programação C para escrever um programa de controle de software contendo um programa principal e duas rotinas de serviço de interrupção para o temporizador emo microcontrolador 18.
- Verifique se o programa principal inicializa registo do microcontrolador e constrói um modelo de curva de aceleração adaptativa na memória do microcontrolador.
- Use a rotina de temporizador 0-serviço de interrupção para ativar a curva de aceleração adaptativa e calcular a duração do treino inteiro.
- Utilizar a rotina de temporizador 1-serviço de interrupção para extrair os dados do sinal dos sensores de infravermelhos e para transferir os dados para o computador.
- Use o programa principal para gravar a posição do 0 o para ajustar a velocidade da roda de corrida.
- Uma vez que o sensor de recepção de IV, a 0 ° C é desencadeada, interpretar como uma incidência de queda, que é acumulado pelo programa principal. No momento em que os tempos de ocorrência de incidentes queda atinge o limiar de 10% do número de detecções de posição rato, deaccelerate a roda de corrida automaticamente como medida de segurança para ratos treinados. NOTA: A velocidade of roda em execução é reduzida até que o rato pode retornar à zona segura (0 o a 135 o) e manter um estado de execução estável para a medida de segurança.
6. Operação do Sistema de Posicionamento roda de corrida
- Ligue o microcontrolador e esperar por um operador a pressionar o botão para iniciar modelo de treinamento de cada semana.
- Pressione o botão "Iniciar" para iniciar o modelo de formação para a Semana 1.
NOTA: O motor acelera automaticamente com base na curva de aceleração adaptativa até atingir 20 m / min, e pára automaticamente após 30 min. - Pressione o botão "Iniciar" para iniciar o modelo de formação para a Semana 2.
NOTA: O motor acelera automaticamente com base na curva de aceleração adaptativa até atingir 30 m / min, e pára automaticamente após 30 min. - Pressione o botão "Iniciar" para iniciar o modelo de formação para a Semana 3.
NOTA: O motor automaticamente Accelerates com base na curva de aceleração adaptativa até atingir 30 m / min, e pára automaticamente após 60 min.
NOTA: Durante todo o processo de formação, transmitir os dados dos sinais recebidos dos sensores de infravermelho para um computador sem fio.
- Pressione o botão "Iniciar" para iniciar o modelo de formação para a Semana 1.
- Usando um computador, analisar os dados de localização para obter uma medida de exercício efectivo de todo o processo de exercício (
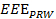 ). Ver Equação 2.
). Ver Equação 2. 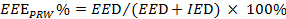 (2)
(2)
NOTA: EEE, EED e IED representam a medida de exercício efectivo, as durações eficazes e ineficazes de exercício, respectivamente.
7. Formação de Rats
- Dividir aleatoriamente adulto ratos Sprague-Dawley machos em cinco grupos (n = 9 em cada grupo): A simulados, controlo, esteira, grupos MRW e PRW.
- Realizar um treinamento físico três semanas para os três grupos de exercício, ou seja, o trgrupos eadmill, MRW e PRW, apesar de não fazer para o os grupos de controle e sham.
NOTA: O exercício físico três semanas para cada grupo de exercício é de 20 m / min durante 30 min durante a Semana 1, 30 m / min durante 30 min durante a Semana 2 e 30 m / min durante 60 min durante a Semana 3.
8. Animal e do curso Modelo
- Como indicado no Sec. 7.1, dividir aleatoriamente todos os adultos machos Sprague-Dawley envolvidos, pesando entre 250-280 g, em 5 grupos.
- Pesar todos os animais para assegurar cálculos de dosagem de drogas precisos. Anestesiar os ratos com pentobarbital de sódio (25 mg / kg, intraperitonealmente [IP]) e uma mistura contendo cetamina (4,4 mg / kg, por via intramuscular [im]), atropina (0,02633 mg / kg, [im]) e xilazina (6,77 mg / kg, [im]).
- Avaliar a profundidade anestésica, monitorando a taxa de respiração (normal 70-115 ciclos / min), ritmo, profundidade da respiração, cor das mucosas e testes regulares de reflexos, por exemplo toe pitada, pitada cauda, pálpebras / cíliose palpebral.
- Inserir sondas de temperatura no reto, e manter as temperaturas retais entre 37-37,5 ° C, utilizando lâmpadas de aquecimento separadas.
- Induzir a isquemia focal, a oclusão da artéria cerebral média transiente (MCAo) através da inserção de um filamento na artéria carótida interna para ocluir o orifício da artéria cerebral média por via da artéria carótida externa 19.
- Executar os mesmos procedimentos operacionais sobre os animais operados de forma simulada, enquanto que não introduza um filamento para dentro da artéria carótida interna. Manter a isquemia cerebral focal durante 1 h, remover o filamento, fechar a incisão, e em seguida, deixar a 1 cm da sutura de nylon saliente, que pode ser retirada para permitir a reperfusão.
- Administrar por via subcutânea (sc), injecções de um analgésico (buprenorfina (0,05 mg / kg, sc)), nos animais para a analgesia duas vezes por dia durante 3 dias.
9. Avaliação de Danos Neural
- evaluate funções neurológicas e motoras, respectivamente, pelo escore de gravidade neurológica (MNSS) 20 e um teste de plano inclinado 21.
NOTA: MNSS é um compósito do motor (estado muscular, movimento anormal), sensoriais (visuais, tácteis e proprioceptivo) e testes de reflexo. Dê um ponto para a falha para executar uma tarefa. função de taxa neurológica em uma escala de 0-18 (pontuação normais = 0; pontuação déficit máximo = 18). - Avaliar todos os ratos em termos de desempenho comportamental no dia antes e diariamente durante um período de tempo de 7 dias após a cirurgia.
- Medir a força de preensão da pata traseira do rato, utilizando um plano inclinado.
- Coloque ratos no aparelho de escalar inclinado, numa base diária, e aclimatar os ratos ao aparelho e as condições de teste de uma semana antes do ensaio.
- Colocar cada rato no aparelho e encorajar o rato para subir a plataforma até que o topo do aparelho durante o período de aclimatação.
- Coloque o rato ema parte superior do aparelho com a cabeça para baixo durante o teste. Assegure-se que o eixo do corpo das estadias de rato ao longo de uma superfície de borracha com nervuras 2 20 x 20 cm no plano inclinado a partir de um ângulo de 25 °.
- Aumentar o ângulo de forma dinâmica usando um parafuso de esfera, ligada com um motor de passo para determinar o ângulo máximo a que um animal pode realizar ao plano. Aumentar o ângulo do plano inclinado gradualmente até que o rato não conseguiu segurar no plano inclinado, e, em seguida, detectar um evento de deslizamento para baixo. O grau de base de plano inclinado é de 25 ° no começo.
- Peça a dois observadores (sem saber o que o tratamento dos ratos tinha sido dado), para examinar de forma independente e marcar todos os testes comportamentais, ou seja, a média dos ângulos máximos do lado esquerdo e direito.
- Sacrifício de todos os animais no dia 7 após MCAo. Perfundir os corações dos animais sob anestesia profunda (pentobarbital de sódio 100 mg / kg, ip) com solução salina 22 . Remover e depois imergir o tecido cerebral em solução salina fria durante 5 min, que é então cortado em secções coronais de 2,0 mm usando um cortador de tecido 22.
- Submergir as secções de cérebro fresco em 2, 3, 5-trifeniltetrazólio cloreto de (TTC) a 37 ° C durante 30 min, em seguida, transferir as fatias para uma solução de formaldeído 5% de fi xação a 4 ° C durante 24 h. Coloque as fatias de cérebro coradas em um suporte de plexiglas.
- Fotografar as fatias TTC-corada com uma escala calibrada utilizando uma câmara CCD ligada a um computador pessoal carregado com o software de processamento de imagem. Use um sistema de análise de imagem semi-automatizado, assim como para estimar a área enfartada (mm 2) de cada fatia do cérebro TTC-corada 23.
- Calcule o volume total de enfarte para cada fatia pelo somatório das áreas infartadas de todas as fatias de cérebro. Marcar a área não corada (cérebro isquémico) separadamente em cada lado das fatias de 2 mm de espessura, em seguida, calcular o volume de enfarte e o valor médio.
- Calcufinal do volume de enfarte corrigido (CIV) como
CIV = {LT- (RT- RI)}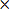 d (3)
d (3)
NOTA: Se LT e RT denotar as áreas dos hemisférios direito e esquerdo em mm 2, respectivamente, RI é a área de enfarte em mm 2, e d = 2 mm, é a espessura da fatia.
Resultados
Esta seção é dedicada a comparações, feita uma semana após a cirurgia, na pontuação MNSS, resultados de testes plano inclinado e cerebrais volumes de infarto entre os cinco grupos. Figura 4A e 4B apresentam os resultados médios MNSS e a média dos resultados dos testes plano inclinado, respectivamente. O grupo PRW aparece como o melhor em termos de melhoria MNSS. As diferenças significativas entre PRW e MRW e entre esteira e PRW sugerem clarame...
Discussão
Este protocolo descreve um sistema de roda de funcionamento altamente eficaz para reduzir a gravidade dos efeitos do acidente vascular cerebral em animais. Como um teste ideal para rato, esta plataforma está concebido também de tal modo que uma velocidade de funcionamento estável pode ser mantida por ratos ao longo de um processo de execução por meio de uma curva de aceleração adaptativa predeterminado. Em sistemas de formação típicas, as velocidades de formação programadas e durações são ajustados manual...
Divulgações
The authors have nothing to disclose.
Agradecimentos
The authors would like to thank Dr. Jhi-Joung Wang, who is the Vice Superintendent of Education at Chi-Mei Medical Center, and Dr. Chih-Chan Lin from the Laboratory Animal Center, Department of Medical Research, Chi-Mei Medical Center, 901 Zhonghua, Yongkang Dist., Tainan City 701, Taiwan, for providing the shooting venue. They would also like to thank Miss Ling-Yu Tang and Mr. Chung-Ham Wang from the Department of Medical Research, Chi-Mei Medical Center, Tainan, Taiwan, for their valuable assistance in demonstrating the prototype system in real experiments with rats. The author gratefully acknowledges the support provided for this study by the Ministry of Science and Technology (MOST 104- 2218-E-167-001-) of Taiwan.
Materiais
| Name | Company | Catalog Number | Comments |
| Brushless DC motor | Oriental Motor | BLEM512-GFS | |
| Motor driver | Oriental Motor | BLED12A | |
| Motor reducer | Oriental Motor | GFS5G20 | |
| Speedometer | Oriental Motor | OPX-2A | |
| Treadmill | Columbus Instruments | Exer-6M | |
| Infrared transmitter | Seeed Studio | TSAL6200 | |
| Infrared Receiver | Seeed Studio | TSOP382 | |
| Microcontroller | Silicon Labs | C8051F330 | |
| CCD camera | Canon Inc. | EOS 450D | |
| Image processing software | Adobe Systems Incorporated | ADOBE Photoshop CS5 12.0 | |
| Image analysis | Media Cybernetics | Pro Plus 4.50.29 | |
| Sodium pentobarbital | Sigma-Aldrich (Saint Louis, MO, USA) | SIGMA P-3761 | |
| Ketamine | Pfizer (Kent, UK) | 1867-66-9 | |
| Atropine | Taiwan Biotech Co., Ltd. (Taoyuan, Taiwan) | A03BA01 | |
| Xylazine | Sigma-Aldrich (Saint Louis, MO, USA) | SIGMA X1126 | |
| Buprenorphine | Sigma-Aldrich (Saint Louis, MO, USA) | B9275 |
Referências
- Mayo, N. E., Wood-Dauphinee, S., Cote, R., Durcan, L., Carlton, J. Activity, participation, and quality of life 6 months poststroke. Arch Phys Med Rehabil. 83 (8), 1035-1042 (2002).
- Duncan, P. W., Goldstein, L. B., Horner, R. D., Landsman, P. B., Samsa, G. P., Matchar, D. B. Similar motor recovery of upper and lower-extremities after stroke. Stroke. 25 (6), 1181-1188 (1994).
- Raichlen, D. A., Gordon, A. D. Relationship between exercise capacity and brain size in mammals. PLoS One. 6 (6), (2011).
- Trejo, J. L., Carro, E., Torres-Aleman, I. Circulating insulin-like growth factor I mediates exercise-induced increases in the number of new neurons in the adult hippocampus. J Neurosci. 21 (5), 1628-1634 (2001).
- Zhang, F., Wu, Y., Jia, J. Exercise preconditioning and brain ischemic tolerance. Neuroscience. 177, 170-176 (2011).
- Wang, R. Y., Yang, Y. R., Yu, S. M. Protective effects of treadmill training on infarction in rats. Brain Res. 922 (1), 140-143 (2001).
- Ding, Y., et al. Exercise pre-conditioning reduces brain damage in ischemic rats that may be associated with regional angiogenesis and cellular overexpression of neurotrophin. Neuroscience. 124 (3), 583-591 (2004).
- Li, J., Luan, X. D., Clark, J. C., Rafols, J. A., Ding, Y. C. Neuroprotection against transient cerebral ischemia by exercise pre-conditioning in rats. Brain Res. 26 (4), 404-408 (2004).
- Leasure, J. L., Jones, M. Forced and voluntary exercise differentially affect brain and behavior. Neuroscience. 156 (3), 456-465 (2008).
- Chen, C. C., et al. A Forced running wheel system with a microcontroller that provides high-intensity exercise training in an animal ischemic stroke model. Braz J Med Biol Res. 47 (10), 858-868 (2014).
- Chen, C. -. C., et al. Improved infrared-sensing running wheel systems with an effective exercise activity indicator. PLoS One. 10 (4), (2015).
- Fantegrossi, W. E., Xiao, W. R., Zimmerman, S. M. Novel technology for modulating locomotor activity as an operant response in the mouse: Implications for neuroscience studies involving "exercise" in rodents. J Neurosci Methods. 212 (2), 338-343 (2013).
- Hayes, K., et al. Forced, not voluntary, exercise effectively induces neuroprotection in stroke. Acta Neuropathol. 115 (3), 289-296 (2008).
- Arida, R. M., Scorza, C. A., da Silva, A. V., Scorza, F. A., Cavalheiro, E. A. Differential effects of spontaneous versus forced exercise in rats on the staining of parvalbumin-positive neurons in the hippocampal formation. Neurosci Lett. 364 (3), 135-138 (2004).
- Waters, R. P., et al. Selection for aerobic capacity affects corticosterone, monoamines and wheel-running activity. Physiol Behav. (4-5), 1044-1054 (2008).
- Ke, Z., Yip, S. P., Li, L., Zheng, X. -. X., Tong, K. -. Y. The effects of voluntary, involuntary, and forced exercises on brain-derived neurotrophic factor and motor function recovery: A rat brain ischemia model. PLoS One. 6 (2), (2011).
- Caton, S. J., et al. Low-carbohydrate high-fat diets in combination with daily exercise in rats: Effects on body weight regulation, body composition and exercise capacity. Physiol Behav. 106 (2), 185-192 (2012).
- . C8051F330/1/2/3/4/5 datasheet Available from: https://www.silabs.com/Support%20Documents/TechnicalDocs/C8051F33x.pdf (2006)
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Chen, J. L., et al. Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats. Stroke. 32 (4), 1005-1011 (2001).
- Chang, M. -. W., Young, M. -. S., Lin, M. -. T. An inclined plane system with microcontroller to determine limb motor function of laboratory animals. J Neurosci Methods. 168 (1), 186-194 (2008).
- Gartshore, G., Patterson, J., Macrae, I. M. Influence of ischemia and reperfusion on the course of brain tissue swelling and blood-brain barrier permeability in a rodent model of transient focal cerebral ischemia. Exp Neurol. 147 (2), 353-360 (1997).
- Chen, F., et al. Rodent stroke induced by photochemical occlusion of proximal middle cerebral artery: Evolution monitored with MR imaging and histopathology. Eur J Radiol. 63 (1), 68-75 (2007).
- Almenning, I., Rieber-Mohn, A., Lundgren, K. M., Lovvik, T. S., Garnaes, K. K., Moholdt, T. Effects of high intensity interval training and strength training on metabolic, cardiovascular and hormonal outcomes in women with polycystic ovary syndrome: a pilot study. PLoS One. 10 (9), (2015).
- Costigan, S. A., Eather, N., Plotnikoff, R. C., Taaffe, D. R., Lubans, D. R. High-intensity interval training for improving health-related fitness in adolescents: a systematic review and meta-analysis. Br J Sports Med. 49 (19), (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados