È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un Esecuzione meccanismo innovativo Wheel-based per migliorare le prestazioni Rat Formazione
In questo articolo
Riepilogo
Questo studio presenta un sistema di mobilità degli animali innovativo a base di ruota in esecuzione di quantificare un attività di esercitazione efficace nei ratti. Un banco di prova topo-friendly è costruito, utilizzando una curva di accelerazione adattativo predefinita, e una forte correlazione tra il tasso effettivo esercizio e il volume dell'infarto suggerisce il potenziale del protocollo per gli esperimenti di prevenzione ictus.
Abstract
Questo studio presenta un sistema di mobilità animale, dotato di una ruota di posizionamento esecuzione (PRW), come un modo per quantificare l'efficacia di un'attività esercizio per ridurre la gravità degli effetti della corsa in ratti. Questo sistema fornisce più efficace l'esercizio fisico degli animali rispetto ai sistemi disponibili in commercio, come tapis roulant e ruote da corsa motorizzate (MRW). Contrariamente ad un MRW che può raggiungere solo velocità inferiori a 20 m / min, i ratti sono autorizzati a funzionare ad una velocità stabile di 30 m / min su un più ampio e gomma funzionamento ad alta densità di traccia supportato da un largo 15 cm ruota acrilico un diametro di 55 cm in questo lavoro. Utilizzando una curva di accelerazione adattativo predefinita, il sistema non solo riduce l'errore dell'operatore pure treni i ratti per eseguire costantemente fino a raggiungere un'intensità specificato. Come un modo per valutare l'efficacia di esercizio, la posizione in tempo reale di un ratto viene rilevato da quattro coppie di sensori ad infrarossi distribuiti sulla ruota portante. una volta che uncurva di accelerazione adattativo viene iniziata utilizzando un microcontrollore, i dati ottenuti dai sensori infrarossi vengono automaticamente registrati e analizzati in un computer. A scopo di confronto, a 3 settimana di formazione è condotta su ratti utilizzando un tapis roulant, un MRW e PRW. Dopo chirurgicamente inducendo occlusione dell'arteria cerebrale media (MCAO), sono state condotte punteggi modificati neurologici di gravità (mNSS) e un test di piano inclinato per valutare i danni neurologici per i topi. PRW è sperimentalmente convalidato come il più efficace tra tali sistemi di mobilità animale. Inoltre, una misura dell'efficacia esercizio, sulla base di un'analisi posizione ratto, ha dimostrato che vi è una forte correlazione negativa tra l'esercizio effettivo e il volume dell'infarto, e può essere impiegato per quantificare una formazione di ratto in qualsiasi tipo di esperimenti riduzione dei danni cerebrali.
Introduzione
Strokes esistono continuamente come un onere finanziario per i paesi a livello globale, lasciando innumerevoli pazienti disabili fisici e psichici 1, 2. Ci sono prove cliniche che suggeriscono che l'esercizio fisico regolare può migliorare la rigenerazione dei nervi e rafforzare le connessioni neurali 3, 4, ed è anche dimostrato che l'esercizio fisico può ridurre il rischio di subire ictus ischemico 5. Sia con un tapis roulant o una ruota in esecuzione come un sistema di formazione esercizio, roditori, come i ratti, servire come proxy per gli esseri umani per testare l'efficacia di esercizi in una vasta maggioranza di esperimenti clinici 6 - 8. Un sistema di formazione comporta normalmente la formazione di un ratto per un certo periodo di tempo, durante il quale un topo funziona a una certa velocità. Pertanto, l'intensità di allenamento è generalmente calcolato in base alla velocità di esercizio e la durata 6 - 8. Lo stesso approccio viene applicatostimare la quantità di esercizio necessaria per la protezione neurofisiologico. Tuttavia, gli esercizi sperimentali si trovano a volte ad essere inefficaci, come ad esempio quando un ratto inciampa, cade, o afferra i binari, una volta che sono in grado di raggiungere con il funzionamento di velocità della ruota 9 - 11. Inutile dire che, episodi di esercizio inefficace riducono in modo significativo il beneficio esercizio. Anche se non vi è alcun metodo universalmente accettato attualmente di quantificare gli esercizi efficaci per ridurre i danni al cervello, il livello di esercizi efficaci si trova ancora come una valutazione oggettiva per i ricercatori clinici per illustrare i benefici di esercizio nella disciplina della neurofisiologia.
Ci sono una serie di limitazioni sui sistemi di mobilità degli animali disponibili in commercio utilizzati nei danni cerebrali esperimenti di riduzione di oggi 12. In un caso tapis roulant, i ratti sono costretti a correre per mezzo di scosse elettriche, inducendo tremenda psicologicolo stress sugli animali e quindi l'interferenza nel test neurofisiologico risultati finali 8, 13, 14. ruote in corso possono essere classificati in due tipi, vale a dire volontari e forzati. Ruote da corsa volontari consentono di eseguire ratti naturalmente, la creazione di eccessiva variabilità dovuta delle differenze di caratteristiche e abilità fisiche 15 dei ratti, mentre le ruote in esecuzione motorizzate (MRW) impiegano un motore a girare la ruota, costringendo i ratti per l'esecuzione. Nonostante anche essere una forma di addestramento forzato, MRW impone meno stress psicologico sui ratti di tapis roulant 13, 16, 17. Tuttavia, esperimenti usando MRW hanno riferito che i ratti a volte interrompono l'esercizio afferrando le rotaie sulla carreggiata e si rifiuta di funzionare a velocità superiori a 20 m / min 9. Questi esempi mostrano che i sistemi di mobilità degli animali attualmente disponibili hanno uno svantaggio intrinseco che inibisce efficace esercizio. Percorsi di formazione ratto oggettive, lo sviluppo di un sistema di formazione altamente efficace, ma con bassa interferenza è quindi visto come un problema urgente per gli esperimenti di esercizio neurofisiologici.
Questo studio presenta un sistema ruota in esecuzione altamente efficace per esperimenti sulla riduzione della gravità degli effetti della corsa 11. Oltre ad un ridotto numero di fattori di interferenza durante un processo di formazione, il sistema rileva la posizione di marcia di un ratto utilizzando sensori a infrarossi incorporati nella ruota, ottenendo così una stima più affidabile dell'attività esercizio effettivo. Lo stress psicologico imposto dal tapis roulant tradizionali e le frequenti interruzioni di esercizio in MRW sia inclinare l'oggettività delle stime di esercizio risultanti. Un sistema di ruota posizionatrice esecuzione (PRW) presentata in questo studio si sviluppa in un tentativo di minimizzare le interferenze indesiderate, fornendo un modello di formazione affidabile per quantificare exe efficacercise.
Protocollo
Etica Dichiarazione: Le procedure sperimentali sono state approvate dal comitato etico degli animali di Southern Taiwan University of Science and Technology Laboratory Animal Center, National Science Council, Repubblica di Cina (Tainan, Taiwan).
1. Costruire la struttura ruota in esecuzione
Nota: Tutti acrilico dovrebbe essere trasparente. Lavare la ruota smontata con acqua, quindi utilizzare alcool per pulire la pista di gomma e lastre acriliche dopo ogni utilizzo.
- Ottenere una ruota portante acrilica essere di 55 cm di diametro e 15 cm di larghezza.
NOTA: Questa ruota è più grande di una ruota tradizionale corsa (diametro = 35 cm; width = 12 cm) (F IGURA 1A). - Utilizzando un cutter, tagliare un'apertura quarto di cerchio in un lato della ruota portante di agire come un ingresso e un'uscita, nonché per i ratti (Figura 1B). Posizionare uno strato di alto attrito cingolo in gomma all'interno della acrrotella ylic (Figura 1B).
- Inserire un tondino di ferro con cuscinetti per collegare la ruota portante (Figura 1B). Inserire due colonne triangolari acrilico su entrambi i lati della ruota portante di agire come telaio di supporto (Figura 1B).
- Attaccare uno spesso foglio di 1 millimetro semicircolare acrilico trasparente ai lati esterni delle due colonne triangolari con viti. Utilizzare questa scheda per distribuire i sensori a raggi infrarossi. Assicurarsi che le lastre acriliche sono circa 3 cm di distanza da ciascun lato della ruota portante.
2. Distribuire i sensori a infrarossi e la definizione del esercizio Area effettiva
NOTA: Prendere in considerazione le dimensioni della ruota esecuzione e la lunghezza topo nella progettazione di un sistema a infrarossi. Un ratto innesca un solo sensore per volta. In questo esperimento, i ratti sono lunghi tra 20 e 23 cm.
- Praticare un foro nelle lastre acriliche ogni (intervallo di arco = 21 cm) a 45 °, con la distanzatra due fori essendo meno equivalente alla lunghezza di un ratto test. Effettuare i fori della stessa dimensione come i sensori a infrarossi (Figura 2A).
NOTA: Per MRW tradizionali, praticare un foro ogni 70 ° (intervallo di arco = 21 cm, Figura 2b). - Durante un esperimento PRW, mantenere i ratti a regime di esecuzione tra 0 ° a 135 °.
NOTA: Così definire questa zona come l'area esercizio effettivo, mentre vista tutte le altre sezioni, come le aree di esercizio inefficaci. Per MRW tradizionali, definire la zona di esercizio efficace come la parte tra 0 ° a 140 ° (Figura 2B).
3. Guidare la ruota in esecuzione
- Usare un motore DC brushless e un driver del motore per guidare la ruota in esecuzione.
- Montare un disco di gomma 10 cm di diametro sull'asse centrale del motore (Figura 1B).
- Utilizzando la struttura in ferro e molle per sostenere il motore, collegare il disco di gomma dall'asse centrale del motore al lato esterno della ruota portante.
NOTA: Le molle devono cooperare con le viti per consentire regolazioni in altezza del motore dinamico e per impedire disco di gomma di essere staccato alla carreggiata corsa a causa di molle allentate. - Azionare il motore per azionare il disco di gomma 10 cm di diametro con un microcontrollore, e osservare la ruota ruotare a causa dell'attrito tra il disco di gomma e la pista di ruota, creando una piattaforma ruota in esecuzione motorizzata.
- Mount quattro sensori infrarossi sequenzialmente da 0 ° a 135 ° (Figura 2A).
NOTA: per MRW tradizionali, montare sensori tra 0 ° e 140 ° (Figura 2B). - Collegare quattro coppie di sensori a infrarossi montati in entrambe le lastre acriliche ai pin generali del microcontrollore utilizzando cavi unipolari, formando così un sistema di posizionamento ruota in esecuzione.
4. Costruire un Adaptive Acceleratisulla curva
- Tre giorni prima dell'inizio delle tre settimane di formazione ufficiale esercizio, allenare i ratti azionando manualmente la ruota in esecuzione.
NOTA: L'obiettivo è quello di permettere ai topi di familiarizzare con l'ambiente in esecuzione, ed è quello di verificare se ogni ratto può sopportare in esecuzione a 20 m / min.- Durante la formazione azionato manualmente, accelerare gradualmente la velocità di funzionamento fino un ratto è in grado di tenere il passo. Quando si verifica ciò, diminuire la velocità fino ratto riacquista un ritmo funzionamento costante, e quindi aumentare gradualmente la velocità fino a che il ratto raggiunge i 20 m / min (linee tratteggiate in figura 3). La formazione manuale coinvolge sette ratti per costruire le curve di formazione.
- Utilizzando una equazione numerica per adattarsi ai dati misurati il giorno 3 del test manuale, calcolare le curve di accelerazione più vicini alla formazione manuale (la curva con cerchi, Figura 3). Adatta Equazione 1 a dati grezzi, dove C ini = 8, C pinna = 20 e τ = 30 rappresentano la velocità iniziale, la velocità finale e la costante di tempo, rispettivamente).
NOTA: Questa equazione si adatta alle condizioni del corpo di un topo. Pertanto, fare riferimento alla curva calcolata come un modello di accelerazione-formazione di adattamento.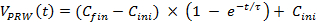 (1)
(1) - Utilizzare Equazione 1 per settimana 1 della formazione formale.
- Per settimane 2 e 3 della formazione, regolare i parametri di Equazione 1, vale a dire, il cambiamento A da 12 a 22, per consentire la velocità per arrivare a 30 m / min.
5. Controllo del Programma software
NOTA: Esclusivamente sviluppare un codice per il funzionamento del motore a microcontrollore e la trasmissione dei segnali dai sensori infrarossi a un computer per la successiva analisi dei dati.
- Utilizzare il linguaggio di programmazione C per scrivere un programma di controllo del software contenente un programma principale e due routine di interrupt-service per il timer ail microcontrollore 18.
- Assicurarsi che il programma principale inizializza il registro del microcontrollore e costruisce un modello di curva di accelerazione adattativo nella memoria del microcontrollore.
- Utilizzare la routine di interrupt-servizio Timer 0 per attivare la curva di accelerazione adattativo e calcolare l'intera durata della formazione.
- Utilizzare la routine di interrupt-servizio Timer 1 per estrarre i dati di segnale dai sensori infrarossi e trasferire i dati al computer.
- Utilizzare il programma principale per registrare la posizione di 0 o per regolare la velocità della ruota portante.
- Una volta che il sensore di ricezione IR a 0 ° viene attivato, interpretarlo come incidenza caduta, che viene accumulata dal programma principale. Il momento in cui i tempi di occorrenza di incidenza caduta colpisce la soglia del 10% del numero dei rilevamenti posizione ratto, deaccelerate ruota portante automaticamente come misura di sicurezza per i ratti addestrati. NOTA: La velocità of ruota di esecuzione si riduce fino a quando il topo può tornare alla zona di sicurezza (0 o al 135 o) e mantenere uno stato di esecuzione stabile per la misura di sicurezza.
6. operativo Running Wheel System Positioning
- Accendere il microcontrollore e attendere che un operatore di premere il pulsante per avviare il modello di formazione di ogni settimana.
- Premere il pulsante "Start" per avviare il modello di formazione per la Settimana 1.
NOTA: Il motore accelera automaticamente in base alla curva di accelerazione adattativo fino a raggiungere 20 m / min, e si ferma automaticamente dopo 30 min. - Premere il pulsante "Start" per avviare il modello di formazione per la Settimana 2.
NOTA: Il motore accelera automaticamente in base alla curva di accelerazione adattativo fino a raggiungere 30 m / min, e si ferma automaticamente dopo 30 min. - Premere il pulsante "Start" per avviare il modello di formazione per la Settimana 3.
NOTA: Il motore automaticamente Accelerates basati sulla curva di accelerazione adattativo fino a raggiungere 30 m / min, e si ferma automaticamente dopo 60 min.
NOTA: Durante l'intero processo di formazione, trasmettere i dati del segnale ricevuto dai sensori infrarossi a un computer wireless.
- Premere il pulsante "Start" per avviare il modello di formazione per la Settimana 1.
- Utilizzando un computer, analizzare i dati di posizione per ottenere una misura efficace esercizio per l'intero processo di esercizio (
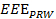 ). Vedere Equazione 2.
). Vedere Equazione 2. 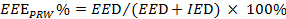 (2)
(2)
NOTA: EEE, EED e IED rappresentano la misura esercizio effettivo, la durata di esercizio efficaci e inefficaci, rispettivamente.
7. La formazione dei Ratti
- Casualmente dividere maschio adulto ratti Sprague-Dawley in cinque gruppi (n = 9 per ogni gruppo): i finti, controllo, tapis roulant, MRW e PRW gruppi.
- Condurre un esercizio fisico tre settimane per i tre gruppi di esercizio, vale a dire il TReadmill, MRW e PRW gruppi, mentre non lo fanno per la farsa e gruppi di controllo.
NOTA: La formazione esercizio 3 settimane per ciascun gruppo di esercizio è di 20 m / min per 30 minuti durante la settimana 1, 30 m / min per 30 minuti durante la settimana 2 e 30 m / min per 60 minuti durante la Settimana 3.
8. animali e Stroke Modello
- Come indicato nella Sez. 7.1, dividere in modo casuale tutti i maschi adulti ratti Sprague-Dawley coinvolte, di peso compreso tra 250-280 g, in 5 gruppi.
- Pesare tutti gli animali al fine di garantire i calcoli di dosaggio della droga precisi. Anestetizzare i ratti con pentobarbital sodico (25 mg / kg, intraperitoneale [ip]) ed una miscela contenente ketamina (4.4 mg / kg, intramuscolare [im]), atropina (0,02,633 mila mg / kg, [im]) e xilazina (6,77 mg / kg, [im]).
- Valutare la profondità di anestesia monitorando la frequenza respiratoria (normali 70-115 respiri / min), il ritmo, la profondità della respirazione, colore delle mucose e controllo periodico dei riflessi, ad esempio pizzico punta, coda pizzico, palpebra / cigliae palpebrale.
- Inserire sonde di temperatura nel retto, e mantenere le temperature rettali tra 37-37,5 ° C utilizzando lampade individuali di riscaldamento.
- Indurre ischemia focale transitoria cerebrale media occlusione (MCAO) inserendo un filamento in arteria carotide interna per occludere l'orifizio dell'arteria cerebrale media tramite carotide esterna approccio arteria 19.
- Eseguire le stesse modalità operative sugli animali sham-operati, mentre non inserire un filamento in arteria carotide interna. Mantenere ischemia cerebrale focale per 1 ora, togliere il filamento, chiudere l'incisione, e poi lasciare 1 cm di sutura di nylon sporgenti, che potrebbe essere ritirato per consentire la riperfusione.
- Somministrare sottocutanea (sc) iniezioni di analgesico (buprenorfina (0,05 mg / kg, sc)), in animali per l'analgesia due volte al giorno per 3 giorni.
9. Valutare neurale Danni
- EvalUATE neurologiche e motorie funzioni, rispettivamente, da parte del punteggio di gravità neurologica (mNSS) 20 e un test di piano inclinato 21.
NOTA: mNSS è un composto di motore (stato muscolare, movimenti anomali), sensoriali (visivo, tattile e propriocettiva) e test riflessi. Dare un punto per mancata esecuzione di un compito. Vota la funzione neurologica su una scala da 0-18 (punteggio normale = 0; massimo punteggio deficit = 18). - Valutare tutti i topi in termini di prestazioni del comportamento il giorno prima e tutti i giorni in un arco di tempo di 7 giorni dopo l'intervento chirurgico.
- Misurare la forza degli arti presa posteriore del ratto utilizzando un piano inclinato.
- Posizionare ratti sull'apparato arrampicata inclinata su base giornaliera, e acclimatarsi i ratti alla apparecchiatura e le condizioni di prova 1 settimana prima prova.
- Posizionare ogni ratto sull'apparato e incoraggiare il ratto di salire sulla piattaforma fino all'inizio della apparecchiatura durante il periodo di acclimatazione.
- Posizionare il ratto ala parte superiore dell'apparecchiatura con la testa verso il basso durante il test. Assicurarsi che l'asse del corpo dei soggiorni ratto lungo di 20 x 20 cm Spazio nervata 2 gomma sul piano inclinato a partire da un angolo di 25 °.
- Aumentare l'angolo dinamicamente utilizzando una vite a sfere collegato con un motore passo-passo per determinare l'angolo massimo a cui un animale poteva contenere al piano. Aumentare l'angolo del piano inclinato gradualmente fino mouse non trattiene sul piano inclinato, e quindi rilevare un evento scivolare giù. Il grado basale del piano inclinato è di 25 ° in principio.
- Chiedi due osservatori (ignari di ciò che il trattamento i topi erano state date), per esaminare in modo indipendente e segnare tutti i test comportamentali, vale a dire la media degli angoli massimi sinistro e sul lato destro.
- Sacrificio tutti gli animali il giorno 7 dopo MCAO. Perfusione il cuore degli animali sotto anestesia profonda (pentobarbital sodico 100 mg / kg, ip) con soluzione fisiologica 22 . Rimuovere e poi immergere il tessuto cerebrale in soluzione salina fredda per 5 minuti, che viene poi tagliata in 2,0 mm sezioni coronali utilizzando un'affettatrice tessuto 22.
- Immergere le sezioni di cervello fresche in 2, 3, 5-trifeniltetrazolio cloruro (TTC) a 37 ° C per 30 minuti, poi trasferire le fette di soluzione di formaldeide al 5% per di fissazione a 4 ° C per 24 ore. Mettere le fette di cervello colorate su un supporto in plexiglas.
- Fotografare le fette TTC-macchiato a scala graduata con una telecamera CCD collegato ad un personal computer caricato con software di elaborazione delle immagini. Utilizzare un sistema di analisi dell'immagine semi-automatico anche per stimare l'area infartuata (mm 2) da ogni fetta cervello TTC-macchiato 23.
- Calcolare il volume dell'infarto totale per ogni fetta per sommatoria delle aree infartuati di tutte le sezioni di cervello. Mark zona macchia (ischemico cerebrale) separatamente su ciascun lato fette spesse 2 mm, quindi calcolare il volume dell'infarto e il valore medio.
- Calcuritardo il volume dell'infarto corretto (CIV) come
CIV = {LT- (RT RI)}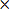 d (3)
d (3)
NOTA: Dove LT e RT denotano le aree degli emisferi destro e sinistro in mm 2, rispettivamente, RI è la zona infartuata in mm 2, e d = 2 mm è lo spessore della fetta.
Risultati
Questa sezione è dedicata ai confronti, ha fatto 1 settimana dopo l'intervento chirurgico, sui punteggi mNSS, piano inclinato risultati dei test e del cervello volumi infarto tra i cinque gruppi. Figura 4A e 4B presentare i punteggi medi mNSS e la media dei risultati dei test piano inclinato, rispettivamente. Il gruppo PRW appare come il migliore in termini di miglioramento mNSS. Le differenze significative tra PRW e MRW e tra tapis roulant e PRW in...
Discussione
Questo protocollo descrive un sistema ruota in esecuzione altamente efficace per ridurre la gravità degli effetti della corsa in animali. Come testbed rat-friendly, tale piattaforma è stata progettata e in modo tale che una velocità funzionamento stabile può essere mantenuta da ratti durante un processo in esecuzione mediante una curva di accelerazione adattativo predeterminato. Nei sistemi di formazione tipici, le velocità di formazione preimpostate e le durate sono impostati manualmente. Una volta che un esercizi...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
The authors would like to thank Dr. Jhi-Joung Wang, who is the Vice Superintendent of Education at Chi-Mei Medical Center, and Dr. Chih-Chan Lin from the Laboratory Animal Center, Department of Medical Research, Chi-Mei Medical Center, 901 Zhonghua, Yongkang Dist., Tainan City 701, Taiwan, for providing the shooting venue. They would also like to thank Miss Ling-Yu Tang and Mr. Chung-Ham Wang from the Department of Medical Research, Chi-Mei Medical Center, Tainan, Taiwan, for their valuable assistance in demonstrating the prototype system in real experiments with rats. The author gratefully acknowledges the support provided for this study by the Ministry of Science and Technology (MOST 104- 2218-E-167-001-) of Taiwan.
Materiali
| Name | Company | Catalog Number | Comments |
| Brushless DC motor | Oriental Motor | BLEM512-GFS | |
| Motor driver | Oriental Motor | BLED12A | |
| Motor reducer | Oriental Motor | GFS5G20 | |
| Speedometer | Oriental Motor | OPX-2A | |
| Treadmill | Columbus Instruments | Exer-6M | |
| Infrared transmitter | Seeed Studio | TSAL6200 | |
| Infrared Receiver | Seeed Studio | TSOP382 | |
| Microcontroller | Silicon Labs | C8051F330 | |
| CCD camera | Canon Inc. | EOS 450D | |
| Image processing software | Adobe Systems Incorporated | ADOBE Photoshop CS5 12.0 | |
| Image analysis | Media Cybernetics | Pro Plus 4.50.29 | |
| Sodium pentobarbital | Sigma-Aldrich (Saint Louis, MO, USA) | SIGMA P-3761 | |
| Ketamine | Pfizer (Kent, UK) | 1867-66-9 | |
| Atropine | Taiwan Biotech Co., Ltd. (Taoyuan, Taiwan) | A03BA01 | |
| Xylazine | Sigma-Aldrich (Saint Louis, MO, USA) | SIGMA X1126 | |
| Buprenorphine | Sigma-Aldrich (Saint Louis, MO, USA) | B9275 |
Riferimenti
- Mayo, N. E., Wood-Dauphinee, S., Cote, R., Durcan, L., Carlton, J. Activity, participation, and quality of life 6 months poststroke. Arch Phys Med Rehabil. 83 (8), 1035-1042 (2002).
- Duncan, P. W., Goldstein, L. B., Horner, R. D., Landsman, P. B., Samsa, G. P., Matchar, D. B. Similar motor recovery of upper and lower-extremities after stroke. Stroke. 25 (6), 1181-1188 (1994).
- Raichlen, D. A., Gordon, A. D. Relationship between exercise capacity and brain size in mammals. PLoS One. 6 (6), (2011).
- Trejo, J. L., Carro, E., Torres-Aleman, I. Circulating insulin-like growth factor I mediates exercise-induced increases in the number of new neurons in the adult hippocampus. J Neurosci. 21 (5), 1628-1634 (2001).
- Zhang, F., Wu, Y., Jia, J. Exercise preconditioning and brain ischemic tolerance. Neuroscience. 177, 170-176 (2011).
- Wang, R. Y., Yang, Y. R., Yu, S. M. Protective effects of treadmill training on infarction in rats. Brain Res. 922 (1), 140-143 (2001).
- Ding, Y., et al. Exercise pre-conditioning reduces brain damage in ischemic rats that may be associated with regional angiogenesis and cellular overexpression of neurotrophin. Neuroscience. 124 (3), 583-591 (2004).
- Li, J., Luan, X. D., Clark, J. C., Rafols, J. A., Ding, Y. C. Neuroprotection against transient cerebral ischemia by exercise pre-conditioning in rats. Brain Res. 26 (4), 404-408 (2004).
- Leasure, J. L., Jones, M. Forced and voluntary exercise differentially affect brain and behavior. Neuroscience. 156 (3), 456-465 (2008).
- Chen, C. C., et al. A Forced running wheel system with a microcontroller that provides high-intensity exercise training in an animal ischemic stroke model. Braz J Med Biol Res. 47 (10), 858-868 (2014).
- Chen, C. -. C., et al. Improved infrared-sensing running wheel systems with an effective exercise activity indicator. PLoS One. 10 (4), (2015).
- Fantegrossi, W. E., Xiao, W. R., Zimmerman, S. M. Novel technology for modulating locomotor activity as an operant response in the mouse: Implications for neuroscience studies involving "exercise" in rodents. J Neurosci Methods. 212 (2), 338-343 (2013).
- Hayes, K., et al. Forced, not voluntary, exercise effectively induces neuroprotection in stroke. Acta Neuropathol. 115 (3), 289-296 (2008).
- Arida, R. M., Scorza, C. A., da Silva, A. V., Scorza, F. A., Cavalheiro, E. A. Differential effects of spontaneous versus forced exercise in rats on the staining of parvalbumin-positive neurons in the hippocampal formation. Neurosci Lett. 364 (3), 135-138 (2004).
- Waters, R. P., et al. Selection for aerobic capacity affects corticosterone, monoamines and wheel-running activity. Physiol Behav. (4-5), 1044-1054 (2008).
- Ke, Z., Yip, S. P., Li, L., Zheng, X. -. X., Tong, K. -. Y. The effects of voluntary, involuntary, and forced exercises on brain-derived neurotrophic factor and motor function recovery: A rat brain ischemia model. PLoS One. 6 (2), (2011).
- Caton, S. J., et al. Low-carbohydrate high-fat diets in combination with daily exercise in rats: Effects on body weight regulation, body composition and exercise capacity. Physiol Behav. 106 (2), 185-192 (2012).
- . C8051F330/1/2/3/4/5 datasheet Available from: https://www.silabs.com/Support%20Documents/TechnicalDocs/C8051F33x.pdf (2006)
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Chen, J. L., et al. Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats. Stroke. 32 (4), 1005-1011 (2001).
- Chang, M. -. W., Young, M. -. S., Lin, M. -. T. An inclined plane system with microcontroller to determine limb motor function of laboratory animals. J Neurosci Methods. 168 (1), 186-194 (2008).
- Gartshore, G., Patterson, J., Macrae, I. M. Influence of ischemia and reperfusion on the course of brain tissue swelling and blood-brain barrier permeability in a rodent model of transient focal cerebral ischemia. Exp Neurol. 147 (2), 353-360 (1997).
- Chen, F., et al. Rodent stroke induced by photochemical occlusion of proximal middle cerebral artery: Evolution monitored with MR imaging and histopathology. Eur J Radiol. 63 (1), 68-75 (2007).
- Almenning, I., Rieber-Mohn, A., Lundgren, K. M., Lovvik, T. S., Garnaes, K. K., Moholdt, T. Effects of high intensity interval training and strength training on metabolic, cardiovascular and hormonal outcomes in women with polycystic ovary syndrome: a pilot study. PLoS One. 10 (9), (2015).
- Costigan, S. A., Eather, N., Plotnikoff, R. C., Taaffe, D. R., Lubans, D. R. High-intensity interval training for improving health-related fitness in adolescents: a systematic review and meta-analysis. Br J Sports Med. 49 (19), (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon