Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La separación por cristalización selectiva sulfato con un ligando bis-iminoguanidinium
En este artículo
Resumen
Se presenta un protocolo para la síntesis acuosa situ de un ligando bis (iminoguanidinium) y su utilización en la separación selectiva de sulfato.
Resumen
A simple and effective method for selective sulfate separation from aqueous solutions by crystallization with a bis-guanidinium ligand, 1,4-benzene-bis(iminoguanidinium) (BBIG), is demonstrated. The ligand is synthesized as the chloride salt (BBIG-Cl) by in situ imine condensation of terephthalaldehyde with aminoguanidinium chloride in water, followed by crystallization as the sulfate salt (BBIG-SO4). Alternatively, BBIG-Cl is synthesized ex situ in larger scale from ethanol. The sulfate separation ability of the BBIG ligand is demonstrated by selective and quantitative crystallization of sulfate from seawater. The ligand can be recycled by neutralization of BBIG-SO4 with aqueous NaOH and crystallization of the neutral bis-iminoguanidine, which can be converted back into BBIG-Cl with aqueous HCl and reused in another separation cycle. Finally, 35S-labeled sulfate and β liquid scintillation counting are employed for monitoring the sulfate concentration in solution. Overall, this protocol will instruct the user in the necessary skills to synthesize a ligand, employ it in the selective crystallization of sulfate from aqueous solutions, and quantify the separation efficiency.
Introducción
Separación selectiva de oxoaniones hidrófilos (por ejemplo, sulfato, cromato, fosfato) de soluciones acuosas competitivos representa un reto fundamental con relevancia para la remediación ambiental, producción de energía, y la salud humana. 1,2 Sulfato en particular, es difícil de extraer de agua debido a su renuencia intrínseca de deshacerse de su esfera de hidratación y migrar hacia entornos menos polares. 3 Realización de la extracción acuosa de sulfato más eficiente requiere típicamente receptores complejos que son difíciles y tedioso para sintetizar y purificar, a menudo con reactivos y disolventes tóxicos 4,5.
La cristalización selectiva ofrece una alternativa sencilla y eficaz a sulfato separación de agua. 6-9 Aunque algunos cationes metálicos tales como Ba 2 +, Pb2 +, o sales de sulfato muy insolubles forma Ra 2+, su uso en la separación de sulfato no siempre es práctico debido a su alta toxila ciudad y, a veces de baja selectividad. El empleo de ligandos orgánicos como precipitantes de sulfato se aprovecha de la diversidad estructural y IMPREGNABILIDAD diseñar característica para las moléculas orgánicas. Un ligando orgánico ideal para la cristalización de sulfato acuosa debe ser soluble en agua, sin embargo, formar una sal de sulfato insoluble o complejo en un tiempo relativamente corto y en presencia de altas concentraciones de iones competidores. Además, debería ser fácil de sintetizar y de reciclaje. Uno de estos, un ligando 1,4-benceno-bis (iminoguanidinium) (bbig), auto-ensamblado in situ a partir de dos precursores disponibles comercialmente, tereftalaldehıdo y cloruro aminoguanidinium, se encontró recientemente para ser extremadamente eficaz en la separación de sulfato acuosa. 10 El ligando es en forma de cloruro soluble en agua, y se cristaliza selectivamente con sulfato en una sal de extremadamente insoluble que se puede quitar fácilmente de la solución por filtración simple. El ligando bbig puede entonces ser recuperado por desprotonación con unaNaOH queous y cristalización de la neutral bis-iminoguanidine, que se puede convertir de nuevo en la forma de cloruro con HCl acuoso, y volver a utilizar en otro ciclo de separación. La eficacia de este ligando en la eliminación de sulfato del agua es tan grande que el control de la concentración de sulfato que queda en solución ya no es una tarea trivial, lo que requiere una técnica más avanzada que permite una medición precisa de cantidades traza de anión. Para este fin, se empleó radiomarcado 35 S trazador sulfato en conjunción con recuento de centelleo líquido β, una técnica comúnmente utilizada en las separaciones de extracción líquido-líquido, y ha demostrado recientemente ser eficaz en la cristalización de monitoreo sulfato. 8
Este protocolo demuestra la de un solo recipiente en la síntesis in situ del ligando bbig y su cristalización como la sal de sulfato a partir de soluciones acuosas. La síntesis ex situ del ligando 11 se presenta también como un cométodo nvenient para la producción de cantidades más grandes de bbig-Cl, que pueden ser almacenadas en la forma cristalina hasta que esté listo para su uso. a continuación, se demuestra de eliminación de sulfatos del agua de mar usando el ligando bbig-Cl previamente preparada. Finalmente, se demuestra el uso de 35-S etiquetados sulfato y recuento de centelleo líquido β para medir la concentración de sulfato en agua de mar. Este protocolo tiene por objeto proporcionar un tutorial para aquellos interesados en explorar ampliamente el uso de cristalización selectiva para la separación de aniones acuosa.
Protocolo
1. Síntesis de 1,4-benceno-bis (iminoguanidinium) Cloruro (Cl-bbig)
- In Situ Síntesis de la 1,4-benceno-bis (iminoguanidinium) Cloruro de ligando (bbig-Cl) y su cristalización con sulfato
- Añadir 0,067 g de tereftalaldehído y 2,2 ml de una solución acuosa 0,5 M de cloruro de aminoguanidinium a 10 ml de agua desionizada en un matraz de 25 mL de fondo redondo equipado con una barra de agitación magnética.
- Se agita la solución magnéticamente durante cuatro horas a 20 ° C. Esto dará lugar a una solución ligeramente amarilla de bbig-Cl.
- Añadir 0,5 ml de una solución acuosa 1 M de sulfato de sodio. Esto resultará en el instante precipitación de bbig-SO 4 como un sólido blanco cristalino.
- Filtrar el sólido mediante filtración al vacío para recuperar bbig-SO 4. Se lava el sólido en el papel de filtro cinco veces con alícuotas de 5 ml de agua con el fin de obtener la sal de sulfato puro.
- Comprobar la pureza de la fase cristalina bbig-SO 4 obtenida por difracción de rayos X 12. Comparar con el patrón que se muestra en la Figura 1.
- Ex Situ Síntesis de 1,4-benceno-bis (iminoguanidinium) Cloruro de 11
- Añadir 4 g de tereftalaldehído y 7,26 g de cloruro de aminoguanidinium a 20 ml de etanol en un matraz de 50 ml de fondo redondo equipado con una barra de agitación magnética.
- Se calienta la solución a 60 ° C con una placa caliente, y se agita con una barra de agitación magnética durante 2 horas. Se enfría la solución a 20 ° C y se deja reposar durante 3 horas, a continuación, se recoge el sólido por filtración al vacío a través de un embudo Büchner papel de filtro equipada.
- Suspender los obtenidos sólido en 20 ml de etanol y el calor sobre una placa caliente hasta que hierva. Si el sólido no se va completamente en solución en este punto, añadir alícuotas pequeñas (1 ml) de etanol, permitiendo cada vez que la solución alcance la temperatura de ebullición, hasta que se disuelve todo el sólido.
- Deje enfriar el matraz a temperatu de la habitaciónRe, a continuación, colocar en un congelador a 0 ° C durante la noche. Recoger el sólido por filtración a través de un filtro de papel equipado Büchner embudo usando filtración al vacío.
- Confirmar la identidad y pureza de bbig-Cl mediante espectroscopia de RMN de 1H 13. Comparar con el espectro mostrado en la Figura 2.
2. Separación sulfato del agua de mar
- Cristalización de sulfato como bbig-SO 4
NOTA: La cantidad de bbig-Cl necesario retirar el sulfato depende de la cantidad exacta de sulfato en el agua de mar. Se encontró que el uso de 1,5 equivalentes de bbig-Cl relativa a los resultados de sulfato en la eliminación del 99% de sulfato. El agua de mar utilizada en este protocolo tiene una concentración de sulfato de 30 mM, como se determina por titulación con BaCl2.- Se filtra el agua de mar con un filtro de jeringa de 0,22 micras o membrana de filtración con un tamaño de poro pequeño para eliminar las partículas en suspensión y bio organismos.
- Hacer una 30solución mM de bbig-Cl usando agua desionizada y sólida bbig-Cl preparado como se describe en la sección anterior.
- Añadir la solución de bbig-Cl al agua de mar en un 1.5: (v / v) de proporción 1.
- Se agita la mezcla durante algunas horas para asegurar la eliminación cuantitativa (> 99%) de sulfato.
- Recoger el sólido por filtración a través de un filtro de papel equipado Büchner embudo usando filtración al vacío. Se lava el sólido en el papel de filtro cinco veces con alícuotas de 5 ml de agua.
- Se seca el sólido aislado al vacío y se pesa para determinar el rendimiento.
- ligando de recuperación
- Añadir 53,1 mg de bbig-SO 4 a una solución 2 ml de NaOH (10%) en un vial de centelleo de 20 ml equipado con una barra de agitación magnética.
- Se agita la mezcla durante dos horas a 20 ° C. se formará un precipitado de color ligeramente amarillo.
- Filtrar el sólido a través de un papel de filtro equipada Büchner embudo usando filtración al vacío. Se lava el sólido en el papel de filtro con 0,2ml de agua, y secar a vacío.
- Caracterizar el sólido recuperado por RMN 13 para confirmar su identidad como la base libre de bis (guanidina). Comparar con el espectro de RMN muestra en la Figura 3.
- La determinación de la cantidad de sulfato Fuera del agua de mar mediante recuento de centelleo líquido ß
PRECAUCIÓN: Esta técnica implica el uso de radioisótopos, que suponen una clase diferente de los peligros de lo que normalmente se encuentran en la mayoría de los laboratorios. Equipo especial de protección radiológica por lo general se requiere la manipulación de los radionucleidos. Por lo tanto, es esencial que el procedimiento se sigue cuidadosamente y que un oficial de seguridad es consultado para el consejo y orientación.- Calcular el volumen de la solución madre del radioisótopo de azufre-35 (5 mCi / ml) que se utiliza para asegurar que no es más de 5 millones de cuentas por minuto (cpm) por mililitro de solución de agua de mar, utilizando las siguientes ecuaciones (cpm y curies (Ci ) son las dos unidades de medida fo radiactividad):
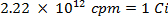
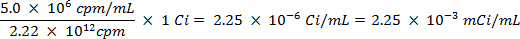
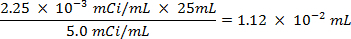
- Pico 25 ml de agua de mar con 0,0112 ml de solución 5,0 / ml mCi de 35 S solución de sulfato de sodio radiomarcado.
- Preparar 0, 15, 30, 33, 45, y 60 mM de soluciones de bbig-Cl en agua desionizada y combinar 0,750 ml de estas soluciones con un volumen igual de sulfato de S-35 radiomarcado claveteado agua de mar en un tubo de centrífuga de 2 ml.
- Se agita la mezcla a través de una rueda giratoria o vórtice en un / aire caja incubadora mantenida a una temperatura constante de 25 ± 0,2 ° C durante 24 hr.
- Centrifugar las soluciones a 1.500 xg durante 10 minutos a 25 ° C.
- Después de la centrifugación, eliminar 1,2 ml de cada solución utilizando una jeringa, a continuación, filtrar a través de un filtro de jeringa de 0,22 micras para eliminar el suspendida precipitado. Pipetear 1,0 ml de cada una de estas soluciones en 20 ml de cóctel de centelleo en viales de polipropileno de centelleo. La solución que no contiene bbig-Cl (la solución control) debe ser diluido diez veces con agua desionizada antes de la adición a la mezcla de centelleo.
- Colocar los viales de centelleo que contenían las muestras y el cóctel de centelleo en un contador de centelleo líquido y se deja reposar durante 1 hora antes de contar para permitir que las muestras a oscuro adaptarse.
NOTA: Antes de contar las muestras, calibrar el instrumento y permitir que cada muestra de contar durante 30 minutos. Contar viales adicionales que contienen sólo un cóctel de centelleo con el fin de permitir una corrección de fondo que se utiliza cuando la determinación de las concentraciones de sulfato en solución. - Determinar la cantidad de sulfato eliminado, utilizando las siguientes ecuaciones:
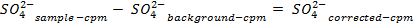
54411 / 54411eq5.jpg "/>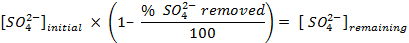
- Calcular el volumen de la solución madre del radioisótopo de azufre-35 (5 mCi / ml) que se utiliza para asegurar que no es más de 5 millones de cuentas por minuto (cpm) por mililitro de solución de agua de mar, utilizando las siguientes ecuaciones (cpm y curies (Ci ) son las dos unidades de medida fo radiactividad):
Resultados
El patrón de difracción de rayos X en polvo de bbig-SO 4 (Figura 1) permite la confirmación inequívoca de la identidad del sólido cristalizado. Al comparar el patrón obtenido en comparación con el de referencia, la intensidad del pico importa menos que el posicionamiento de pico. Todos los picos fuertes que se muestran en la referencia deben estar presentes en la muestra obtenida. La aparición de fuertes picos en la muestra que están ausentes en el pa...
Discusión
Esta técnica es bastante tolerante a muchas desviaciones de la fase escrita del procedimiento, lo que lo hace bastante robusto. Hay sin embargo dos pasos críticos que se deben seguir. En primer lugar, el ligando bbig-Cl tiene que ser lo más pura posible. Las impurezas no sólo afectará a la cristalización y la solubilidad de la sal sulfato resultante, sino que también hará que sea difícil de calcular la cantidad necesaria para la eliminación de sulfatos cuantitativa de la solución. En segundo lugar, todos los ...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was supported by the U.S. Department of Energy, Office of Science, Basic Energy Sciences, Chemical Sciences, Geosciences, and Biosciences Division. We thank the University of North Carolina Wilmington for providing the seawater.
Materiales
| Name | Company | Catalog Number | Comments |
| Terephthalaldehyde | Sigma | T2207 | |
| Aminoguanidinium Chloride | Sigma | #396494 | |
| Sodium Sulfate | Sigma | #239313 | |
| Barium Chloride | Sigma | #342920 | Highly Toxic |
| Ethanol | Any | Reagent Grade (190 proof) | |
| Sodium Hydroxide | EMD | SX0590-1 | |
| Hydrochloric Acid | Sigma | #258148 | |
| Filter Paper | Any | - | Any qualitative or analytical filter paper will work |
| Syringe Filter (0.22 μm) | Any | - | Nylon filter |
| 35S Labeled Sulfate | Perkin Elmer | NEX041005MC | |
| Ultima Gold Scintillation Cocktail | Perkin Elmer | #6013329 | |
| Polypropylene Vials | Any | - | |
| Disposable Syringe (2-3 ml) | Any | - | Any disposable plastic syringe works |
Referencias
- Langton, M. L., Serpell, C. J., Beer, P. D. Anion Recognition in Water: Recent Advances from Supramolecular and Macromolecular Perspective. Angew. Chem. Int. Ed. 55, 1974-1987 (2016).
- Busschaert, N., Caltagirone, C., Van Rossom, W., Gale, P. A. Applications of Supramolecular Anion Recognition. Chem. Rev. 115, 8038-8155 (2015).
- Moyer, B. A., Custelcean, R., Hay, B. P., Sessler, J. L., Bowman-James, K., Day, V. W., Sung-Ok, K. A Case for Molecular Recognition in Nuclear Separations: Sulfate Separation from Nuclear Wastes. Inorg. Chem. 52, 3473-3490 (2013).
- Kim, S. K., Lee, J., Williams, N. J., Lynch, V. M., Hay, B. P., Moyer, B. A., Sessler, J. L. Bipyrrole-Strapped Calix[4]pyrroles: Strong Anion Receptors That Extract the Sulfate Anion. J. Am. Chem. Soc. 136, 15079-15085 (2014).
- Jia, C., Wu, B., Li, S., Huang, X., Zhao, Q., Li, Q., Yang, X. Highly Efficient Extraction of Sulfate Ions with a Tripodal Hexaurea Receptor. Angew. Chem. Int. Ed. 50, 486-490 (2011).
- Rajbanshi, A., Moyer, B. A., Custelcean, R. Sulfate Separation from Aqueous Alkaline Solutions by Selective Crystallization of Alkali Metal Coordination Capsules. Cryst. Growth Des. 11, 2702-2706 (2011).
- Custelcean, R. Urea-Functionalized Crystalline Capsules for Recognition and Separation of Tetrahedral Oxoanions. Chem. Commun. 49, 2173-2182 (2013).
- Custelcean, R., Sloop, F. V., Rajbanshi, A., Wan, S., Moyer, B. A. Sodium Sulfate Separation from Aqueous Alkaline Solutions via Crystalline Urea-Functionalized Capsules: Thermodynamics and Kinetics of Crystallization. Cryst. Growth Des. 15, 517-522 (2015).
- Custelcean, R., Williams, N. J., Seipp, C. A. Aqueous Sulfate Separation by Crystallization of Sulfate-Water Clusters. Angew. Chem. Int. Ed. 54, 10525-10529 (2015).
- Custelcean, R., Williams, N. J., Seipp, C. A., Ivanov, A. S., Bryantsev, V. S. Aqueous Sulfate Separation by Sequestration of [(SO4)(H2O)4]4- Clusters within Highly Insoluble Imine-Linked Bis-Guanidinium Crystals. Chem. Eur. J. 22, 1997-2003 (2016).
- Khownium, K., Wood, S. J., Miller, K. A., Balakrishna, R., Nguyen, T. B., Kimbrell, M. R., Georg, G. I., David, S. A. Novel Endotoxin-Sequestering Compounds with Terephthaldehyde-bis-guanylhydrazone Scaffolds. Bioorg. Med. Chem. Lett. 16, 1305-1308 (2006).
- Pecharsky, V. K., Zavalij, P. Y. . Fundamentals of Powder Diffraction and Structural Characterization of Materials. , (2005).
- Goldenberg, D. P. . Principles of NMR Spectroscopy: An Illustrated Guide. , (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados