É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Separação sulfato por cristalização selectiva com um ligando bis-iminoguanidinium
Neste Artigo
Resumo
Um protocolo para síntese em solução aquosa in situ de um composto bis (iminoguanidinium) ligando e sua utilização na separação selectiva de sulfato é apresentada.
Resumo
A simple and effective method for selective sulfate separation from aqueous solutions by crystallization with a bis-guanidinium ligand, 1,4-benzene-bis(iminoguanidinium) (BBIG), is demonstrated. The ligand is synthesized as the chloride salt (BBIG-Cl) by in situ imine condensation of terephthalaldehyde with aminoguanidinium chloride in water, followed by crystallization as the sulfate salt (BBIG-SO4). Alternatively, BBIG-Cl is synthesized ex situ in larger scale from ethanol. The sulfate separation ability of the BBIG ligand is demonstrated by selective and quantitative crystallization of sulfate from seawater. The ligand can be recycled by neutralization of BBIG-SO4 with aqueous NaOH and crystallization of the neutral bis-iminoguanidine, which can be converted back into BBIG-Cl with aqueous HCl and reused in another separation cycle. Finally, 35S-labeled sulfate and β liquid scintillation counting are employed for monitoring the sulfate concentration in solution. Overall, this protocol will instruct the user in the necessary skills to synthesize a ligand, employ it in the selective crystallization of sulfate from aqueous solutions, and quantify the separation efficiency.
Introdução
Separação selectiva de oxoanions hidrofílicos (por exemplo, sulfato, cromato, fosfato) de soluções aquosas competitivos representa um desafio fundamental com relevância para a remediação ambiental, produção de energia, e na saúde humana. 1,2 Sulfato em particular, é difícil extrair da água, devido à sua relutância intrínseca para lançar sua esfera de hidratação e migram para ambientes menos polares. 3 Fazendo extração de sulfato aquosa mais eficiente geralmente requer receptores de complexos que são difíceis e tedioso para sintetizar e purificar, muitas vezes envolvendo reagentes tóxicos e solventes. 4,5
Cristalização selectiva oferece uma alternativa simples, mas eficaz para sulfato de separação de água. 09/06 Embora alguns catiões metálicos, tais como Ba 2+, Pb 2+, ou formar sais de sulfato muito insolúveis Ra 2+, a sua utilização na separação de sulfato de nem sempre é prático devido à sua alta toxicidade e, por vezes, de baixa seletividade. Empregando ligandos orgânicos como precipitantes sulfato tira proveito da diversidade estrutural e receptividade ao desenho característico para moléculas orgânicas. Um ligando orgânico ideal para a cristalização de sulfato aquosa deve ser solúvel em água, ainda formar um sal de sulfato ou complexo insolúvel num tempo relativamente curto e, na presença de concentrações elevadas de iões concorrentes. Além disso, deve ser fácil de sintetizar e de reciclagem. Um destes um ligando, 1,4-benzeno-bis (iminoguanidinium) (BBiG), auto-montadas in situ a partir de dois precursores disponíveis comercialmente, e cloreto de teref aminoguanidinium, foi recentemente encontrada para ser extremamente eficaz na separação de sulfato aquoso. 10 O ligando está na forma de cloreto solúvel em água, e cristaliza selectivamente com sulfato num sal extremamente insolúvel que pode ser facilmente removido da solução por filtração simples. O ligando BBiG pode então ser recuperado por desprotonação com umaNaOH queous e cristalização do neutro bis-iminoguanidine, que pode ser convertido de volta para a forma de cloreto com HCl aquoso, e reutilizado num outro ciclo de separação. A eficácia deste ligando na remoção de sulfato de água é tão grande que o controlo da concentração de sulfato restante em solução já não é uma tarefa trivial, requerendo uma técnica mais avançada que permite uma medição precisa de quantidades vestigiais do anião. Para este efeito, radiomarcado 35S marcador em conjunto com sulfato de contagem de cintilação líquida β foi empregue, uma técnica largamente utilizada para separações de extracção líquido-líquido, e recentemente demonstrou ser eficaz em cristalização de sulfato de monitorização. 8
Este protocolo demonstra a um só recipiente na síntese in situ do ligando e a sua BBiG Cristalização como o sal de sulfato a partir de soluções aquosas. A síntese ex situ do ligando 11 é também apresentada como um convenient método para a produção de grandes quantidades de BBiG-Cl, que podem ser armazenadas na forma cristalina até estar pronto para usar. Remoção de sulfato a partir de água do mar utilizando o ligando BBiG-Cl previamente preparada é então demonstrado. Finalmente, o uso de 35 S-sulfato rotulados e contagem de cintilação líquida β para medir a concentração de sulfato na água do mar é demonstrada. Este protocolo destina-se a fornecer um tutorial para aqueles amplamente interessado em explorar o uso de cristalização seletiva para a separação ânion aquosa.
Protocolo
1. Síntese de 1,4-benzeno-bis (iminoguanidinium) Cloreto (Cl-BBiG)
- In situ síntese do 1,4-benzeno-bis (iminoguanidinium) Cloreto de Ligand (BBiG-Cl) e sua cristalização com sulfato
- Adicionar 0,067 g de tereftalaldeído e 2,2 ml de uma solução aquosa 0,5 M de cloreto de aminoguanidinium a 10 ml de água desionizada num balão de 25 ml de fundo redondo equipado com uma barra de agitação magnética.
- Agita-se a solução magneticamente durante quatro horas a 20 ° C. Isto irá dar uma solução ligeiramente amarela de BBiG-Cl.
- Adicionar 0,5 ml de uma solução aquosa 1 M de sulfato de sódio. Isto irá resultar na precipitação imediata de BBiG-SO 4 como um sólido branco cristalino.
- Filtra-se o sólido utilizando filtração sob vácuo para se recuperar BBiG-SO 4. Lava-se o sólido sobre o papel de filtro cinco vezes com alíquotas de 5 ml de água, a fim de obter o sal de sulfato puro.
- Verificar a pureza fase do cristalino BBiG-SO 4 obtida por difracção de raios X 12. Comparar com o padrão mostrado na Figura 1.
- Ex Situ Síntese de 1,4-benzeno-bis (iminoguanidinium) Chloride 11
- Adicionar 4 g de tereftalaldeído e 7,26 g de cloreto de aminoguanidinium a 20 ml de etanol num frasco de 50 ml de fundo redondo equipado com uma barra de agitação magnética.
- Aquece-se a solução a 60 ° C utilizando uma placa de aquecimento, e agitar com uma barra de agitação magnética durante 2 horas. Arrefece-se a solução para 20 ° C e deixar repousar durante 3 h, em seguida, recolher o sólido por filtração sob vácuo através de um funil de Buchner de papel-filtro equipado.
- Suspender o sólido obtido em 20 ml de etanol e de calor em uma chapa quente até ferver. Se o sólido não entrar completamente em solução, neste ponto, adicionar pequenas alíquotas (1 ml) de etanol, permitindo que cada vez que a solução atingir a temperatura de ebulição, até que todo o sólido estar dissolvido.
- Deixar o balão arrefecer até à temperatu quartoRe, em seguida, coloque em uma temperatura de 0 ° C congelador durante a noite. Recolher o sólido por filtração através de um filtro de papel equipado funil de Buchner utilizando filtração sob vácuo.
- Confirmar a identidade e pureza do BBiG-Cl por 1 H espectroscopia de RMN 13. Comparar com o espectro apresentado na Figura 2.
2. Separação de sulfato da água do mar
- Cristalização de sulfato como BBiG-SO 4
NOTA: A quantidade de BBiG-Cl necessário para remover o sulfato depende da quantidade exacta de sulfato na água do mar. Verificou-se que a utilização de 1,5 equivalentes de BBiG-Cl em relação ao sulfato de resultados na remoção de 99% de sulfato. A água do mar usada no presente protocolo tem uma concentração de sulfato de 30 mM, tal como determinado por titulação com BaCl2.- Filtra-se a água do mar com um filtro de seringa de 0,22? M ou com membrana de filtração de tamanho de poro pequeno para remover as partículas em suspensão e organismos bio.
- Adicione uma 30solução mM de BBiG-Cl usando água desionizada e sólido BBiG-Cl preparada tal como descrito na secção anterior.
- Adicionar a solução BBiG-Cl à água do mar em 1.5: (v / v), proporção 1.
- Agita-se a mistura durante algumas horas para assegurar a remoção quantitativa (> 99%) de sulfato.
- Recolher o sólido por filtração através de um filtro de papel equipado funil de Buchner utilizando filtração sob vácuo. Lava-se o sólido sobre o papel de filtro cinco vezes com alíquotas de 5 ml de água.
- Seca-se o sólido isolado sob vácuo e pesá-lo para determinar o rendimento.
- Recuperação Ligand
- Adicionar 53,1 mg de BBiG-SO 4 a uma solução de 2 ml de NaOH (10%) num frasco de cintilação de 20 mL equipado com uma barra de agitação magnética.
- Agita-se a mistura durante duas horas a 20 ° C. Um precipitado de cor ligeiramente amarela irá formar.
- Filtrar o sólido através de um filtro de papel equipado funil de Buchner utilizando filtração sob vácuo. Lava-se o sólido sobre o papel de filtro com 0,2ml de água, e seco sob vácuo.
- Caracterizar o sólido recuperado por RMN 13 para confirmar a sua identidade como a base livre de bis (guanidina). Comparar com o espectro de RMN mostrado na Figura 3.
- A determinação da quantidade de sulfato Removido Seawater por p líquido de contagem de cintilação
CUIDADO: Esta técnica envolve a utilização de radioisótopos, que representam uma classe diferente de perigos do que o que é normalmente encontrado na maioria dos laboratórios. Equipamento especial de protecção contra radiações normalmente é exigida durante o manuseio dos radionuclídeos. Assim, é essencial que o procedimento é seguido com atenção e que um oficial de segurança é consultado para aconselhamento e orientação.- Calcular o volume da solução de reserva de o enxofre-35 radioisótopo (5 mCi / ml) usadas para assegurar que não é mais de 5 milhões de contagens por minuto (cpm) por mililitro de solução de água salgada, utilizando as seguintes equações (cpm e Curies (Ci ) são ambas unidades de medida fou radioactividade):
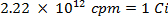
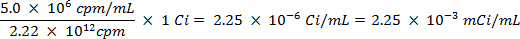
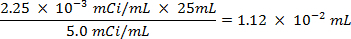
- Pico 25 ml de água do mar com 0,0112 ml de solução 5,0 mCi / ml de 35 S uma solução de sulfato de sódio radiomarcado.
- Preparar soluções de 0, 15, 30, 33, 45, e 60 mM de Cl-BBiG em água desionizada e combinar 0,750 ml destas soluções com um volume igual de sulfato de S-35 marcado radioactivamente água do mar enriquecida em um tubo de centrífuga de 2 ml.
- Agita-se a mistura através de uma roda rotativa ou de vórtice, em um / caixa de ar incubadora mantida a uma temperatura constante de 25 ± 0,2 ° C durante 24 h.
- Centrifugar as soluções a 1.500 xg durante 10 min a 25 ° C.
- Após centrifugação, retirar 1,2 ml de cada solução, utilizando uma seringa, seguida de filtração através de um filtro de seringa de 0,22 um para retirar a suspensão precipitado. Pipetar 1,0 ml de cada uma destas soluções em 20 ml de cocktail de cintilação em frascos de cintilação em polipropileno. A solução não contendo BBiG-Cl (a solução de controlo) deve ser diluída dez-vezes com água desionizada antes da adição do cocktail de cintilação.
- Coloque os frascos de cintilação contendo as amostras e o cocktail de cintilação em um contador de cintilação líquida e deixe descansar por 1 hora antes de contar para permitir que as amostras para dark-se adaptar.
NOTA: antes da contagem das amostras, calibrar o instrumento e permite que cada amostra para contar durante 30 min. Contagem de frascos adicionais contendo apenas cocktail de cintilação a fim de permitir uma correcção de fundo que é utilizado na determinação das concentrações de sulfato em solução. - Determinar a quantidade de sulfato de removido, utilizando as seguintes equações:
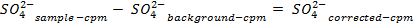
54411 / 54411eq5.jpg "/>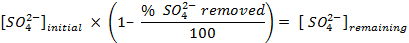
- Calcular o volume da solução de reserva de o enxofre-35 radioisótopo (5 mCi / ml) usadas para assegurar que não é mais de 5 milhões de contagens por minuto (cpm) por mililitro de solução de água salgada, utilizando as seguintes equações (cpm e Curies (Ci ) são ambas unidades de medida fou radioactividade):
Resultados
O raio-X padrão de difracção de de BBiG-SO 4 (Figura 1) permite a confirmação inequívoca da identidade do sólido cristalizado. Ao comparar o padrão obtido versus a referência um, pico de intensidade importa menos do que o posicionamento de pico. Todos os picos fortes mostrados na referência deve estar presente na amostra obtida. O aparecimento de fortes picos na amostra que estão ausentes no padrão de referência indica a presença de impurezas.
Discussão
Esta técnica é bastante tolerante a muitos desvios do procedimento escrito, o que torna bastante robusto. No entanto, existem dois passos críticos que devem ser seguidas. Em primeiro lugar, o ligando BBiG-Cl necessita de ser tão puro quanto possível. As impurezas não só afecta a cristalização e a solubilidade do sal de sulfato resultante, mas também vai fazer com que seja difícil para calcular a quantidade necessária para a remoção do sulfato de quantitativa a partir da solução. Em segundo lugar, todos o...
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by the U.S. Department of Energy, Office of Science, Basic Energy Sciences, Chemical Sciences, Geosciences, and Biosciences Division. We thank the University of North Carolina Wilmington for providing the seawater.
Materiais
| Name | Company | Catalog Number | Comments |
| Terephthalaldehyde | Sigma | T2207 | |
| Aminoguanidinium Chloride | Sigma | #396494 | |
| Sodium Sulfate | Sigma | #239313 | |
| Barium Chloride | Sigma | #342920 | Highly Toxic |
| Ethanol | Any | Reagent Grade (190 proof) | |
| Sodium Hydroxide | EMD | SX0590-1 | |
| Hydrochloric Acid | Sigma | #258148 | |
| Filter Paper | Any | - | Any qualitative or analytical filter paper will work |
| Syringe Filter (0.22 μm) | Any | - | Nylon filter |
| 35S Labeled Sulfate | Perkin Elmer | NEX041005MC | |
| Ultima Gold Scintillation Cocktail | Perkin Elmer | #6013329 | |
| Polypropylene Vials | Any | - | |
| Disposable Syringe (2-3 ml) | Any | - | Any disposable plastic syringe works |
Referências
- Langton, M. L., Serpell, C. J., Beer, P. D. Anion Recognition in Water: Recent Advances from Supramolecular and Macromolecular Perspective. Angew. Chem. Int. Ed. 55, 1974-1987 (2016).
- Busschaert, N., Caltagirone, C., Van Rossom, W., Gale, P. A. Applications of Supramolecular Anion Recognition. Chem. Rev. 115, 8038-8155 (2015).
- Moyer, B. A., Custelcean, R., Hay, B. P., Sessler, J. L., Bowman-James, K., Day, V. W., Sung-Ok, K. A Case for Molecular Recognition in Nuclear Separations: Sulfate Separation from Nuclear Wastes. Inorg. Chem. 52, 3473-3490 (2013).
- Kim, S. K., Lee, J., Williams, N. J., Lynch, V. M., Hay, B. P., Moyer, B. A., Sessler, J. L. Bipyrrole-Strapped Calix[4]pyrroles: Strong Anion Receptors That Extract the Sulfate Anion. J. Am. Chem. Soc. 136, 15079-15085 (2014).
- Jia, C., Wu, B., Li, S., Huang, X., Zhao, Q., Li, Q., Yang, X. Highly Efficient Extraction of Sulfate Ions with a Tripodal Hexaurea Receptor. Angew. Chem. Int. Ed. 50, 486-490 (2011).
- Rajbanshi, A., Moyer, B. A., Custelcean, R. Sulfate Separation from Aqueous Alkaline Solutions by Selective Crystallization of Alkali Metal Coordination Capsules. Cryst. Growth Des. 11, 2702-2706 (2011).
- Custelcean, R. Urea-Functionalized Crystalline Capsules for Recognition and Separation of Tetrahedral Oxoanions. Chem. Commun. 49, 2173-2182 (2013).
- Custelcean, R., Sloop, F. V., Rajbanshi, A., Wan, S., Moyer, B. A. Sodium Sulfate Separation from Aqueous Alkaline Solutions via Crystalline Urea-Functionalized Capsules: Thermodynamics and Kinetics of Crystallization. Cryst. Growth Des. 15, 517-522 (2015).
- Custelcean, R., Williams, N. J., Seipp, C. A. Aqueous Sulfate Separation by Crystallization of Sulfate-Water Clusters. Angew. Chem. Int. Ed. 54, 10525-10529 (2015).
- Custelcean, R., Williams, N. J., Seipp, C. A., Ivanov, A. S., Bryantsev, V. S. Aqueous Sulfate Separation by Sequestration of [(SO4)(H2O)4]4- Clusters within Highly Insoluble Imine-Linked Bis-Guanidinium Crystals. Chem. Eur. J. 22, 1997-2003 (2016).
- Khownium, K., Wood, S. J., Miller, K. A., Balakrishna, R., Nguyen, T. B., Kimbrell, M. R., Georg, G. I., David, S. A. Novel Endotoxin-Sequestering Compounds with Terephthaldehyde-bis-guanylhydrazone Scaffolds. Bioorg. Med. Chem. Lett. 16, 1305-1308 (2006).
- Pecharsky, V. K., Zavalij, P. Y. . Fundamentals of Powder Diffraction and Structural Characterization of Materials. , (2005).
- Goldenberg, D. P. . Principles of NMR Spectroscopy: An Illustrated Guide. , (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados