Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Lisímetro suelo de excavación para acoplados hidrológicos, geoquímicos, e investigaciones microbiológicas
En este artículo
Resumen
Este estudio presenta un método de excavación para la investigación hidrológica subterránea, geoquímica, y la heterogeneidad microbiológica de un lisímetro suelo. El lisímetro simula una ladera artificial que era inicialmente bajo condición homogénea y se había sometido a aproximadamente 5000 mm de agua durante ocho ciclos de riego en un período de 18 meses.
Resumen
Studying co-evolution of hydrological and biogeochemical processes in the subsurface of natural landscapes can enhance the understanding of coupled Earth-system processes. Such knowledge is imperative in improving predictions of hydro-biogeochemical cycles, especially under climate change scenarios. We present an experimental method, designed to capture sub-surface heterogeneity of an initially homogeneous soil system. This method is based on destructive sampling of a soil lysimeter designed to simulate a small-scale hillslope. A weighing lysimeter of one cubic meter capacity was divided into sections (voxels) and was excavated layer-by-layer, with sub samples being collected from each voxel. The excavation procedure was aimed at detecting the incipient heterogeneity of the system by focusing on the spatial assessment of hydrological, geochemical, and microbiological properties of the soil. Representative results of a few physicochemical variables tested show the development of heterogeneity. Additional work to test interactions between hydrological, geochemical, and microbiological signatures is planned to interpret the observed patterns. Our study also demonstrates the possibility of carrying out similar excavations in order to observe and quantify different aspects of soil-development under varying environmental conditions and scale.
Introducción
La dinámica del suelo y del paisaje están determinadas por la interacción compleja de factores físicos, químicos y biológicos 1. El flujo de agua, la erosión geoquímica, y la actividad biológica dan forma al desarrollo general del paisaje en un ecosistema estable 2,3. Si bien los cambios de superficie son las características más notables de paisaje 4, los efectos acumulados de la comprensión hidrológica, geoquímica, y los procesos microbiológicos en la región subsuperficial es crucial para comprender las fuerzas subyacentes que dan forma a un paisaje 2. Futuros escenarios de perturbación climática confunden aún más la previsibilidad y el patrón de la evolución del paisaje 5. Por lo tanto, se convierte en un desafío de vincular los procesos a pequeña escala para su manifestación a gran escala en la escala de paisaje 6. Tradicionales experimentos o experimentos en los paisajes naturales con condiciones iniciales desconocidos y variable en el tiempo obligando están a la altura en la captura de TH laboratorio de corto plazoe heterogeneidad intrínseca de la evolución del paisaje. También, debido a la fuerte acoplamiento no lineal, es difícil predecir los cambios biogeoquímicos de modelización hidrológica en los sistemas heterogéneos 7. A continuación, describimos un método experimental novedoso para excavar una ladera totalmente controlado y vigilado suelos con condiciones iniciales conocidas. Nuestro procedimiento de excavación y de muestreo está dirigido a la captura de la heterogeneidad en desarrollo de la ladera a lo largo de su longitud y profundidad, con el objetivo de proporcionar un amplio conjunto de datos para investigar las interacciones hidro-bio-geoquímicos y su impacto en los procesos de formación del suelo.
Sistemas hidrológicos que se encuentran en la naturaleza están lejos de ser estática en el tiempo, con cambios en las respuestas hidrológicas que tienen lugar dentro de un amplio rango de escalas espaciales y temporales 3. La estructura espacial de las vías de flujo a lo largo de paisajes determina la velocidad, extensión y distribución de reacciones geoquímicas y colonización biológica que impulsanla intemperie, el transporte y la precipitación de solutos y sedimentos, y el desarrollo posterior de la estructura del suelo. Por lo tanto, la incorporación de conocimiento a partir de la edafología, la geofísica y la ecología en las teorías y diseños experimentales para evaluar los procesos hidrológicos y mejorar las predicciones hidrológicas se ha sugerido 8,9. Evolución del paisaje también se ve afectada por los procesos biogeoquímicos del subsuelo, en relación con la dinámica del agua, migración elemental durante el desarrollo del suelo, y por las transformaciones mineralógicas provocados por la reacción de las superficies minerales con el aire, el agua y los microorganismos 10. En consecuencia, es importante para estudiar el desarrollo de puntos de acceso geoquímicas dentro de un paisaje en constante evolución. Además, es fundamental para relacionar patrones de erosión geoquímicas a procesos hidrológicos y las firmas microbiológicos durante la formación del suelo incipiente con el fin de comprender la dinámica del desarrollo del paisaje complejo. Los procesos específicos de la génesis del suelo se rigenpor la influencia combinada del clima, insumos biológicos, el alivio y la hora en un material de matriz específica. Este experimento fue diseñado para hacer frente a las heterogeneidades en la erosión de material de matriz regulada por las variaciones hidrológicas y geoquímicas asociados con la asistencia (incluyendo la pendiente y profundidad) y la variabilidad asociada a la actividad microbiana que es impulsada por gradientes ambientales (es decir, el potencial redox) en condiciones en las material parental, el clima y el tiempo se mantienen constantes. Con respecto a la actividad microbiana, los microorganismos del suelo son componentes críticos y tener un profundo impacto en la estabilidad del paisaje 11. Ellos juegan un papel crucial en la estructura del suelo, los ciclos biogeoquímicos de los nutrientes, y el crecimiento de las plantas. Por lo tanto, es necesario entender la importancia de estos organismos como impulsores de la intemperie, la génesis del suelo, y los procesos de formación del paisaje, mientras que simultáneamente identificar los efectos recíprocos de las trayectorias de flujo hidrológicos y geoquímicos queathering en la estructura de la comunidad microbiana y la diversidad. Esto se puede lograr mediante el estudio de la heterogeneidad espacial de la diversidad de la comunidad microbiana sobre un paisaje cuya evolución hidrológica y las características geoquímicas también están siendo estudiados en paralelo.
A continuación, presentamos un procedimiento de excavación de un lisímetro suelo, operacionalmente llamado miniLEO, diseñado para imitar los modelos a gran escala de las cuencas de orden cero del Observatorio de la evolución del paisaje (LEO) alojado en la Biosfera 2 (Universidad de Arizona). El miniLEO fue desarrollado para identificar los patrones de evolución del paisaje a pequeña escala que surgen de los procesos hidro-bio-geoquímicos heterogéneos acumulativos. Es un lisímetro 2-m de longitud, 0,5 m de ancho y 1 m de altura, y la pendiente de 10 ° (figura 1). Además, las paredes del lisímetro están aisladas y recubiertas con no biodegradable imprimación epoxi de dos componentes y un recubrimiento de uretano alifático de relleno con agregado para evitar la contaminación potencial o lixiviaciónde metales del marco lisímetro en el suelo. El lisímetro se llenó de roca de basalto triturado que se extrae de un depósito de tefra finales del Pleistoceno asociado con Merriam Cráter en el norte de Arizona. El material de basalto cargado era idéntica a la del material utilizado en los experimentos LEO mucho más grandes. La composición mineral, la distribución del tamaño de partícula y propiedades hidráulicas son descritos por Pangle et al. 12. La cara de la filtración pendiente abajo se alinea con una pantalla perforada de plástico (poros de 0,002 m de diámetro, 14% de porosidad). El sistema está equipado con sensores tales como el contenido de agua y de temperatura, sensores de dos tipos de sensores posibles de agua, muestreadores de suelo-agua, el equilibrio de peso hidráulica, sondas de conductividad eléctrica, y transductores de presión para determinar la altura de la capa freática. El lisímetro se regó durante 18 meses antes de la excavación.
La excavación fue meticuloso en su enfoque y estaba dirigido a responder a dos preguntas generales: (1) lo hidrológica, geoquímica, y las firmas microbianas se puede observar a través de la longitud y profundidad de la pendiente con respecto a las condiciones de lluvia simulada y (2) si las relaciones y retroalimentaciones entre los procesos hidro-bio-geoquímicos que ocurren en la ladera se pueden deducir de las firmas individuales. Junto a la configuración experimental y el procedimiento de excavación, se presentan datos representativos y sugerencias sobre cómo aplicar los protocolos de excavación similares para los investigadores interesados en el estudio de la dinámica del sistema Tierra acoplados y / o procesos de desarrollo del suelo.
Protocolo
1. Elaborar una matriz de muestreo para garantizar sistemática y exhaustiva de muestreo de Lisímetro
- Divida lisímetro en voxels de longitud, el ancho y la profundidad fija.
- Utilice un espacio euclidiano sistema de coordenadas y dividir la distancia total a lo largo de cada dirección (X, Y y Z) en un número suficiente de intervalos igualmente espaciados. Considere la posibilidad de desechar el suelo cerca de las paredes del lisímetro para evitar los efectos de contorno.
NOTA: Un buffer de 5 cm a lo largo de las cuatro paredes que se adopte en este experimento para evitar los efectos de frontera, asegurando al mismo tiempo que el volumen de suelo recogida es suficiente. - Asignar a cada muestra una localización única XYZ e identificar como un voxel.
NOTA: En esta excavación, X indica la localización a lo largo de la anchura de la pendiente, Y indica la ubicación a lo largo de la longitud de la pendiente, mientras que Z indica la ubicación a lo largo de la profundidad de la pendiente. El tamaño de los intervalos dentro de cada dimensión determina la anchura, la longitud, y la profundidad de los voxels. Figura 2 muestra la división de la lisímetro después de determinar los intervalos de espaciado junto con el origen elegido para el sistema XYZ. La división en el esquema de excavación actual tiene 9 intervalos a lo largo ambas direcciones Y y Z y 4 intervalos a lo largo de la dirección X, produciendo un total de 324 elementos de imagen volumétrica de 10 cm x 20 cm x 10 cm Dimensiones (Figura 3).
NOTA: La estrategia de muestreo elegido garantiza que todo el sistema se muestrea de manera uniforme con un daño mínimo a los sensores. Los límites de cada voxel (1-2 cm) se descartan para limitar la contaminación cruzada de los voxels vecinos. Además, las dimensiones del voxel asegurar que el material de suelo suficiente está disponible para microbiológica, geoquímica, y la recogida de muestras hidrológica en cada voxel.
- Utilice un espacio euclidiano sistema de coordenadas y dividir la distancia total a lo largo de cada dirección (X, Y y Z) en un número suficiente de intervalos igualmente espaciados. Considere la posibilidad de desechar el suelo cerca de las paredes del lisímetro para evitar los efectos de contorno.

Figura 1. Vista lateral del lisímetro. Vista del lisímetro de la fa filtracionesce. También son visibles tres regiones del sensor (tubos de PVC blanco) a lo largo del sistema de rociadores pendiente y en las cuatro esquinas.

Figura 2. Esquema de muestreo. Esquema de muestra del lisímetro a lo largo de XYZ. La dimensión A. X divide el ancho en 4 secciones, cada una de 10 cm mientras que Y divide la longitud en 20 cm. Dimensión B. La Z indica la profundidad y se dividió en 9 capas de 10 cm de profundidad. Se identificó un límite de 5 cm a lo largo de los bordes de la lisímetro para evitar la recogida de muestras que potencialmente pueden exhibir efecto frontera. Por favor, haga clic aquí para descargar este archivo.
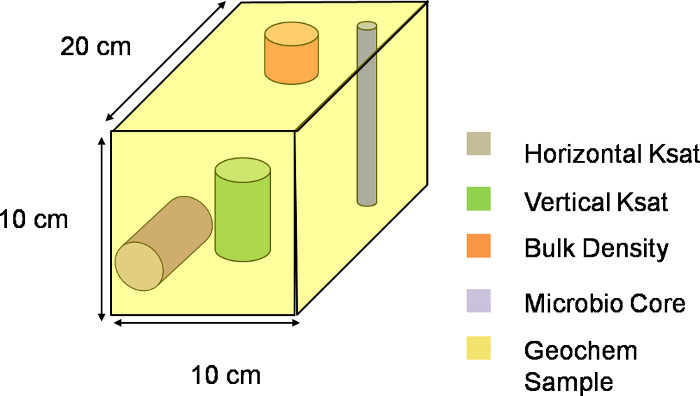
Figura 3. Tres-dimensional representación de un voxel. Visual esquemática de un voxel lo largo del plano XYZ del lisímetro. La pendiente entera se divide en 324 esos voxels, con cada voxel representa una única unidad de muestreo. Por favor, haga clic aquí para descargar este archivo.
2. Añadir azul brillante FCF Dye a la pista de agua de infiltración en la Cuesta
- Aplicar colorante azul brillante en la superficie del suelo, lo suficiente para cubrir top 105 cm de la superficie a lo largo de la dirección Y. Cubrir el suelo restante con láminas de plástico.
- Elija una concentración (en este caso 10 g / L) para garantizar el contraste contra el suelo de basalto negro. Añadir el colorante a los tanques del sistema de riego y diluir con agua hasta la concentración deseada.
- Decidir la duración del riego en base a la profundidad deseada del frente de la infiltración y la tasa suministrada por el sistema de riego.
NOTA: Para este estudio, un itasa de riego fueron de 30 mm / hr durante 20 minutos (Figura 4) antes de la excavación se considera suficiente con el fin de identificar los patrones heterogéneos de la infiltración de agua durante los primeros pocos centímetros. - Después de la aplicación de tinte, dar tiempo para la infiltración se detenga y los estados de humedad dentro del lisímetro se equilibre. Para este estudio, un período de 10 horas (durante la noche) entre la aplicación de tinte y la excavación era apropiado.
3. Delimitación de voxels
- Coloque la cinta a lo largo de la longitud de la pendiente de medición para proporcionar un sistema de referencia in-situ para la orientación durante demarcación de voxels.
- Marque la dimensión de cada voxel del suelo con la ayuda de la cinta de medir. Dibujar líneas de la cuadrícula para cada capa usando escudos-aluminio de la lámina de plástico y cuchillos de masilla (Figura 4). Desechar los materiales de contorno (5 cm de cada pared para evitar los efectos de frontera).

Figura 4. Vista superior de lisímetro. Esta vista muestra la superficie teñida de la capa 2 (10 cm de profundidad). Grids dibujados en la superficie del suelo para ayudar muestreo también son visibles, junto con regiones agujeros centrales en cada voxel después de la recogida de muestras microbiológicas.
4. Recolección de muestras de Microbiología
- Recoger muestras de microbiología asépticamente de cada voxel antes de la hidrológica y análisis geoquímicos para evitar la contaminación cruzada de las muestras. Asegúrese de que los nuevos guantes son usados por todos los miembros que llevan a cabo la excavación para reducir la contaminación de la piel humana.
- Use un descorazonador de suelo de 1 cm de diámetro y 20 cm de altura, y una espátula fina para la recogida de muestras microbiológicas. Limpiar el extractor y la espátula con agua destilada, secar con toallas limpias, y enjuagar con etanol al 75% utilizando una botella de spray. Permitir descorazonador y espátula para secar al aire.
- Tenga en cuenta el colecci tiempo de cada muestra. Utilice el extractor de núcleo a una profundidad de 10 cm en cada ubicación de voxel, y la espátula para vaciar la muestra de suelo en bolsas de plástico pre-esterilizados (Figura 5). Tener cuidado para abrir la bolsa justo antes de depositar la muestra. Homogeneizar las bolsas de muestras con la mano.
- Guarde la bolsa de muestra en un refrigerador de hielo durante el muestreo, y la transferencia tan pronto como sea posible al congelador a -80ºC.

Figura 5. recogida de muestras de Microbiología. Aquí se muestra una pequeña nucleador de mano de 20 cm x 1 cm, bolsas estériles, y una espátula durante el muestreo microbiológico. Por favor, haga clic aquí para descargar este archivo.
5. La geoquímica e hidrología de recogida de muestras
- regiones fotografía teñida en X e Y plAnes durante la excavación para profundidades donde se observa el tinte. Utilice una tarjeta de color para proporcionar referencia para el observado en color (Figura 6). Garantizar la correcta iluminación natural está presente para documentar correctamente la intensidad del color.
- Calibrar el espectrómetro portátil de fluorescencia de rayos X (pXRF) al día, antes de iniciar las mediciones. Para calibración y medición detalles, consulte las instrucciones del fabricante 13 (Figura 7). En pocas palabras, colocar el instrumento en el soporte y el punto de la ventana del rayo directamente a la cuenta de metal fábrica. Seleccione 'Cal' y esperar 30 segundos para permitir que la calibración se complete.
- Limpiar la ventana del rayo antes de tomar cualquier medida. Medir la superficie de cada voxel por triplicado en tres lugares diferentes. Coloque el instrumento pXRF sobre la superficie del suelo y esperar 90 segundos para permitir la medición se complete.
NOTA: de rayos X puede penetrar a través de una larga distancia en la dirección de la viga. Por lo tanto, ensure que sólo personal capacitado maneja el equipo y mantiene protocolos de seguridad adecuadas.
- Limpiar la ventana del rayo antes de tomar cualquier medida. Medir la superficie de cada voxel por triplicado en tres lugares diferentes. Coloque el instrumento pXRF sobre la superficie del suelo y esperar 90 segundos para permitir la medición se complete.

Figura 6. tarjeta de color a seguir tinte infiltración. Cada ubicación con la penetración del colorante visible fue fotografiada con una carta de colores que sirve como referencia. Por favor, haga clic aquí para descargar este archivo.

Figura 7. portátil de rayos X de fluorescencia espectrómetro. Orientable pXRF posicionado en la superficie de un voxel. Las medidas se registraron en tres lugares diferentes en la superficie de cada voxel y luego se promedian.
- limpia núcleos metálicos (altura = 3 cm de diámetro, muerto. = 5,7 cm) y policarbonato cores (altura = 6 cm, diámetro. = 5,7 cm) para densidades de masa (BD) y mediciones de conductividad hidráulica (Ksat) de voxels deseados, respectivamente (Figura 8).
- Verticalmente insertar núcleos de metal y núcleos de policarbonato (Ksat vertical) en voxels deseados, teniendo cuidado de no dañar los sensores o cables de los sensores. Para ello, golpeando uniformemente en los núcleos en el suelo, teniendo cuidado de utilizar una superficie plana, como un bloque de madera entre el núcleo y el martillo con el fin de reducir al mínimo la perturbación del suelo. Además, una vez que el núcleo está a medio camino en el suelo, colocar un segundo núcleo en la parte superior de la primera base. Coloque el bloque de madera en la parte superior de la segunda base y el martillo suavemente el bloque hasta que el primer núcleo está incrustado en el suelo con el borde de núcleo todavía visible.
- Insertar núcleos para Ksat horizontal que la cara lateral del voxel se abre con la excavación secuencial. Utilice el bloque de madera y segundo núcleo como se menciona en el paso 5.4 para minimizar la compactación.
- Tener cuidado para asegurar que el voxelse extrajo la muestra se aísla de las fronteras y los voxels vecinos, antes de la recogida de muestras geoquímicas. Utilice espátulas de plástico para este propósito, seguido de paletas de mano para recoger muestras de suelo alrededor de núcleos de metal o de polipropileno en geoquímicas bolsas (GC) muestra marcada hasta que los núcleos se pueden quitar fácilmente (por ejemplo, la Figura 9a, b).

Figura 8. densidad a granel y núcleos de conductividad hidráulica. Núcleos de polipropileno (izquierda) se usaron para recoger muestras de conductividad hidráulica vertical y horizontal mientras que los núcleos de metal (derecha) se usaron para recoger muestras de densidad aparente.

Figura 9. Voxel demarcación. Espátulas de plástico se utilizaron para (A) aislarvoxel fronteras anteriores a geoquímica (B), densidad aparente, y la colección de referencia de conductividad hidráulica. Por favor, haga clic aquí para descargar este archivo.
- Retire el núcleo metálico, cepillar el exceso de material de ambos extremos, y la transferencia de la muestra desde el núcleo a una bolsa de muestras BD marcado. Pese cada bolsa de muestra con la muestra y registrar el peso total.
- Separar las cuñas de polipropileno. Cubrir ambos lados con tapas de plástico de color rojo y la etiqueta de núcleo de polipropileno vertical "V" y núcleo de polipropileno horizontal "H" seguido de la identificación de la muestra.
- Recoger el material restante del voxel en la bolsa de muestra GC, dejando detrás de un par de centímetros de suelo en los cuatro lados para evitar la contaminación cruzada con el siguiente voxel.
- Repita de los pasos 5.1 a 5.9 para el resto de los voxels en una capa.
- Una vez que todos los voxels de una capa han sidocompletado, repita los pasos desde 3.2 a la 5.10 de la capa posterior.
Nota: El paso 5.1 se debe realizar sólo para los voxels que tienen tinte visible. Consulte la Figura 10 para visualizar el diagrama representativo de un voxel destacando todas las muestras recogidas de cada voxel.

Figura 10. Representante voxel. La línea discontinua roja indica núcleo recogido para la muestra de la microbiología, la línea discontinua verde indica núcleo conductividad hidráulica horizontal, la línea de trazos de color amarillo indica núcleo conductividad hidráulica vertical, el punteado de color púrpura indica núcleo de densidad aparente, y el límite óvalo azul indica que la muestra del voxel restante se utiliza para el análisis geoquímico. por favor, haga clic aquí para descargar este archivo.
Análisis 6. Muestra
- Use las muestras recogidas para análisis microbiológicos para (extracción de ADN microbiano del suelo) 14 molecular y cultivadas (recuentos de placas heterotróficas) 15 análisis. Utilizar el ADN extraído de las reacciones en cadena de polimerasa cuantitativa (qPCR) 16, y de alto rendimiento experimentos de secuenciación de genes 17,18.
- Use las muestras recogidas para análisis geoquímicos para medir una multitud de propiedades geoquímicas incluyendo el pH (el método US EPA 150.2), conductividad eléctrica (EC) (US método EPA 120.1), carbono y nitrógeno (US método EPA 415.3, extracción secuencial de los elementos 19, y difracción de rayos X (DRX) y ampliado estructura fina de absorción de rayos X (EXAFS) espectroscopia de acuerdo con las especificaciones de Stanford Laboratorio de Radiación Sincrotrón, para investigar las transformaciones minerales.
- Utilice muestras de testigos recogidos para los análisis hidrológicos para experimentos de laboratorio como la densidad aparente 20y la conductividad hidráulica 21.
Resultados
Las dimensiones de los voxels aseguraron toma de muestras para hidrológica, geoquímica, y las mediciones microbiológicos. El procedimiento de excavación se descubrieron 324 núcleos para el análisis microbiológico, 972 puntos de datos pXRF, 324 bolsas de muestras geoquímicas, 180 muestras Ksat (128 vertical y horizontal 52), y 311 muestras de densidad aparente. flujo preferencial de colorante azul brillante también se observó a una profundidad de 30 cm por debajo de la superfici...
Discusión
Evolución del paisaje es el efecto acumulativo de la hidrológica, geoquímicos y biológicos 12. Estos procesos de control de flujo y transporte de agua y elementos, y las reacciones biogeoquímicos en la evolución de los paisajes. Sin embargo, la captura de las interacciones de forma simultánea requiere un diseño experimental precisamente coordinada y toma de muestras. Además, el estudio de la evolución del paisaje incipiente es difícil en los sistemas naturales, con capacidades limitadas para identi...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We thank Ty P.A. Ferré, Till Volkman, Edwin Donker, Mauricio Vera for helping us during the excavation, and Triffon J. Tatarin, Manpreet Sahnan and Edward Hunt for their help in sample analysis. This work was carried out at Biosphere 2, University of Arizona and funded by National Science Foundation grant EAR_1344552 and Honors Research Program of Biosphere 2.
Materiales
| Name | Company | Catalog Number | Comments |
| Measuring tape | Any | Any | Preventing cross-contamination of samples is crucial. Therefore, it is helpful to have multiple putty knives to isolate voxel boundary. |
| Brilliant Blue dye | Waldeck GmBH &Co | B0770 | Rulers can be used to draw grids. The sampling strategy can be modified based on individual experiments. |
| Soil Corer | AMS | 56975 | Any commercially manufactured Brilliant Blue dye can be used. |
| 75% Ethanol | Any | Any | A Nikon D90 camera and 50 mm lens were used for photography. Any high resolution camera and lens can be used for this purpose. |
| Spray Bottle | Any | Any | Use of dye and color card is subjective to individual experiments and/or research questions. |
| Spatula | Any | Any | Gardening gloves may be used if handling of corer becomes tedious. |
| Gloves | Any | Any | Ensure microbiology samples are kept in ice during sampling and frozen as soon as possible. |
| KimWipes | KimTech Science | Any | Water can be used to wash soil corer, prior to sanitizing with ethanol. |
| Sterile Sample bags | Fisher Scientific | Whirl-Pak 4 OZ. 24 OZ | Keep buckets and dustpans handy to facilitate removal of waste soil. |
| Color Card | Any | Any | The original design of miniLEO has various sensors embedded in the lysimeter. Such sensors may or may not be necessary based on the scope of individual experimental design. |
| X-ray Fluoresce Spectrophotmeter | XRF, OLYMPUS | DS-2000 Delta XRF | |
| Polypropylene cores | Any | Any | |
| Metal cores | Any | Any | |
| Caps for polypropylene cores | Any | Any | |
| Hammer | Any | Any | |
| Plastic putty knives | Any | Any | |
| Face masks | Any | Any |
Referencias
- Brady, N. C., Weil, R. R. . The nature and properties of soils. , (2008).
- Chorover, J., Kretzschmar, R., Garica-Pichel, F., Sparks, D. L. Soil biogeochemicial processes within the critical zone. Elements. 3, 321-326 (2007).
- Troch, P. A., et al. Catchment coevolution: A useful framework for improving predictions of hydrological change?. Water Resour. Res. 6, 1-20 (2015).
- Sharp, R. P. Landscape evolution (A Review). Proc. Natl. Acad. Sci. U. S. A. 79, 4477-4486 (1982).
- Temme, A., Montgomery, D. R., Bierman, P. R. Predicting the effect of changing climate on landscapes with computer based landscape evolution models. Key Concepts in Geomorphology. , (2013).
- Troch, P. A., et al. Dealing with Landscape Heterogeneity in Watershed Hydrology: A Review of Recent Progress toward New Hydrological Theory. Geogr. Compass. 3, 375-392 (2009).
- Wang, Y., et al. Dissecting the Hydrobiogeochemical Box. in Am. Geophys. Union Fall Meet. , (2015).
- Lin, H., et al. Hydropedology: Synergistic integration of pedology and hydrology. Water Resour. Res. 42 (5), W05301 (2006).
- Band, L. E., et al. Ecohydrological flow networks in the subsurface. Ecohydrology. 7, 1073-1078 (2014).
- Churchman, G. j., Lowe, D. . Handbook of Soil Science Properties and Process. 1, (2012).
- van der Heijden, M. G. A., Bardgett, R. D., van Straalen, N. M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecol. Lett. 11 (3), 296-310 (2008).
- Pangle, L. a., et al. The Landscape Evolution Observatory: A large-scale controllable infrastructure to study coupled Earth-surface processes. Geomorphology. 244, 190-203 (2015).
- . . User Manual: Delta Famiy Handheld XRF Analyzers. , (2013).
- Valentìn-Vargas, A., Root, R. A., Neilson, J. W., Chorover, J., Maier, R. M. Environmental factors influencing the structural dynamics of soil microbial communities during assisted phytostabilization of acid-generating mine tailings: A mesocosm experiment. Sci Total Environ. 500-501, 314-324 (2014).
- JoVE Science Education Database. . Essentials of Environmental Microbiology. Culturing and Enumerating Bacteria from Soil Samples. , (2016).
- JoVE Science Education Database. . Essentials of Environmental Microbiology: Quantifying Environmental Microorganisms and Viruses Using qPCR. , (2016).
- Sengupta, A., Dick, W. A. Bacterial community diversity in soil under two tillage practices as determined by pyrosequencing. Microb. Ecol. 70, 853-859 (2015).
- Caporaso, J. G., et al. Correspondence - QIIME allows analysis of high- throughput community sequencing data. Nat. Publ. Gr. 7, 335-336 (2010).
- Hall, G. E. M., Vaive, J. E., Beer, R., Hoashi, M. Selective leaches revisited, with emphasis on the amorphous Fe oxyhydroxide phase extraction. J. Geochemical Explor. 56, 59-78 (1996).
- Grossman, R. B., Reinsch, T. G., Dane, J. H., Topp, G. C. Bulk density and linear extensibility. Methods of Soil Analysis. Part 4-Physical Methods. , 201-228 (2002).
- Reynolds, W. D., Elrick, D. E., Youngs, E. G., Amoozegar, A., Bootlink, H. W. G., Bouma, J., Dane, J. H., Topp, G. C. Saturated and field-saturated water flow parameters. Methods of Soil Analysis, Part 4-Physical Methods. , 802-816 (2002).
- King, G. M. Contributions of atmospheric CO and hydrogen uptake to microbial dynamics on recent Hawaiian volcanic deposits. Appl. Environ. Microbiol. 69 (7), 4067-4075 (2003).
- Meyer, W. S., Barrs, H. D. Roots in irrigated clay soils: Measurement techniques and responses to rootzone conditions. Irrig. Sci. 12 (3), 125-134 (1991).
- Graham, C. B., Woods, R. A., McDonnell, J. J. Hillslope threshold response to rainfall: (1) A field based forensic approach. J. Hydrol. 393 (1-2), 65-76 (2010).
- Anderson, A. E., Weiler, M., Alila, Y., Hudson, R. O. Dye staining and excavation of a lateral preferential flow network. Hydrol. Earth Syst. Sci. Discuss. 5 (2), 1043-1065 (2008).
- Gleeson, T., Paszkowski, D. Perceptions of scale in hydrology: what do you mean by regional scale?. Hydrol. Sci. J. 00, 1-9 (2013).
- Molins, S., Trebotich, D., Steefel, C. I., Shen, C. An investigation of the effect of pore scale flow on average geochemical reaction rates using direct numerical simulation. Water Resour. Res. 48, W03527 (2012).
- Fierer, N., Lennon, J. T. The generation and maintenance of diversity in microbial communities. Am. J. Bot. 98 (3), 439-448 (2011).
- Niu, G. Y., Pasetto, D., Scudeler, C., Paniconi, C., Putti, M., Troch, P. A. Analysis of an extreme rainfall-runoff event at the Landscape Evolution Observatory by means of a three-dimensional physically-based hydrologic model. Hydrol. Earth Syst. Sci. Discuss. 10, 12615-12641 (2013).
- Marteinsson, V., et al. Microbial colonization in diverse surface soil types in Surtsey and diversity analysis of its subsurface microbiota. Biogeosciences. 12, 1191-1203 (2015).
- Orcutt, B. N., Sylvan, J. B., Rogers, D. R., Delaney, J., Lee, R. W., Girguis, P. R. Carbon fixation by basalt-hosted microbial communities. Front. Microbiol. 6, 00904 (2015).
- Wu, L., Jacobson, A. D., Chen, H. C., Hausner, M. Characterization of elemental release during microbe-basalt interactions at T=28°C. Geochim. Cosmochim. Acta. 71, 2224-2239 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados