Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Почва лизиметре Выемка для связанных гидрологические, геохимические и микробиологические исследования
В этой статье
Резюме
Данное исследование представляет собой метод выемки грунта для исследования подповерхностных гидрологические, геохимические и микробиологические гетерогенность лизиметре почвы. Лизиметра имитирует искусственную hillslope, который был первоначально под однородным условием и были подвергнуты около 5000 мм воды в течение восьми циклов полива в 18-месячный период.
Аннотация
Studying co-evolution of hydrological and biogeochemical processes in the subsurface of natural landscapes can enhance the understanding of coupled Earth-system processes. Such knowledge is imperative in improving predictions of hydro-biogeochemical cycles, especially under climate change scenarios. We present an experimental method, designed to capture sub-surface heterogeneity of an initially homogeneous soil system. This method is based on destructive sampling of a soil lysimeter designed to simulate a small-scale hillslope. A weighing lysimeter of one cubic meter capacity was divided into sections (voxels) and was excavated layer-by-layer, with sub samples being collected from each voxel. The excavation procedure was aimed at detecting the incipient heterogeneity of the system by focusing on the spatial assessment of hydrological, geochemical, and microbiological properties of the soil. Representative results of a few physicochemical variables tested show the development of heterogeneity. Additional work to test interactions between hydrological, geochemical, and microbiological signatures is planned to interpret the observed patterns. Our study also demonstrates the possibility of carrying out similar excavations in order to observe and quantify different aspects of soil-development under varying environmental conditions and scale.
Введение
Почва и ландшафтные динамика формируются под воздействием сложного взаимодействия физических, химических и биологических процессов 1. Расход воды, геохимические погодным условиям , а также биологическая активность формируют общее развитие ландшафта в стабильную экосистему 2,3. В то время как изменения поверхности являются наиболее заметные особенности ландшафта 4, понимание совокупное воздействие гидрологических, геохимических и микробиологические процессы в приповерхностной области имеет решающее значение для понимания основных сил , которые формируют ландшафт 2. Сценарии будущего климата возмущение далее запутать предсказуемость и характер ландшафта эволюции 5. Таким образом, становится непростой задачей связать мелкомасштабные процессы их крупномасштабного проявления на ландшафтном уровне 6. Традиционные лабораторные эксперименты мелкосерийных или эксперименты в естественных ландшафтов с неизвестными начальными условиями и временной переменной вынуждающих не дотягивают в захвате тысе внутренняя неоднородность эволюции ландшафта. Кроме того , из - за сильной нелинейной связи, трудно предсказать биогеохимические изменения от гидрологического моделирования в гетерогенных системах 7. Здесь мы опишем новый экспериментальный метод выкопать полностью управляемый и контролируемый hillslope почвы с известными начальными условиями. Наша методика раскопок и отбор проб направлен на захват развивающейся гетерогенность hillslope вдоль его длины и глубины, с целью предоставления полного набора данных для исследования гидро-био-геохимических взаимодействий и их влияние на процессы почвообразования.
Гидрологические системы , встречающиеся в природе далеки от статического времени, с изменением гидрологических реакций , происходящих в широком диапазоне пространственных и временных масштабах 3. Пространственная структура путей потока вдоль ландшафтов определяет скорость, объем и распределение геохимических реакций и биологической колонизации, которые управляютвыветривание, перенос и осаждение растворенных веществ и отложений, а также дальнейшее развитие структуры почвы. Таким образом, включение знаний из почвоведения, геофизики, экологии и в теории и экспериментальных проектов для оценки гидрологических процессов и улучшить гидрологические прогнозы было предложено 8,9. Эволюция ландшафта также влияние подповерхностных биогеохимических процессов в сочетании с динамикой воды, элементарной миграции в процессе развития почвы, и минералогических преобразований , вызванных взаимодействием минеральных поверхностей с воздухом, водой и микроорганизмов 10. Следовательно, важно изучить развитие геохимических горячих точек в рамках развивающейся пейзаж. Кроме того, важно, чтобы связать геохимические закономерности выветривания гидрологических процессов и микробиологических подписей в процессе формирования зарождающегося почвы для того, чтобы понять динамику комплексного развития ландшафта. Конкретные процессы генезиса почв регулируютсякомбинированным воздействием климатических, биологических ресурсов, рельефа и времени на конкретном исходного материала. Этот эксперимент был разработан для решения гетерогенность в выветривание исходного материала регулируется гидрологических и геохимических вариаций , связанных с рельефом ( в том числе наклона и глубины) и связанного с изменчивостью микробной активности, приводимый от градиентов окружающей среды (то есть, окислительно - восстановительный потенциал) в условиях , когда Исходный материал, климат и время остаются постоянными. Что касается активности микроорганизмов, почвенных микроорганизмов являются важнейшими компонентами , и оказывают сильное влияние на ландшафтном стабильность 11. Они играют важную роль в структуре почвы, биогеохимического круговорота питательных веществ и роста растений. Поэтому необходимо понять значение этих организмов в качестве водителей выветривания, генезиса почв и процессов формирования ландшафта, при одновременном определении взаимных эффектов гидрологических потоков-путей и геохимической мыathering на структуру микробного сообщества и разнообразия. Это может быть достигнуто путем изучения пространственной неоднородности разнообразия микробного сообщества над изменяющимися которого гидрологические и геохимические характеристики также изучаются параллельно.
Здесь мы представляем процедуру раскопок лизиметре почвы, операционно под названием miniLEO, предназначенный для имитации крупномасштабных нулевого порядка бассейновых моделей ландшафтной Evolution обсерватории (НОО) размещались на Биосферы-2 (Университет штата Аризона). MiniLEO была разработана с целью выявления мелких эволюции ландшафта закономерности, связанные с кумулятивными гетерогенных гидро-био-геохимических процессов. Это лизиметре 2-м в длину, 0,5 м в ширину и 1-м в высоту и наклон на 10 ° (рис 1). Кроме того, стены лизиметра изолированы и покрыты не поддающихся биохимическому разложению двух частей эпоксидной грунтовки и совокупным заполненные алифатического уретана пальто, чтобы избежать возможного загрязнения или выщелачиваниеметаллов из лизиметра рамы в почву. Лизиметра был наполнен дробленым базальтовых пород, извлеченном из месторождения позднего плейстоцена тефрой связанного с Merriam Кратер в северной части штата Аризона. Загруженный базальт материал идентичен материалу, используемому в гораздо больших экспериментов на НОО. Минеральный состав, распределение размера частиц, а также гидравлические свойства описываются Pangle и др. 12. Вниз по склону просачивания лицо было выложено перфорированной пластиковой экрана (порами диаметром 0,002-м, 14% пористости). Система оснащена датчиками, такими как содержание воды и датчиков температуры, двух типов потенциальных водных датчиков, почвенно-воды пробников, гидравлический баланс веса, электрических датчиков проводимости и датчиков давления для определения высоты грунтовых вод. Лизиметра орошали в течение 18 месяцев до начала земляных работ.
Выемка грунта дотошный в своем подходе и была направлена на ответы на два широких вопроса: (1) то, что гидрологические, геохимические и микробные подписи можно наблюдать по всей длине и глубине наклона по отношению к моделируемых условиях осадков и (2) являются ли отношения и обратные связи между гидро-био-геохимических процессов, происходящих на hillslope можно вывести из отдельные подписи. Наряду с экспериментальной установки и процедуры раскопок, мы представляем репрезентативные данные и предложения о том, как применять аналогичные протоколы раскопок для исследователей, заинтересованных в изучении динамики в сочетании земной системы и / или процессы разработки почвы.
протокол
1. Придумайте Sampling Матрицу Обеспечить систематический и комплексный Отбор проб лизиметре
- Разделить лизиметре в вокселей фиксированной длины, ширины и глубины.
- Используйте евклидово пространство системы координат и разделить общее расстояние вдоль каждого направления (X, Y и Z) в достаточном количестве, равномерно распределенных интервалов. Рассмотрим отбрасывая почву вблизи стен лизиметра избежать граничных эффектов.
Примечание: Буфер размером 5 см вдоль четырех стен принимается в этом эксперименте, чтобы избежать граничных эффектов, обеспечивая при этом, что объем почвы, собранных достаточно. - Назначение каждого образца уникальный XYZ местоположение и идентифицировать как вокселе.
Примечание: В этом котлована, Х обозначает расположение по ширине склона, Y обозначает месте по длине склона, в то время как Z обозначает расположение по глубине склона. Размер интервалов в пределах каждого размера определяет ширину, длину и глубину вокселей. Figure 2 показано разделение лизиметра после определения интервалов распорных вместе с выбранным происхождения для системы XYZ. Разделение в текущей схеме раскопа имеет 9 интервалов вдоль обоих Y и Z направлениях и 4 интервалов вдоль направления X, производя в общей сложности 324 вокселей 10 см х 20 см х 10 см Размеры (рисунок 3).
Примечание: стратегия выборки выбирается гарантирует, что вся система равномерно оцифровываются с минимальным ущербом для датчиков. Границы каждого воксела (1-2 см) отбрасываются, чтобы ограничить перекрестное загрязнение из соседних вокселей. Кроме того, размеры вокселей гарантировать, что достаточное количество материала почвы для микробиологических, геохимических и гидрологического сбора проб в каждом воксела.
- Используйте евклидово пространство системы координат и разделить общее расстояние вдоль каждого направления (X, Y и Z) в достаточном количестве, равномерно распределенных интервалов. Рассмотрим отбрасывая почву вблизи стен лизиметра избежать граничных эффектов.

Рисунок 1. Боковой вид лизиметре. Вид лизиметре из фильтрационного фасе. Также видны три области датчика (белые трубы ПВХ) вдоль склона и спринклерной системы на четырех углах.

Рисунок 2. Схема выборки. Схема Отбор проб лизиметре по XYZ. Размерности А. Х делит ширину на 4 секции , каждая из которых 10 см , тогда как Y делит длину на 20 см. В. Z размер указывает на глубину и был разделен на 9 слоев глубины 10 см. Граница 5 см все по краям лизиметра был идентифицирован , чтобы предотвратить сбор образцов , которые могут потенциально проявляющих краевой эффект. Пожалуйста , нажмите здесь , чтобы загрузить этот файл.
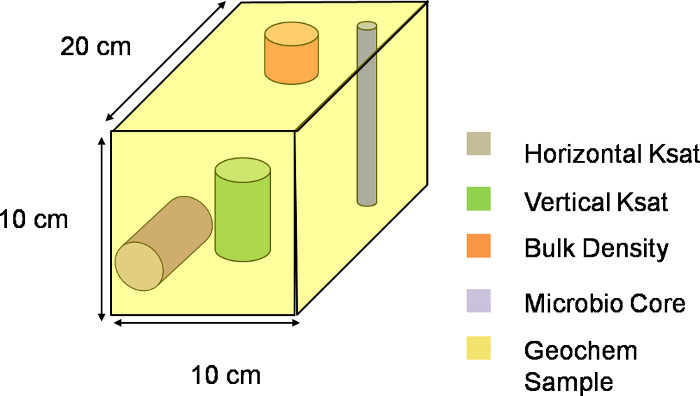
Рисунок 3. Три-dimensional представление вокселе. Визуальная схема одного воксела вдоль XYZ плоскости лизиметре. Весь склон был разделен на 324 таких вокселей, с каждым воксела , изображающей одну единицу выборки. Пожалуйста , нажмите здесь , чтобы загрузить этот файл.
2. Добавить Brilliant Blue FCF красителю Track инфильтрации воды в наклоне
- Нанести бриллиантовый синий краситель на поверхности почвы, достаточно, чтобы покрыть 105 см верхние поверхности вдоль направления Y. Накройте оставшейся почвы с пластиковыми листами.
- Выберите концентрацию (здесь 10 г / л), чтобы гарантировать контраст против черной базальтовой почвы. Добавьте краситель в системе резервуаров орошения и разбавляют водой до нужной концентрации.
- Определите продолжительность орошения на основе желаемой глубины инфильтрации фронта и скоростью, подаваемой системой орошения.
Примечание: Для этого исследования, изоСкорость rrigation 30 мм / ч в течение 20 мин (рисунок 4) до начала земляных работ считается достаточным для того , чтобы выявить закономерности гетерогенных инфильтрации воды в течение первых нескольких сантиметров. - После нанесения красителя, дать время для инфильтрации, чтобы остановить и состояния влаги в пределах лизиметра уравновешиваться. Для этого исследования в течение 10 ч (в течение ночи) между применением красителя и земляных работ был соответствующим.
3. Разграничение вокселей
- Приложить измерительной ленты по длине склона для обеспечения системы отсчета в месте для руководства в процессе демаркации вокселей.
- Отметьте размер каждого воксела почвы с помощью измерительной ленты. Нарисуйте линии сетки для каждого слоя с использованием алюминиевого лезвия щиты и пластиковые Шпатели (рисунок 4). Откажитесь граничные материалы (5 см от каждой стены, чтобы предотвратить краевые эффекты).

Рисунок 4. Вид сверху лизиметре. Этот вид показывает окрашенную поверхность слоя 2 (10 см глубиной). Сетки, нарисованные на поверхности почвы для облегчения отбора проб также видны, наряду с основными отверстиями областей на каждом воксела после микробиологического сбора проб.
4. Сбор образцов Микробиология
- Соберите образцы микробиологическую асептических от каждого воксела до гидрологического и геохимического анализа для предотвращения перекрестного загрязнения образцов. Убедитесь в том, что новые перчатки носят все члены, осуществляющих раскопки, чтобы уменьшить загрязнение из человеческой кожи.
- Используйте бур почвы диаметром 1 см и высотой 20 см, а тонкой лопаточкой для микробиологического сбора проб. Очистите бур и лопаточку с дистиллированной водой, вытереть насухо чистой салфетки и промыть 75% этанола с помощью пульверизатора. Разрешить бур и шпатель высохнуть на воздухе.
- Обратите внимание на грollection время каждого образца. Используйте бур для ядра на глубину 10 см в каждом месте воксельном и лопаточкой , чтобы очистить образец почвы в предварительно стерилизованные пластиковые пакеты (рисунок 5). Позаботьтесь, чтобы открыть сумку непосредственно перед нанесением образца. Гомогенизацию пакеты с пробами вручную.
- Храните мешок образца в холодильнике со льдом во время отбора проб, а также передавать как можно скорее до -80 ° C морозильнике.

Рисунок 5. Сбор Микробиология образца. Небольшой портативный пробоотборник 20 см х 1 см, стерильные мешки и лопатка показан здесь во время микробиологического отбора проб. Пожалуйста , нажмите здесь , чтобы загрузить этот файл.
5. геохимии и гидрология Сбор образцов
- Фотограф окрашенные области в X и Y плAnes во время земляных работ на глубинах, где наблюдается краситель. Используйте цветную карту , чтобы обеспечить ссылку на наблюдаемый цвет (рисунок 6). Обеспечить надлежащее естественное освещение присутствует правильно документировать интенсивность цвета.
- Калибровка портативный рентгеновский флуоресцентный спектрометр (pXRF) ежедневно перед началом измерений. Для калибровки и измерений деталей, смотрите инструкции изготовителя 13 (рисунок 7). Если коротко, то поместите прибор на держателе и направьте окно луча непосредственно на завод металлического шарика. Выберите 'Cal' и подождите 30 секунд, чтобы калибровка будет завершена.
- Очистите окно луча, прежде чем принимать каждое измерение. Измерьте поверхность каждого воксела в трех экземплярах на трех разных местах. Поместите прибор pXRF на поверхности почвы и подождать 90 секунд, чтобы позволить измерение будет завершено.
Примечание: Рентгеновский может проникать через большое расстояние в направлении луча. Поэтому ensuповторно, что только квалифицированный персонал обрабатывает оборудования и поддерживает соответствующие протоколы безопасности.
- Очистите окно луча, прежде чем принимать каждое измерение. Измерьте поверхность каждого воксела в трех экземплярах на трех разных местах. Поместите прибор pXRF на поверхности почвы и подождать 90 секунд, чтобы позволить измерение будет завершено.

Рисунок 6. Цвет карты , чтобы следовать окрасить инфильтрацию. Каждое место с проникновением видимого красителя был сфотографирован с картой цветов , выступающей в качестве ссылки. Пожалуйста , нажмите здесь , чтобы загрузить этот файл.

Рисунок 7. Портативный рентгеновский флуоресцентный спектрометр. Ручной pXRF расположен на поверхности вокселе. Измерения были записаны в трех различных местах на поверхности каждого воксела, а затем усредняются.
- Чисто металлические жилы (высота = 3 см, диам. = 5,7 см) и поликарбоната соРез (высота = 6 см, диаметр = 5,7 см) для объемной плотности (BD) и измерения гидравлической проводимости (КСАТ) желаемого вокселей, соответственно (рисунок 8).
- Вертикально вставить металлические стержни и поликарбонат сердечники (вертикальные) КСАТ в желаемые вокселей, стараясь не повредить датчики или провода датчика. Делайте это осторожно ковкой ядра в почву, следя за тем, чтобы использовать плоскую поверхность, как кусок дерева между ядром и молотка для того, чтобы свести к минимуму нарушения почвы. Кроме того, как только сердечник находится на полпути в почву, поместите второе ядро поверх первого сердечника. Поместите деревянный блок в верхней части второго сердечника и осторожно вбить блок, пока первый сердечник не встроен в почву вместе с основной ободе до сих пор видны.
- Вставьте сердечников для горизонтального КСАТ как боковой грани вокселе открывает с последовательным котлована. Используйте деревянный блок и второе ядро, как указано в пункте 5.4, чтобы минимизировать уплотнение почвы.
- Позаботьтесь, чтобы убедиться, что вокселев выборку изолирован от границ и соседних вокселей до геохимической сбора проб. Используйте пластиковые Шпатели для этой цели, за которыми следуют ручных совками , чтобы собрать образцы почвы вокруг металла или полипропилена ядер в маркированные геохимических (GC) образцов упаковки до ядра не могут быть легко удалены (например, 9а, б).

Рисунок 8. Плотность Объемная и сердечники влагопроводность. Полипропиленовые сердечники (слева) были использованы для сбора вертикальных и горизонтальных образцов влагопроводность в то время как металлические стержни (справа) были использованы для сбора образцов насыпной плотности.

Рисунок 9. Воксельный демаркация. Пластиковые ножи замазки были использованы для (A) изолируетвокселей границы до начала (В) геохимических, насыпной плотности и гидравлического сбора основной проводимости. Пожалуйста , нажмите здесь , чтобы загрузить этот файл.
- Удалите металлическое ядро, счищать излишки материала с обоих концов, и передавать пробы от ядра к меченым BD мешок образца. Взвесить каждую сумку образца с образцом и запишите общий вес.
- Удалить жилы из полипропилена. Накройте обе стороны с красными пластиковыми крышками и маркировать вертикальной сердечник из полипропилена, как "V" и горизонтального ядра полипропилена, как "H", а затем образца ID.
- Собрать оставшийся материал из вокселе в образец мешок GC, оставляя за пару сантиметров почвы на всех четырех сторон для предотвращения перекрестного загрязнения со следующей вокселе.
- Повторите шаги с 5,1 до 5,9 для остальных вокселей в одном слое.
- После того, как все вокселей из одного слоя былозавершена, повторите шаги от 3.2 до 5.10 для последующего слоя.
Примечание: шаг 5.1 должен быть выполнен анализ только для вокселей, которые имеют видимый краситель. Обратитесь к рисунку 10 , чтобы визуализировать представительную схему вокселе подсветки все образцы , собранные с каждого воксела.

Рисунок 10. Представитель воксельная. Красная пунктирная линия указывает на ядро собирают для микробиологического образца, зеленая пунктирная линия указывает на ядро горизонтальную влагопроводность, желтая пунктирная линия показывает вертикальный стержень влагопроводность, пурпурная пунктирная показывает объемную плотность ядра, а синий овал границу определение оставшегося образца из вокселе используется для геохимического анализа. Пожалуйста , нажмите здесь , чтобы загрузить этот файл.
6. Анализ проб
- Используйте образцы , собранные для микробиологических анализов на молекулярном (микробного экстракции ДНК почвы) 14 и культивируют (счет гетеротрофные пластины) 15 анализов. Используйте извлеченную ДНК для количественной полимеразной цепной реакции (КПЦР) 16, а также с высокой пропускной способностью экспериментов секвенирования генов 17,18.
- Используйте образцы , собранные для геохимического анализа для измерения множество геохимических свойств , включая рН (US EPA метод 150,2), электропроводность (EC) (США метод EPA 120.1), содержание углерода и азота (США метод EPA 415.3, последовательное извлечение элементов 19, и рентгеновской дифракции (XRD) и расширенный рентгеновского поглощения тонкой структуры (EXAFS) спектроскопии в соответствии со спецификациями Стэнфордского лаборатории синхротронного излучения, исследовать минеральные преобразования.
- Используйте образцы керна , собранные для гидрологических анализов для лабораторных экспериментов , таких как объемная плотность 20и гидравлическая проводимость 21.
Результаты
Размеры вокселей обеспечили сбор образцов для гидрологических, геохимических и микробиологических измерений. Процедура раскопки дали 324 сердечников для микробиологического анализа, 972 pXRF точек данных, 324 геохимических мешки для образцов, 180 КСАТ образцов (128 по вертик...
Обсуждение
Эволюция ландшафта является кумулятивный эффект гидрологических, геохимических и биологических процессов 12. Эти процессы управления потоком и транспортировки воды и элементов, и биогеохимических реакций в эволюции ландшафтов. Однако, захватив взаимодействие одновременно тре?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
We thank Ty P.A. Ferré, Till Volkman, Edwin Donker, Mauricio Vera for helping us during the excavation, and Triffon J. Tatarin, Manpreet Sahnan and Edward Hunt for their help in sample analysis. This work was carried out at Biosphere 2, University of Arizona and funded by National Science Foundation grant EAR_1344552 and Honors Research Program of Biosphere 2.
Материалы
| Name | Company | Catalog Number | Comments |
| Measuring tape | Any | Any | Preventing cross-contamination of samples is crucial. Therefore, it is helpful to have multiple putty knives to isolate voxel boundary. |
| Brilliant Blue dye | Waldeck GmBH &Co | B0770 | Rulers can be used to draw grids. The sampling strategy can be modified based on individual experiments. |
| Soil Corer | AMS | 56975 | Any commercially manufactured Brilliant Blue dye can be used. |
| 75% Ethanol | Any | Any | A Nikon D90 camera and 50 mm lens were used for photography. Any high resolution camera and lens can be used for this purpose. |
| Spray Bottle | Any | Any | Use of dye and color card is subjective to individual experiments and/or research questions. |
| Spatula | Any | Any | Gardening gloves may be used if handling of corer becomes tedious. |
| Gloves | Any | Any | Ensure microbiology samples are kept in ice during sampling and frozen as soon as possible. |
| KimWipes | KimTech Science | Any | Water can be used to wash soil corer, prior to sanitizing with ethanol. |
| Sterile Sample bags | Fisher Scientific | Whirl-Pak 4 OZ. 24 OZ | Keep buckets and dustpans handy to facilitate removal of waste soil. |
| Color Card | Any | Any | The original design of miniLEO has various sensors embedded in the lysimeter. Such sensors may or may not be necessary based on the scope of individual experimental design. |
| X-ray Fluoresce Spectrophotmeter | XRF, OLYMPUS | DS-2000 Delta XRF | |
| Polypropylene cores | Any | Any | |
| Metal cores | Any | Any | |
| Caps for polypropylene cores | Any | Any | |
| Hammer | Any | Any | |
| Plastic putty knives | Any | Any | |
| Face masks | Any | Any |
Ссылки
- Brady, N. C., Weil, R. R. . The nature and properties of soils. , (2008).
- Chorover, J., Kretzschmar, R., Garica-Pichel, F., Sparks, D. L. Soil biogeochemicial processes within the critical zone. Elements. 3, 321-326 (2007).
- Troch, P. A., et al. Catchment coevolution: A useful framework for improving predictions of hydrological change?. Water Resour. Res. 6, 1-20 (2015).
- Sharp, R. P. Landscape evolution (A Review). Proc. Natl. Acad. Sci. U. S. A. 79, 4477-4486 (1982).
- Temme, A., Montgomery, D. R., Bierman, P. R. Predicting the effect of changing climate on landscapes with computer based landscape evolution models. Key Concepts in Geomorphology. , (2013).
- Troch, P. A., et al. Dealing with Landscape Heterogeneity in Watershed Hydrology: A Review of Recent Progress toward New Hydrological Theory. Geogr. Compass. 3, 375-392 (2009).
- Wang, Y., et al. Dissecting the Hydrobiogeochemical Box. in Am. Geophys. Union Fall Meet. , (2015).
- Lin, H., et al. Hydropedology: Synergistic integration of pedology and hydrology. Water Resour. Res. 42 (5), W05301 (2006).
- Band, L. E., et al. Ecohydrological flow networks in the subsurface. Ecohydrology. 7, 1073-1078 (2014).
- Churchman, G. j., Lowe, D. . Handbook of Soil Science Properties and Process. 1, (2012).
- van der Heijden, M. G. A., Bardgett, R. D., van Straalen, N. M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecol. Lett. 11 (3), 296-310 (2008).
- Pangle, L. a., et al. The Landscape Evolution Observatory: A large-scale controllable infrastructure to study coupled Earth-surface processes. Geomorphology. 244, 190-203 (2015).
- . . User Manual: Delta Famiy Handheld XRF Analyzers. , (2013).
- Valentìn-Vargas, A., Root, R. A., Neilson, J. W., Chorover, J., Maier, R. M. Environmental factors influencing the structural dynamics of soil microbial communities during assisted phytostabilization of acid-generating mine tailings: A mesocosm experiment. Sci Total Environ. 500-501, 314-324 (2014).
- JoVE Science Education Database. . Essentials of Environmental Microbiology. Culturing and Enumerating Bacteria from Soil Samples. , (2016).
- JoVE Science Education Database. . Essentials of Environmental Microbiology: Quantifying Environmental Microorganisms and Viruses Using qPCR. , (2016).
- Sengupta, A., Dick, W. A. Bacterial community diversity in soil under two tillage practices as determined by pyrosequencing. Microb. Ecol. 70, 853-859 (2015).
- Caporaso, J. G., et al. Correspondence - QIIME allows analysis of high- throughput community sequencing data. Nat. Publ. Gr. 7, 335-336 (2010).
- Hall, G. E. M., Vaive, J. E., Beer, R., Hoashi, M. Selective leaches revisited, with emphasis on the amorphous Fe oxyhydroxide phase extraction. J. Geochemical Explor. 56, 59-78 (1996).
- Grossman, R. B., Reinsch, T. G., Dane, J. H., Topp, G. C. Bulk density and linear extensibility. Methods of Soil Analysis. Part 4-Physical Methods. , 201-228 (2002).
- Reynolds, W. D., Elrick, D. E., Youngs, E. G., Amoozegar, A., Bootlink, H. W. G., Bouma, J., Dane, J. H., Topp, G. C. Saturated and field-saturated water flow parameters. Methods of Soil Analysis, Part 4-Physical Methods. , 802-816 (2002).
- King, G. M. Contributions of atmospheric CO and hydrogen uptake to microbial dynamics on recent Hawaiian volcanic deposits. Appl. Environ. Microbiol. 69 (7), 4067-4075 (2003).
- Meyer, W. S., Barrs, H. D. Roots in irrigated clay soils: Measurement techniques and responses to rootzone conditions. Irrig. Sci. 12 (3), 125-134 (1991).
- Graham, C. B., Woods, R. A., McDonnell, J. J. Hillslope threshold response to rainfall: (1) A field based forensic approach. J. Hydrol. 393 (1-2), 65-76 (2010).
- Anderson, A. E., Weiler, M., Alila, Y., Hudson, R. O. Dye staining and excavation of a lateral preferential flow network. Hydrol. Earth Syst. Sci. Discuss. 5 (2), 1043-1065 (2008).
- Gleeson, T., Paszkowski, D. Perceptions of scale in hydrology: what do you mean by regional scale?. Hydrol. Sci. J. 00, 1-9 (2013).
- Molins, S., Trebotich, D., Steefel, C. I., Shen, C. An investigation of the effect of pore scale flow on average geochemical reaction rates using direct numerical simulation. Water Resour. Res. 48, W03527 (2012).
- Fierer, N., Lennon, J. T. The generation and maintenance of diversity in microbial communities. Am. J. Bot. 98 (3), 439-448 (2011).
- Niu, G. Y., Pasetto, D., Scudeler, C., Paniconi, C., Putti, M., Troch, P. A. Analysis of an extreme rainfall-runoff event at the Landscape Evolution Observatory by means of a three-dimensional physically-based hydrologic model. Hydrol. Earth Syst. Sci. Discuss. 10, 12615-12641 (2013).
- Marteinsson, V., et al. Microbial colonization in diverse surface soil types in Surtsey and diversity analysis of its subsurface microbiota. Biogeosciences. 12, 1191-1203 (2015).
- Orcutt, B. N., Sylvan, J. B., Rogers, D. R., Delaney, J., Lee, R. W., Girguis, P. R. Carbon fixation by basalt-hosted microbial communities. Front. Microbiol. 6, 00904 (2015).
- Wu, L., Jacobson, A. D., Chen, H. C., Hausner, M. Characterization of elemental release during microbe-basalt interactions at T=28°C. Geochim. Cosmochim. Acta. 71, 2224-2239 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены