A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חפירה באדמה Lysimeter עבור ההידרולוגי מצמידים, גיאוכימיות, וחקירות מיקרוביולוגיות
In This Article
Summary
מחקר זה מציג שיטה החפירה לחקירת הידרולוגיים מתחת לפני הקרקע, גיאוכימיים, וההטרוגניות מיקרוביולוגיות של lysimeter אדמה. Lysimeter מדמה hillslope המלאכותי שהיה בתחילה בתנאי הומוגניות היה נתון כ -5,000 מ"מ של מים במשך שמונה מחזורים של השקיה ב תקופה של 18 חודשים.
Abstract
Studying co-evolution of hydrological and biogeochemical processes in the subsurface of natural landscapes can enhance the understanding of coupled Earth-system processes. Such knowledge is imperative in improving predictions of hydro-biogeochemical cycles, especially under climate change scenarios. We present an experimental method, designed to capture sub-surface heterogeneity of an initially homogeneous soil system. This method is based on destructive sampling of a soil lysimeter designed to simulate a small-scale hillslope. A weighing lysimeter of one cubic meter capacity was divided into sections (voxels) and was excavated layer-by-layer, with sub samples being collected from each voxel. The excavation procedure was aimed at detecting the incipient heterogeneity of the system by focusing on the spatial assessment of hydrological, geochemical, and microbiological properties of the soil. Representative results of a few physicochemical variables tested show the development of heterogeneity. Additional work to test interactions between hydrological, geochemical, and microbiological signatures is planned to interpret the observed patterns. Our study also demonstrates the possibility of carrying out similar excavations in order to observe and quantify different aspects of soil-development under varying environmental conditions and scale.
Introduction
דינמיקת קרקע ונוף מעוצבת על ידי האינטראקציה המורכבת של פיסיקלי, כימי ותהליכים ביולוגיים 1. זרימת מים, בלית גיאוכימיים, ופעילות ביולוגית לעצב את הפיתוח הכולל של הנוף לתוך המערכת אקולוגית יציבה 2,3. למרות שינויים פני שטח הם המאפיינים הבולטים ביותר של נוף 4, השפעות מצטברות הבנה, גיאוכימיים הידרולוגיים, ותהליכי מיקרוביולוגים באזור מתחת לפני הקרקע הוא קריטי להבנת הכוחות הבסיסיים המעצבים נוף 2. תרחישי הפרעות אקלימים עתידיים נוספים לבלבל יכולת ניבוי המסלול של התפתחות נוף 5. בכך הוא הופך לאתגר לקשר תהליכים בקנה מידה קטנה כדי הביטוי בקנה המידה הגדולה שלהם על נוף המידה 6. ניסויי מעבדה קצר טווח מסורתי או ניסויים באזורי טבע עם תנאי התחלה ידועים-משתנה זמן מכריחים להספיק בלכידת הההטרוגניות דואר פנימיות של אבולוצית נוף. כמו כן, בשל צימוד קוי חזק, קשה לחזות שינויי biogeochemical מדוגמנות הידרולוגית במערכות הטרוגניות 7. כאן אנו מתארים שיטה ניסיונית רומן לחפור בשליטה מלאה ומבוקרת hillslope אדמה עם תנאי התחלה ידועים. הליך החפירה ודגימה שלנו נועד ללכוד את ההטרוגניות בפיתוח של hillslope לאורכו ועומקו, במטרה לספק בסיס נתונים מקיפים לחקור אינטראקציות הדרו-ביו-גיאוכימיים והשפיעו על תהליכי היווצרות קרקע.
מערכות הידרולוגיות נמצאות בטבע רחוק מלהיות סטטי בזמן, עם שינויים בתגובות הידרולוגיות המתרחשות על פני טווח רחב של סולמות במרחב ובזמן 3. המבנה המרחבי של מסלולי זרימה לאורך נופים מקובע את הקצב, במידה והפצה של תגובות גיאוכימיים והתנחלות ביולוגית שמניעותבליה, התחבורה ממטרים של מומסים ומשקעים, לבין התפתחות נוספת של מבנה הקרקע. לפיכך, משלב ידע שמגיע פדולוגיה, גיאופיסיקה, ואקולוגיה לתוך תאוריות עיצובים ניסיוניים להעריך תהליכים הידרולוגיים ולשפר תחזיות הידרולוגיות הוצע 8,9. אבולוצית נוף מושפעת גם מתהליכי biogeochemical מתחת לפני קרקע בשילוב עם דינמיקת מים, גירת יסודות במהלך פיתוח קרקע, ועל ידי טרנספורמציות מינרלוגיות שחוללו תגובה של משטחים מינרליים עם אוויר, מים, ומיקרואורגניזמים 10. כתוצאה מכך, חשוב ללמוד פיתוח של נקודות חמות גיאוכימיים בתוך נוף מתפתח. בנוסף, חשוב להתייחס דפוסי בליה גיאוכימיים להליך הידרולוגי וחתימות מיקרוביולוגית במהלך היווצרות קרקע מתחלה כדי להבין את הדינמיקה של התפתחות נוף מורכבת. התהליכים הספציפיים של בראשית אדמה נשלטיםעל ידי השפעתו של אקלים בשילוב, תשומות ביולוגיות, הקלה וזמן על חומר הורה ספציפי. ניסוי זה נועד לטפל heterogeneities ב הבליה של חומר ההורה נשלטת על ידי וריאציות הידרולוגיות גיאוכימיים קשורות קל (כולל מדרון ועומק) ואת ההשתנות הקשורים בפעילות חיידקים כי הוא מונע על ידי מילויי סביבה (כלומר, חיזור פוטנציאל) בתנאים בם חומר, האקלים וזמן הורה נשארים קבועים. עם כל כבוד לפעילות חיידקים, מיקרואורגניזמים באדמה הם מרכיבים קריטיים ויש להם השפעה מכרעת על יציבות נוף 11. הם משחקים תפקיד מכריע מבנה קרקע, רכיבה על אופני biogeochemical של חומרים מזינים, גידול צמחים. לכן, יש צורך להבין את המשמעות של אורגניזמים אלה כנהגים של בליה, אדמה בראשית, ותהליכי היווצרות הנוף, תוך זיהוי בעת ובעונה אחת את השפעות הגומלין של נתיבי הזרימה הידרולוגיים ואנחנו גיאוכימייםathering על מבנה ומגוון קהילת חיידקים. זו יכולה להיות מושגת על ידי לימוד הטרוגניות מרחבית של גיוון קהילת חיידקים על פני נוף מתפתח שתכונותיהם הידרולוגיות גיאוכימיים נבדקים גם במקביל.
כאן, אנו מציגים הליך החפירה של lysimeter אדמה, בשם מבצעית miniLEO, שנועד לחקות מודלים אגן אפס מסדר בקנה מידה גדול של המצפה אבולוציה לנדשפט (LEO) שוכנו בבית ביוספרית 2 (אוניברסיטת אריזונה). MiniLEO פותח כדי לזהות דפוסי התפתחות נוף בקנה מידה קטנה כתוצאה מתהליכים הדרו-ביו-גיאוכימיים הטרוגנית מצטברים. זהו lysimeter 2-מ 'אורך, 0.5 מ' רוחב, ו 1-מ 'גובה, ושיפוע של 10 מעלות (איור 1). בנוסף, הקירות של lysimeter מבודדים ומצופים מתכלות שני חלקים פריימר אפוקסי מעיל urethane אליפטיות מולא המצרפי כדי למנוע זיהום פוטנציאלי או שטיפתמתכות ממסגרת lysimeter לתוך האדמה. Lysimeter התמלא רוק בזלת כתוש כי היה שחולצו מן פיקדון של טפרה הפלייסטוקן מאוחר הקשורים Merriam מכתש בצפון אריזונה. חומר הבזלת הטעון היה זהה החומר המשמש בניסויי LEO הרבה יותר הגדולים. רכב המינרלים, התפלגות גודל חלקיקים, והמאפיינים הידראוליים מתוארים על ידי Pangle et al. 12. פן החלחול במדרון דופנה מסך פלסטיק מחורר (נקבובי בקוטר 0.002 מ ', 14% נקבוביים). המערכת מצוידת בחיישנים כגון חיישנים תכולים מים וטמפרטורה, שני סוגים של חיישני פוטנציאל מים, סמפלרים אדמה-מים, איזון משקל הידראולי, בדיקות מוליכות חשמליות, ואת התמר לחץ כדי לקבוע את הגובה מפלס מי תהום. Lysimeter הושק במשך 18 חודשים טרם החפירה.
החפירה הייתה מוקפדת בגישתה מן המעלה הראשונה ונועדה לענות על שתי שאלות עיקריות: (1) מה הידרולוגי, גיאוכימיים, וחתימות חיידקים ניתן לראות על פני האורך והעומק של המדרון ביחס לתנאי גשמים מדומים (2) אם יחסים פידבקים בין תהליכים הדרו-ביו-גיאוכימיים המתרחשים על hillslope ניתן להסיק חתימות הפרט. במקביל להליך ההתקנה וחפירה הניסיוניות, אנו מציגים נתונים והצעות נציג כיצד ליישם פרוטוקולי חפירה דומים לחוקרים המעוניינים ללמוד יחד דינמיקת הארץ-מערכה ו / או תהליכי פיתוח קרקע.
Protocol
1. תכננו מטריקס דגימה כדי להבטיח שיטתית ומקיפה דגימה של Lysimeter
- מחלקים lysimeter לתוך ווקסלים של אורך, רוחב קבוע, ועומק.
- השתמש במרחב אוקלידי מערכת הקואורדינטות ולחלק את המרחק הכולל יחד לכל כיוון (X, Y ו- Z) לתוך מספר מספיק של מרווחים ברווחים שווים. שקל שלכת באדמה בסמוך לחומות של lysimeter כדי למנוע תופעות גבול.
הערה: הצפת 5 סנטימטר לאורך ארבעת הקירות תאומץ בניסוי זה כדי למנוע תופעות גבול, תוך הקפדה כי הנפח של אדמה שנאסף מספיקה. - הקצאת כל דגימה במיקום XYZ ייחודי לזהות בתור voxel.
הערה: בחפירה זו, X מציין את המיקום לרוחב המדרון, Y מציין מיקום לאורך המדרון, בעוד Z מציין מיקום לאורך העומק של המדרון. גודלו של מרווחי בתוך כל מימד קובע את רוחב, אורך, ועומק של ווקסלים. Figure 2 מראה את חלוקת lysimeter לאחר קביעת מרווחי המרווח יחד עם המקור שנבחר במערכת XYZ. החלוקה בתכנית החפירה הנוכחית יש 9 קבועים לאורך בשני הכיוונים Y ו- Z ו -4 במרווחים לאורך כיוון X, להפיק בסך הכול 324 ווקסלים של 10 ס"מ x 20 ס"מ x 10 ס"מ מידות (איור 3).
הערה: אסטרטגית הדגימה נבחרה מבטיחה כי המערכת כולה תדגם באופן שווה עם ניזק מינימאלי החיישנים. גבולות של כל voxel (1-2 סנטימטר) מבוטלים להגביל זיהום שהוגבה ווקסלים שכנים. בנוסף, מידות voxel להבטיח שחומר האדמה מספיק זמין עבור מיקרוביולוגית, גיאוכימיים, אוסף מדגם הידרולוגי בכל voxel.
- השתמש במרחב אוקלידי מערכת הקואורדינטות ולחלק את המרחק הכולל יחד לכל כיוון (X, Y ו- Z) לתוך מספר מספיק של מרווחים ברווחים שווים. שקל שלכת באדמה בסמוך לחומות של lysimeter כדי למנוע תופעות גבול.

איור 1. מבט צד של lysimeter. הבט lysimeter מן fa חלחוללִספִירַת הַנוֹצרִים. כמו כן גלוי הם שלושה אזורי חיישן (צינורות PVC לבנים) לאורך מערכת מדרון ממטרה בארבע הפינות.

איור 2. דגימה Scheme. ערכת דגימה של lysimeter יחד XYZ. הממד א X מחלק את רוחב לתוך 4 חלקים כל אחד 10 ס"מ ואילו Y מחלק את אורך לתוך 20 ס"מ. ממד .ב Z מציין עומק וחולקה 9 שכבות 10 ס"מ עומק. גבול של 5 ס"מ לאורך כל הקצוות של lysimeter זוהה כדי למנוע איסוף דגימות פוטנציאלי שיכול להציג השפעה של גבול. אנא לחץ כאן כדי להוריד את הקובץ.
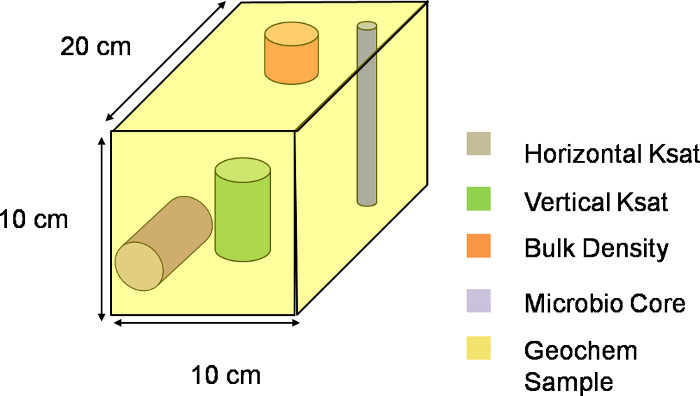
איור 3. שלוש-דייצוג imensional של voxel. סכמטי חזותית של voxel אחד במישור XYZ של lysimeter. המדרון כולו היה מחולק 324 ווקסלים כזה, עם כל voxel המתארת יחידת דגימה אחת. אנא לחץ כאן להורדת הקובץ הזה.
2. מוסיפים דיי FCF הכחול מבריק כדי מסלול מי הסתננות של המדרון
- החל צבע כחול מבריק על פני השטח של הקרקע, מספיק כדי לכסות 105 סנטימטרים גבי המשטח לאורך כיוון Y. מכסים את האדמה הנותרים עם יריעות פלסטיק.
- בחר ריכוז (כאן 10 גר '/ ל') כדי להבטיח בניגוד נגד אדמת בזלת שחורה. מוסיף את הצבע למכלי מערכת השקיה לדלל במים לריכוז הרצוי.
- החלט משך ההשקיה בהתאם לעומק הרצוי של החזית החדירה והשיעור המסופק על ידי מערכת ההשקיה.
הערה: לצורך המחקר הזה, אני שיעור rrigation של 30 מ"מ / שעה למשך 20 דקות (איור 4) לפני החפירה נחשב מספיק כדי לזהות דפוסים הטרוגנית של חדירת מים במהלך כמה סנטימטרים הראשון. - לאחר יישום צבע, לתת זמן החדיר להפסיק והמדינות הלחות בתוך lysimeter לאזן. לצורך המחקר, לתקופה של 10 שעות (לילה) בין יישום לצבוע וחפירה הייתה מתאימה.
שביתת 3. ווקסלים
- צרף סרט מדידה לאורך המדרון לספק מערכת התייחסות in-situ להדרכה במהלך התיחום של ווקסלים.
- סמן את הממד של כל voxel הקרקע בעזרת סרט המדידה. צייר קווי רשת עבור כל שכבה באמצעות מגיני שבשבת אלומיניום וסכינים מרק פלסטיק (איור 4). מחק את חומרי הגבול (5 ס"מ אחד הקיר כדי למנוע תופעות הגבול).
together.within-page = "1"> 
איור 4. למעלה לאור lysimeter. תצוגה זו מראה את משטח צבוע של שכבה 2 (10 ס"מ עומק). רשתות נמשכות על פני הקרקע כדי לסייע מדגמיות גם גלויות, יחד עם אזורי חורי ליבה בכל voxel לאחר איסוף דגימת מיקרוביולוגית.
4. אוסף דוגמאות למיקרוביולוגיה
- לאסוף דגימות מיקרוביולוגיה בסביבה נקייה מחיידקים מכל voxel לפני הידרולוגיים גיאוכימיים מנתחת כדי למנוע זיהום לחצות של דגימות. ודא כפפות חדשות נלבשות על ידי כל החברים בביצוע החפירה להפחתת זיהום מעוור אדם.
- השתמש corer אדמת בקוטר 1 ס"מ ו -20 ס"מ גובה, ו מרית דקה עבור אוסף מדגם מיקרוביולוגית. נקו את corer ואת מרית עם מים מזוקקים, לייבש בעזרת מגבונים נקיים, ולשטוף עם אתנול 75% באמצעות בקבוק תרסיס. אפשר corer ו מרית לייבוש באוויר.
- שימו לב גזמן ollection של כל דגימה. השתמש corer כדי ליבה לעומק של 10 ס"מ בכל מיקום של פיקסלים, ואת מרית לרוקן את דגימת קרקע לשקיות ניילון מראש מעוקרים (איור 5). תשמור על עצמך כדי לפתוח את התיק רק לפני הפקדת המדגם. Homogenize את שקיות מדגם ביד.
- אחסן את תיק הדוגמאות ב מצנן קרח במהלך הדגימה, ולהעביר בהקדם האפשרי אל מקפיא -80 מעלות צלזיוס.

איור 5. אוסף מדגם למיקרוביולוגיה. Corer כף יד קטנה של 20 ס"מ x 1 ס"מ, שקיות סטרילי, מרית מוצג כאן במהלך הדגימה מיקרוביולוגית. אנא לחץ כאן כדי להוריד את הקובץ.
אוסף דוגמאות גיאוכימיה הידרולוגיה 5.
- אזורים צבוע צילום ב X ו- Y plAnes במהלך החפירה לעומקים שבהם הצבע הוא ציין. השתמש בכרטיס צבע לספק התייחסות ונצפה הצבע (איור 6). ודא תאורה טבעית ראויה נוכח לתעד כראוי את עוצמת הצבע.
- כיול ספקטרומטר קרינת רנטגן נייד (pXRF) יומי לפני תחילת מדידות. לפרטים כיול ומדידה, ראה הוראות היצרן 13 (איור 7). בקצרה, למקם את המכשיר על בעל וכוון את חלון קרן ישירות חרוז מתכת במפעל. בחר "קאל" ולחכות 30 שניות כדי לאפשר כיול להסתיים.
- נקה את חלון הקרן לפני נטילת כל מדידה. מדוד את השטח של כל voxel בשלושה עותקים בשלושה מוקדים שונים. מניחים את המכשיר pXRF על פני הקרקע ולחכות 90 שניות על מנת לאפשר מדידה להסתיים.
הערה: רנטגן יכול לחדור דרך למרחקים ארוכים לכיוון הקורה. לכן, ensuמחדש שרק אדם מיומן מטפל ציוד ושומר פרוטוקולי בטיחות נאותים.
- נקה את חלון הקרן לפני נטילת כל מדידה. מדוד את השטח של כל voxel בשלושה עותקים בשלושה מוקדים שונים. מניחים את המכשיר pXRF על פני הקרקע ולחכות 90 שניות על מנת לאפשר מדידה להסתיים.

איור 6. כרטיס הצבע לעקוב לצבוע הסתננות. מיקום כל עם חדירה לצבוע גלוי הצטלם עם כרטיס צבע המשרת כנקודת התייחסות. אנא לחץ כאן כדי להוריד את הקובץ.

איור 7. הקרינה ספקטרומטר קרני רנטגן נייד. מחשבי כף-יד pXRF ממוקם על פני השטח של voxel. מדידות נרשמו בשלושה מוקדים שונים על פני השטח של כל voxel ואז בממוצע.
- ליבות מתכתי נקי (height = 3 ס"מ, קוטר. = 5.7 ס"מ) ושיתוף פוליקרבונטמיל (height = 6 ס"מ, קוטר. = 5.7 ס"מ) עבור צפיפות בצובר (BD) ומדידות מוליכות הידראולית (Ksat) של ווקסלים הרצוי, בהתאמה (איור 8).
- אנכי להכניס ליבות מתכת ליבות פוליקרבונט (אנכי Ksat) לתוך ווקסלים רצוי נזהר שלא לפגוע חיישנים או חוטי חיישן. האם זה על ידי פטישי הליבות בעדינות לתוך האדמה, מקפידים להשתמש משטח שטוח כמו בול העץ בין הליבה לבין הפטיש כדי למזער הפרעה אל האדמה. בנוסף, פעם הליבה היא באמצע הדרך לתוך האדמה, למקם גרעין שני על גבי הגרעין הראשון. מניחים את גוש העץ על גבי הליבה השנייה בעדינות בפטיש הבלוק עד הגרעין הראשון מוטבע בקרקע עם שפת הליבה עדיין גלוי.
- הכנס ליבות עבור Ksat האופקי בתור פן לרוחב של voxel נפתחו עם חפירה רציפה. השתמש בגוש עץ הליבה שנייה כאמור בשלב 5.4 למזער דחיסה.
- תשמור על מנת להבטיח כי voxelלהיות שנדגמו מבודד גבולות ווקסלים שכנים לפני איסוף דגימת גיאוכימיים. משתמשים בסכינים מרק פלסטיק למטרה זו, ואחריו כפות סיידים כף יד כדי לאסוף דגימות קרקע סביב ליבות מתכת או פוליפרופילן לתוך גיאוכימיים שכותרתו (GC) שקיות דגימה עד ליבות ניתן להסיר בקלות (למשל, 9 א איור, ב).

צפיפות איור 8. גורפת וליבות מוליכות הידראולית. ליבות פוליפרופילן (משמאל) שימשו לאיסוף דגימות מוליכות הידראולית אנכיים ואופקיים בעוד ליבות מתכת (מימין) שימשו לאיסוף דגימות צפיפות בצובר.

איור 9. Voxel תיחום. סכינים מרק פלסטיק שימשו (א) לבודדגבולות voxel לפני (B) גיאוכימיים, צפיפות בצובר, ואיסוף הליבה מוליכות הידראולית. אנא לחץ כאן כדי להוריד את הקובץ.
- הסר את הליבה המתכתית, סרוב חומר עודף משני קצותיו, ולהעביר מדגם מהליכת שקית מדגם BD שכותרתו. לשקול כל שקית מדגם עם מדגם ולהקליט את המשקל הכולל.
- הסר את ליבות פוליפרופילן. מכסים משני הצדדים עם כובעי פלסטיק אדומים תווית ליבת פוליפרופילן אנכית כמו "V" ליבת פוליפרופילן אופקית כמו "H" ואחריו זיהה המדגם.
- אסוף החומר הנותר מן voxel לשקית מדגם GC, והותיר אחריו כמה סנטימטרים של אדמה בכל ארבעת הצדדים כדי למנוע זיהום צולב עם voxel הבא.
- חזור מ צעדים 5.1 כדי 5.9 עבור שאר ווקסלים בשכבה אחת.
- לאחר כל ווקסלים משכבה אחת כברהושלם, חזור על שלבי 3.2-5.10 עבור השכבה הבאה.
הערה: שלב 5.1 צריכה להתבצע רק עבור ווקסלים שיש לצבוע גלוי. עיין איור 10 כדי להמחיש דיאגרמת נציג של voxel הדגשת כל הדגימות שנאספו מכל voxel.

איור 10. נציגי voxel. האדום קו מקווקו מציין אסף ליבה למדגם מיקרוביולוגיה, הירוק קו מקווקו מציין ליבת מוליכות הידראולית אופקית, קו המקף הצהוב מציין ליבת מוליכות הידראולית אנכית, המקווקו הסגול מציין ליבת צפיפות בצובר, לבין גבול הכחול הסגלגל מציין הנותרים מדגם מן voxel בשימוש לניתוח גיאוכימיים. אנא לחץ כאן כדי להוריד את הקובץ.
ניתוח מדגם 6.
- דגימות השתמשו שנאספו עבור מיקרוביולוגית ניתוחיות (מיצוי DNA אדמת חיידקים) מולקולרי 14 ותרבותית (ספירת צלחת heterotrophic) 15 ניתוחים. השתמש DNA חילוץ לתגובות שרשרת פולימראז כמותיים (qPCR) 16, וניסויי רצף גן תפוקה גבוהה 17,18.
- השתמש בדגימות שנאספו עבור גיאוכימיים המנתח למדוד שפע של תכונות גיאוכימיים כולל pH (שיטת ארה"ב EPA 150.2), מוליכות חשמלית (EC) (שיטת EPA בארה"ב 120.1), פחמן תוכן חנקן (שיטת EPA בארה"ב 415.3, מיצוי רציף של אלמנטים 19, ו קרני ה- X עקיפה (XRD) ומבנה משובחים הקליטה רנטגן המורחבת (EXAFS) ספקטרוסקופיה לפי מפרטים של Synchrotron סטנפורד קרינה מעבדה, לחקור טרנספורמציות מינרליים.
- השתמש דגימות ליבה שנאספו עבור ניתוחים הידרולוגיים עבור ניסויי מעבדה כגון צפיפות בצובר 20הידראולי מוליך 21.
תוצאות
ממדי ווקסלים הבטיחו איסוף דגימות עבור הידרולוגיים, גיאוכימיים, ומדידות מיקרוביולוגית. הליך החפירה הניב 324 ליבות לניתוח מיקרוביולוגיות, 972 נקודות נתוני pXRF, 324 שקיות מדגם גיאוכימיים, 180 דגימות Ksat (128 אנכים ו -52 אופקים), ו 311 דגימות צפיפות בצובר. זרימת מועד...
Discussion
אבולוצית נוף היא ההשפעה המצטברת של, גיאוכימיים הידרולוגיים, ותהליכים ביולוגיים 12. תהליכים אלה בקרת זרימה והובלה של מים ואלמנטים, ותגובות biogeochemical ב המתפתחת נופים. עם זאת, ללכוד את האינטראקציות זמנית דורש תכנון ניסוי מתואם באופן מדויק ודגימה. בנוסף, אבולוציית נו?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Ty P.A. Ferré, Till Volkman, Edwin Donker, Mauricio Vera for helping us during the excavation, and Triffon J. Tatarin, Manpreet Sahnan and Edward Hunt for their help in sample analysis. This work was carried out at Biosphere 2, University of Arizona and funded by National Science Foundation grant EAR_1344552 and Honors Research Program of Biosphere 2.
Materials
| Name | Company | Catalog Number | Comments |
| Measuring tape | Any | Any | Preventing cross-contamination of samples is crucial. Therefore, it is helpful to have multiple putty knives to isolate voxel boundary. |
| Brilliant Blue dye | Waldeck GmBH &Co | B0770 | Rulers can be used to draw grids. The sampling strategy can be modified based on individual experiments. |
| Soil Corer | AMS | 56975 | Any commercially manufactured Brilliant Blue dye can be used. |
| 75% Ethanol | Any | Any | A Nikon D90 camera and 50 mm lens were used for photography. Any high resolution camera and lens can be used for this purpose. |
| Spray Bottle | Any | Any | Use of dye and color card is subjective to individual experiments and/or research questions. |
| Spatula | Any | Any | Gardening gloves may be used if handling of corer becomes tedious. |
| Gloves | Any | Any | Ensure microbiology samples are kept in ice during sampling and frozen as soon as possible. |
| KimWipes | KimTech Science | Any | Water can be used to wash soil corer, prior to sanitizing with ethanol. |
| Sterile Sample bags | Fisher Scientific | Whirl-Pak 4 OZ. 24 OZ | Keep buckets and dustpans handy to facilitate removal of waste soil. |
| Color Card | Any | Any | The original design of miniLEO has various sensors embedded in the lysimeter. Such sensors may or may not be necessary based on the scope of individual experimental design. |
| X-ray Fluoresce Spectrophotmeter | XRF, OLYMPUS | DS-2000 Delta XRF | |
| Polypropylene cores | Any | Any | |
| Metal cores | Any | Any | |
| Caps for polypropylene cores | Any | Any | |
| Hammer | Any | Any | |
| Plastic putty knives | Any | Any | |
| Face masks | Any | Any |
References
- Brady, N. C., Weil, R. R. . The nature and properties of soils. , (2008).
- Chorover, J., Kretzschmar, R., Garica-Pichel, F., Sparks, D. L. Soil biogeochemicial processes within the critical zone. Elements. 3, 321-326 (2007).
- Troch, P. A., et al. Catchment coevolution: A useful framework for improving predictions of hydrological change?. Water Resour. Res. 6, 1-20 (2015).
- Sharp, R. P. Landscape evolution (A Review). Proc. Natl. Acad. Sci. U. S. A. 79, 4477-4486 (1982).
- Temme, A., Montgomery, D. R., Bierman, P. R. Predicting the effect of changing climate on landscapes with computer based landscape evolution models. Key Concepts in Geomorphology. , (2013).
- Troch, P. A., et al. Dealing with Landscape Heterogeneity in Watershed Hydrology: A Review of Recent Progress toward New Hydrological Theory. Geogr. Compass. 3, 375-392 (2009).
- Wang, Y., et al. Dissecting the Hydrobiogeochemical Box. in Am. Geophys. Union Fall Meet. , (2015).
- Lin, H., et al. Hydropedology: Synergistic integration of pedology and hydrology. Water Resour. Res. 42 (5), W05301 (2006).
- Band, L. E., et al. Ecohydrological flow networks in the subsurface. Ecohydrology. 7, 1073-1078 (2014).
- Churchman, G. j., Lowe, D. . Handbook of Soil Science Properties and Process. 1, (2012).
- van der Heijden, M. G. A., Bardgett, R. D., van Straalen, N. M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecol. Lett. 11 (3), 296-310 (2008).
- Pangle, L. a., et al. The Landscape Evolution Observatory: A large-scale controllable infrastructure to study coupled Earth-surface processes. Geomorphology. 244, 190-203 (2015).
- . . User Manual: Delta Famiy Handheld XRF Analyzers. , (2013).
- Valentìn-Vargas, A., Root, R. A., Neilson, J. W., Chorover, J., Maier, R. M. Environmental factors influencing the structural dynamics of soil microbial communities during assisted phytostabilization of acid-generating mine tailings: A mesocosm experiment. Sci Total Environ. 500-501, 314-324 (2014).
- JoVE Science Education Database. . Essentials of Environmental Microbiology. Culturing and Enumerating Bacteria from Soil Samples. , (2016).
- JoVE Science Education Database. . Essentials of Environmental Microbiology: Quantifying Environmental Microorganisms and Viruses Using qPCR. , (2016).
- Sengupta, A., Dick, W. A. Bacterial community diversity in soil under two tillage practices as determined by pyrosequencing. Microb. Ecol. 70, 853-859 (2015).
- Caporaso, J. G., et al. Correspondence - QIIME allows analysis of high- throughput community sequencing data. Nat. Publ. Gr. 7, 335-336 (2010).
- Hall, G. E. M., Vaive, J. E., Beer, R., Hoashi, M. Selective leaches revisited, with emphasis on the amorphous Fe oxyhydroxide phase extraction. J. Geochemical Explor. 56, 59-78 (1996).
- Grossman, R. B., Reinsch, T. G., Dane, J. H., Topp, G. C. Bulk density and linear extensibility. Methods of Soil Analysis. Part 4-Physical Methods. , 201-228 (2002).
- Reynolds, W. D., Elrick, D. E., Youngs, E. G., Amoozegar, A., Bootlink, H. W. G., Bouma, J., Dane, J. H., Topp, G. C. Saturated and field-saturated water flow parameters. Methods of Soil Analysis, Part 4-Physical Methods. , 802-816 (2002).
- King, G. M. Contributions of atmospheric CO and hydrogen uptake to microbial dynamics on recent Hawaiian volcanic deposits. Appl. Environ. Microbiol. 69 (7), 4067-4075 (2003).
- Meyer, W. S., Barrs, H. D. Roots in irrigated clay soils: Measurement techniques and responses to rootzone conditions. Irrig. Sci. 12 (3), 125-134 (1991).
- Graham, C. B., Woods, R. A., McDonnell, J. J. Hillslope threshold response to rainfall: (1) A field based forensic approach. J. Hydrol. 393 (1-2), 65-76 (2010).
- Anderson, A. E., Weiler, M., Alila, Y., Hudson, R. O. Dye staining and excavation of a lateral preferential flow network. Hydrol. Earth Syst. Sci. Discuss. 5 (2), 1043-1065 (2008).
- Gleeson, T., Paszkowski, D. Perceptions of scale in hydrology: what do you mean by regional scale?. Hydrol. Sci. J. 00, 1-9 (2013).
- Molins, S., Trebotich, D., Steefel, C. I., Shen, C. An investigation of the effect of pore scale flow on average geochemical reaction rates using direct numerical simulation. Water Resour. Res. 48, W03527 (2012).
- Fierer, N., Lennon, J. T. The generation and maintenance of diversity in microbial communities. Am. J. Bot. 98 (3), 439-448 (2011).
- Niu, G. Y., Pasetto, D., Scudeler, C., Paniconi, C., Putti, M., Troch, P. A. Analysis of an extreme rainfall-runoff event at the Landscape Evolution Observatory by means of a three-dimensional physically-based hydrologic model. Hydrol. Earth Syst. Sci. Discuss. 10, 12615-12641 (2013).
- Marteinsson, V., et al. Microbial colonization in diverse surface soil types in Surtsey and diversity analysis of its subsurface microbiota. Biogeosciences. 12, 1191-1203 (2015).
- Orcutt, B. N., Sylvan, J. B., Rogers, D. R., Delaney, J., Lee, R. W., Girguis, P. R. Carbon fixation by basalt-hosted microbial communities. Front. Microbiol. 6, 00904 (2015).
- Wu, L., Jacobson, A. D., Chen, H. C., Hausner, M. Characterization of elemental release during microbe-basalt interactions at T=28°C. Geochim. Cosmochim. Acta. 71, 2224-2239 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved