É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Monólito escavação para Coupled Hidrológicos, geoquímicos e microbiológicos Investigações
Neste Artigo
Resumo
Este estudo apresenta um método de escavação para investigar hidrológico subsuperfície, geoquímicos e heterogeneidade microbiológica de um lisímetro de solo. O lisímetro simula um hillslope artificial que foi inicialmente sob condição homogênea e tinha sido submetido a aproximadamente 5.000 mm de água ao longo de oito ciclos de irrigação em um período de 18 meses.
Resumo
Studying co-evolution of hydrological and biogeochemical processes in the subsurface of natural landscapes can enhance the understanding of coupled Earth-system processes. Such knowledge is imperative in improving predictions of hydro-biogeochemical cycles, especially under climate change scenarios. We present an experimental method, designed to capture sub-surface heterogeneity of an initially homogeneous soil system. This method is based on destructive sampling of a soil lysimeter designed to simulate a small-scale hillslope. A weighing lysimeter of one cubic meter capacity was divided into sections (voxels) and was excavated layer-by-layer, with sub samples being collected from each voxel. The excavation procedure was aimed at detecting the incipient heterogeneity of the system by focusing on the spatial assessment of hydrological, geochemical, and microbiological properties of the soil. Representative results of a few physicochemical variables tested show the development of heterogeneity. Additional work to test interactions between hydrological, geochemical, and microbiological signatures is planned to interpret the observed patterns. Our study also demonstrates the possibility of carrying out similar excavations in order to observe and quantify different aspects of soil-development under varying environmental conditions and scale.
Introdução
Solo e da paisagem dinâmicas são moldadas pela interação complexa de física, química e processos biológicos 1. Fluxo de água, erosão geoquímica, e atividade biológica moldar o desenvolvimento global da paisagem em um ecossistema estável 2,3. Embora as mudanças de superfície são as características mais visíveis da paisagem 4, efeitos cumulativos compreensão de hidrológico, geoquímicos e microbiológicos na região do subsolo é crucial para entender as forças subjacentes que moldam a paisagem 2. Cenários futuros de perturbação climática confundir ainda mais a previsibilidade e padrão de evolução da paisagem 5. Torna-se, assim, um desafio para ligar os processos de pequena escala a sua manifestação em grande escala sobre a paisagem escala 6. experimentos de laboratório de curto prazo tradicionais ou experimentos em paisagens naturais com condições iniciais desconhecidas e tempo variável forçando queda curta em capturar the heterogeneidade intrínseca da evolução da paisagem. Além disso, devido ao acoplamento não linear forte, é difícil prever mudanças biogeoquímicos de modelagem hidrológica em sistemas heterogêneos 7. Aqui, descrevemos um método experimental romance para escavar uma hillslope solo totalmente controlado e monitorado com condições iniciais conhecidos. Nosso procedimento de escavação e amostragem é destinado a capturar a heterogeneidade desenvolvimento do hillslope ao longo do seu comprimento e profundidade, com o objetivo de fornecer um conjunto de dados abrangente para investigar as interações hidro-bio-geoquímicos e seu impacto sobre os processos de formação do solo.
Sistemas hidrológicos encontrados na natureza estão longe de ser estática no tempo, com mudanças nas respostas hidrológicas que ocorrem em uma ampla gama de escalas espaciais e temporais 3. A estrutura espacial das vias de escoamento ao longo paisagens determina a taxa, a extensão e distribuição de reacções geoquímicas e colonização biológica que impulsionamintempéries, o transporte ea precipitação de solutos e sedimentos, e no desenvolvimento da estrutura do solo. Assim, incorporando o conhecimento de pedologia, geofísica, e ecologia em teorias e modelos experimentais para avaliar processos hidrológicos e melhorar as previsões hidrológicas foi sugerido 8,9. Evolução da paisagem também é afetado por processos biogeoquímicos subsuperficiais em conjunto com a dinâmica da água, migração elemental durante o desenvolvimento do solo, e por transformações mineralógicas trazidas pela reacção de superfícies minerais com ar, água e microorganismos 10. Consequentemente, é importante para estudar o desenvolvimento de hotspots geoquímicos dentro de um cenário em evolução. Além disso, é fundamental para relacionar os padrões de intemperismo geoquímicos para processos hidrológicos e assinaturas microbiológicos durante a formação incipiente do solo a fim de compreender a dinâmica do desenvolvimento paisagem complexa. Os processos específicos de gênese dos solos são regidospela influência combinada de clima, insumos biológicos, alívio e tempo em um material de origem específica. Este experimento foi projetado para resolver heterogeneidades no desgaste de material mãe regida por variações hidrológicas e geoquímicas associadas com alívio (incluindo inclinação e profundidade) e a variabilidade associada na atividade microbiana que é conduzido por gradientes ambientais (isto é, em potencial redox) sob condições em que material de origem, clima e tempo são mantidos constantes. Com relação à atividade microbiana, microrganismos do solo são componentes críticos e têm um profundo impacto sobre a estabilidade paisagem 11. Eles desempenham um papel crucial na estrutura do solo, ciclo biogeoquímico de nutrientes e crescimento da planta. Portanto, é necessário compreender a importância desses organismos como condutores de intempérie, gênese do solo e processos de formação de paisagem, enquanto identifica simultaneamente os efeitos recíprocos de percursos de escoamento hidrológicos e nós geoquímicaathering na estrutura da comunidade microbiana e diversidade. Isto pode ser conseguido através do estudo de heterogeneidade espacial da diversidade da comunidade microbiana sobre uma paisagem em evolução cuja hidrológico e características geoquímicas também estão sendo estudadas em paralelo.
Aqui, apresentamos um procedimento de escavação de um lisímetro de solo, operacionalmente chamado miniLEO, projetado para imitar os de grande escala modelos de bacias de ordem zero da evolução Observatório Paisagem (LEO) alojado na Biosfera 2 (University of Arizona). O miniLEO foi desenvolvido para identificar pequena escala padrões de evolução da paisagem decorrentes de processos hidro-bio-geoquímicos heterogêneos cumulativos. É lisímero 2-m de comprimento, 0,5 m de largura, e 1-m de altura e inclinação de 10 ° (Figura 1). Além disso, as paredes do lisímetro são isolados e revestido com não-biodegradável primer epóxi de duas partes e um casaco de uretano alifático agregado preenchido para evitar a contaminação ou potencial de lixiviaçãode metais do quadro lisímero no solo. O lisímetro foi preenchido com rocha de basalto moído que foi extraído a partir de um depósito de tephra Pleistoceno final associado com Merriam cratera no norte do Arizona. O material de basalto carregado era idêntico ao material utilizado nas experiências LEO muito maiores. A composição mineral, a distribuição do tamanho de partícula, e as propriedades hidráulicas são descritos por Pangle et ai. 12. O rosto infiltração downslope foi revestido com uma tela perfurada de plástico (poros 0,002-m de diâmetro, 14% de porosidade). O sistema está equipado com sensores, tais como conteúdo de água e temperatura sensores, dois tipos de sensores de potencial de água, amostradores de água no solo, equilíbrio de peso hidráulica, sondas de condutividade elétrica, e transdutores de pressão para determinar a altura da tabela de água. O lisímetro foi irrigada por 18 meses antes da escavação.
A escavação foi meticuloso na sua abordagem e foi elaborado para responder a duas grandes questões: (1) o que hidrológico, geoquímicos e assinaturas microbianos podem ser observadas em todo o comprimento ea profundidade da inclinação em relação às condições e chuva simulada (2) se os relacionamentos e feedbacks entre os processos hidro-bio-geoquímicos que ocorrem na hillslope pode ser deduzida as assinaturas individuais. Juntamente com a configuração experimental e procedimento de escavação, apresentamos dados representativos e sugestões sobre como aplicar protocolos de escavação semelhantes para os pesquisadores interessados em estudar a dinâmica do sistema da Terra acoplados e / ou processos de desenvolvimento do solo.
Protocolo
1. Elaborar uma matriz de amostragem para garantir sistemática e abrangente Amostragem de Lysimeter
- Divida lisímetro em voxels de comprimento, largura e profundidade fixa.
- Usar um espaço euclidiano sistema de coordenadas e dividir a distância total ao longo de cada direcção (X, Y e Z) em um número suficiente de intervalos igualmente espaçados. Considere descartar o solo perto das paredes do lisímetro para evitar os efeitos de fronteira.
NOTA: Um buffer de 5 cm ao longo das quatro paredes é adotado neste experimento para evitar os efeitos de fronteira, garantindo ao mesmo tempo que o volume de solo recolhida é suficiente. - Atribuir cada amostra de uma localização única XYZ e identificar como um voxel.
NOTA: Nesta escavação, X denota a localização ao longo da largura do declive, Y indica a localização ao longo do comprimento da inclinação, enquanto que Z indica a localização ao longo da profundidade do declive. O tamanho dos intervalos dentro de cada dimensão determina a largura, o comprimento e a profundidade dos voxeis. Figura 2 mostra a divisão do lisímero após a determinação dos intervalos de espaçamento, juntamente com a origem escolhida para o sistema XYZ. A divisão no esquema escavação corrente tem 9 intervalos ao longo de ambas as direcções Y e Z e os 4 intervalos ao longo da direcção X, produzindo um total de 324 voxels de 10 cm x 20 cm x 10 cm dimensões (Figura 3).
NOTA: A estratégia de amostragem escolhido garante que todo o sistema está uniformemente amostrados com danos mínimos para os sensores. Limites de cada voxel (1-2 cm) são descartadas para limitar a contaminação cruzada de voxels vizinhos. Além disso, as dimensões do voxel garantir que material suficiente do solo está disponível para microbiológica, geoquímicos e coleta de amostras hidrológico em cada voxel.
- Usar um espaço euclidiano sistema de coordenadas e dividir a distância total ao longo de cada direcção (X, Y e Z) em um número suficiente de intervalos igualmente espaçados. Considere descartar o solo perto das paredes do lisímetro para evitar os efeitos de fronteira.

Figura 1. Lado-vista do lisímetro. Vista do lisímetro do fa infiltraçãoce. Também são visíveis três regiões do sensor (tubos de PVC branco) ao longo do sistema de inclinação e extinção de incêndios nos quatro cantos.

Figura 2. A amostragem esquema. Esquema de amostragem de lisímetro junto XYZ. A. A dimensão X divide a largura em 4 seções cada um de 10 cm, enquanto Y divide o comprimento para 20 cm. Dimensão B. O Z indica profundidade e foi dividido em 9 camadas de 10 cm de profundidade. Um limite de 5 cm ao longo das bordas do lisímetro foi identificado para evitar a recolha de amostras que podem potencialmente apresentam efeito limite. Por favor clique aqui para baixar esse arquivo.
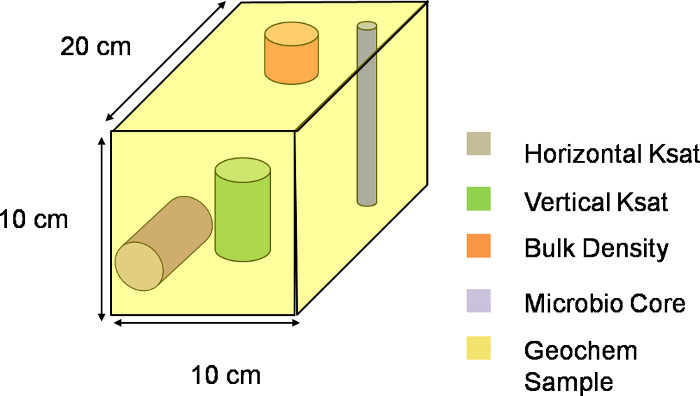
Figura 3. Três-drepresentação imensional de um voxel. esquema visual de um voxel ao longo do plano XYZ do lisímetro. Toda a encosta foi dividido em 324 tais voxels, com cada voxel que descreve uma única unidade de amostragem. Por favor clique aqui para baixar esse arquivo.
2. Adicione Brilliant Blue FCF Dye a pista de água de infiltração na Slope
- Aplicar o corante azul brilhante na superfície do solo, o suficiente para a tampa superior 105 cm de superfície ao longo da direcção de Y. Cobrir o solo restante com folhas de plástico.
- Escolha uma concentração (aqui 10 g / L) para garantir contraste contra o solo de basalto negro. Adicionar o corante para tanques de sistema de irrigação e dilui-se com água até à concentração desejada.
- Decidir a duração da irrigação com base na profundidade desejada de a frente de infiltração e a taxa fornecido pelo sistema de irrigação.
NOTA: Para este estudo, um irrigation taxa de 30 mm / h durante 20 minutos (Figura 4) antes da escavação é considerada suficiente, a fim de identificar padrões heterogéneas de infiltração de água durante os primeiros poucos centímetros. - Após a aplicação do corante, dar tempo para a infiltração de parar e os estados de humidade no interior do lisímetro para equilibrar. Para este estudo, um período de 10 horas (durante a noite) entre a aplicação do corante e escavação era adequada.
3. Delimitação das Voxels
- Anexar fita de medição ao longo do comprimento da pista para proporcionar um sistema de referência in situ para orientação durante demarcação de voxels.
- Marque a dimensão de cada voxel do solo com a ajuda da fita métrica. Desenhar linhas de grade para cada camada usando escudos de alumínio de lâminas e facas de plástico massa de vidraceiro (Figura 4). Elimine os materiais de contorno (5 cm de cada parede, para evitar os efeitos de limite).

Figura 4. Vista de cima de lisímetro. Esta visão mostra a superfície tingido de camada 2 (10 cm de profundidade). Grids desenhadas na superfície do solo para auxiliar de amostragem são também visíveis, junto com regiões furos centrais em cada voxel após a coleta de amostras microbiológicas.
4. Coleta de Amostras Microbiologia
- Coletar amostras de microbiologia assepticamente a partir de cada voxel antes hidrológico e análises geoquímicas para evitar a contaminação cruzada de amostras. Certifique-se de que as novas luvas são usados por todos os membros que efectuam a escavação para reduzir a contaminação da pele humana.
- Use um corer do solo de 1 cm de diâmetro e 20 cm de altura, e uma espátula fina para coleta de amostras microbiológicas. Limpe a corer ea espátula com água destilada, seque com toalhetes de limpeza e enxágüe com 75% de etanol usando um borrifador. Permitir corer e espátula para secar ao ar.
- Note-se a collection tempo de cada amostra. Utilizar a sonda para o núcleo a uma profundidade de 10 cm em cada local do voxel, e a espátula para esvaziar a amostra de solo em sacos de plástico pré-esterilizados (Figura 5). Cuidar para abrir o saco imediatamente antes de depositar a amostra. Homogeneizar as bolsas de amostra à mão.
- Armazenar a bolsa de amostra num refrigerador de gelo durante a amostragem, e transferir o mais rapidamente possível a -80 ° C congelador.

Figura 5. coleta de amostras Microbiology. Uma pequena sonda portátil de 20 cm x 1 cm, sacos estéreis, e uma espátula é mostrado aqui durante a amostragem microbiológica. Por favor clique aqui para baixar esse arquivo.
5. Geochemistry e Hidrologia de Coleta de Amostras
- regiões fotografia tingido em X e Y planes durante escavações para profundidades onde o corante é observado. Utilizar um cartão de cor para fornecer uma referência para a cor observada (Figura 6). Garantir iluminação natural adequada está presente para documentar corretamente a intensidade da cor.
- Calibre portátil de raios-x espectrômetro de fluorescência (pXRF) diariamente antes de iniciar as medições. Para obter detalhes de calibração e medição, consulte as instruções do fabricante 13 (Figura 7). Resumidamente, coloque o instrumento no suporte e apontar a janela do feixe diretamente para o cordão fábrica de metal. Selecione 'Cal' e aguarde 30 segundos para permitir que a calibração seja concluída.
- Limpar a janela do feixe antes de tomar qualquer medida. Medir a superfície de cada voxel, em triplicado, em três locais diferentes. Colocar o aparelho pXRF na superfície do solo e esperar durante 90 s para permitir que a medição seja completado.
NOTA: Raio-X podem penetrar através de uma grande distância, na direcção do feixe. Portanto, ensure que apenas pessoal treinado lida com o equipamento e mantém protocolos de segurança apropriados.
- Limpar a janela do feixe antes de tomar qualquer medida. Medir a superfície de cada voxel, em triplicado, em três locais diferentes. Colocar o aparelho pXRF na superfície do solo e esperar durante 90 s para permitir que a medição seja completado.

Figura 6. cartão de cores para seguir tingir infiltração. Cada local com penetração do corante visível foi fotografada com um cartão de cor servindo como referência. Por favor clique aqui para baixar esse arquivo.

Figura 7. portátil fluorescência de raios X Espectrômetro. Handheld pXRF posicionado na superfície de um voxel. As medições foram registadas em três locais diferentes sobre a superfície de cada voxel e, em seguida, em média.
- núcleos limpo metálicos (altura = 3 cm, diâmetro. = 5,7 cm) e co policarbonatores (altura = 6 cm, diâmetro. = 5,7 cm) para densidades (BD) e medidas de condutividade hidráulica (Ksat) de voxels desejados, respectivamente (Figura 8).
- Verticalmente inserir núcleos de metal e núcleos de policarbonato (verticais Ksat) em voxels desejados tomando cuidado para não danificar os sensores ou fios do sensor. Para fazer isso, os núcleos martelar suavemente para o solo, tendo o cuidado de usar uma superfície plana como bloco de madeira entre o núcleo e o martelo, a fim de minimizar perturbações no solo. Além disso, uma vez que o núcleo está a meio caminho para o solo, colocar um segundo núcleo no topo do primeiro núcleo. Colocar o bloco de madeira na parte superior do segundo núcleo e suavemente martelar o bloco até que o primeiro núcleo é incorporado no solo, com o aro do núcleo ainda visível.
- Insira núcleos para Ksat horizontal como a face lateral do voxel abre-se com a escavação sequencial. Use o bloco de madeira e segundo núcleo, como mencionado no passo 5,4 para minimizar a compactação.
- Tome cuidado para garantir que o voxelsendo amostrado é isolado de fronteiras e voxels vizinhos antes da coleta de amostras geoquímicas. Use espátulas de plástico para esta finalidade, seguido de espátulas de mão para coletar amostras de solo em torno de núcleos de metal ou de polipropileno em geoquímicos rotulados sacos (GC) de amostra até núcleos podem ser facilmente removidos (por exemplo, a Figura 9a, b).

Figura 8. densidade a granel e núcleos de condutividade hidráulica. Núcleos de polipropileno (esquerda) foram utilizados para a recolha de amostras de condutividade hidráulica vertical e horizontal, enquanto núcleos de metal (à direita) foram utilizados para a recolha de amostras de densidade.

Figura 9. Voxel demarcação. Espátulas plásticas foram usadas para (A) isolarlimites voxel anteriores (B) geoquímica, densidade e coleta de núcleo condutividade hidráulica. Por favor clique aqui para baixar esse arquivo.
- Retirar o núcleo metálico, escovar o excesso do material de ambas as extremidades, e transferir a amostra de núcleo a um saco de recolha BD marcada. Pesar cada saco de amostra com a amostra e registrar o peso total.
- Remover os núcleos de polipropileno. Cobrir ambos os lados com tampas de plástico vermelho e rotular núcleo de polipropileno vertical, como "V" e núcleo de polipropileno horizontal como "H" seguido do ID da amostra.
- Recolher o material restante a partir do voxel dentro do saco de amostra de CG, deixando para trás um par de centímetros do solo em todos os quatro lados para evitar a contaminação cruzada com o próximo do voxel.
- Repetir passos de 5,1-5,9 para o resto dos voxeis em uma camada.
- Uma vez que todos os voxels de uma camada ter sidoconcluída, repita os passos 3,2-5,10 para a camada posterior.
NOTA: Passo 5.1 tem de ser realizada apenas para os voxels que têm corante visível. Consulte a Figura 10 para visualizar diagrama representativo de um voxel destacando todas as amostras coletadas de cada voxel.

Linha Figura 10. voxel Representante. A linha tracejada vermelha indica núcleo coletado para amostra microbiologia, o verde tracejada indica horizontal núcleo condutividade hidráulica, a linha do traço amarelo indica núcleo condutividade hidráulica vertical, o tracejado roxo indica núcleo densidade, eo limite oval azul indica restante amostra do voxel sendo usado para análise geoquímica. por favor clique aqui para baixar esse arquivo.
Análise 6. Amostra
- Use amostras coletadas para análises microbiológicas para molecular (extração de DNA microbiana do solo) 14 e em cultura (contagens de placas heterotróficas) 15 análises. Use DNA extraído para reações em cadeia da polimerase quantitativa (qPCR) 16, e de alto rendimento experimentos de seqüenciamento de genes 17,18.
- Use amostras coletadas para análises geoquímicas para medir uma variedade de propriedades geoquímicas incluindo pH (método US EPA 150.2), condutividade elétrica (CE) (US método EPA 120.1), carbono e teor de nitrogênio (US método EPA 415.3, extração seqüencial de elementos 19, e difração de raios-X (DRX) e estendeu absorção de raios-X estrutura fina (EXAFS) espectroscopia de acordo com especificações do Stanford Synchrotron Radiation Laboratory, para investigar as transformações minerais.
- Use amostras de núcleo coletadas para análises hidrológicas para experimentos de laboratório, tais como densidade 20e condutividade hidráulica 21.
Resultados
As dimensões dos voxels assegurada recolha de amostras para hidrológico, geoquímicos e medições microbiológicos. O procedimento de escavação produziu 324 núcleos para análise microbiológica, 972 pontos de dados pXRF, 324 sacos de amostras geoquímicas, 180 amostras Ksat (128 vertical e horizontal 52), e 311 amostras de densidade a granel. fluxo preferencial de corante Azul Brilhante também foi observado a uma profundidade de 30 cm abaixo da superfície. Um conjunto representa...
Discussão
Evolução da paisagem é o efeito cumulativo de hidrológico, geoquímicos e biológicos 12. Estes processos controlar as reações biogeoquímicas fluxo e transporte de água e elementos, e na evolução das paisagens. No entanto, capturar as interações requer simultaneamente delineamento experimental precisamente coordenada e amostragem. Além disso, o estudo da evolução da paisagem incipiente é difícil em sistemas naturais, com capacidades limitadas para identificar "tempo zero" condiçõe...
Divulgações
The authors have nothing to disclose.
Agradecimentos
We thank Ty P.A. Ferré, Till Volkman, Edwin Donker, Mauricio Vera for helping us during the excavation, and Triffon J. Tatarin, Manpreet Sahnan and Edward Hunt for their help in sample analysis. This work was carried out at Biosphere 2, University of Arizona and funded by National Science Foundation grant EAR_1344552 and Honors Research Program of Biosphere 2.
Materiais
| Name | Company | Catalog Number | Comments |
| Measuring tape | Any | Any | Preventing cross-contamination of samples is crucial. Therefore, it is helpful to have multiple putty knives to isolate voxel boundary. |
| Brilliant Blue dye | Waldeck GmBH &Co | B0770 | Rulers can be used to draw grids. The sampling strategy can be modified based on individual experiments. |
| Soil Corer | AMS | 56975 | Any commercially manufactured Brilliant Blue dye can be used. |
| 75% Ethanol | Any | Any | A Nikon D90 camera and 50 mm lens were used for photography. Any high resolution camera and lens can be used for this purpose. |
| Spray Bottle | Any | Any | Use of dye and color card is subjective to individual experiments and/or research questions. |
| Spatula | Any | Any | Gardening gloves may be used if handling of corer becomes tedious. |
| Gloves | Any | Any | Ensure microbiology samples are kept in ice during sampling and frozen as soon as possible. |
| KimWipes | KimTech Science | Any | Water can be used to wash soil corer, prior to sanitizing with ethanol. |
| Sterile Sample bags | Fisher Scientific | Whirl-Pak 4 OZ. 24 OZ | Keep buckets and dustpans handy to facilitate removal of waste soil. |
| Color Card | Any | Any | The original design of miniLEO has various sensors embedded in the lysimeter. Such sensors may or may not be necessary based on the scope of individual experimental design. |
| X-ray Fluoresce Spectrophotmeter | XRF, OLYMPUS | DS-2000 Delta XRF | |
| Polypropylene cores | Any | Any | |
| Metal cores | Any | Any | |
| Caps for polypropylene cores | Any | Any | |
| Hammer | Any | Any | |
| Plastic putty knives | Any | Any | |
| Face masks | Any | Any |
Referências
- Brady, N. C., Weil, R. R. . The nature and properties of soils. , (2008).
- Chorover, J., Kretzschmar, R., Garica-Pichel, F., Sparks, D. L. Soil biogeochemicial processes within the critical zone. Elements. 3, 321-326 (2007).
- Troch, P. A., et al. Catchment coevolution: A useful framework for improving predictions of hydrological change?. Water Resour. Res. 6, 1-20 (2015).
- Sharp, R. P. Landscape evolution (A Review). Proc. Natl. Acad. Sci. U. S. A. 79, 4477-4486 (1982).
- Temme, A., Montgomery, D. R., Bierman, P. R. Predicting the effect of changing climate on landscapes with computer based landscape evolution models. Key Concepts in Geomorphology. , (2013).
- Troch, P. A., et al. Dealing with Landscape Heterogeneity in Watershed Hydrology: A Review of Recent Progress toward New Hydrological Theory. Geogr. Compass. 3, 375-392 (2009).
- Wang, Y., et al. Dissecting the Hydrobiogeochemical Box. in Am. Geophys. Union Fall Meet. , (2015).
- Lin, H., et al. Hydropedology: Synergistic integration of pedology and hydrology. Water Resour. Res. 42 (5), W05301 (2006).
- Band, L. E., et al. Ecohydrological flow networks in the subsurface. Ecohydrology. 7, 1073-1078 (2014).
- Churchman, G. j., Lowe, D. . Handbook of Soil Science Properties and Process. 1, (2012).
- van der Heijden, M. G. A., Bardgett, R. D., van Straalen, N. M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecol. Lett. 11 (3), 296-310 (2008).
- Pangle, L. a., et al. The Landscape Evolution Observatory: A large-scale controllable infrastructure to study coupled Earth-surface processes. Geomorphology. 244, 190-203 (2015).
- . . User Manual: Delta Famiy Handheld XRF Analyzers. , (2013).
- Valentìn-Vargas, A., Root, R. A., Neilson, J. W., Chorover, J., Maier, R. M. Environmental factors influencing the structural dynamics of soil microbial communities during assisted phytostabilization of acid-generating mine tailings: A mesocosm experiment. Sci Total Environ. 500-501, 314-324 (2014).
- JoVE Science Education Database. . Essentials of Environmental Microbiology. Culturing and Enumerating Bacteria from Soil Samples. , (2016).
- JoVE Science Education Database. . Essentials of Environmental Microbiology: Quantifying Environmental Microorganisms and Viruses Using qPCR. , (2016).
- Sengupta, A., Dick, W. A. Bacterial community diversity in soil under two tillage practices as determined by pyrosequencing. Microb. Ecol. 70, 853-859 (2015).
- Caporaso, J. G., et al. Correspondence - QIIME allows analysis of high- throughput community sequencing data. Nat. Publ. Gr. 7, 335-336 (2010).
- Hall, G. E. M., Vaive, J. E., Beer, R., Hoashi, M. Selective leaches revisited, with emphasis on the amorphous Fe oxyhydroxide phase extraction. J. Geochemical Explor. 56, 59-78 (1996).
- Grossman, R. B., Reinsch, T. G., Dane, J. H., Topp, G. C. Bulk density and linear extensibility. Methods of Soil Analysis. Part 4-Physical Methods. , 201-228 (2002).
- Reynolds, W. D., Elrick, D. E., Youngs, E. G., Amoozegar, A., Bootlink, H. W. G., Bouma, J., Dane, J. H., Topp, G. C. Saturated and field-saturated water flow parameters. Methods of Soil Analysis, Part 4-Physical Methods. , 802-816 (2002).
- King, G. M. Contributions of atmospheric CO and hydrogen uptake to microbial dynamics on recent Hawaiian volcanic deposits. Appl. Environ. Microbiol. 69 (7), 4067-4075 (2003).
- Meyer, W. S., Barrs, H. D. Roots in irrigated clay soils: Measurement techniques and responses to rootzone conditions. Irrig. Sci. 12 (3), 125-134 (1991).
- Graham, C. B., Woods, R. A., McDonnell, J. J. Hillslope threshold response to rainfall: (1) A field based forensic approach. J. Hydrol. 393 (1-2), 65-76 (2010).
- Anderson, A. E., Weiler, M., Alila, Y., Hudson, R. O. Dye staining and excavation of a lateral preferential flow network. Hydrol. Earth Syst. Sci. Discuss. 5 (2), 1043-1065 (2008).
- Gleeson, T., Paszkowski, D. Perceptions of scale in hydrology: what do you mean by regional scale?. Hydrol. Sci. J. 00, 1-9 (2013).
- Molins, S., Trebotich, D., Steefel, C. I., Shen, C. An investigation of the effect of pore scale flow on average geochemical reaction rates using direct numerical simulation. Water Resour. Res. 48, W03527 (2012).
- Fierer, N., Lennon, J. T. The generation and maintenance of diversity in microbial communities. Am. J. Bot. 98 (3), 439-448 (2011).
- Niu, G. Y., Pasetto, D., Scudeler, C., Paniconi, C., Putti, M., Troch, P. A. Analysis of an extreme rainfall-runoff event at the Landscape Evolution Observatory by means of a three-dimensional physically-based hydrologic model. Hydrol. Earth Syst. Sci. Discuss. 10, 12615-12641 (2013).
- Marteinsson, V., et al. Microbial colonization in diverse surface soil types in Surtsey and diversity analysis of its subsurface microbiota. Biogeosciences. 12, 1191-1203 (2015).
- Orcutt, B. N., Sylvan, J. B., Rogers, D. R., Delaney, J., Lee, R. W., Girguis, P. R. Carbon fixation by basalt-hosted microbial communities. Front. Microbiol. 6, 00904 (2015).
- Wu, L., Jacobson, A. D., Chen, H. C., Hausner, M. Characterization of elemental release during microbe-basalt interactions at T=28°C. Geochim. Cosmochim. Acta. 71, 2224-2239 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados