このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
結合水文学、地球化学、および微生物学的調査のための土壌ライシメータ発掘
要約
本研究では、地下水文学、地球化学、および土壌ライシメータの微生物学的異質性を調査するための掘削方法を提示します。ライシメータは、均一の条件で最初にあったと18ヶ月の期間中に灌漑の8サイクルにわたって水の約5000ミリメートルを施した人工hillslopeをシミュレートします。
要約
Studying co-evolution of hydrological and biogeochemical processes in the subsurface of natural landscapes can enhance the understanding of coupled Earth-system processes. Such knowledge is imperative in improving predictions of hydro-biogeochemical cycles, especially under climate change scenarios. We present an experimental method, designed to capture sub-surface heterogeneity of an initially homogeneous soil system. This method is based on destructive sampling of a soil lysimeter designed to simulate a small-scale hillslope. A weighing lysimeter of one cubic meter capacity was divided into sections (voxels) and was excavated layer-by-layer, with sub samples being collected from each voxel. The excavation procedure was aimed at detecting the incipient heterogeneity of the system by focusing on the spatial assessment of hydrological, geochemical, and microbiological properties of the soil. Representative results of a few physicochemical variables tested show the development of heterogeneity. Additional work to test interactions between hydrological, geochemical, and microbiological signatures is planned to interpret the observed patterns. Our study also demonstrates the possibility of carrying out similar excavations in order to observe and quantify different aspects of soil-development under varying environmental conditions and scale.
概要
土壌や風景ダイナミクスは、物理、化学物質の複雑な相互作用、及び生物学的プロセス1により成形されます。水の流れ、地球化学的風化、および生物学的活性は、安定した生態系2,3に風景全体の発展を形作ります。表面変化が景観4の最も顕著な特徴であるが、地下領域における水文学、地球化学、および微生物学的プロセスの累積的影響を理解することは景観2を形作る基礎となる力を理解するために重要です。将来の気候摂動シナリオは、さらに景観進化5の予測可能性やパターンを混乱させる。したがって、景観スケール6上での大規模な症状に小規模なプロセスをリンクすることが課題となります。伝統的な短期室内実験や目をキャプチャするには、短い秋を強制的に未知の初期条件と時間変化と自然景観での実験風景の進化の電子固有異質。また、強い非線形結合のために、それは異機種システム7に水文モデリングから生物地球化学的変化を予測することは困難です。ここでは、既知の初期条件と完全に制御および監視土壌hillslopeを掘削するための新規な実験方法を説明します。私たちの発掘及びサンプリング手順は、ハイドロバイオ地球化学的相互作用と土壌形成過程への影響を調査するために総合的なデータセットを提供することを目標に、その長さと深さに沿ってhillslopeの開発異質を取り込むことを目的としています。
自然界に見られる水文システムは、空間的・時間的スケール3の広い範囲にわたって行わ水文応答の変化と、時間的に静的であることから遠く離れています。景観に沿った流れ経路の空間構造は、ドライブ地球化学反応や生物学的植民地化の速度、程度及び配分を決定します風化、輸送、溶質および沈殿物の沈殿、および土壌構造のさらなる発展。したがって、水文プロセスを評価し、水文予測を改善するために、理論と実験デザインに土壌学、地球物理学、および生態から知識を組み込むことは8,9示唆されています。ランドスケープの進化は、水力学、土壌の発達中の元素の移行に関連して、および空気と鉱物表面の反応、水、および微生物10によってもたらさ鉱物学変換によって地下生物地球化学的プロセスによって影響を受けます。したがって、進化する風景の中に地球化学的ホットスポットの開発を検討することが重要です。さらに、複雑な景観開発のダイナミクスを理解するために初期の土壌形成時の水文過程および微生物学の署名に地球化学的風化パターンを関連付けることが重要です。土壌起源の特定のプロセスが管理されています特定の親材料に対する気候、生物学的な入力、救済と時間を合わせた影響で。この実験は、どこの条件下で(スロープおよび深さを含む)の救済に関連した水文学と地球化学的変化によって支配母材の風化や環境勾配によって駆動され、微生物の活動の関連する変動( すなわち 、酸化還元電位)で不均一に対処するために設計されました母材、気候や時間が一定に保たれます。微生物活性に関しては、土壌微生物は重要なコンポーネントであり、景観の安定性11に大きな影響を持っています。これらは、土壌構造、栄養素の生物地球化学的循環、および植物の成長に重要な役割を果たしています。したがって、同時に水文流路と地球化学の我々の逆数影響を特定しながら、風化のドライバー、土壌生成、および景観形成プロセスとしてこれらの生物の重要性を理解することが必要です微生物群集の構造と多様性にathering。これは、水文学と地球化学的特性も並行して検討されている進化する風景の上に微生物群集の多様性の空間的不均一性を研究することによって達成することができます。
ここでは、バイオスフィア2(アリゾナ大学)に収容された風景の進化天文台(LEO)の大規模なゼロ次流域モデルを模倣するように設計された土壌のライシメータ、運用という名前miniLEO、の掘削手順を提示します。 miniLEOは累積異種のハイドロバイオ地球化学的プロセスから生じる小規模な景観の進化のパターンを識別するために開発されました。これはライシメータ長さ2メートル、幅0.5メートル、高さ1メートル、および10°の傾き( 図1)です。さらに、ライシメータの壁は絶縁および非生分解性の二液型エポキシプライマーおよび潜在的汚染または浸出を回避するために集合充填脂肪族ウレタンコートでコーティングされています土壌へのライシメータフレームからの金属の。ライシメータは、アリゾナ州北部にメリアムクレーターに関連した後期更新世テフラの堆積物から抽出された破砕玄武岩を充填しました。ロードされた玄武岩材料は、はるかに大きいLEO実験に使用される材料と同一でした。鉱物組成、粒子サイズ分布、油圧特性がPangle ら 12に記載されています。下り坂浸透面はあきプラスチックスクリーン(0.002-メートルの直径の孔、14%の気孔率)が並んでました。システムは、地下水面の高さを決定するために、含水量および温度センサー、水ポテンシャルセンサの2つのタイプ、土壌水サンプラー、油圧重量バランス、電気伝導プローブ、および圧力変換器などのセンサが取り付けられています。ライシメータは、掘削に先立って18ヶ月間灌漑ました。
掘削は、そのアプローチに細心のあった二つの大きな疑問に答えることを目的としました。(1)水文学もの、地球化学的、微生物署名模擬降雨条件とに対して傾斜面の長さと深さにわたって観察することができる(2)hillslopeで発生ハイドロ生物地球化学的プロセスとの関係とフィードバックから推定することができるかどうか個々の署名。実験のセットアップおよび掘削手順と並んで、我々は結合された地球システムのダイナミクスおよび/または土壌の開発プロセスの研究に興味を持って研究者のための同様の発掘・プロトコルを適用する方法に関する代表的なデータや提案を提示します。
プロトコル
1.ライシメータの体系的かつ包括的なサンプリングを確保するためのサンプリングマトリックスを考案
- 固定長さ、幅、深さのボクセルにライシメータ分割します。
- 座標系ユークリッド空間を使用し、等間隔の適切な数に各方向(X、YおよびZ)に沿った総距離を分割。境界効果を避けるために、ライシメータの壁の近くに土を捨てることを検討してください。
注:収集された土壌の量が十分であることを保証しながら四方の壁に沿って5cmのバッファは、境界効果を避けるために、この実験で採用されています。 - 各サンプルに一意のXYZの位置を割り当て、ボクセルとして特定します。
注:この掘削では、Xは、斜面の幅に沿った位置を表し、Zは、斜面の深さに沿った位置を示し、一方、Yは、斜面の長さに沿った位置を表します。各ディメンション内の間隔の大きさは、ボクセルの幅、長さ、深さを決定します。Figure 2はXYZシステムの選択された原点と一緒にスペーシング間隔を決定した後ライシメータの分裂を示しています。現在の掘削方式で分割を10cm×20 cmのX 10cmの寸法( 図3)の324ボクセルの合計を生成し、YおよびZ方向の双方に沿って9時間間隔、X方向に沿って4区間を有します。
注:選択したサンプリング戦略は、システム全体が均等にセンサーへの最小限のダメージでサンプリングされることを保証します。各ボクセル(1-2センチ)の境界は、隣接するボクセルから交差汚染を制限するために破棄されます。また、ボクセルの大きさは、十分な土壌物質は、各ボクセル内の微生物学、地球化学、および水文サンプル収集のために利用可能であることを確認してください。
- 座標系ユークリッド空間を使用し、等間隔の適切な数に各方向(X、YおよびZ)に沿った総距離を分割。境界効果を避けるために、ライシメータの壁の近くに土を捨てることを検討してください。

ライシメータの図1.サイドビュー。浸透FAからのライシメータの眺めCE。また、可視四隅スロープやスプリンクラーシステムに沿って3つのセンサ領域(白PVC管)があります。

Yは20センチメートルに長さを分割しながら、 図2.サンプリングスキーム。XYZ。A.ザ・X次元に沿ったライシメータのサンプリング方式は、4つのセクション10cmのそれぞれに幅を分割する。B.ザ・Z寸法は、深さを示し、9層に分けました10cmの深さの。すべてのライシメータの縁に沿って5cmの境界は、潜在的に境界効果を発揮することができるサンプルの収集を防ぐために同定された。 このファイルをダウンロードするにはこちらをクリックしてください。
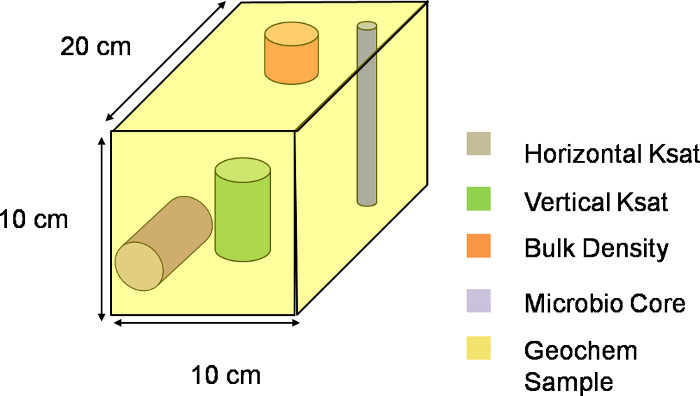
図3.三次元ボクセルのimensional表現。ライシメータのXYZ面に沿って1ボクセルの視覚的概略図。全体の傾きは、単一のサンプリング部を描いた各ボクセルに、324などのボクセルに分割した。 このファイルをダウンロードするにはこちらをクリックしてください。
2.斜面に水浸透を追跡するブリリアントブルーFCF染料を追加
- Y方向に沿った面の上部105センチメートルをカバーするのに十分な、土の表面に鮮やかな青色色素を適用します。プラスチックシートと残りの土をカバーしています。
- 黒玄武岩質土壌に対してコントラストを保証するために(ここでは10グラム/ L)の濃度を選択してください。灌漑システムタンクに染料を追加し、所望の濃度に水で希釈します。
- 浸潤前線の所望の深さや灌漑システムによって供給されたレートに基づいて灌漑の持続時間を決定します。
注:この研究のために、私前の掘削に20分間、30 mm / hrのrrigation率( 図4)は、最初の数センチメートルの間の水の浸透の不均一パターンを識別するために十分であると考えられます。 - 色素塗布後、浸潤が停止するとライシメータ内の水分状態が平衡化するための時間を与えます。この研究のために、染料のアプリケーションと掘削の間に10時間(一晩)の期間は適切でした。
ボクセルの3分界
- ボクセルの境界の間、指導のためのin-situ基準システムを提供するために、スロープの長さに沿ってテープを測定取り付けます。
- 測定テープの助けを借りて各土壌ボクセルの寸法をマークします。アルミブレードシールドとプラスチックパテナイフ( 図4)を使用して、各レイヤのグリッド線を描画します。境界材料(境界効果を防止するために、各壁から5センチ)捨てます。

ライシメータの図4.トップビュー。このビューでは、レイヤ2(10センチメートル深い)の染色された表面を示しています。サンプリングを支援するために土壌表面に描かれたグリッドは、微生物学的サンプル採取後の各ボクセルでのコア穴領域と一緒に、また表示されます。
4.微生物のサンプル採取
- 各ボクセルから前に水文学と地球化学に無菌的に微生物学のサンプルを収集するには、サンプルの交差汚染を防止するために分析します。新しい手袋をヒトの皮膚からの汚染を減らすために掘削を行うすべてのメンバーが着用していることを確認します。
- 直径1cm、20センチ、高さ、および微生物学的サンプル収集のための薄いへらの土壌コアラを使用してください。コアラや蒸留水でへらを清掃し、清潔なワイプで水分を拭き取り、スプレーボトルを使用して、75%エタノールですすいでください。空気乾燥さコアラやへらを許可します。
- C注各サンプルのollection時間。各ボクセルの場所で10cmの深さ、および予め滅菌プラスチックバッグ( 図5)に土壌サンプルを空にするためのへらをコアにコアラを使用してください。サンプルを堆積する直前に袋を開くように注意してください。手でサンプルパウチを均質化します。
- サンプリング中クーラー氷のサンプルバッグを保管、およびCの冷凍庫-80に、できるだけ早く転送します。

図5.微生物のサンプル収集。×1センチ、滅菌バッグ20cmの小型携帯コアラ、スパチュラは微生物学的サンプリング時にここに表示されます。 このファイルをダウンロードするにはこちらをクリックしてください。
5.地球化学と水文サンプル採取
- XとY PLで写真染め地域色素が観察された深さのための掘削中にanes。色観察した( 図6)のための基準を提供するために、色のカードを使用してください。適切な自然光が正しく色強度を文書化する存在であることを確認してください。
- 測定を開始する前に、毎日のポータブル蛍光X線分光計(pXRF)を調整します。キャリブレーションおよび測定の詳細については、製造元の指示13( 図7)を参照してください。簡単に言えば、ホルダーに楽器を配置し、工場出荷時の金属ビーズに直接ビーム窓を指します。 「カル」を選択し、キャリブレーションが完了することができるようにするために30秒間待ちます。
- すべての測定を行う前に、ビーム窓を清掃してください。 3つの異なる場所で三連の各ボクセルの表面を測定します。土壌表面にpXRF器を配置し、測定が完了することができるようにするために90秒間待ちます。
注:X線ビームの方向に長い距離を貫通することができます。したがって、ensu唯一の訓練を受けた担当者が機器を処理し、適切な安全プロトコルを維持していることを再度。
- すべての測定を行う前に、ビーム窓を清掃してください。 3つの異なる場所で三連の各ボクセルの表面を測定します。土壌表面にpXRF器を配置し、測定が完了することができるようにするために90秒間待ちます。

図6.カラーカードは、浸潤を染める従うこと。目に見える染料浸透との各位置は、基準となる色のカードで撮影した。 このファイルをダウンロードするにはこちらをクリックしてください。

図7.ポータブル蛍光X線分光計。ハンドヘルドpXRFは、ボクセルの表面上に配置します。測定は、各ボクセルの表面上の3つの異なる位置に記録した後、平均化しました。
- きれいな金属コア(高さ= 3センチ、直径= 5.7センチメートル)とポリカーボネートコ解像度(高さ= 6センチ、直径= 5.7センチメートル)をそれぞれ希望するボクセルの嵩密度(BD)と油圧伝導率測定用(KSAT)、( 図8)。
- 垂直方向センサーやセンサーの配線を損傷しないように注意しながら希望のボクセルに金属コアとポリカーボネートコア(垂直KSAT)を挿入します。土壌に乱れを最小限にするために、コアとハンマーの間に木のブロックのような平らな面を使用するように注意しながら、静かに土にコアを打撃することによってこれを行います。コアは、土壌中に途中で一度に加え、第一コアの上に第二のコアを配置します。第二コアの上に木製のブロックを置き、静かに最初のコアはまだ目に見えるコアリムと土壌中に埋め込まれるまでブロックをハンマー。
- ボクセルの側面は、順次掘削で開くように、水平KSATのためのコアを挿入します。ステップ5.4で述べたように圧縮を最小限にするために木製のブロックと第2のコアを使用してください。
- ボクセルことを確実にするために注意してくださいサンプリングされると、前の地球化学的試料採取の境界と隣接するボクセルから単離されます。コアが容易に除去することができるまで、ラベルされた地球化学(GC)サンプルバッグに金属やポリプロピレンのコアの周りの土壌サンプルを収集するために手持ちこて続いて、この目的のためにプラスチックパテナイフを使用し( 例えば 、 図9a、b)に 。

図8嵩密度と透水コアポリプロピレンコア(左)金属コア(右)嵩密度のサンプルを収集するために使用しながら、垂直方向と水平方向の透水サンプルを収集するために使用しました。

図9.ボクセル境界。プラスチックパテナイフは、(A)単離するために使用しました(B)地球化学、嵩密度、および透水コアコレクションの前にボクセルの境界。 このファイルをダウンロードするにはこちらをクリックしてください。
- 、金属コアを取り外し両端から過剰な材料をはねのける、および標識されたBDのサンプルバッグにコアからサンプルを転送します。サンプルと各サンプルバッグの重量を測定し、総重量を記録します。
- ポリプロピレンコアを削除します。赤いプラスチック製のキャップで両面を覆い、「H」は、サンプルのIDが続くように「V」と水平ポリプロピレンコアとして垂直ポリプロピレンコアにラベルを付けます。
- 次のボクセルと交差汚染を防ぐためにすべての4つの辺に土壌のセンチのカップルを残して、GCのサンプルバッグにボクセルから残りの材料を収集します。
- 1層内のボクセルの残りのステップから5.9から5.1を繰り返します。
- いったん1層からの全てのボクセルはされています完了し、次の層のために3.2から5.10へのステップを繰り返します。
注:のみ可視色素を持つボクセルに対して実行する5.1ニーズをステップ。各ボクセルから収集されたすべてのサンプルを強調ボクセルの代表的な図を視覚化するために、図10を参照してください。

図10.代表的ボクセル。赤線がコア微生物学サンプルのために収集示し点線、緑の破線が水平透水コアを示し、黄色の破線が垂直透水コアを示し、紫の破線は、バルク密度コア、および青色の楕円形の境界を示します地球化学的分析のために使用されているボクセルからの残りのサンプルを示します。 このファイルをダウンロードするにはこちらをクリックしてください。
6.サンプル分析
- 微生物学のために収集し使用したサンプルは、分子(土壌微生物のDNA抽出)のために14培養(従属栄養プレートカウント)15分析を分析します。使用は、定量的ポリメラーゼ連鎖反応(定量PCR)16、およびハイスループット遺伝子配列決定実験17,18のためのDNAを抽出しました。
- 地球化学のために収集し使用したサンプルは、pH値(米国EPA法150.2)、電気伝導度(EC)(US EPAメソッド120.1)、炭素および窒素含有量(米国EPA方法415.3、エレメント19の逐次抽出を含めた地球化学的特性の多くを測定するために分析し、およびX線回折(XRD)、スタンフォード放射光研究所の仕様に従って、拡張X線吸収微細構造(EXAFS)分光法は、鉱物の変換を調査します。
- このような嵩密度20などの研究実験用水文解析のために収集したコアサンプルを使用しますそして、透水係数21。
結果
ボクセルの寸法は、水文地球化学、および微生物学的測定のためのサンプルの収集を確実にしました。掘削手順は、微生物学的分析のために324コア、972 pXRFデータポイント、324地球化学試料バッグ180 KSATサンプル(128垂直および52水平)、および311嵩密度のサンプルを得ました。ブリリアントブルー染料の優先的な流れは、表面下に30cmの深さまで観察されました。ライ...
ディスカッション
景観の進化は、水文地球化学的、および生物学的プロセス12の累積的な効果です。これらのプロセスは、風景を進化における流れと水と要素の輸送、および生物地球化学的な反応を制御します。しかし、同時に相互作用を捕捉することは、正確に調整された実験計画とサンプリングが必要です。また、初期の風景の進化を研究することは「時間ゼロ」状態を識別するための制限された...
開示事項
The authors have nothing to disclose.
謝辞
We thank Ty P.A. Ferré, Till Volkman, Edwin Donker, Mauricio Vera for helping us during the excavation, and Triffon J. Tatarin, Manpreet Sahnan and Edward Hunt for their help in sample analysis. This work was carried out at Biosphere 2, University of Arizona and funded by National Science Foundation grant EAR_1344552 and Honors Research Program of Biosphere 2.
資料
| Name | Company | Catalog Number | Comments |
| Measuring tape | Any | Any | Preventing cross-contamination of samples is crucial. Therefore, it is helpful to have multiple putty knives to isolate voxel boundary. |
| Brilliant Blue dye | Waldeck GmBH &Co | B0770 | Rulers can be used to draw grids. The sampling strategy can be modified based on individual experiments. |
| Soil Corer | AMS | 56975 | Any commercially manufactured Brilliant Blue dye can be used. |
| 75% Ethanol | Any | Any | A Nikon D90 camera and 50 mm lens were used for photography. Any high resolution camera and lens can be used for this purpose. |
| Spray Bottle | Any | Any | Use of dye and color card is subjective to individual experiments and/or research questions. |
| Spatula | Any | Any | Gardening gloves may be used if handling of corer becomes tedious. |
| Gloves | Any | Any | Ensure microbiology samples are kept in ice during sampling and frozen as soon as possible. |
| KimWipes | KimTech Science | Any | Water can be used to wash soil corer, prior to sanitizing with ethanol. |
| Sterile Sample bags | Fisher Scientific | Whirl-Pak 4 OZ. 24 OZ | Keep buckets and dustpans handy to facilitate removal of waste soil. |
| Color Card | Any | Any | The original design of miniLEO has various sensors embedded in the lysimeter. Such sensors may or may not be necessary based on the scope of individual experimental design. |
| X-ray Fluoresce Spectrophotmeter | XRF, OLYMPUS | DS-2000 Delta XRF | |
| Polypropylene cores | Any | Any | |
| Metal cores | Any | Any | |
| Caps for polypropylene cores | Any | Any | |
| Hammer | Any | Any | |
| Plastic putty knives | Any | Any | |
| Face masks | Any | Any |
参考文献
- Brady, N. C., Weil, R. R. . The nature and properties of soils. , (2008).
- Chorover, J., Kretzschmar, R., Garica-Pichel, F., Sparks, D. L. Soil biogeochemicial processes within the critical zone. Elements. 3, 321-326 (2007).
- Troch, P. A., et al. Catchment coevolution: A useful framework for improving predictions of hydrological change?. Water Resour. Res. 6, 1-20 (2015).
- Sharp, R. P. Landscape evolution (A Review). Proc. Natl. Acad. Sci. U. S. A. 79, 4477-4486 (1982).
- Temme, A., Montgomery, D. R., Bierman, P. R. Predicting the effect of changing climate on landscapes with computer based landscape evolution models. Key Concepts in Geomorphology. , (2013).
- Troch, P. A., et al. Dealing with Landscape Heterogeneity in Watershed Hydrology: A Review of Recent Progress toward New Hydrological Theory. Geogr. Compass. 3, 375-392 (2009).
- Wang, Y., et al. Dissecting the Hydrobiogeochemical Box. in Am. Geophys. Union Fall Meet. , (2015).
- Lin, H., et al. Hydropedology: Synergistic integration of pedology and hydrology. Water Resour. Res. 42 (5), W05301 (2006).
- Band, L. E., et al. Ecohydrological flow networks in the subsurface. Ecohydrology. 7, 1073-1078 (2014).
- Churchman, G. j., Lowe, D. . Handbook of Soil Science Properties and Process. 1, (2012).
- van der Heijden, M. G. A., Bardgett, R. D., van Straalen, N. M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecol. Lett. 11 (3), 296-310 (2008).
- Pangle, L. a., et al. The Landscape Evolution Observatory: A large-scale controllable infrastructure to study coupled Earth-surface processes. Geomorphology. 244, 190-203 (2015).
- . . User Manual: Delta Famiy Handheld XRF Analyzers. , (2013).
- Valentìn-Vargas, A., Root, R. A., Neilson, J. W., Chorover, J., Maier, R. M. Environmental factors influencing the structural dynamics of soil microbial communities during assisted phytostabilization of acid-generating mine tailings: A mesocosm experiment. Sci Total Environ. 500-501, 314-324 (2014).
- JoVE Science Education Database. . Essentials of Environmental Microbiology. Culturing and Enumerating Bacteria from Soil Samples. , (2016).
- JoVE Science Education Database. . Essentials of Environmental Microbiology: Quantifying Environmental Microorganisms and Viruses Using qPCR. , (2016).
- Sengupta, A., Dick, W. A. Bacterial community diversity in soil under two tillage practices as determined by pyrosequencing. Microb. Ecol. 70, 853-859 (2015).
- Caporaso, J. G., et al. Correspondence - QIIME allows analysis of high- throughput community sequencing data. Nat. Publ. Gr. 7, 335-336 (2010).
- Hall, G. E. M., Vaive, J. E., Beer, R., Hoashi, M. Selective leaches revisited, with emphasis on the amorphous Fe oxyhydroxide phase extraction. J. Geochemical Explor. 56, 59-78 (1996).
- Grossman, R. B., Reinsch, T. G., Dane, J. H., Topp, G. C. Bulk density and linear extensibility. Methods of Soil Analysis. Part 4-Physical Methods. , 201-228 (2002).
- Reynolds, W. D., Elrick, D. E., Youngs, E. G., Amoozegar, A., Bootlink, H. W. G., Bouma, J., Dane, J. H., Topp, G. C. Saturated and field-saturated water flow parameters. Methods of Soil Analysis, Part 4-Physical Methods. , 802-816 (2002).
- King, G. M. Contributions of atmospheric CO and hydrogen uptake to microbial dynamics on recent Hawaiian volcanic deposits. Appl. Environ. Microbiol. 69 (7), 4067-4075 (2003).
- Meyer, W. S., Barrs, H. D. Roots in irrigated clay soils: Measurement techniques and responses to rootzone conditions. Irrig. Sci. 12 (3), 125-134 (1991).
- Graham, C. B., Woods, R. A., McDonnell, J. J. Hillslope threshold response to rainfall: (1) A field based forensic approach. J. Hydrol. 393 (1-2), 65-76 (2010).
- Anderson, A. E., Weiler, M., Alila, Y., Hudson, R. O. Dye staining and excavation of a lateral preferential flow network. Hydrol. Earth Syst. Sci. Discuss. 5 (2), 1043-1065 (2008).
- Gleeson, T., Paszkowski, D. Perceptions of scale in hydrology: what do you mean by regional scale?. Hydrol. Sci. J. 00, 1-9 (2013).
- Molins, S., Trebotich, D., Steefel, C. I., Shen, C. An investigation of the effect of pore scale flow on average geochemical reaction rates using direct numerical simulation. Water Resour. Res. 48, W03527 (2012).
- Fierer, N., Lennon, J. T. The generation and maintenance of diversity in microbial communities. Am. J. Bot. 98 (3), 439-448 (2011).
- Niu, G. Y., Pasetto, D., Scudeler, C., Paniconi, C., Putti, M., Troch, P. A. Analysis of an extreme rainfall-runoff event at the Landscape Evolution Observatory by means of a three-dimensional physically-based hydrologic model. Hydrol. Earth Syst. Sci. Discuss. 10, 12615-12641 (2013).
- Marteinsson, V., et al. Microbial colonization in diverse surface soil types in Surtsey and diversity analysis of its subsurface microbiota. Biogeosciences. 12, 1191-1203 (2015).
- Orcutt, B. N., Sylvan, J. B., Rogers, D. R., Delaney, J., Lee, R. W., Girguis, P. R. Carbon fixation by basalt-hosted microbial communities. Front. Microbiol. 6, 00904 (2015).
- Wu, L., Jacobson, A. D., Chen, H. C., Hausner, M. Characterization of elemental release during microbe-basalt interactions at T=28°C. Geochim. Cosmochim. Acta. 71, 2224-2239 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved