Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Fabricación y entrega de medicamentos Aplicaciones de seda nanopartículas
En este artículo
Resumen
Las nanopartículas están emergiendo sistemas de administración de fármacos como prometedores para una amplia gama de indicaciones. A continuación, describimos un método simple pero potente para la fabricación de nanopartículas de seda usando seda Bombyx mori ingeniería inversa. Estas nanopartículas de seda pueden ser cargados fácilmente con una carga útil terapéutica y posteriormente exploradas para aplicaciones de administración de fármacos.
Resumen
La seda es un biopolímero prometedor para aplicaciones biomédicas y farmacéuticas debido a su excelente propiedades mecánicas, la biocompatibilidad y biodegradabilidad, así como su capacidad para proteger y posteriormente liberar su carga útil en respuesta a un disparador. Mientras que la seda se puede formular en varios formatos de materiales, las nanopartículas de seda están emergiendo sistemas de administración de fármacos como prometedores. Por lo tanto, este artículo se refiere a los procedimientos de capullos de seda de ingeniería inversa, para dar una solución de seda regenerada que se puede utilizar para generar nanopartículas de seda estables. Estas nanopartículas se caracterizan posteriormente, el fármaco cargado y explorado como un sistema de administración de fármacos contra el cáncer potencial. En pocas palabras, los capullos de seda son técnicas de ingeniería inversa por primera vez por el desgomado los capullos, seguido por disolución de seda y limpiar, para producir una solución acuosa de seda. A continuación, la solución de seda regenerada se somete a nanoprecipitation para producir nanopartículas de seda - un método simple pero potenteque genera nanopartículas uniformes. Las nanopartículas de seda se caracterizan de acuerdo a su tamaño, el potencial zeta, la morfología y la estabilidad en medios acuosos, así como su capacidad para atrapar una carga útil quimioterapéutico y matar las células de cáncer de mama humanos. En general, la metodología descrita produce nanopartículas de seda uniformes que se pueden explorar fácilmente para una gran variedad de aplicaciones, incluyendo su uso como un nanomedicina potencial.
Introducción
Los sistemas de administración de fármacos de tamaño nanométrico se utilizan a menudo para controlar la liberación del fármaco y para entregar un conjunto diverso de cargas útiles terapéuticos - por ejemplo, proteínas, péptidos y fármacos de bajo peso molecular - para apuntar las células y tejidos. Estas cargas útiles terapéuticos se incorporan a menudo en varios vehículos de fármacos macromoleculares, tales como liposomas, polímeros solubles en agua (incluyendo dendrímeros), y micro y nanopartículas 1. Las nanopartículas (típicamente en un intervalo de tamaño de 1 nm a 1.000 nm) están siendo ampliamente exploradas como posibles portadores de fármacos, en particular para la administración de fármacos contra el cáncer 2. La introducción exitosa de Abraxane (120 nanopartículas a base de albúmina de tamaño nm cargados con paclitaxel) en la práctica clínica habitual 3 ha catalizado el campo, por lo que muchas más nanopartículas para la administración de fármacos están entrando ahora en ensayos clínicos 4. Los tumores sólidos en general, muestran un mal drenaje linfático y tienen vasos sanguíneos que gotean que significa que nanoparticles de hasta 200 nm se pasivamente dirigidos a estos tumores después de la administración intravenosa. Este fenómeno de orientación pasiva se llama la permeabilidad mejorada y retención de efecto (EPR) y se informó por primera vez en 1986 5. El efecto EPR puede conducir a un aumento de 50 a 100 veces en las concentraciones de fármaco dentro del microambiente del tumor para una dosis de fármaco dada cuando la carga útil fármaco se administra utilizando un enfoque de soporte del fármaco macromolecular en lugar de el fármaco libre sin el portador. Nanopartículas cargadas con fármaco-diseñadas para la administración de fármacos contra el cáncer tienen que alcanzar el microambiente tumoral y, a menudo deben introducir un compartimiento intracelular específica, por lo general mediante la captación endocítica, para el fármaco para lograr su efecto terapéutico deseado 3. Las nanopartículas diseñadas para la administración de fármacos intracelular explotan endocitosis como puerta de entrada en la célula, así como una ruta para superar los mecanismos de resistencia a fármacos. La liberación del fármaco a partir de nanopartículas es a menudo diseñados específicamente para oCCur en los lisosomas (es decir, la administración de fármacos lysosomotropic) 6, donde la capacidad de respuesta del pH de la portadora de nanopartículas (lisosomal pH aproximadamente 4,5) puede servir como detonante de liberación de fármacos o enzimas lisosomales que liberan la carga útil del portador 7.
Muchas clases diferentes de materiales se pueden utilizar para generar las nanopartículas (por ejemplo, metales y muchos materiales orgánicos e inorgánicos). Sin embargo, los biopolímeros están surgiendo como materiales atractivos debido a su biocompatibilidad conocida, biodegradabilidad y baja toxicidad 8. Muchos biopolímeros están siendo explorados, incluyendo la albúmina, alginato, quitosano y seda. De éstos, la seda se ha convertido en un contendiente prometedor para el desarrollo en los sistemas de administración de fármacos 9. Las sedas de diversos tipos son producidos por un número de artrópodos, como arañas (por ejemplo, Nephila clavipes) y gusanos de seda (por ejemplo, Bombyx mori). la seda del gusano de seda se utiliza mucho más extenvamente que la seda de araña, porque el gusano de seda está totalmente domesticado y por lo tanto su seda representa un material de partida reproducible. la seda del gusano de seda es una Administración de Alimentos y Medicamentos (FDA) ha aprobado un plan para el uso humano, en particular como material de sutura; que tiene un historial de seguridad robusta en los seres humanos y se sabe que degradan in vivo 10. El perfil de degradación de la seda puede ser afinado en un rango de horas (de seda cristalina bajo) a 12 meses o más (seda muy cristalino). Productos de degradación de seda son no tóxicos y se metabolizan en el cuerpo 10. La estructura de seda imparte la capacidad de unirse compuestos de peso molecular pequeñas y fármacos de proteínas macromoleculares 11, por lo que es un buen material para liberación controlada de fármacos. Fármacos de proteínas (por ejemplo, anticuerpos) son susceptibles a la desnaturalización, agregación, escisión proteolítica y el aclaramiento por el sistema inmune. Sin embargo, la seda se estabiliza proteínas terapéuticas debido a la capacidad de amortiguación de su re nanocristalinaregiones y su capacidad de adaptar el contenido de agua en la nanoescala 11. Estas características únicas proporcionan protección física y reducen la movilidad de carga útil 11 y por lo general no se ven con otros (bio) polímeros. Muchos sistemas de suministro de fármacos contra el cáncer, por ejemplo hidrogeles basados en seda 12, películas 13-15 y nanopartículas 16,17, ahora se han desarrollado para aprovechar estas características (revisado en las referencias 18,19)
Aquí, las nanopartículas de seda se caracterizaron mediante la determinación de su tamaño y carga sobre un marco de tiempo prolongado. La doxorrubicina, un fármaco contra el cáncer clínicamente relevante, se utilizó como un fármaco modelo para estudios de carga de drogas y de citotoxicidad en células de cáncer de mama humano triple negativos tratados con nanopartículas de seda cargados con el fármaco.
Protocolo
1. Preparación de una solución de ingeniería inversa de seda de Bombyx mori capullos
NOTA: Esta metodología se basa en protocolos descritos en otras partes 12,27.
- Cortar 5 g de capullos secos con unas tijeras en 5 mm x 5 mm pedazos. Retire cualquier capas sucias.
- Pesar 4,24 g de carbonato de sodio y añadir esta cuidadosamente para 2 l de agua destilada hirviendo.
NOTA: Esto produce una solución de carbonato 0,02 M de sodio. - Añadir los trozos de corte de capullo a la solución de carbonato de sodio hirviendo y se deja hervir durante 60 minutos para DEGUM las fibras de seda. Se agita la seda de vez en cuando para asegurarse de procesamiento de la muestra homogénea.
- Eliminar la seda desgomado y se lava con 1 L de agua destilada durante 20 min; repetir la etapa de lavado al menos 3 veces.
- Retire la seda lavada y apretarlo bien para eliminar el exceso de líquido y luego desatar / tire de la seda con la mano. Coloque la seda desatada en una campana de extracción de aire durante la noche seco. Esto normalmente produce 3,6 g de s desgomadofibras calaña.
- El día siguiente, pésese fibras de seda desgomado secadas al aire 5 g y el paquete de la seda firmemente en la parte inferior de un vaso de precipitados de 50 ml.
- Prepare una solución fresca 9,3 M de bromuro de litio. Disolver las fibras de seda en bromuro de litio usando una seda 1 ga relación de 4 ml de bromuro de litio. Cubrir la muestra LiBr seda con papel de aluminio para evitar la evaporación y permitir que la seda se disuelva completamente a 60 ° C. Este paso puede tardar hasta 4 horas y es ayudada por la agitación de vez en cuando.
- Humedecer un casete de diálisis (peso molecular de corte de 3.500 Da) en agua durante 5 minutos. Inyectar 15 ml de la solución de bromuro de litio de seda en el casete de diálisis 15 ml y el uso de una aguja y una jeringa para eliminar las burbujas de aire.
- Se dializa frente a 1 L de agua destilada y cambiar el agua a los 1, 3 y 6 horas (es decir, 3 cambios en el primer día) y de nuevo a la mañana siguiente y por la noche (es decir, 2 cambios en el segundo día), y de nuevo el a la mañana siguiente (es decir, 1 cambio en la tercera día).
- Recoge los soluti sedadesde el casete de diálisis y se centrifuga la solución durante 20 min a 5 ° C a 9500 x g. Recuperar el sobrenadante y repetir este proceso de centrifugación dos veces más.
- Determinar el peso de un recipiente pesado vacío (W1) y añadir 1 ml de la solución de seda. Anotar el peso de nuevo (W2) y luego secar la muestra dejando el recipiente de pesar a 60 ºC durante la noche. A continuación, determinar el peso total seco (W3) (seda seca y barco de pesada). La concentración de la solución de seda (w / v) es:% = (W3-W1 / W2-W1) x 100.
2. Preparación de nanopartículas de seda de seda de soluciones de ingeniería inversa
- Añadir un 5% (w / v) gota a gota solución de seda a la acetona, manteniendo a> 75% (v / v) de solución de acetona. Por ejemplo, añadir 9 ml de un 5% (w / v) gota a gota solución de seda (10 l / gota a un ritmo de 50 gotas / min) a 34 ml de acetona.
- Se centrifuga el precipitado a 48.000 xg durante 2 horas a 4 ° C.
- Aspirar el sobrenadante y resuspender el pellet en agua destilada por desalojar primero el sedimento con una espátula y después añadiendo 20 ml de agua destilada. Utilice puntas de pipeta para eliminar el sedimento de la espátula. Después de agitación durante 20 segundos, seguido de dos ciclos de sonicación usando una sonda ultrasónica a 30% de amplitud durante 30 segundos, hasta la parte superior del tubo de centrífuga de capacidad con agua destilada.
- Repetir la centrifugación y resuspensión paso al menos dos veces.
- Resuspender el precipitado en 6 ml de agua destilada, según se detalla en el apartado 2.3 y se almacena a 4 ° C hasta su uso. Para los estudios de cultivo de células, las poblaciones de nanopartículas de seda pueden ser irradiadas con radiación gamma 17.
3. Determinación de la concentración de nanopartículas de seda
- nanopartículas de seda centrifugar a 48.000 xg durante 2 horas a 4 ° C.
- Recoge todas las nanopartículas en 3 ml de agua destilada, seguido de dos ciclos de sonicación a 30% de amplitud durante 30 seg.
- Dividir la población de 3 ml de nanopartículas de seda en 2 ml y 1 ml lotes y transferir a pre-pesaba tubos de 2 ml. Anotar el peso total de la muestra de 2 ml. Almacenar el lote 1 ml a 4 ° C hasta su uso; esta muestra 1 ml se utiliza para generar una curva de calibración.
- Snap congelación y luego liofilizar la gran cantidad de nanopartículas de seda de 2 ml en un liofilizador durante la noche. Después de la liofilización, se vuelve a pesar el tubo de 2 ml y calcular la cantidad de nanopartículas de seda (mg) que fue originalmente presente en la muestra de 2 ml.
- Diluir 1 ml de la nanopartícula de seda stock con agua destilada para generar una curva de calibración de 5 puntos (0,04-7 mg / ml). Asegurarse de que las muestras no exceden del máximo de absorbancia.
- Determinar la absorbancia de cada dilución estándar a 600 nm. Esto se realiza mejor utilizando una configuración de placa de 96 pocillos. Parcela absorbancia frente a la concentración (mg / ml) para la curva estándar. A continuación, utilice esta curva estándar de rutina para determinar la concentración de las nanopartículas de seda en suspensiones.
4. Preparación de seda cargada con doxorrubicina nanopartículas
- Preparación de la solución de doxorrubicina
- Disolver 1,2 mg de HCl de doxorrubicina en 8 ml de agua destilada.
- Completar hasta 10 ml con agua destilada para obtener una solución de trabajo de 116 mg / ml (0,2 mmol / ml).
- Preparación de seda cargada con doxorrubicina nanopartículas
- Mezclar 2 ml de solución de doxorrubicina 0,2 mol / ml con 200 l de 10, 30 o 50 mg / ml de las nanopartículas de seda en un tubo de 2 ml.
- Incubar la suspensión de seda-doxorrubicina a temperatura ambiente (25 ° C) durante la noche en un mezclador giratorio.
- A continuación, se centrifuga la suspensión de seda-doxorrubicina a 194.000 xg durante 30 min. Se lavan las nanopartículas de seda cargadas de doxorrubicina con agua destilada y repetir este procedimiento dos veces más.
- En común el sobrenadante y tenga en cuenta el volumen total (esta muestra se utiliza para determinar la eficacia de encapsulación).
- Volver a suspender las nanopartículas de seda cargadas de doxorrubicina en agua destilada, protegerlo de la luz y se almacena a 4 ° C ONUhasta su uso.
- Determinación de la eficiencia de encapsulación y la carga de fármaco
- Pipetear 200 l del sobrenadante de la etapa 4.2.4 en una placa de microtitulación de color negro.
- Use un lector de microplacas de fluorescencia para medir la fluorescencia asociada a la doxorrubicina en un entorno fotomultiplicador fijo.
- Establecer la longitud de onda de excitación de longitud de onda a 485 nm y emisión a 590 nm y registrar los valores de fluorescencia.
- Generar una curva de calibración de la doxorrubicina. Mediciones garantizar se adquieren con la misma configuración del instrumento (es decir, con un ajuste fijo fotomultiplicador). Usando la curva de calibración, se calcula la concentración de doxorrubicina en el sobrenadante combinado. Repetir la medición en tres experimentos independientes.
- Utilizar la ecuación (1) para determinar la eficiencia de encapsulación:
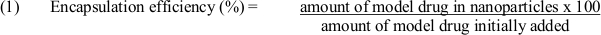
5. Caracterización de seda Nanopartículas
- Evaluación del tamaño y el potencial zeta de recién preparado y almacenado seda nanopartículas.
- Las tiendas de seda nanopartículas en agua destilada a 4 ° C y 25 ° C.
- Medir el tamaño y el potencial zeta de las nanopartículas de seda en los días 0, 14 y 28 utilizando dispersión dinámica de luz (DLS). Establecer índices de refracción de 1,33 para el agua destilada y 1,60 para la proteína 17. Calcular los tamaños de partículas con el software de interfaz de usuario.
- Evaluación morfológica de seda nanopartículas mediante microscopía electrónica de barrido (SEM).
- Coloque un disco adhesivo de carbono sobre un trozo SEM y luego colocar una oblea de silicio.
- Diluir nanopartículas de seda a una concentración de 1 mg / ml. Pipetear 10 l de la muestra sobre una oblea de silicio, se congela la muestra a -80 ° C y liofiliza durante la noche utilizando un sistema de secado por congelación según las instrucciones del fabricante.
- Escudo de la muestra con una capa de oro de hasta 20 nm de espesorutilizando un aplicador de pulverización catódica bajo vacío.
NOTA: La configuración del equipo varían según el modelo. El modelo utilizado aquí es totalmente automatizado y funciona mediante la única espesor. - muestras de imagen con un microscopio electrónico de barrido a 5 kV y una ampliación de 40.000 veces.
6. Citotoxicidad in vitro de Control y cargadas con doxorubicina seda nanopartículas
- La viabilidad celular tras la exposición a nanopartículas de seda.
- Cultura MDA-MB-231 células en RPMI 1640 con 10% v / v FBS. Células de la placa de cultivo de tejidos tratados de poliestireno y se incuban en un 5% humidificado atmósfera de CO 2 a 37 ° C. Rutinariamente subcultivo a 80% de confluencia cada 2-3 días.
- Placa de células MDA-MB-231 a una densidad de 2 x 10 4 células / cm 2 en placas de 96 pocillos. Dejar que las células se recuperaran durante la noche.
- Añadir (i) 0,001 a 1 mg de doxorrubicina libremente difusible, (ii) 0,001-0,5 nanopartículas de seda mg y 0,1 mg de nanopartículas de sedacargado con 0,001 a 1 mg de doxorrubicina en placas de 96 pocillos (volumen final de 100 l por pocillo).
- Determinar la viabilidad celular y la media máxima concentración inhibitoria (IC 50) mediante la adición de (3- (4,5-dimetiltiazol-2-il) -2,5-difeniltetrazolio (MTT 5 mg / ml en PBS) a 72 hr. Incubar durante 5 horas, escurrir con cuidado los pocillos con una pipeta y disolver el formazano con 100 l de dimetilsulfóxido. Medir la absorbancia a 560 nm., repetir la medición en tres experimentos independientes.
NOTA: Los valores de absorbancia de los controles no tratados sirven como valor de referencia para la viabilidad celular 100%.
- SEM de las células expuestas a nanopartículas de seda.
- Seed MDA-MB-231 células en cubreobjetos de vidrio estéril a una densidad de 2 x 10 4 células / cm 2. Dejar que las células se recuperaran durante la noche. Exponer las células a las condiciones de tratamiento deseadas para 72 hr.
- Fijar las células con 2% v / v de glutaraldehído en PBS durante 30 min, se lava con diagua calmado dos veces, se deshidratan con una serie de etanol, y el punto crítico secar las muestras, como se detalla en otro lugar 28.
- Pulverización catódica revestir las muestras con un oro capa hacia arriba a 20 nm de espesor utilizando un dispositivo de recubrimiento por pulverización catódica bajo vacío.
NOTA: La configuración del equipo varían según el modelo. El modelo utilizado aquí es totalmente automatizado y funciona mediante la única espesor. - Imagen por SEM de las muestras utilizando una aceleración de electrones de 5 kV y ampliación de 700 veces.
Resultados
Los datos se analizaron estadísticamente como se detalla anteriormente 17. Se utilizó la prueba t de Student para pares de muestras y análisis unidireccional de la varianza (ANOVA) seguido de comparaciones múltiples de Bonferroni test post hoc de múltiples muestras. El asterisco indica significación estadística de la siguiente manera: * P <0,05 y ** P <0,001. Todos los datos se presentan como valores medios ± desviación estándar (SD) y los números entre parén...
Discusión
Están disponibles diversos métodos para producir nanopartículas de seda, incluyendo el alcohol de polivinilo combinando 20, secando por pulverización 21, 22 desalado, micropuntos capilar de impresión 23, CO2 supercrítico precipitación 24 y nanoprecipitation 16,25 (revisado en la referencia 26). Sin embargo, nanoprecipitation, debido a su simplicidad general, es la técnica más popular para la generación de nanopartículas de...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This research was supported by a Marie Curie FP7 Career Integration Grant 334134 within the seventh European Union Framework Program.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetone | VWR International, Radnor, PA, USA | 20066.33 | |
| Automated Critical Point Dryer | Leica Microsystems, Wetzlar, Germany | EM CPD300 | |
| Balancing | Mettler Toledo, Greifensee, Switzerland | NewClassic MS | |
| Black polystyrene microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3991 | |
| Capillary cell (DTS 1070) | Malvern Instrument, Worcestershire, UK | DTS107 | |
| Carbon adhesive disc | Agar Scientific, Essex, UK | G3347N | |
| Centrifuge | Hermle Labortechnik, Wehingen, Germany | Z323K | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Avanti J-E, Rotor: J20 | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Optima L-70K, Rotor: 50.2 Ti, Adaptor 303392 | |
| Coater, low vacuum | Leica Microsystems, Wetzlar, Germany | EM ACE200 | |
| Cuvettes, polystyrene, disposable | Fisher Scientific, Waltham, MA, USA | FB55147 | |
| Doxorubixin | LC Laboratories, Boston, MA, USA | D4000 | |
| Electronic pipetting, Easypet | Eppendorf, Hamburg, Germany | N/A | |
| FE-SEM | Hitachi High-Technologies, Krefeld, Germany | SU6600 | |
| Fetal Bovine Serum | Thermo Scientific, Waltham, MA, USA | 16000-044 | |
| Freeze dryer | Martin Christ, Osterode, Germany | Epsilon 2-4 | |
| Heat inactivated Bombyx mori silk cocoons | Tajima Shoji, Kanagawa, Japan | N/A | |
| Hotplate with Stirrer | Bibby Scientific, Stanffordshire, UK | US 152 | |
| Incubator | Memmert, Schwabach, Germany | INB 200 | |
| Insulin, human recombinant, zinc solution | Thermo Scientific, Waltham, MA, USA | 12585-014 | |
| Lithium bromide | Acros Organics, Geel, Belgium | AC199870025 | |
| MDA-MB-231 | ATCC, Manassas, VA, U.S.A | N/A | |
| Micropipette and tips | Eppendorf, Hamburg, Germany | N/A | |
| Microplate Reader | Molecular devices, Sunnyvale, CA, USA | SpectraMax M5 | |
| Oak Ridge High-Speed Centrifuge Tubes, 50 ml | Thermo Scientific, Waltham, MA, USA | N/A | |
| Open-Top Thickwall Polycarbonate tube, 4 ml | Beckman Coulter, Brea, CA, USA | 355645 | |
| Penicilin/streptomycin | Thermo Scientific, Waltham, MA, USA | 15140-122 | |
| RPMI medium | Thermo Scientific, Waltham, MA, USA | 11875-093 | |
| Serological pipettes, 5 ml | Sigma-Aldrich, St. Louis, MO, USA | ||
| Silicon wafers | Agar Scientific, Essex, UK | G3391 | |
| Slide-A-Lyzer Dialysis cassettes, 3.5K MWCO, 15 ml | Thermo Scientific, Waltham, MA, USA | 87724 | |
| Sodium carbonate anhydrous | Fisher Scientific, Waltham, MA, USA | S/2840/62 | |
| Specimen stubs for SEM | Agar Scientific, Essex, UK | G301 | |
| Ultrasonic homogenizer | Bandelin, Berlin, Germany | Sonoplus HD 2070 | |
| UV transparent microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3635 | |
| Vortex | IKA, Staufen, Germany | Genius 3 | |
| Zetasizer | Malvern Instrument, Worcestershire, UK | Nano ZS | |
| Zetasizer Software version 7.11 | DLS software | ||
| Micro Modulyo | Thermo Fisher | 230 | Freeze drying system |
Referencias
- Haley, B., Frenkel, E. Nanoparticles for drug delivery in cancer treatment. Urol. Oncol. 26 (1), 57-64 (2008).
- Sun, T., Zhang, Y. S., Pang, B., Hyun, D. C., Yang, M., Xia, Y. Engineered nanoparticles for drug delivery in cancer therapy. Angew. Chem. Int. Ed. 53 (46), 12320-12364 (2014).
- Davis, M. E., Chen, Z. G., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nat. Rev. Drug Discov. 7 (9), 771-782 (2008).
- Sheridan, C. Proof of concept for next-generation nanoparticle drugs in humans. Nature Biotechnol. 30 (6), 471-473 (2012).
- Matsumura, Y., Hitoshi, M. A New Concept for Macromolecular Therapeutics in Cancer Chemotherapy: Mechanism of Tumoritropic Accumulation of Proteins and the Antitumor Agent Smancs. Cancer Res. 46, 6387 (1986).
- De Duve, C., De Barsy, T., Poole, B., Trouet, A., Tulkens, P., Van Hoof, F. Lysosomotropic agents. Biochem. Pharmacol. 23 (18), 2495-2531 (1974).
- Duncan, R., Richardson, S. C. W. Endocytosis and intracellular trafficking as gateways for nanomedicine delivery: opportunities and challenges. Mol. Pharm. 9 (9), 2380-2402 (2012).
- Vishakha, K., Kishor, B., Sudha, R. Natural Polymers - A Comprehensive Review. Int. J. Pharm. Biomed. Res. 3 (4), 1597-1613 (2012).
- Pritchard, E. M., Kaplan, D. L. Silk fibroin biomaterials for controlled release drug delivery. Expert. Opin. Drug Del. 8 (6), 797-811 (2011).
- Thurber, A. E., Omenetto, F. G., Kaplan, D. L. In vivo bioresponses to silk proteins. Biomaterials. 71, 145-157 (2015).
- Pritchard, E. M., Dennis, P. B., Omenetto, F., Naik, R. R., Kaplan, D. L. Physical and chemical aspects of stabilization of compounds in silk. Biopolymers. 97 (6), 479-498 (2012).
- Seib, F. P., Pritchard, E. M., Kaplan, D. L. Self-Assembling Doxorubicin Silk Hydrogels for the Focal Treatment of Primary Breast. Adv. Funct. Mater. 23 (1), 58-65 (2013).
- Seib, F. P., Kaplan, D. L. Doxorubicin-loaded silk films: drug-silk interactions and in vivo performance in human orthotopic breast cancer. Biomaterials. 33 (33), 8442-8450 (2012).
- Seib, F. P., Coburn, J., et al. Focal therapy of neuroblastoma using silk films to deliver kinase and chemotherapeutic agents in vivo. Acta. Biomater. 20, 32-38 (2015).
- Coburn, J. M., Na, E., Kaplan, D. L. Modulation of vincristine and doxorubicin binding and release from silk films. J. Control. Release. 220, 229-238 (2015).
- Seib, F. P., Jones, G. T., Rnjak-Kovacina, J., Lin, Y., Kaplan, D. L. pH-dependent anticancer drug release from silk nanoparticles. Adv. Healthc. Mater. 2 (12), 1606-1611 (2013).
- Wongpinyochit, T., Uhlmann, P., Urquhart, A. J., Seib, F. P. PEGylated Silk Nanoparticles for Anticancer Drug Delivery. Biomacromolecules. 16 (11), 3712-3722 (2015).
- Seib, F. P., Kaplan, D. L. Silk for Drug Delivery Applications: Opportunities and Challenges. Isr. J. Chem. 53 (9-10), 1-12 (2013).
- Yucel, T., Lovett, M. L., Kaplan, D. L. Silk-based biomaterials for sustained drug delivery. J. Control. Release. 190, 381-397 (2014).
- Wang, X., Yucel, T., Lu, Q., Hu, X., Kaplan, D. L. Silk nanospheres and microspheres from silk/pva blend films for drug delivery. Biomaterials. 31 (6), 1025-1035 (2010).
- Qu, J., Wang, L., Hu, Y., You, R., Li, M. Preparation of Silk Fibroin Microspheres and Its Cytocompatibility. J. Biomater. Nanobiotechnol. 4, 84-90 (2013).
- Lammel, A., Hu, X., Park, S., Kaplan, D., Scheibel, T. Controlling silk fibroin particle features for drug delivery. Biomaterials. 31 (16), 4583-4591 (2010).
- Gupta, V., Aseh, A., Rìos, C. N., Aggarwal, B. B., Mathur, A. B. Fabrication and characterization of silk fibroin-derived curcumin nanoparticles for cancer therapy. Int. J. Nanomedicine. 4, 115-122 (2009).
- Zhao, Z., et al. Generation of silk fibroin nanoparticles via solution-enhanced dispersion by supercritical CO2. Ind. Eng. Chem. Res. 52 (10), 3752-3761 (2013).
- Tudora, M., Zaharia, C., Stancu, I. Natural silk Fibroin micro-and nanoparticles with potential uses in drug delivery systems. U.P.B. Sci. Bull., Series B. 75 (1), 43-52 (2013).
- Zhao, Z., Li, Y., Xie, M. B. Silk Fibroin-Based Nanoparticles for Drug Delivery. Int. J. Mol. Sci. 16 (3), 4880-4903 (2015).
- Rockwood, D., Preda, R., Yücel, T. Materials fabrication from Bombyx mori silk fibroin. Nat. Protoc. 6 (10), 1-43 (2011).
- Seib, F. P., Müller, K., Franke, M., Grimmer, M., Bornhäuser, M., Werner, C. Engineered extracellular matrices modulate the expression profile and feeder properties of bone marrow-derived human multipotent mesenchymal stromal cells. Tissue. Eng. Part A. 15 (10), 3161-3171 (2009).
- Lai, P., Daear, W., Löbenberg, R., Prenner, E. J. Overview of the preparation of organic polymeric nanoparticles for drug delivery based on gelatine, chitosan, poly(d,l-lactide-co-glycolic acid) and polyalkylcyanoacrylate. Colloids Surf., B, Biointerfaces. 118, 154-163 (2014).
- Subia, B., Kundu, S. C. Drug loading and release on tumor cells using silk fibroin-albumin nanoparticles as carriers. Nanotechnology. 24 (3), 035103 (2013).
- Zhang, Y. Q., Shen, W. D., Xiang, R. L., Zhuge, L. J., Gao, W. J., Wang, W. B. Formation of silk fibroin nanoparticles in water-miscible organic solvent and their characterization. J. Nanopart. Res. 9 (5), 885-900 (2006).
- Jin, H. J., Kaplan, D. L. Mechanism of silk processing in insects and spiders. Nature. 424 (6952), 1057-1061 (2003).
- Yhr Bae, ., Park, K. Targeted drug delivery to tumors: myths, reality and possibility. J. Control. Release. 153 (3), 198-205 (2011).
- Lammel, A., Schwab, M., Hofer, M., Winter, G., Scheibel, T. Recombinant spider silk particles as drug delivery vehicles. Biomaterials. 32 (8), 2233-2240 (2011).
- Holliday, D. L., Speirs, V. Choosing the right cell line for breast cancer research. Breast. Cancer. Res. 13, 215 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados