Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung und Drug-Delivery-Anwendungen von Silk Nanopartikel
In diesem Artikel
Zusammenfassung
Nanopartikel sind, sich als viel versprechende Wirkstoffabgabesysteme für ein breites Spektrum von Indikationen. Hier beschreiben wir eine einfache , aber leistungsfähige Methode Seide Nanopartikel mit Reverse Engineering Bombyx mori Seide herzustellen. Diese Seide Nanopartikel können leicht mit einem therapeutischen Nutzlast beladen werden und anschließend für Drug-Delivery-Anwendungen untersucht.
Zusammenfassung
Seide ist ein vielversprechender Biopolymer für biomedizinische und pharmazeutische Anwendungen aufgrund ihrer hervorragenden mechanischen Eigenschaften, Biokompatibilität und biologische Abbaubarkeit sowie ihre Fähigkeit zu schützen und anschließend freizugeben seine Nutzlast in Antwort auf ein Trigger. Während Seide kann in verschiedenen Materialformaten formuliert werden, Seide Nanopartikel sind, sich als viel versprechende Wirkstoffabgabesysteme. Daher deckt dieser Artikel die Verfahren für Reverse-Engineering-Seidenkokons eine regenerierte Seiden Lösung zu erhalten, die verwendet werden können, stabile Seide Nanopartikel zu erzeugen. Diese Nanopartikel werden anschließend charakterisiert, Wirkstoff beladen und als potenzielle Anti-Krebs-Arzneimittel-Abgabesystem erforscht. Kurz gesagt, Seide Kokons ersten Rückwärts durch Seide Auflösung von degumming die Kokons, gefolgt entwickelt und reinigen, um eine wässrige Lösung Seide zu erhalten. Als nächstes wird die regenerierte Seiden Lösung Nanopräzipitation zogen Seide Nanopartikel zu erhalten - eine einfache, aber leistungsfähige Methodedass erzeugt einheitliche Nanopartikel. Die Seiden Nanopartikel zeichnen sich dadurch nach ihrer Größe, das Zetapotenzial, die Morphologie und Stabilität in wässrigen Medien, sowie ihre Fähigkeit, ein chemotherapeutisches Nutzlast und töten menschlichen Brustkrebszellen einzuschließen. Insgesamt ergibt die beschriebene Methodik einheitliche Seiden Nanopartikel, die leicht für eine Vielzahl von Anwendungen untersucht werden können, einschließlich ihrer Verwendung als potentielles Nano.
Einleitung
Nano-Größe Drug-Delivery-Systeme werden oft verwendet, Wirkstofffreisetzung zu steuern und eine vielfältige Reihe von therapeutischen Nutzlasten zu liefern - zum Beispiel Proteine, Peptide und kleine Molekulargewicht Drogen - Zellen und Gewebe zu zielen. Diese therapeutischen Nutzlasten werden oft in verschiedene makromolekulares Arzneimittelträger eingearbeitet, wie Liposome, wasserlösliche Polymere (einschließlich Dendrimere) und Mikro- und Nanopartikel 1. Nanopartikel ( in der Regel in einem Größenbereich von 1 nm bis 1000 nm) werden als potenzielle Wirkstoffträger weit erforscht, vor allem für Anti - Krebs - Medikamentenabgabe 2. Die erfolgreiche Einführung von Abraxane (120 nm großen Albumin-basierte Nanopartikel mit Paclitaxel beladen) in der klinischen Routine 3 hat das Feld katalysiert, so dass noch viele weitere Nanopartikel für Drug Delivery jetzt betreten klinischen Studien 4. Solide Tumoren zeigen in der Regel schlechte Lymphdrainage und haben undichte Blutgefäße, was bedeutet, dass nanoparticles von bis zu 200 nm passiv zu diesen Tumoren nach intravenöser Verabreichung gezielt werden. Dieses passive Targeting Phänomen ist die erhöhte Permeabilität und Retention (EPR) Effekt genannt und wurde erstmals 1986 5 angegeben. Der EPR - Effekt zu einer 50- bis 100-fache Erhöhung der Arzneimittelkonzentrationen im Tumor - Mikroumgebung für eine bestimmte Medikamentendosis führen kann , wenn die Droge Nutzlast ist ein hochmolekulares Wirkstoffträger-Ansatz, anstatt die freie Arzneimittel ohne Träger geliefert. Drug beladene Nanopartikel für Anti - Krebs - Medikamentenabgabe entwickelt haben den Tumor - Mikroumgebung zu erreichen und oft muss eine bestimmte intrazelluläre Kompartiment, in der Regel durch endocytic Aufnahme eingeben, für das Medikament seine gewünschten therapeutischen Effekt 3 zu erzielen. Nanopartikel die für intrazelluläre Arzneimittelabgabe auszunutzen Endozytose als Gateway in die Zelle als auch einen Weg Arzneimittelresistenzmechanismen zu überwinden. Die Wirkstofffreisetzung von Nanopartikeln wird häufig speziell entwickelt, um oCCur in Lysosomen (dh lysosomotropes Arzneimittelabgabe) 6 , wobei der pH - Wert Ansprechverhalten des Nanopartikel - Träger (lysosomalen pH ca. 4,5) als Auslöser für die Wirkstofffreisetzung oder lysosomale Enzyme, die die Nutzlast von dem Träger 7 befreien dienen kann.
Viele unterschiedliche Klassen von Materialien können verwendet werden Nanopartikel zu erzeugen (beispielsweise Metallen und vielen organischen und anorganischen Materialien). Allerdings Biopolymere sind , sich als attraktive Materialien aufgrund ihrer bekannten Biokompatibilität, die biologische Abbaubarkeit und geringe Toxizität 8. Viele Biopolymere werden erforscht, einschließlich Albumin, Alginat, Chitosan und Seide. Von diesen Seide hat sich als vielversprechende Anwärter für die Entwicklung in Systeme 9 Arzneimittelabgabe entstanden. Seiden verschiedener Typen werden durch eine Anzahl von Arthropoden hergestellt, einschließlich Spinnen (zB Nephila clavipes) und Seidenraupen (zB Bombyx mori). Silkworm Seide wird weit mehr exten verwendetlich als Spinnenseide, weil die Seidenraupe ist vollständig domestiziert und seine Seide stellt somit ein reproduzierbares Ausgangsmaterial. Silkworm Seide ist ein Food and Drug Administration (FDA) genehmigt Material für den menschlichen Gebrauch, insbesondere als Nahtmaterial; es verfügt über eine robuste Sicherheitsstandard bei Menschen und bekannt ist , 10 in vivo abzubauen. Der Abbauprofil von Seide kann fein abgestimmt werden von Stunden (niedrige kristalline Seide) zu 12 Monaten oder mehr (hohe kristalline Seide) zu reichen. Seidenabbauprodukte nicht toxisch sind und in dem Körper 10 metabolisiert. Die Seide Struktur verleiht die Fähigkeit , 11 kleine molekulare Verbindungen und hochmolekularen Proteinwirkstoffen zu binden, ist es ein gutes Material für die kontrollierte Wirkstofffreisetzung zu machen. Protein Medikamente (zB Antikörper) sind anfällig für Denaturierung, Aggregation, proteolytische Spaltung und Clearance durch das Immunsystem. Allerdings Seide stabilisiert therapeutische Proteine aufgrund der Pufferkapazität seiner nanokristallinem WiederRegionen und ihre Fähigkeit , Wassergehalt im Nanobereich 11 anzupassen. Diese einzigartigen Eigenschaften bieten physischen Schutz und reduzieren Nutzlast Mobilität 11 und sind in der Regel nicht mit anderen (Bio-) Polymeren gesehen. Viele Antikrebsarzneimittelabgabesysteme, zum Beispiel Seidenbasis Hydrogelen 12, Folien 13-15 und Nanopartikel 16,17 haben nun diese Funktionen (besprochen in Referenzen 18,19) zu nutzen , entwickelt
Hier Seide Nanopartikel wurden durch Bestimmung ihrer Größe und Ladung über einen längeren Zeitrahmen aus. Doxorubicin, eine klinisch relevante Anti-Krebs-Medikament, wurde als Modell Medikament zur Wirkstoffbeladung und Zytotoxizitätsuntersuchungen in triple negativen menschlichen Brustkrebszellen mit Wirkstoff beladenen Nanopartikel Seide behandelt verwendet.
Protokoll
1. Herstellung eines Reverse-Engineering Silk - Lösung von Bombyx mori Cocoons
HINWEIS: Diese Methode basiert auf Protokolle an anderer Stelle 12,27 beschrieben.
- Schneiden 5 g getrocknetes Kokons mit einer Schere in 5 mm x 5 mm große Stücke. Entfernen Sie alle verschmutzte Schichten.
- Man wiegt 4,24 g Natriumcarbonat und fügen Sie diese sorgfältig zu 2 l destilliertem Wasser kocht.
HINWEIS: Dies ergibt eine 0,02 M Natriumcarbonat-Lösung. - Fügen Sie die geschnittenen Kokon Stücke zum Kochen Natriumcarbonatlösung und kochen für 60 min die Seidenfasern zu DEGUM. Rühren Sie die Seide gelegentlich homogene Probenverarbeitung zu gewährleisten.
- Entfernen Sie die entschleimt Seide und waschen mit 1 l destilliertem Wasser für 20 min; Wiederholung der Waschstufe mindestens 3 mal.
- Entfernen Sie die gewaschener Seide und drücken Sie es gut um überschüssige Flüssigkeit zu entfernen, und dann lösen / ziehen die Seide von Hand. Legen Sie die ungebundene Seide in einem Abzug über Nacht trocknen an der Luft. Dies ergibt typischerweise 3,6 g entschleimt silk Fasern.
- Am nächsten Tag wiegen 5 g luftgetrocknete entschleimt Seidenfasern und packen die Seide fest in den Boden eines 50 ml-Becher.
- Eine frische 9,3 M LiBr-Lösung. Man löst die Seidenfasern in LiBr mit einer 1 g Seide bis 4 ml LiBr-Verhältnis. Decken Sie die Seide LiBr Probe mit Aluminiumfolie Verdunstung verhindern und damit die Seide zu lösen vollständig bei 60 ° C. Dieser Schritt dauert 4 Stunden und wird von gelegentlichem Rühren unterstützt.
- Benetzen eine Dialysekassette (Molekulargewicht cut-off von 3.500 Da) in Wasser für 5 min. Injizieren Sie 15 ml der Seide LiBr-Lösung in die 15 ml Dialysekassette und die Verwendung einer Nadel und Spritze Luftblasen zu entfernen.
- Dialysieren gegen 1 l destilliertes Wasser und das Wasser wechseln bei 1, 3 und 6 Stunden (dh 3 Änderungen am ersten Tag) und wieder am nächsten Morgen und am Abend (dh 2 Änderungen am zweiten Tag) und wieder am nächsten Morgen (dh 1 Änderung am dritten Tag).
- Sammeln Sie die Seide solutiauf von der Dialysekassette und Zentrifuge die Lösung 20 min bei 5 ° C bei 9.500 x g. Gewinnen Sie den Überstand und wiederholen Sie diesen Zentrifugierprozesses zweimal.
- Bestimmen Sie das Gewicht eines leeren Wiegeschiffchen (W1) und 1 ml der Seiden Lösung. Nehmen Sie das Gewicht wieder (W2) und dann die Probe trocken durch das Wiegeschiffchen bei 60 ºC über Nacht verlassen. Als nächstes wird das gesamte Trockengewicht (W3) (getrocknet Seide und Wiegeschiffchen) bestimmen. Die Konzentration der Seidenlösung (w / v) beträgt:% = (W3-W1 / W2-W1) x 100.
2. Herstellung von Seide Nanopartikel aus Reverse-Engineering Silk-Lösung
- Fügen eine 5% (w / v) Seiden Lösung tropfenweise zu Aceton während eine> 75% aufrechterhalten (v / v) Acetonlösung. Beispielsweise fügen 9 ml einer 5% (w / v) Seiden Lösung tropfenweise (10 & mgr; l / Drop mit einer Geschwindigkeit von 50 Tropfen / min) auf 34 ml Aceton.
- Zentrifugieren der Niederschlag bei 48.000 xg für 2 h bei 4 ° C.
- Den Überstand aspirieren und resuspendieren pellet in destilliertem Wasser, indem man zuerst das Pellet mit einem Spatel Verdrängen und dann Zugabe von 20 ml destilliertem Wasser. Verwenden Sie Pipettenspitzen des Pellets aus dem Spachtel zu entfernen. Nach Vortexen für 20 Sekunden durch zwei Beschallungszyklen gefolgt für eine Ultraschallsonde bei 30% Amplitude unter Verwendung von 30 sec, oben das Zentrifugenröhrchen, um die Kapazität mit destilliertem Wasser.
- Wiederholen Sie die Zentrifugation und Resuspension Schritt mindestens zweimal.
- Das Pellet in 6 ml destilliertem Wasser, wie bei 4 ° C bis zur Verwendung in 2.3 und speichern beschrieben. Für Zellkulturstudien, Seide Nanopartikel Aktien können Gamma sein 17 bestrahlt.
3. Bestimmung der Silk Nanoparticle Concentration
- Zentrifuge Seiden Nanopartikel bei 48.000 xg für 2 h bei 4 ° C.
- Sammle alle Nanopartikel in 3 ml destilliertem Wasser, gefolgt von zwei Beschallungszyklen bei 30% Amplitude für 30 sec.
- Teilen Sie die 3 ml Lager aus Seide Nanopartikel in 2 ml und 1 ml-Portionen und Transfer in prE-wog 2-ml-Röhrchen. Notieren Sie die Gesamtgewicht der 2 ml Probe. Bewahren Sie die 1 ml Menge bei 4 ° C bis zur Verwendung; Diese 1 ml-Probe wird verwendet, um eine Kalibrierungskurve zu erzeugen.
- Schnellfrost und dann lyophilisieren die 2 ml Seide Nanopartikel Menge in einem Gefriertrockner über Nacht. Nach Gefriertrocknung, reweigh die 2-ml-Röhrchen und berechnen die Menge an Seide Nanopartikel (mg), die ursprünglich in der 2-ml-Probe war.
- Verdünnen Sie die 1 ml Seide Nanopartikel Lager mit destilliertem Wasser zu erzeugen, einen 5-Punkt-Kalibrierungskurve (0,04-7 mg / ml). Stellen Sie sicher, dass die Proben nicht das Absorptionsmaximum überschreiten.
- Bestimmen Sie die Absorption jeder Standardverdünnung bei 600 nm. Dies wird am besten mit einem 96-Well-Platte-Setup. Plot der Absorption gegen die Konzentration (mg / ml) für die Standardkurve. Dann verwenden Sie diese Standardkurve routinemäßig die Konzentration von Seide Nanopartikel in Suspensionen zu bestimmen.
4. Herstellung von Doxorubicin-beladenen Nanopartikeln Silk
- Vorbereitung der Doxorubicin-Lösung
- Man löst 1,2 mg Doxorubicin HCl in 8 ml destilliertem Wasser.
- Machen Sie bis zu 10 ml mit destilliertem Wasser ein Arbeits Bestand von 116 ug / ml zu erhalten (0,2 mmol / ml).
- Herstellung von Doxorubicin-beladenen Nanopartikeln Silk
- Mix 2 ml von 0,2 & mgr; mol / ml Doxorubicin-Lösung mit 200 & mgr; l von 10, 30 oder 50 mg / ml von Seiden Nanopartikel in einem 2 ml Röhrchen.
- Inkubieren Sie die Seide-Doxorubicin Suspension bei Raumtemperatur (25 ° C) über Nacht auf einem Rotationsmischer.
- Als nächstes Zentrifuge die Seide-Doxorubicin Suspension bei 194.000 × g für 30 min. Waschen Sie die Doxorubicin beladenen Nanopartikel Seide mit destilliertem Wasser und wiederholen Sie den Vorgang noch zweimal.
- Pool den Überstand und beachten Sie das Gesamtvolumen (in diesem Beispiel verwendet wird, um die Verkapselungswirksamkeit zu bestimmen).
- Resuspendieren der Doxorubicin beladenen Nanopartikel Seide in destilliertem Wasser, vor Licht schützen und lagern bei 4 ° C until Einsatz.
- Bestimmung der Encapsulation Efficiency and Drug Loading
- Jeweils 200 & mgr; l des Überstandes aus Schritt 4.2.4 in einer schwarzen Mikrotiterplatte.
- Verwenden Sie ein Fluoreszenz-Mikroplattenlese Doxorubicin-assoziierte Fluoreszenz bei einer festen Photomultiplier Einstellung zu messen.
- Stellen Sie die Anregungswellenlänge auf 485 nm und die Emissionswellenlänge auf 590 nm und die Fluoreszenzwerte aufzuzeichnen.
- Generieren Sie eine Doxorubicin Kalibrierungskurve. Sicherzustellen Messungen sind mit gleichen Instrumenteneinstellungen erfasst (dh mit einer festen Photomultiplier - Einstellung). Unter Verwendung der Kalibrierungskurve, die Berechnung der Doxorubicin-Konzentration in der kombinierten Überstand. Wiederholen Sie diese Messung in drei unabhängigen Experimenten.
- Verwenden der Gleichung (1) Einkapselungseffizienz zu bestimmen:
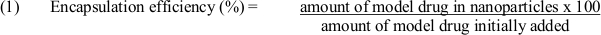
5. Charakterisierung von Silk NanoTeilchen
- Beurteilung der Größe und Zeta-Potential von frisch hergestellt und gelagert Silk Nanopartikel.
- Store Seiden Nanopartikel in destilliertem Wasser bei 4 ° C und 25 ° C.
- Messen Sie die Größe und Zeta-Potential der Seide Nanopartikel an den Tagen 0, 14 und 28 unter Verwendung der dynamischen Lichtstreuung (DLS). Stellen Brechungsindizes auf 1,33 für destilliertes Wasser und 1,60 für Protein 17. Berechnen Partikelgrößen mit der Benutzeroberfläche Software.
- Morphologische Bewertung der Silk-Nanopartikeln durch Rasterelektronenmikroskopie (SEM).
- Legen Sie eine Kohlenstoff Haftscheibe auf eine SEM-Stub und befestigen Sie anschließend einen Siliziumwafer.
- Verdünnte Seiden Nanopartikel bis zu einer Konzentration von 1 mg / ml. Je 10 ul der Probe auf einen Siliziumwafer, gefrieren die Probe bei -80 ° C und über Nacht lyophilisieren eine Gefriertrocknungssystem gemäß den Anweisungen des Herstellers.
- Bestreichen Sie die Probe mit einer Goldschicht von bis zu 20 nm dickmit einem niedrigen Vakuum-Sputter-Beschichtungsvorrichtung.
HINWEIS: Die Einstellungen des Geräts variieren zwischen den Modellen. Das Modell hier verwendet wird, ist voll automatisiert und arbeitet nur mit der Dicke. - Bildproben mit einem Rasterelektronenmikroskop bei 5 kV und einer 40.000-fachen Vergrößerung.
6. In - vitro - Zytotoxizität von Kontrolle und-Doxorubicin beladen Silk Nanopartikel
- Die Lebensfähigkeit der Zellen nach Exposition mit Silk Nanopartikel.
- Kultur MDA-MB-231-Zellen in RPMI 1640 mit 10% v / v FBS. Platten Zellen auf Gewebskultur - Polystyrol behandelt und bei 37 ° C in einem befeuchteten 5% CO 2 -Atmosphäre inkubiert. alle 2-3 Tage Subkultur Routinemäßig bei 80% Konfluenz.
- Platte MDA-MB-231 - Zellen in einer Dichte von 2 x 10 4 Zellen / cm 2 in 96-Well - Platten. Lassen Sie die Zellen über Nacht zu erholen.
- In (i) 0,001 bis 1 & mgr; g frei diffusionsfähig Doxorubicin, (ii) von 0,001 bis 0,5 mg Seide Nanopartikel und 0,1 mg Seide Nanopartikelbeladen mit 0,001 bis 1 & mgr; g Doxorubicin in 96-Well-Platten (Endvolumen 100 ul pro Vertiefung).
- Bestimmen , die Lebensfähigkeit der Zellen und die halbmaximale inhibitorische Konzentration (IC 50) durch Zugabe von (3- (4,5-Dimethylthiazol-2-yl) -2,5-diphenyltetrazoliumbromid (MTT von 5 mg / ml in PBS) bei 72 h. Inkubieren 5 Stunden, abtropfen lassen Sie sorgfältig die Vertiefungen mit einer Pipette und die Formazan mit 100 ul Dimethylsulfoxid aufzulösen. die Absorption bei 560 nm messen. diese Messung in drei unabhängigen Experimenten wiederholen.
HINWEIS: Die Absorptionswerte von unbehandelten Kontrollen dienen als Referenzwert für 100% der Lebensfähigkeit der Zellen.
- SEM von Zellen Exposed Silk Nanopartikel.
- Seed MDA-MB-231 Zellen auf sterilen Glasdeckgläschen in einer Dichte von 2 x 10 4 Zellen / cm 2. Lassen Sie die Zellen über Nacht zu erholen. Belichten der Zellen zu den gewünschten Behandlungsbedingungen für 72 Stunden.
- Fixieren die Zellen mit 2% v / v Glutaraldehyd in PBS für 30 min, wasche mit digestillt Wasser zweimal, dehydrieren mit einer Ethanol - Serie und kritischen Punkt die Proben trocknen, wie an anderer Stelle 28 ausführlich beschrieben.
- Sputter-Beschichtung der Proben mit einer Goldschicht von bis zu 20 nm Dicke mit einem niedrigen Vakuum-Sputter-Beschichtungsvorrichtung.
HINWEIS: Die Einstellungen des Geräts variieren zwischen den Modellen. Das Modell hier verwendet wird, ist voll automatisiert und arbeitet nur mit der Dicke. - Bild die Proben durch SEM eine Elektronenbeschleunigung von 5 kV und 700-facher Vergrößerung verwendet wird.
Ergebnisse
Die Daten wurden statistisch als detailliert zuvor 17 analysiert. Die t-Test nach Student wurde für die Probenpaare und Einwegvarianzanalyse (ANOVA), gefolgt von Bonferroni-Mehrfachvergleichs post-hoc-Test für mehrere Proben verwendet. Ein Sternchen bezeichnet eine statistische Signifikanz wie folgt: * P <0,05 und ** p <0,001. Alle Daten sind als Mittelwerte ± Standardabweichung (SD) und die Zahlen in Klammern geben die Anzahl der unabhängigen Experimenten dargestell...
Diskussion
Verschiedene Methoden stehen zur Verfügung Seide Nanopartikel zu erzeugen, einschließlich Polyvinylalkohol 20 Mischen, Spray 21 Trocknen, Aussalzen 22, Kapillare microdot 23 Druck, überkritischem CO 2 Fällung 24 und Nanopräzipitation 16,25 ( zusammengefasst in Bezug 26). Allerdings Nanopräzipitation aufgrund seiner Gesamt Einfachheit ist die beliebteste Technik für Seide Nanopartikel zu erzeugen. Daher war das Ziel dieser Stud...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This research was supported by a Marie Curie FP7 Career Integration Grant 334134 within the seventh European Union Framework Program.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetone | VWR International, Radnor, PA, USA | 20066.33 | |
| Automated Critical Point Dryer | Leica Microsystems, Wetzlar, Germany | EM CPD300 | |
| Balancing | Mettler Toledo, Greifensee, Switzerland | NewClassic MS | |
| Black polystyrene microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3991 | |
| Capillary cell (DTS 1070) | Malvern Instrument, Worcestershire, UK | DTS107 | |
| Carbon adhesive disc | Agar Scientific, Essex, UK | G3347N | |
| Centrifuge | Hermle Labortechnik, Wehingen, Germany | Z323K | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Avanti J-E, Rotor: J20 | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Optima L-70K, Rotor: 50.2 Ti, Adaptor 303392 | |
| Coater, low vacuum | Leica Microsystems, Wetzlar, Germany | EM ACE200 | |
| Cuvettes, polystyrene, disposable | Fisher Scientific, Waltham, MA, USA | FB55147 | |
| Doxorubixin | LC Laboratories, Boston, MA, USA | D4000 | |
| Electronic pipetting, Easypet | Eppendorf, Hamburg, Germany | N/A | |
| FE-SEM | Hitachi High-Technologies, Krefeld, Germany | SU6600 | |
| Fetal Bovine Serum | Thermo Scientific, Waltham, MA, USA | 16000-044 | |
| Freeze dryer | Martin Christ, Osterode, Germany | Epsilon 2-4 | |
| Heat inactivated Bombyx mori silk cocoons | Tajima Shoji, Kanagawa, Japan | N/A | |
| Hotplate with Stirrer | Bibby Scientific, Stanffordshire, UK | US 152 | |
| Incubator | Memmert, Schwabach, Germany | INB 200 | |
| Insulin, human recombinant, zinc solution | Thermo Scientific, Waltham, MA, USA | 12585-014 | |
| Lithium bromide | Acros Organics, Geel, Belgium | AC199870025 | |
| MDA-MB-231 | ATCC, Manassas, VA, U.S.A | N/A | |
| Micropipette and tips | Eppendorf, Hamburg, Germany | N/A | |
| Microplate Reader | Molecular devices, Sunnyvale, CA, USA | SpectraMax M5 | |
| Oak Ridge High-Speed Centrifuge Tubes, 50 ml | Thermo Scientific, Waltham, MA, USA | N/A | |
| Open-Top Thickwall Polycarbonate tube, 4 ml | Beckman Coulter, Brea, CA, USA | 355645 | |
| Penicilin/streptomycin | Thermo Scientific, Waltham, MA, USA | 15140-122 | |
| RPMI medium | Thermo Scientific, Waltham, MA, USA | 11875-093 | |
| Serological pipettes, 5 ml | Sigma-Aldrich, St. Louis, MO, USA | ||
| Silicon wafers | Agar Scientific, Essex, UK | G3391 | |
| Slide-A-Lyzer Dialysis cassettes, 3.5K MWCO, 15 ml | Thermo Scientific, Waltham, MA, USA | 87724 | |
| Sodium carbonate anhydrous | Fisher Scientific, Waltham, MA, USA | S/2840/62 | |
| Specimen stubs for SEM | Agar Scientific, Essex, UK | G301 | |
| Ultrasonic homogenizer | Bandelin, Berlin, Germany | Sonoplus HD 2070 | |
| UV transparent microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3635 | |
| Vortex | IKA, Staufen, Germany | Genius 3 | |
| Zetasizer | Malvern Instrument, Worcestershire, UK | Nano ZS | |
| Zetasizer Software version 7.11 | DLS software | ||
| Micro Modulyo | Thermo Fisher | 230 | Freeze drying system |
Referenzen
- Haley, B., Frenkel, E. Nanoparticles for drug delivery in cancer treatment. Urol. Oncol. 26 (1), 57-64 (2008).
- Sun, T., Zhang, Y. S., Pang, B., Hyun, D. C., Yang, M., Xia, Y. Engineered nanoparticles for drug delivery in cancer therapy. Angew. Chem. Int. Ed. 53 (46), 12320-12364 (2014).
- Davis, M. E., Chen, Z. G., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nat. Rev. Drug Discov. 7 (9), 771-782 (2008).
- Sheridan, C. Proof of concept for next-generation nanoparticle drugs in humans. Nature Biotechnol. 30 (6), 471-473 (2012).
- Matsumura, Y., Hitoshi, M. A New Concept for Macromolecular Therapeutics in Cancer Chemotherapy: Mechanism of Tumoritropic Accumulation of Proteins and the Antitumor Agent Smancs. Cancer Res. 46, 6387 (1986).
- De Duve, C., De Barsy, T., Poole, B., Trouet, A., Tulkens, P., Van Hoof, F. Lysosomotropic agents. Biochem. Pharmacol. 23 (18), 2495-2531 (1974).
- Duncan, R., Richardson, S. C. W. Endocytosis and intracellular trafficking as gateways for nanomedicine delivery: opportunities and challenges. Mol. Pharm. 9 (9), 2380-2402 (2012).
- Vishakha, K., Kishor, B., Sudha, R. Natural Polymers - A Comprehensive Review. Int. J. Pharm. Biomed. Res. 3 (4), 1597-1613 (2012).
- Pritchard, E. M., Kaplan, D. L. Silk fibroin biomaterials for controlled release drug delivery. Expert. Opin. Drug Del. 8 (6), 797-811 (2011).
- Thurber, A. E., Omenetto, F. G., Kaplan, D. L. In vivo bioresponses to silk proteins. Biomaterials. 71, 145-157 (2015).
- Pritchard, E. M., Dennis, P. B., Omenetto, F., Naik, R. R., Kaplan, D. L. Physical and chemical aspects of stabilization of compounds in silk. Biopolymers. 97 (6), 479-498 (2012).
- Seib, F. P., Pritchard, E. M., Kaplan, D. L. Self-Assembling Doxorubicin Silk Hydrogels for the Focal Treatment of Primary Breast. Adv. Funct. Mater. 23 (1), 58-65 (2013).
- Seib, F. P., Kaplan, D. L. Doxorubicin-loaded silk films: drug-silk interactions and in vivo performance in human orthotopic breast cancer. Biomaterials. 33 (33), 8442-8450 (2012).
- Seib, F. P., Coburn, J., et al. Focal therapy of neuroblastoma using silk films to deliver kinase and chemotherapeutic agents in vivo. Acta. Biomater. 20, 32-38 (2015).
- Coburn, J. M., Na, E., Kaplan, D. L. Modulation of vincristine and doxorubicin binding and release from silk films. J. Control. Release. 220, 229-238 (2015).
- Seib, F. P., Jones, G. T., Rnjak-Kovacina, J., Lin, Y., Kaplan, D. L. pH-dependent anticancer drug release from silk nanoparticles. Adv. Healthc. Mater. 2 (12), 1606-1611 (2013).
- Wongpinyochit, T., Uhlmann, P., Urquhart, A. J., Seib, F. P. PEGylated Silk Nanoparticles for Anticancer Drug Delivery. Biomacromolecules. 16 (11), 3712-3722 (2015).
- Seib, F. P., Kaplan, D. L. Silk for Drug Delivery Applications: Opportunities and Challenges. Isr. J. Chem. 53 (9-10), 1-12 (2013).
- Yucel, T., Lovett, M. L., Kaplan, D. L. Silk-based biomaterials for sustained drug delivery. J. Control. Release. 190, 381-397 (2014).
- Wang, X., Yucel, T., Lu, Q., Hu, X., Kaplan, D. L. Silk nanospheres and microspheres from silk/pva blend films for drug delivery. Biomaterials. 31 (6), 1025-1035 (2010).
- Qu, J., Wang, L., Hu, Y., You, R., Li, M. Preparation of Silk Fibroin Microspheres and Its Cytocompatibility. J. Biomater. Nanobiotechnol. 4, 84-90 (2013).
- Lammel, A., Hu, X., Park, S., Kaplan, D., Scheibel, T. Controlling silk fibroin particle features for drug delivery. Biomaterials. 31 (16), 4583-4591 (2010).
- Gupta, V., Aseh, A., Rìos, C. N., Aggarwal, B. B., Mathur, A. B. Fabrication and characterization of silk fibroin-derived curcumin nanoparticles for cancer therapy. Int. J. Nanomedicine. 4, 115-122 (2009).
- Zhao, Z., et al. Generation of silk fibroin nanoparticles via solution-enhanced dispersion by supercritical CO2. Ind. Eng. Chem. Res. 52 (10), 3752-3761 (2013).
- Tudora, M., Zaharia, C., Stancu, I. Natural silk Fibroin micro-and nanoparticles with potential uses in drug delivery systems. U.P.B. Sci. Bull., Series B. 75 (1), 43-52 (2013).
- Zhao, Z., Li, Y., Xie, M. B. Silk Fibroin-Based Nanoparticles for Drug Delivery. Int. J. Mol. Sci. 16 (3), 4880-4903 (2015).
- Rockwood, D., Preda, R., Yücel, T. Materials fabrication from Bombyx mori silk fibroin. Nat. Protoc. 6 (10), 1-43 (2011).
- Seib, F. P., Müller, K., Franke, M., Grimmer, M., Bornhäuser, M., Werner, C. Engineered extracellular matrices modulate the expression profile and feeder properties of bone marrow-derived human multipotent mesenchymal stromal cells. Tissue. Eng. Part A. 15 (10), 3161-3171 (2009).
- Lai, P., Daear, W., Löbenberg, R., Prenner, E. J. Overview of the preparation of organic polymeric nanoparticles for drug delivery based on gelatine, chitosan, poly(d,l-lactide-co-glycolic acid) and polyalkylcyanoacrylate. Colloids Surf., B, Biointerfaces. 118, 154-163 (2014).
- Subia, B., Kundu, S. C. Drug loading and release on tumor cells using silk fibroin-albumin nanoparticles as carriers. Nanotechnology. 24 (3), 035103 (2013).
- Zhang, Y. Q., Shen, W. D., Xiang, R. L., Zhuge, L. J., Gao, W. J., Wang, W. B. Formation of silk fibroin nanoparticles in water-miscible organic solvent and their characterization. J. Nanopart. Res. 9 (5), 885-900 (2006).
- Jin, H. J., Kaplan, D. L. Mechanism of silk processing in insects and spiders. Nature. 424 (6952), 1057-1061 (2003).
- Yhr Bae, ., Park, K. Targeted drug delivery to tumors: myths, reality and possibility. J. Control. Release. 153 (3), 198-205 (2011).
- Lammel, A., Schwab, M., Hofer, M., Winter, G., Scheibel, T. Recombinant spider silk particles as drug delivery vehicles. Biomaterials. 32 (8), 2233-2240 (2011).
- Holliday, D. L., Speirs, V. Choosing the right cell line for breast cancer research. Breast. Cancer. Res. 13, 215 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten