Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Производство и поставка снадобья Применение шелкового наночастицами
В этой статье
Резюме
Наночастицы появляются в качестве перспективных систем доставки лекарственных средств для широкого спектра показаний. Здесь мы опишем простой , но мощный способ изготовления наночастиц из шелка с использованием обратной инженерии тутовый шелкопряд шелк. Эти шелковые наночастицы могут быть легко загружены с терапевтическим полезной нагрузки, а затем исследовали для применения доставки лекарств.
Аннотация
Шелк является перспективным биополимер для биомедицинских и фармацевтических применений из-за его выдающиеся механические свойства, биосовместимость и биодеградация, а также его способность защищать и впоследствии освободить свою полезную нагрузку в ответ на спусковой крючок. В то время как шелк может быть приготовлена в различных форматах материалов, наночастицы шелка появляются в качестве перспективных систем доставки лекарств. Поэтому в данной статье рассматриваются процедуры обратного инженерного коконов с получением регенерированного шелкового раствора, который можно использовать для создания стабильных наночастиц шелка. Эти наночастицы характеризуются впоследствии, наполненные лекарством, и исследовали в качестве потенциальной системы противоопухолевый доставки лекарственного средства. Вкратце, шелковые коконы обратной инженерии сначала дегуммирования коконов, а затем шелковой растворения и очистки, с получением водного раствора, шелка. Затем регенерированный шелк раствор подвергают nanoprecipitation с получением наночастиц шелка - это простой, но мощный методчто создает однородные наночастицы. Шелковые наночастицы характеризуются в соответствии с их размером, зета-потенциал, морфологии и стабильности в водной среде, а также их способность запутать полезной нагрузки химиотерапевтического и убить клетки рака молочной железы человека. В целом, описанная методика дает однородные наночастицы шелка, которые могут быть легко разведанные для множества приложений, в том числе их использование в качестве потенциального наномедицины.
Введение
Наноразмерные системы доставки лекарственных средств часто используются для контроля высвобождения лекарственного средства и доставлять разнообразный набор терапевтических полезных нагрузок - например, белки, пептиды и малых препаратов молекулярного веса - в клетки-мишени и ткани. Эти терапевтические полезные нагрузки часто включены в различные макромолекулярных носителей лекарственных средств, таких как липосомы, водорастворимые полимеры ( в том числе и дендримеров), а также микро- и наночастицы 1. Наночастицы ( которые, как правило , в диапазоне размеров от 1 нм до 1000 нм) , которые в настоящее время широко исследованы в качестве потенциальных носителей лекарственных средств, в частности , для противораковой доставки лекарственных средств 2. Успешное внедрение Abraxane (120 нм наночастицы размером альбумина на основе загружен с паклитакселом) в повседневную клиническую практику 3 стало катализатором поле, так что многие другие наночастицы для доставки лекарственных средств в настоящее время вступают клинические испытания 4. Солидные опухоли обычно показывают плохое лимфатический дренаж и имеют протекающие кровеносные сосуды, что означает, что пanoparticles до 200 нм будет пассивно направлены на этих опухолей после внутривенного введения. Это пассивное явление называется нацеливание Улучшенную проницаемость и удерживающую способность (ЭПР) и был впервые описан в 1986 году 5. ЭПР эффект может привести к 50- до 100-кратного увеличения концентрации препарата в опухоли микроокружения для данной дозы препарата при полезная нагрузка препарат поставляется с использованием макромолекулярную подход носителя лекарственного средства, а не свободное лекарственное средство без носителя. Лекарственное наночастицы загруженным , предназначенные для противораковой доставки лекарственного средства должны достичь микросреды опухоли и часто должны ввести определенный внутриклеточный отделение, как правило , путем эндоцитоза поглощения, для лекарственного средства для достижения ее желаемого терапевтического эффекта 3. Наночастицы, предназначенные для внутриклеточной доставки лекарственного вещества используют эндоцитоз в качестве шлюза в клетку, а также пути преодоления механизмов лекарственной устойчивости. Высвобождение лекарственного средства из наночастиц часто специально разработан для оCCur в лизосомах (т.е. лизосомотропный доставки лекарственного средства) 6 , где рН отзывчивость носителя наночастицами (лизосомальная рН примерно 4,5) может служить триггером для высвобождения лекарственного средства или лизосомальных ферментов, выделяющих полезную нагрузку от носителя 7.
Много различных классов материалов , могут быть использованы для создания наночастиц (например, металлов и целого ряда органических и неорганических материалов). Тем не менее, биополимеры появляются как привлекательные материалы из - за их известной биосовместимости, биоразлагаемости и низкой токсичностью 8. Многие биополимеры в настоящее время изучаются, в том числе альбумин, альгинат, хитозан и шелка. Из них, шелк стала перспективным претендентом на развитие в системах доставки лекарственных средств 9. Шелка различных типов производятся несколькими членистоногих, включая пауков (например, Nephila clavipes) и шелкопрядов (например, тутовый шелкопряд). Шелкопряд шелк используется гораздо больше EXTENключительно, чем шелка паука, потому что шелкопряд полностью одомашнены и, таким образом, его шелк представляет собой воспроизводимое исходный материал. Шелкопряд шелк является Пищевых продуктов и медикаментов (FDA) одобрило материал для использования человеком, в частности, в качестве шовного материала; он имеет надежную показатели безопасности в организме человека и , как известно, разлагаются в естественных условиях 10. Профиль деградации из шелка может быть доработаны в диапазоне от нескольких часов (низкий кристаллический шелк) до 12 месяцев или более (высокий кристаллический шелк). Шелковые продукты разложения являются нетоксичными и метаболизируются в организме 10. Шелк структура придает способность связывать небольшие соединения молекулярной массой и макромолекулярных препаратов 11 белка, что делает его хорошим материалом для контролируемого высвобождения лекарственного средства. Белковые препараты (например, антитела) , чувствительны к денатурации, агрегации, протеолитическое расщепление и клиренса иммунной системы. Тем не менее, шелк стабилизирует терапевтические протеины из-за буферной способности его нанокристаллической регионов и его способность адаптировать содержание воды на наноуровне 11. Эти уникальные особенности обеспечивают физическую защиту и уменьшить полезную нагрузку мобильности 11 и , как правило , не видели с другими (био) полимеров. Многие системы доставки противоракового лекарственного средства, например шелка на основе гидрогелей 12, пленки 13-15 и наночастиц 16,17, в настоящее время разработаны , чтобы использовать эти функции (обзор в ссылках 18,19)
Здесь наночастицы шелка были охарактеризованы путем определения их размера и заряда в течение длительного периода времени. Доксорубицин, клинически значимый противораковое лекарственное средство, использовали в качестве модельного лекарственного средства для загрузки лекарственного средства и цитотоксичности исследований в тройном отрицательных клеток рака молочной железы человека, обработанных наночастиц шелковых наркотиков загруженным.
протокол
1. Получение обратной инженерии шелкового решение от тутовый шелкопряд Коконы
Примечание: Данная методика основана на протоколах , описанных в других 12,27.
- Отрежьте 5 г сухих коконов с ножницами на 5 мм х 5 мм штук. Удалите все загрязненные слои.
- Взвешивают 4,24 г карбоната натрия и добавить осторожно к 2 л кипящей дистиллированной воды.
Примечание: В результате получается раствор карбоната натрия 0,02 М. - Добавьте нарезанные кокон кусочки в кипящий раствор карбоната натрия и кипятят в течение 60 мин до DEGUM шелковые волокна. Перемешать шелк иногда, чтобы обеспечить однородную обработку образца.
- Удалите Degummed шелк и промывают 1 л дистиллированной воды в течение 20 мин; повторить стадию промывки по меньшей мере, 3 раза.
- Удалите промытого шелк и отожмите ее, чтобы удалить лишнюю жидкость, а затем развязать / тянуть шелк вручную. Поместите РАЗВЯЗАЛ шелк в вытяжном шкафу, чтобы высохнуть на воздухе в течение ночи. Как правило, это дает 3,6 г Degummed сИЛК волокна.
- На следующий день, отвешивают 5 г высушенных на воздухе Degummed шелковые волокна и упаковать шелк плотно в дно стакана емкостью 50 мл.
- Приготовить свежий раствор 9,3 М LiBr. Растворите шелковые волокна в LiBr с использованием 1 г шелка соотношении 4 мл LiBr. Накройте образец шелка LiBr с алюминиевой фольгой для предотвращения испарения и позволить шелка до полного растворения при 60 ° C. Этот шаг занимает до 4 часов и помогали периодически перемешивая.
- Влажный диализной кассеты (молекулярная масса отсечки 3500 Da) в воде в течение 5 мин. Вводят 15 мл шелк LiBr раствор в диализной кассеты 15 мл и с помощью иглы и шприца, чтобы удалить пузырьки воздуха.
- Диализировать против 1 л дистиллированной воды и менять воду на 1, 3 и 6 часов (то есть, 3 изменения в первый день) и снова на следующее утро и вечером (то есть, 2 меняется на второй день), и снова на следующее утро (то есть, 1 смена на третий день).
- Соберите шелковые Solutiна из диализной кассеты и центрифугировать раствор в течение 20 мин при температуре 5 ° C при 9,500 х г. Восстановление супернатант и повторите этот процесс центрифугирования в два раза больше.
- Определите вес пустого взвешенную лодочку (W1) и добавьте 1 мл раствора шелка. Запишите вес снова (W2), а затем высушить образец, оставив лодку весом при 60 ° С в течение ночи. Затем определяют общий сухой вес (W3) (высушенный шелк и весом лодки). Концентрация шелкового раствора (вес / объем) составляет:% = (W3-W1 / W2-W1) х 100.
2. Получение шелкового наночастицами от обратного проектирования шелкового решения
- Добавление 5% (вес / объем) по каплям раствор шелка в ацетоне при сохранении> 75% (об / об) раствора ацетона. Например, можно добавить 9 мл 5% -ного (вес / объем) по каплям раствор шелка (10 мкл / капли со скоростью 50 капель / мин) до 34 мл ацетона.
- Центрифуга осадок при 48000 х г в течение 2 часов при температуре 4 ° С.
- Аспирируйте супернатант и ресуспендируют Pelleт в дистиллированной воде, сначала выбивании осадок с помощью шпателя, а затем добавлением 20 мл дистиллированной воды. Используйте пипетку советы для удаления осадка из шпателем. После того, как встряхиванием в течение 20 секунд с последующими двумя циклами обработки ультразвуком с использованием ультразвукового зонда при амплитуде 30% в течение 30 сек, доливают центрифугу трубку к емкости с дистиллированной водой.
- Повторите центрифугирования и ресуспендирования шаг, по крайней мере в два раза.
- Ресуспендируют осадок в 6 мл дистиллированной воды, как указано в 2.3, и хранят при температуре 4 ° С до использования. Для исследования клеточных культур, шелковые запасы наночастиц может быть гамма - излучением 17.
3. Определение концентрации шелкового наночастиц
- Наночастицы шелковые центрифуге при 48000 х г в течение 2 ч при 4 ° С.
- Соберите все наночастицы в 3 мл дистиллированной воды, а затем два цикла обработки ультразвуком при амплитуде 30% в течение 30 сек.
- Разделите запас наночастиц шелка 3 мл на 2 мл и 1 мл много и передачи в пре-взвешивают 2 мл пробирки. Регистрируют общий вес образца 2 мл. Хранить много 1 мл при 4 ° С до использования; это 1 мл образца будет использоваться для создания калибровочной кривой.
- Мгновенного замораживания, а затем лиофилизацией 2 мл шелка наночастицами много в сублимационной сушилке в течение ночи. После сушки вымораживанием, МЛ повторное взвешивание трубки 2 и рассчитать количество наночастиц шелка (мг), который был первоначально присутствует в образце 2 мл.
- Развести 1 мл шелковое наночастицами запас дистиллированной водой для создания 5-балльной калибровочной кривой (0.04-7 мг / мл). Убедитесь в том, что образцы не превышают максимальную оптическую плотность.
- Определить оптическую плотность каждого стандартного разведения при 600 нм. Это лучше всего сделать с помощью 96-луночного установки плиты. Участок поглощения в зависимости от концентрации (мг / мл) для стандартной кривой. Затем с помощью стандартной кривой обычно для определения концентрации наночастиц шелка в суспензии.
4. Подготовка Доксорубицин-нагруженной шелкового наночастицами
- Приготовление раствора доксорубицина
- Растворить 1,2 мг доксорубицина HCl в 8 мл дистиллированной воды.
- Изготавливают до 10 мл дистиллированной воды, чтобы получить рабочий запас 116 мкг / мл (0,2 мкмоль / мл).
- Получение Доксорубицин-нагруженной шелкового наночастицами
- Смешайте 2 мл 0,2 мкмоль / мл доксорубицина раствора с 200 мкл 10, 30 или 50 мг / мл наночастиц шелка в 2 мл пробирку.
- Выдержите шелка-доксорубицин суспензии при комнатной температуре (25 ° С) в течение ночи на миксере.
- Далее, центрифугирование шелковую-доксорубицин суспензии при 194000 х г в течение 30 мин. Вымойте доксорубицин загружены шелковые наночастицы с дистиллированной водой и повторите эту процедуру еще два раза.
- Бассейн супернатант и отмечают общий объем (в этом примере используется для определения эффективности инкапсулирования).
- Ресуспендируют доксорубицин загружены шелковые наночастицы в дистиллированной воде, защищенном от света и хранить при температуре 4 ºC ипсезам использования.
- Определение Encapsulation эффективности и наркомании Загрузка
- Пипеткой 200 мкл надосадочной жидкости со стадии 4.2.4 в черную планшет для микротитрования.
- С помощью флуоресцентного микропланшет-ридера для измерения доксорубицин-ассоциированной флуоресценции при установке фиксированной ФЭУ.
- Установите длину волны возбуждения 485 нм и длине волны излучения 590 нм и записать значения флуоресценции.
- Генерация калибровочной кривой доксорубицин. Обеспечение измерения приобретаются с одинаковыми параметрами прибора (т.е. с фиксированной настройкой ФЭУ). По калибровочной кривой, вычислить концентрацию доксорубицина в комбинированном супернатанта. Повторите это измерение в трех независимых экспериментах.
- С помощью уравнения (1) для определения эффективности инкапсулирования:
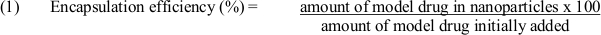
5. Характеристика шелкового Nanoчастицы
- Оценка размера и дзета-потенциал свежеприготовленную и сохраняемого шелкового наночастицами.
- шелковые наночастицы Хранить в дистиллированной воде при температуре 4 ° С и 25 ° C.
- Измерьте размер и дзета-потенциал шелковых наночастиц в дни 0, 14 и 28 с использованием динамического рассеяния света (DLS). Установить показатели преломления 1,33 для дистиллированной воды и 1,60 для белка 17. Расчет размеров частиц с помощью программного обеспечения пользовательского интерфейса.
- Морфологическое Оценка шелковых наночастицами методом сканирующей электронной микроскопии (СЭМ).
- Поместите клейкую углерода диск на заглушке в РЭМ, а затем присоединить кремниевую пластину.
- Развести наночастицы шелка до концентрации 1 мг / мл. Внесите 10 мкл образца на кремниевой подложке, замерзают образца при температуре -80 ° С и лиофилизации в течение ночи с использованием системы для сублимационной сушки в соответствии с инструкциями изготовителя.
- Покрыть образец с золотой слой толщиной до 20 нмс использованием низкого вакуума дл покрыти распылением.
Примечание: Настройки прибора зависит от модели. Используемая здесь модель полностью автоматизирована и работает только толщиной. - Образцы изображений с помощью сканирующего электронного микроскопа при 5 кВ и увеличении в 40000 раз.
6. В Vitro цитотоксичности управления и доксорубицин-нагруженной шелкового наночастицами
- Жизнеспособность клеток после воздействия шелкового наночастицами.
- Культура клеток MDA-MB-231 в среде RPMI 1640 с добавлением 10% об / об FBS. Пластина клеток на культуре ткани обрабатывают полистирол и инкубировать в увлажненной 5% CO 2 атмосферы при температуре 37 ° С. Субкультуры в плановом порядке 80% слияния каждые 2-3 дня.
- Пластина клеток MDA-MB-231 при плотности 2 х 10 4 клеток / см 2 в 96-луночных планшетах. Разрешить клеткам восстановиться в течение ночи.
- Добавить (I) 0,001-1 мкг свободно диффундирующего доксорубицина, (II) 0,001-0,5 мг наночастиц шелка и 0,1 мг шелка наночастицызагружен с 0,001-1 мкг доксорубицина в 96-луночные планшеты (конечный объем 100 мкл на лунку).
- Определение жизнеспособности клеток и половину максимальной ингибирующей концентрации (IC 50) путем добавления (3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолийбромид (МТТ 5 мг / мл в PBS) в 72 ч. Инкубируйте в течение 5 часов, осторожно слейте лунки пипеткой и растворить формазана 100 мкл диметилсульфоксида. Измерьте оптическую плотность при 560 нм. Повторите это измерение в трех независимых экспериментах.
Примечание: Значения оптической плотности необработанных контрольных служат в качестве опорного значения для 100% жизнеспособности клеток.
- СЭМ клетках, подвергнутых шелкового наночастицами.
- Семенной клетки MDA-MB-231 на стерильные покровные стекла при плотности 2 × 10 4 клеток / см 2. Разрешить клеткам восстановиться в течение ночи. Защиту клетки к желаемому условий обработки в течение 72 ч.
- Закрепить клеток с 2% об / об глутаральдегида в PBS в течение 30 мин, промывают диуспокоены воды дважды, обезвоживают с серией этанола, и критическая точка высушить образцы, как подробно описано в другом месте 28.
- Sputter пальто образцы с золотой слой до 20 нм толщиной с использованием низкого вакуума для нанесения покрытий распылением.
Примечание: Настройки прибора зависит от модели. Используемая здесь модель полностью автоматизирована и работает только толщиной. - Изображение образцы помощью сканирующего электронного микроскопа с использованием электронного ускорения 5 кВ и увеличение 700-кратное.
Результаты
Данные были статистически проанализированы , как описано ранее 17. Т-тест Стьюдента используется для пар проб и один дисперсионный анализ (ANOVA) с последующим многоуровневым сравнением Бонферрони постфактум тест для нескольких образцов. Звездочка обозначает стат...
Обсуждение
Существуют различные методы для получения наночастиц из шелка, в том числе поливинилового спирта смешивания 20, распылительная сушка 21, высаливания 22, капиллярный MicroDot печати 23 сверхкритического СО 2 осадков 24 и nanoprecipitation 16,25 (обзор в ссылке 26)....
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This research was supported by a Marie Curie FP7 Career Integration Grant 334134 within the seventh European Union Framework Program.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetone | VWR International, Radnor, PA, USA | 20066.33 | |
| Automated Critical Point Dryer | Leica Microsystems, Wetzlar, Germany | EM CPD300 | |
| Balancing | Mettler Toledo, Greifensee, Switzerland | NewClassic MS | |
| Black polystyrene microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3991 | |
| Capillary cell (DTS 1070) | Malvern Instrument, Worcestershire, UK | DTS107 | |
| Carbon adhesive disc | Agar Scientific, Essex, UK | G3347N | |
| Centrifuge | Hermle Labortechnik, Wehingen, Germany | Z323K | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Avanti J-E, Rotor: J20 | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Optima L-70K, Rotor: 50.2 Ti, Adaptor 303392 | |
| Coater, low vacuum | Leica Microsystems, Wetzlar, Germany | EM ACE200 | |
| Cuvettes, polystyrene, disposable | Fisher Scientific, Waltham, MA, USA | FB55147 | |
| Doxorubixin | LC Laboratories, Boston, MA, USA | D4000 | |
| Electronic pipetting, Easypet | Eppendorf, Hamburg, Germany | N/A | |
| FE-SEM | Hitachi High-Technologies, Krefeld, Germany | SU6600 | |
| Fetal Bovine Serum | Thermo Scientific, Waltham, MA, USA | 16000-044 | |
| Freeze dryer | Martin Christ, Osterode, Germany | Epsilon 2-4 | |
| Heat inactivated Bombyx mori silk cocoons | Tajima Shoji, Kanagawa, Japan | N/A | |
| Hotplate with Stirrer | Bibby Scientific, Stanffordshire, UK | US 152 | |
| Incubator | Memmert, Schwabach, Germany | INB 200 | |
| Insulin, human recombinant, zinc solution | Thermo Scientific, Waltham, MA, USA | 12585-014 | |
| Lithium bromide | Acros Organics, Geel, Belgium | AC199870025 | |
| MDA-MB-231 | ATCC, Manassas, VA, U.S.A | N/A | |
| Micropipette and tips | Eppendorf, Hamburg, Germany | N/A | |
| Microplate Reader | Molecular devices, Sunnyvale, CA, USA | SpectraMax M5 | |
| Oak Ridge High-Speed Centrifuge Tubes, 50 ml | Thermo Scientific, Waltham, MA, USA | N/A | |
| Open-Top Thickwall Polycarbonate tube, 4 ml | Beckman Coulter, Brea, CA, USA | 355645 | |
| Penicilin/streptomycin | Thermo Scientific, Waltham, MA, USA | 15140-122 | |
| RPMI medium | Thermo Scientific, Waltham, MA, USA | 11875-093 | |
| Serological pipettes, 5 ml | Sigma-Aldrich, St. Louis, MO, USA | ||
| Silicon wafers | Agar Scientific, Essex, UK | G3391 | |
| Slide-A-Lyzer Dialysis cassettes, 3.5K MWCO, 15 ml | Thermo Scientific, Waltham, MA, USA | 87724 | |
| Sodium carbonate anhydrous | Fisher Scientific, Waltham, MA, USA | S/2840/62 | |
| Specimen stubs for SEM | Agar Scientific, Essex, UK | G301 | |
| Ultrasonic homogenizer | Bandelin, Berlin, Germany | Sonoplus HD 2070 | |
| UV transparent microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3635 | |
| Vortex | IKA, Staufen, Germany | Genius 3 | |
| Zetasizer | Malvern Instrument, Worcestershire, UK | Nano ZS | |
| Zetasizer Software version 7.11 | DLS software | ||
| Micro Modulyo | Thermo Fisher | 230 | Freeze drying system |
Ссылки
- Haley, B., Frenkel, E. Nanoparticles for drug delivery in cancer treatment. Urol. Oncol. 26 (1), 57-64 (2008).
- Sun, T., Zhang, Y. S., Pang, B., Hyun, D. C., Yang, M., Xia, Y. Engineered nanoparticles for drug delivery in cancer therapy. Angew. Chem. Int. Ed. 53 (46), 12320-12364 (2014).
- Davis, M. E., Chen, Z. G., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nat. Rev. Drug Discov. 7 (9), 771-782 (2008).
- Sheridan, C. Proof of concept for next-generation nanoparticle drugs in humans. Nature Biotechnol. 30 (6), 471-473 (2012).
- Matsumura, Y., Hitoshi, M. A New Concept for Macromolecular Therapeutics in Cancer Chemotherapy: Mechanism of Tumoritropic Accumulation of Proteins and the Antitumor Agent Smancs. Cancer Res. 46, 6387 (1986).
- De Duve, C., De Barsy, T., Poole, B., Trouet, A., Tulkens, P., Van Hoof, F. Lysosomotropic agents. Biochem. Pharmacol. 23 (18), 2495-2531 (1974).
- Duncan, R., Richardson, S. C. W. Endocytosis and intracellular trafficking as gateways for nanomedicine delivery: opportunities and challenges. Mol. Pharm. 9 (9), 2380-2402 (2012).
- Vishakha, K., Kishor, B., Sudha, R. Natural Polymers - A Comprehensive Review. Int. J. Pharm. Biomed. Res. 3 (4), 1597-1613 (2012).
- Pritchard, E. M., Kaplan, D. L. Silk fibroin biomaterials for controlled release drug delivery. Expert. Opin. Drug Del. 8 (6), 797-811 (2011).
- Thurber, A. E., Omenetto, F. G., Kaplan, D. L. In vivo bioresponses to silk proteins. Biomaterials. 71, 145-157 (2015).
- Pritchard, E. M., Dennis, P. B., Omenetto, F., Naik, R. R., Kaplan, D. L. Physical and chemical aspects of stabilization of compounds in silk. Biopolymers. 97 (6), 479-498 (2012).
- Seib, F. P., Pritchard, E. M., Kaplan, D. L. Self-Assembling Doxorubicin Silk Hydrogels for the Focal Treatment of Primary Breast. Adv. Funct. Mater. 23 (1), 58-65 (2013).
- Seib, F. P., Kaplan, D. L. Doxorubicin-loaded silk films: drug-silk interactions and in vivo performance in human orthotopic breast cancer. Biomaterials. 33 (33), 8442-8450 (2012).
- Seib, F. P., Coburn, J., et al. Focal therapy of neuroblastoma using silk films to deliver kinase and chemotherapeutic agents in vivo. Acta. Biomater. 20, 32-38 (2015).
- Coburn, J. M., Na, E., Kaplan, D. L. Modulation of vincristine and doxorubicin binding and release from silk films. J. Control. Release. 220, 229-238 (2015).
- Seib, F. P., Jones, G. T., Rnjak-Kovacina, J., Lin, Y., Kaplan, D. L. pH-dependent anticancer drug release from silk nanoparticles. Adv. Healthc. Mater. 2 (12), 1606-1611 (2013).
- Wongpinyochit, T., Uhlmann, P., Urquhart, A. J., Seib, F. P. PEGylated Silk Nanoparticles for Anticancer Drug Delivery. Biomacromolecules. 16 (11), 3712-3722 (2015).
- Seib, F. P., Kaplan, D. L. Silk for Drug Delivery Applications: Opportunities and Challenges. Isr. J. Chem. 53 (9-10), 1-12 (2013).
- Yucel, T., Lovett, M. L., Kaplan, D. L. Silk-based biomaterials for sustained drug delivery. J. Control. Release. 190, 381-397 (2014).
- Wang, X., Yucel, T., Lu, Q., Hu, X., Kaplan, D. L. Silk nanospheres and microspheres from silk/pva blend films for drug delivery. Biomaterials. 31 (6), 1025-1035 (2010).
- Qu, J., Wang, L., Hu, Y., You, R., Li, M. Preparation of Silk Fibroin Microspheres and Its Cytocompatibility. J. Biomater. Nanobiotechnol. 4, 84-90 (2013).
- Lammel, A., Hu, X., Park, S., Kaplan, D., Scheibel, T. Controlling silk fibroin particle features for drug delivery. Biomaterials. 31 (16), 4583-4591 (2010).
- Gupta, V., Aseh, A., Rìos, C. N., Aggarwal, B. B., Mathur, A. B. Fabrication and characterization of silk fibroin-derived curcumin nanoparticles for cancer therapy. Int. J. Nanomedicine. 4, 115-122 (2009).
- Zhao, Z., et al. Generation of silk fibroin nanoparticles via solution-enhanced dispersion by supercritical CO2. Ind. Eng. Chem. Res. 52 (10), 3752-3761 (2013).
- Tudora, M., Zaharia, C., Stancu, I. Natural silk Fibroin micro-and nanoparticles with potential uses in drug delivery systems. U.P.B. Sci. Bull., Series B. 75 (1), 43-52 (2013).
- Zhao, Z., Li, Y., Xie, M. B. Silk Fibroin-Based Nanoparticles for Drug Delivery. Int. J. Mol. Sci. 16 (3), 4880-4903 (2015).
- Rockwood, D., Preda, R., Yücel, T. Materials fabrication from Bombyx mori silk fibroin. Nat. Protoc. 6 (10), 1-43 (2011).
- Seib, F. P., Müller, K., Franke, M., Grimmer, M., Bornhäuser, M., Werner, C. Engineered extracellular matrices modulate the expression profile and feeder properties of bone marrow-derived human multipotent mesenchymal stromal cells. Tissue. Eng. Part A. 15 (10), 3161-3171 (2009).
- Lai, P., Daear, W., Löbenberg, R., Prenner, E. J. Overview of the preparation of organic polymeric nanoparticles for drug delivery based on gelatine, chitosan, poly(d,l-lactide-co-glycolic acid) and polyalkylcyanoacrylate. Colloids Surf., B, Biointerfaces. 118, 154-163 (2014).
- Subia, B., Kundu, S. C. Drug loading and release on tumor cells using silk fibroin-albumin nanoparticles as carriers. Nanotechnology. 24 (3), 035103 (2013).
- Zhang, Y. Q., Shen, W. D., Xiang, R. L., Zhuge, L. J., Gao, W. J., Wang, W. B. Formation of silk fibroin nanoparticles in water-miscible organic solvent and their characterization. J. Nanopart. Res. 9 (5), 885-900 (2006).
- Jin, H. J., Kaplan, D. L. Mechanism of silk processing in insects and spiders. Nature. 424 (6952), 1057-1061 (2003).
- Yhr Bae, ., Park, K. Targeted drug delivery to tumors: myths, reality and possibility. J. Control. Release. 153 (3), 198-205 (2011).
- Lammel, A., Schwab, M., Hofer, M., Winter, G., Scheibel, T. Recombinant spider silk particles as drug delivery vehicles. Biomaterials. 32 (8), 2233-2240 (2011).
- Holliday, D. L., Speirs, V. Choosing the right cell line for breast cancer research. Breast. Cancer. Res. 13, 215 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены