É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Fabricação e entrega da droga Aplicações de seda Nanopartículas
Neste Artigo
Resumo
As nanopartículas são emergente sistemas de entrega de drogas como promissores para uma variedade de indicações. Aqui, descrevemos um método simples, mas poderosa para a fabricação de nanopartículas de seda usando engenharia reversa de seda Bombyx mori. Estas nanopartículas de seda pode ser facilmente carregado com uma carga útil terapêutica e subsequentemente exploradas para aplicações de entrega de drogas.
Resumo
A seda é um biopolímero promissora para aplicações biomédicas e farmacêuticas, devido à sua excelentes propriedades mecânicas, biocompatibilidade e biodegradabilidade, bem como a sua capacidade para proteger e, subsequentemente, libertar a sua carga em resposta a um gatilho. Enquanto seda podem ser formulados em vários formatos de materiais, as nanopartículas de seda estão a emergir como sistemas de entrega de drogas promissoras. Portanto, este artigo descreve os procedimentos para casulos de seda engenharia inversa para produzir uma solução de seda regenerada que pode ser usado para gerar nanopartículas de seda estáveis. Estas nanopartículas são posteriormente caracterizado, carregadas com droga e explorado como uma potencial sistema de administração de fármaco anticancerígeno. Resumidamente, casulos de seda são engenharia reversa pela primeira vez por degumming os casulos, seguido por dissolução de seda e limpar, para produzir uma solução aquosa de seda. Em seguida, a solução de seda regenerada é submetido a nanoprecipitação para produzir nanopartículas de seda - Um método simples, mas poderosaque gera nanopartículas uniformes. As nanopartículas de seda são caracterizados de acordo com o seu tamanho, potencial zeta, a morfologia e estabilidade em meio aquoso, bem como a sua capacidade para reter uma carga quimioterapêutico e matar as células do cancro da mama humano. Em geral, a metodologia descrita produz nanopartículas de seda uniformes que possam ser facilmente exploradas por uma miríade de aplicações, incluindo a sua utilização como um potencial nanomedicina.
Introdução
sistemas de distribuição de drogas de tamanho nano são muitas vezes utilizados para controlar a libertação do fármaco e para entregar um conjunto diversificado de cargas úteis terapêuticas - por exemplo, proteínas, peptídeos e drogas pequenas peso molecular - para as células e tecidos alvo. Estas cargas terapêuticos são muitas vezes incorporados em vários veículos de fármacos macromoleculares, tais como lipossomas, polímeros solúveis em água (incluindo dendrímeros), e micro e nanopartículas 1. Nanopartículas (tipicamente em uma gama de tamanho de 1 nm a 1000 nm) estão a ser amplamente explorados como potenciais portadores de drogas, em particular para drogas anti-cancro de entrega 2. A introdução bem sucedida de Abraxane (120 nanopartículas à base de albumina porte nm carregado com paclitaxel) em prática clínica rotineira 3 catalisou o campo, de modo que muitos mais nanopartículas para entrega de drogas estão agora a entrar ensaios clínicos 4. tumores sólidos geralmente mostram a drenagem linfática pobres e têm vasos sanguíneos com vazamentos que significa que nanoparticles de até 200 nm vai ser passivamente voltado para esses tumores, após a administração intravenosa. Este fenómeno é chamado de segmentação passiva a permeabilidade aumentada e retenção de efeito (EPR) e foi relatada pela primeira vez em 1986 5. O efeito EPR pode levar a um aumento de 50 a 100 vezes nas concentrações de droga dentro do microambiente do tumor para uma determinada dose de droga quando a carga de fármaco é distribuído através de uma abordagem transportador droga macromolecular, em vez de o fármaco livre, sem o transportador. Nanoparticulas carregadas com fármaco desenhado para entrega de drogas anti-cancro tem que atingir o microambiente do tumor e, muitas vezes tem de inserir um compartimento intracelular específico, geralmente por captação endocítica, para a droga para alcançar o seu efeito terapêutico desejado 3. Nanopartículas concebidos para a distribuição de droga intracelular explorar endocitose como uma porta de entrada para dentro da célula, bem como uma via para superar os mecanismos de resistência a drogas. A libertação do fármaco a partir das nanopartículas é geralmente concebido especificamente para oCCur nos lisossomos (ou seja, a entrega de drogas lysosomotropic) 6, onde a capacidade de resposta pH da transportadora de nanopartículas (lisossômico pH aproximadamente 4,5) pode servir como gatilho para enzimas de libertação de droga ou lisossomais que liberam a carga do transportador 7.
Muitas classes diferentes de materiais podem ser usadas para gerar nanopartículas (por exemplo, metais e muitos materiais orgânicos e inorgânicos). No entanto, os biopolímeros estão surgindo materiais como atraente devido a sua biocompatibilidade conhecida, biodegradabilidade e baixa toxicidade 8. Muitos biopolímeros estão a ser exploradas, incluindo albumina, alginato, quitosano e seda. Destes, seda tem emergido como uma promissora para o desenvolvimento de sistemas de entrega de medicamentos 9. As sedas de vários tipos são produzidas por um número de artrópodes, incluindo por exemplo, aranhas (Nephila clavipes) e bicho da seda (Bombyx mori, por exemplo). silk-da-seda é usado muito mais extensivamente de seda de aranha porque o bicho está totalmente domesticada e sua seda representa, assim, um material de partida reprodutível. Silkworm seda é uma Food and Drug Administration (FDA) material aprovado para uso humano, particularmente como material de sutura; que tem um historial de segurança robusta em seres humanos e é conhecido para degradar in vivo 10. O perfil de degradação da seda podem ser ajustadas para variar de horas (baixo seda cristalina) para 12 meses ou mais (seda de alta cristalina). Produtos de degradação de seda não são tóxicos e são metabolizados no corpo 10. A estrutura de seda dá a capacidade de se ligar compostos de baixo peso molecular e drogas de proteína macromoleculares 11, tornando-se um bom material para liberação controlada de drogas. Fármacos de proteína (por exemplo, anticorpos) são susceptíveis à desnaturação, agregação, clivagem proteolítica e a depuração pelo sistema imunológico. No entanto, seda estabiliza proteínas terapêuticas, devido à capacidade tampão do seu nanocristalino reregiões e sua capacidade de adaptar conteúdo de água em nanoescala 11. Estas características únicas fornecer proteção física e reduzir a mobilidade de carga 11 e, normalmente, não são vistos com outros polímeros (bio). Muitos sistemas de entrega de drogas anticâncer, por exemplo hidrogéis à base de seda 12, filmes 13-15 e nanopartículas 16,17, agora foram desenvolvidos para explorar essas características (revisto em referências 18,19)
Aqui, as nanopartículas de seda foram caracterizados por determinação do seu tamanho e carga ao longo de um período de tempo prolongado. A doxorubicina, uma droga anti-cancro clinicamente relevante, foi utilizado como uma droga modelo para a carga de fármaco e citotoxicidade estudos em células de cancro da mama humano triplos negativos tratados com nanopartículas de seda carregadas com fármaco.
Protocolo
1. Preparação de uma solução de engenharia reversa de seda de Bombyx mori Casulos
NOTA: Esta metodologia é baseada em protocolos descritos em outros lugares 12,27.
- Corte 5 g de casulos secos com uma tesoura em 5 mm x 5 peças mm. Remova todas as camadas sujas.
- Pesar 4,24 g de carbonato de sódio e adicione cuidadosamente para 2 litros de água fervente destilada.
NOTA: Obteve-se uma solução de carbonato de sódio 0,02 M. - Adicione os pedaços de corte casulo para a solução de carbonato de sódio fervente e deixe ferver por 60 minutos para DEGUM as fibras de seda. Agita-se a seda ocasionalmente para assegurar o processamento da amostra homogénea.
- Remover a seda desgomif içado e lava-se com 1 L de água destilada durante 20 min; repetir o passo de lavagem, pelo menos, 3 vezes.
- Remova a seda lavada e apertá-lo bem para remover o excesso de líquido e depois desatar / puxe a seda à mão. Coloque a seda desatado em um exaustor para o ar seco durante a noite. Isto normalmente produz 3,6 g de s desengomadosfibras laia.
- No dia seguinte, pesam-se fibras de seda desgomif içado secas ao ar e 5 g embalar a seda firmemente no fundo de um copo de 50 ml.
- Prepare uma nova solução 9,3 M LiBr. Dissolve-se as fibras de seda no LiBr usando um 1 g de seda à relação de 4 mL de LiBr. Cobrir a amostra de LiBr de seda com uma folha de alumínio para evitar a evaporação e permitir que a seda para dissolver completamente a 60 ° C. Esta etapa pode demorar até 4 horas e é auxiliado por mexendo ocasionalmente.
- Molhar uma cassete de diálise (peso molecular de corte de 3500 Da) em água, durante 5 min. Injectar 15 mL da solução de LiBr seda na cassete de diálise 15 ml e usar uma agulha e seringa para remover quaisquer bolhas de ar.
- Dialisar contra 1 L de água destilada e alterar a água a 1, 3 e 6 h (isto é, 3 mudanças no primeiro dia) e novamente na manhã seguinte, e à noite (isto é, 2 mudanças no segundo dia) e, novamente, em na manhã seguinte (isto é, uma alteração no terceiro dia).
- Recolher os soluti sedasobre a partir da cassete de diálise e centrifugar a solução durante 20 min a 5 ° C a 9500 x g. Recuperar o sobrenadante e repetir este processo de centrifugação mais duas vezes.
- Determinar o peso de um barco de pesagem vazio (W1) e adicionar 1 ml da solução de seda. Grave o peso novamente (W2) e, em seguida, secar a amostra, deixando o barco pesa a 60 ºC durante a noite. Em seguida, determinar o peso total a seco (W3) (seda seca e pesando barco). A concentração da solução de seda (w / v) é:% = (W3-W1 / W2-W1) x 100.
2. Preparação de seda Nanopartículas de Solução de seda engenharia reversa
- Adicionar a 5% (w / v) de solução de seda gota a gota a acetona, mantendo a> 75% (v / v) de solução de acetona. Por exemplo, adicionar 9 ml de um 5% (w / v) gota a gota solução de seda (10 ul / gota a uma taxa de 50 gotas / min) a 34 ml de acetona.
- Centrifuga-se o precipitado a 48000 xg durante 2 hr a 4 ° C.
- Aspirar o sobrenadante e ressuspender o Pellet em água destilada pela primeira desalojar o sedimento com uma espátula e em seguida adição de 20 ml de água destilada. Utilizar pontas de pipeta para remover o sedimento a partir da espátula. Após vortex durante 20 seg seguido de dois ciclos de sonicação usando uma sonda de ultra-sons a 30% de amplitude durante 30 seg, topo-se o tubo de centrífuga de capacidade com água destilada.
- Repita o passo centrifugação e ressuspensão, pelo menos, duas vezes.
- Ressuspender o sedimento em 6 ml de água destilada, tal como descrito em 2.3 e armazenar a 4 ° C até à sua utilização. Para os estudos de cultura de células, os estoques de nanopartículas de seda pode ser irradiadas com raios gama 17.
3. Determinação da Seda nanopartículas Concentração
- nanopartículas de seda centrifugar a 48000 xg durante 2 hr a 4 ° C.
- Recolhe todas as nanopartículas em 3 ml de água destilada, seguido por dois ciclos de sonicação a 30% de amplitude durante 30 seg.
- Divida o stock 3 ml de nanopartículas de seda em 2 ml e 1 ml lotes e transferir para pre-pesava tubos de 2 ml. Registar o peso total da amostra de 2 ml. Armazenar a 1 ml de lote a 4 ° C até à sua utilização; esta amostra 1 mL serão utilizados para gerar uma curva de calibração.
- Pressão congelamento e, em seguida, liofilizar o lote 2 ml de nanopartículas de seda num secador por congelação durante a noite. Após liofilização, pesar de novo o tubo de 2 mL e calcular a quantidade de nanopartículas de seda (mg) que estava originalmente presente na amostra de 2 ml.
- Diluiu-se a 1 ml de caldo de nanopartículas de seda com água destilada, para gerar uma curva de calibração de 5 pontos (0,04-7 mg / ml). Garantir que as amostras não exceder a máxima absorção.
- Determinar a absorvância de cada diluição padrão a 600 nm. Isto é melhor realizado utilizando uma configuração de placa de 96 poços. Lote absorvância em função da concentração (mg / ml) para a curva padrão. Em seguida, use esta curva padrão rotineiramente para determinar a concentração de nanopartículas de seda em suspensões.
4. Preparação de nanopartículas de seda Doxorubicina-carregado
- Preparação da solução de doxorrubicina
- Dissolve-se 1,2 mg de cloridrato de doxorubicina em 8 ml de água destilada.
- Completar o volume até 10 ml com água destilada para se obter um estoque de trabalho de 116 ug / ml (0,2 mmol / mL).
- Preparação de nanopartículas de seda Doxorubicina-carregado
- Misturar 2 ml de 0,2 umol / ml de solução de doxorrubicina com 200 ul de 10, 30 ou 50 mg / ml de nanopartículas de seda num tubo de 2 mL.
- Incubar a suspensão de seda-doxorrubicina à temperatura ambiente (25 ° C) durante a noite num misturador rotativo.
- Em seguida, centrifugar a suspensão de seda-doxorrubicina em 194.000 xg durante 30 min. Lave as nanopartículas de seda carregada com doxorrubicina com água destilada e repetir este procedimento mais duas vezes.
- A piscina do sobrenadante e anotar o volume total (este exemplo é usado para determinar a eficiência de encapsulação).
- Volte a suspender as nanopartículas de seda carregada com doxorrubicina em água destilada, proteger da luz e armazenar a 4 ºC until uso.
- Determinação da eficiência de encapsulação e Carga de Droga
- Pipete 200 pi do sobrenadante a partir do passo 4.2.4 numa placa negra de microtitulação.
- Use um leitor de microplacas de fluorescência para medir a fluorescência associada à doxorrubicina em uma configuração photomultiplier fixa.
- Defina o comprimento de onda de excitação a 485 nm de comprimento e emissão a 590 nm e registar os valores de fluorescência.
- Gerar uma curva de calibração de doxorrubicina. Medidas garantem são adquiridos com configurações idênticas instrumento (ou seja, com uma configuração photomultiplier fixa). Usando a curva de calibração, calcular a concentração de doxorrubicina no sobrenadante combinados. Repita esta medição em três experimentos independentes.
- Use equação (1) para determinar a eficiência de encapsulação:
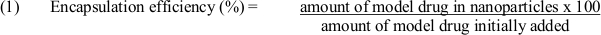
5. Caracterização de seda Nanopartículas
- Avaliação do tamanho e potencial zeta de recém-preparados e armazenados Nanopartículas de seda.
- nanopartículas de seda da loja em água destilada a 4 ° C e 25 ° C.
- Medir o tamanho e potencial zeta das nanopartículas de seda nos dias 0, 14 e 28 usando dispersão dinâmica de luz (DLS). Definir índices de refração para 1,33 em água destilada e 1,60 para a proteína 17. Calcule tamanhos de partículas com o software de interface do usuário.
- Avaliação morfológica de seda Nanopartículas por Microscopia Eletrônica de Varredura (MEV).
- Coloque um disco adesivo de carbono sobre um suporte de SEM e depois colocar uma pastilha de silício.
- Dilui-se nanopartículas de seda para uma concentração de 1 mg / ml. Pipetar 10 ul da amostra sobre uma bolacha de silício, congelar a amostra a -80 ° C e liofilizar durante a noite utilizando um sistema de secagem por congelação de acordo com as instruções do fabricante.
- Brasão da amostra com um ouro camada de até 20 nm de espessurautilizando um revestidor por crepitação baixo vácuo.
NOTA: As definições do aparelho variam entre os modelos. O modelo utilizado aqui é totalmente automatizado e opera em apenas espessura. - amostras de imagem com um microscópio eletrônico de varredura a 5 kV e uma ampliação de 40.000 vezes.
6. In Vitro A citotoxicidade de Controle e Doxorrubicina-carregado Nanopartículas Silk
- A viabilidade das células após exposição a seda nanopartículas.
- Culturas MDA-MB-231 células em RPMI 1640 com 10% v / v de FBS. As células na placa por cultura de tecidos de poliestireno tratada e incubar numa atmosfera humidificada de 5% de CO2 a 37 ° C. Rotineiramente subcultura a 80% de confluência a cada 2-3 dias.
- Placa células MDA-MB-231 a uma densidade de 2 x 10 4 células / cm2 em placas de 96 poços. Permitir que as células recuperar durante a noite.
- Adicionar (i) 0,001-1 ug doxorrubicina livremente difusivel, (ii) 0,001-0,5 nanopartículas de seda mg e 0,1 mg de seda nanopartículascarregada com doxorrubicina 0,001-1 ug em placas de 96 poços (volume final de 100 ul por poço).
- Determinar a viabilidade celular e a metade da concentração máxima inibitória (IC50) através da adição de (3- (4,5-dimetiltiazol-2-il) -2,5-difeniltetrazólio (MTT 5 mg / ml em PBS) a 72 h. Incubar durante 5 h, drenar os poços cuidadosamente com uma pipeta e dissolver o formazano com 100 ul de dimetilsulfóxido. Medir a absorvância a 560 nm. Repetir esta medição em três experiências independentes.
NOTA: Os valores de absorvância dos controlos não tratados servem como um valor de referência para a viabilidade celular de 100%.
- SEM das células expostas a Silk nanopartículas.
- Semente MDA-MB-231 células em lamelas de vidro esterilizadas a uma densidade de 2 x 10 4 células / cm2. Permitir que as células recuperar durante a noite. Expor as células para as condições de tratamento desejados durante 72 h.
- Fixar as células com 2% v / v em PBS durante 30 min, lava-se com diágua acalmou duas vezes, desidratam com uma série de etanol, e ponto crítico secar as amostras, conforme detalhado em outro lugar 28.
- Sputter revestir as amostras com um ouro camada de até 20 nm de espessura utilizando um aplicador de baixo pulverização catódica vácuo.
NOTA: As definições do aparelho variam entre os modelos. O modelo utilizado aqui é totalmente automatizado e opera em apenas espessura. - Imagem as amostras por SEM usando uma aceleração de elétrons de 5 kV e ampliação de 700 vezes.
Resultados
Os dados foram analisados estatisticamente, conforme detalhado anteriormente 17. O teste t de Student foi utilizado para pares de amostras e análise de uma via de variância (ANOVA), seguido de comparações múltiplas de Bonferroni teste post hoc de várias amostras. Um asterisco indica a significância estatística da seguinte forma: * P <0,05 e ** P <0,001. Todos os dados são apresentados como valores médios ± desvio padrão (DP) e os números entre parêntesis in...
Discussão
Estão disponíveis vários métodos para produzir nanopartículas de seda, incluindo álcool polivinílico de mistura 20, 21 de secagem por pulverização, salting out 22, microdot capilar de impressão 23, CO2 supercrítico precipitação 24 e nanoprecipitação 16,25 (revisto em referência 26). No entanto, nanoprecipitação, devido à sua simplicidade, em geral, é a técnica mais popular para a geração de nanopart?...
Divulgações
The authors have nothing to disclose.
Agradecimentos
This research was supported by a Marie Curie FP7 Career Integration Grant 334134 within the seventh European Union Framework Program.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetone | VWR International, Radnor, PA, USA | 20066.33 | |
| Automated Critical Point Dryer | Leica Microsystems, Wetzlar, Germany | EM CPD300 | |
| Balancing | Mettler Toledo, Greifensee, Switzerland | NewClassic MS | |
| Black polystyrene microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3991 | |
| Capillary cell (DTS 1070) | Malvern Instrument, Worcestershire, UK | DTS107 | |
| Carbon adhesive disc | Agar Scientific, Essex, UK | G3347N | |
| Centrifuge | Hermle Labortechnik, Wehingen, Germany | Z323K | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Avanti J-E, Rotor: J20 | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Optima L-70K, Rotor: 50.2 Ti, Adaptor 303392 | |
| Coater, low vacuum | Leica Microsystems, Wetzlar, Germany | EM ACE200 | |
| Cuvettes, polystyrene, disposable | Fisher Scientific, Waltham, MA, USA | FB55147 | |
| Doxorubixin | LC Laboratories, Boston, MA, USA | D4000 | |
| Electronic pipetting, Easypet | Eppendorf, Hamburg, Germany | N/A | |
| FE-SEM | Hitachi High-Technologies, Krefeld, Germany | SU6600 | |
| Fetal Bovine Serum | Thermo Scientific, Waltham, MA, USA | 16000-044 | |
| Freeze dryer | Martin Christ, Osterode, Germany | Epsilon 2-4 | |
| Heat inactivated Bombyx mori silk cocoons | Tajima Shoji, Kanagawa, Japan | N/A | |
| Hotplate with Stirrer | Bibby Scientific, Stanffordshire, UK | US 152 | |
| Incubator | Memmert, Schwabach, Germany | INB 200 | |
| Insulin, human recombinant, zinc solution | Thermo Scientific, Waltham, MA, USA | 12585-014 | |
| Lithium bromide | Acros Organics, Geel, Belgium | AC199870025 | |
| MDA-MB-231 | ATCC, Manassas, VA, U.S.A | N/A | |
| Micropipette and tips | Eppendorf, Hamburg, Germany | N/A | |
| Microplate Reader | Molecular devices, Sunnyvale, CA, USA | SpectraMax M5 | |
| Oak Ridge High-Speed Centrifuge Tubes, 50 ml | Thermo Scientific, Waltham, MA, USA | N/A | |
| Open-Top Thickwall Polycarbonate tube, 4 ml | Beckman Coulter, Brea, CA, USA | 355645 | |
| Penicilin/streptomycin | Thermo Scientific, Waltham, MA, USA | 15140-122 | |
| RPMI medium | Thermo Scientific, Waltham, MA, USA | 11875-093 | |
| Serological pipettes, 5 ml | Sigma-Aldrich, St. Louis, MO, USA | ||
| Silicon wafers | Agar Scientific, Essex, UK | G3391 | |
| Slide-A-Lyzer Dialysis cassettes, 3.5K MWCO, 15 ml | Thermo Scientific, Waltham, MA, USA | 87724 | |
| Sodium carbonate anhydrous | Fisher Scientific, Waltham, MA, USA | S/2840/62 | |
| Specimen stubs for SEM | Agar Scientific, Essex, UK | G301 | |
| Ultrasonic homogenizer | Bandelin, Berlin, Germany | Sonoplus HD 2070 | |
| UV transparent microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3635 | |
| Vortex | IKA, Staufen, Germany | Genius 3 | |
| Zetasizer | Malvern Instrument, Worcestershire, UK | Nano ZS | |
| Zetasizer Software version 7.11 | DLS software | ||
| Micro Modulyo | Thermo Fisher | 230 | Freeze drying system |
Referências
- Haley, B., Frenkel, E. Nanoparticles for drug delivery in cancer treatment. Urol. Oncol. 26 (1), 57-64 (2008).
- Sun, T., Zhang, Y. S., Pang, B., Hyun, D. C., Yang, M., Xia, Y. Engineered nanoparticles for drug delivery in cancer therapy. Angew. Chem. Int. Ed. 53 (46), 12320-12364 (2014).
- Davis, M. E., Chen, Z. G., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nat. Rev. Drug Discov. 7 (9), 771-782 (2008).
- Sheridan, C. Proof of concept for next-generation nanoparticle drugs in humans. Nature Biotechnol. 30 (6), 471-473 (2012).
- Matsumura, Y., Hitoshi, M. A New Concept for Macromolecular Therapeutics in Cancer Chemotherapy: Mechanism of Tumoritropic Accumulation of Proteins and the Antitumor Agent Smancs. Cancer Res. 46, 6387 (1986).
- De Duve, C., De Barsy, T., Poole, B., Trouet, A., Tulkens, P., Van Hoof, F. Lysosomotropic agents. Biochem. Pharmacol. 23 (18), 2495-2531 (1974).
- Duncan, R., Richardson, S. C. W. Endocytosis and intracellular trafficking as gateways for nanomedicine delivery: opportunities and challenges. Mol. Pharm. 9 (9), 2380-2402 (2012).
- Vishakha, K., Kishor, B., Sudha, R. Natural Polymers - A Comprehensive Review. Int. J. Pharm. Biomed. Res. 3 (4), 1597-1613 (2012).
- Pritchard, E. M., Kaplan, D. L. Silk fibroin biomaterials for controlled release drug delivery. Expert. Opin. Drug Del. 8 (6), 797-811 (2011).
- Thurber, A. E., Omenetto, F. G., Kaplan, D. L. In vivo bioresponses to silk proteins. Biomaterials. 71, 145-157 (2015).
- Pritchard, E. M., Dennis, P. B., Omenetto, F., Naik, R. R., Kaplan, D. L. Physical and chemical aspects of stabilization of compounds in silk. Biopolymers. 97 (6), 479-498 (2012).
- Seib, F. P., Pritchard, E. M., Kaplan, D. L. Self-Assembling Doxorubicin Silk Hydrogels for the Focal Treatment of Primary Breast. Adv. Funct. Mater. 23 (1), 58-65 (2013).
- Seib, F. P., Kaplan, D. L. Doxorubicin-loaded silk films: drug-silk interactions and in vivo performance in human orthotopic breast cancer. Biomaterials. 33 (33), 8442-8450 (2012).
- Seib, F. P., Coburn, J., et al. Focal therapy of neuroblastoma using silk films to deliver kinase and chemotherapeutic agents in vivo. Acta. Biomater. 20, 32-38 (2015).
- Coburn, J. M., Na, E., Kaplan, D. L. Modulation of vincristine and doxorubicin binding and release from silk films. J. Control. Release. 220, 229-238 (2015).
- Seib, F. P., Jones, G. T., Rnjak-Kovacina, J., Lin, Y., Kaplan, D. L. pH-dependent anticancer drug release from silk nanoparticles. Adv. Healthc. Mater. 2 (12), 1606-1611 (2013).
- Wongpinyochit, T., Uhlmann, P., Urquhart, A. J., Seib, F. P. PEGylated Silk Nanoparticles for Anticancer Drug Delivery. Biomacromolecules. 16 (11), 3712-3722 (2015).
- Seib, F. P., Kaplan, D. L. Silk for Drug Delivery Applications: Opportunities and Challenges. Isr. J. Chem. 53 (9-10), 1-12 (2013).
- Yucel, T., Lovett, M. L., Kaplan, D. L. Silk-based biomaterials for sustained drug delivery. J. Control. Release. 190, 381-397 (2014).
- Wang, X., Yucel, T., Lu, Q., Hu, X., Kaplan, D. L. Silk nanospheres and microspheres from silk/pva blend films for drug delivery. Biomaterials. 31 (6), 1025-1035 (2010).
- Qu, J., Wang, L., Hu, Y., You, R., Li, M. Preparation of Silk Fibroin Microspheres and Its Cytocompatibility. J. Biomater. Nanobiotechnol. 4, 84-90 (2013).
- Lammel, A., Hu, X., Park, S., Kaplan, D., Scheibel, T. Controlling silk fibroin particle features for drug delivery. Biomaterials. 31 (16), 4583-4591 (2010).
- Gupta, V., Aseh, A., Rìos, C. N., Aggarwal, B. B., Mathur, A. B. Fabrication and characterization of silk fibroin-derived curcumin nanoparticles for cancer therapy. Int. J. Nanomedicine. 4, 115-122 (2009).
- Zhao, Z., et al. Generation of silk fibroin nanoparticles via solution-enhanced dispersion by supercritical CO2. Ind. Eng. Chem. Res. 52 (10), 3752-3761 (2013).
- Tudora, M., Zaharia, C., Stancu, I. Natural silk Fibroin micro-and nanoparticles with potential uses in drug delivery systems. U.P.B. Sci. Bull., Series B. 75 (1), 43-52 (2013).
- Zhao, Z., Li, Y., Xie, M. B. Silk Fibroin-Based Nanoparticles for Drug Delivery. Int. J. Mol. Sci. 16 (3), 4880-4903 (2015).
- Rockwood, D., Preda, R., Yücel, T. Materials fabrication from Bombyx mori silk fibroin. Nat. Protoc. 6 (10), 1-43 (2011).
- Seib, F. P., Müller, K., Franke, M., Grimmer, M., Bornhäuser, M., Werner, C. Engineered extracellular matrices modulate the expression profile and feeder properties of bone marrow-derived human multipotent mesenchymal stromal cells. Tissue. Eng. Part A. 15 (10), 3161-3171 (2009).
- Lai, P., Daear, W., Löbenberg, R., Prenner, E. J. Overview of the preparation of organic polymeric nanoparticles for drug delivery based on gelatine, chitosan, poly(d,l-lactide-co-glycolic acid) and polyalkylcyanoacrylate. Colloids Surf., B, Biointerfaces. 118, 154-163 (2014).
- Subia, B., Kundu, S. C. Drug loading and release on tumor cells using silk fibroin-albumin nanoparticles as carriers. Nanotechnology. 24 (3), 035103 (2013).
- Zhang, Y. Q., Shen, W. D., Xiang, R. L., Zhuge, L. J., Gao, W. J., Wang, W. B. Formation of silk fibroin nanoparticles in water-miscible organic solvent and their characterization. J. Nanopart. Res. 9 (5), 885-900 (2006).
- Jin, H. J., Kaplan, D. L. Mechanism of silk processing in insects and spiders. Nature. 424 (6952), 1057-1061 (2003).
- Yhr Bae, ., Park, K. Targeted drug delivery to tumors: myths, reality and possibility. J. Control. Release. 153 (3), 198-205 (2011).
- Lammel, A., Schwab, M., Hofer, M., Winter, G., Scheibel, T. Recombinant spider silk particles as drug delivery vehicles. Biomaterials. 32 (8), 2233-2240 (2011).
- Holliday, D. L., Speirs, V. Choosing the right cell line for breast cancer research. Breast. Cancer. Res. 13, 215 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados