Method Article
Mesenquimales estromales de cultivo celular y de entrega en autólogas Condiciones: Enfoque inteligente para aplicaciones ortopédicas
En este artículo
Resumen
El cultivo de células mesenquimales estromales humanas (hMSC) con suero autólogo, reduce los riesgos de rechazo por el material xenogénico y otros efectos negativos. También permite la recuperación de un subconjunto de progenitores mesodérmicos, que puede entregar hMSCs frescas. Incorporación de hMSCs en un coágulo de fibrina autóloga permite un manejo fácil y efectiva implantación quirúrgica.
Resumen
Las células estromales mesenquimales humanas (hMSC) se cultivan in vitro con diferentes medios. Límites a su uso en la práctica clínica, sin embargo, dependen principalmente de los riesgos potenciales de riesgo biológico y la inflamación ejercidas por los nutrientes xenogénicos para su cultura. derivados de humanos o materiales recombinantes son los primeros candidatos de elección para reducir estas reacciones. Por lo tanto, los suplementos de cultivo y materiales de origen autólogo representan los mejores nutrientes y los productos más seguros.
A continuación, describimos un nuevo protocolo para el aislamiento y cultivo de hMSC médula ósea autólogas en condiciones - a saber, el suero derivado del paciente como un suplemento para el medio de cultivo y la fibrina como un andamio para la administración hMSC. De hecho, hMSC construcciones / coágulo de fibrina podría ser muy útil para varias aplicaciones clínicas. En particular, nos centramos en su uso en cirugía ortopédica, donde el coágulo de fibrina derivada de la propia sangre del donante permitióde suministro de células eficaz y de nutrientes / desechos intercambios. Para garantizar las condiciones de seguridad óptimas, es de suma importancia para evitar los riesgos de la transformación y el crecimiento excesivo de tejido hMSC. Por estas razones, el enfoque descrito en este documento también indica un ex vivo hMSC expansión mínimamente, para reducir la senescencia celular y cambios morfológicos, y de corto plazo osteo-diferenciación antes de la implantación, para inducir la especificación de linaje osteogénico, disminuyendo así el riesgo de una posterior no controlado proliferación.
Introducción
Las células humanas mesenquimales del estroma (hMSC) representan una de las mejores fuentes de células para su uso en la ingeniería de tejidos para la promoción de la osteogénesis 1,2. Son fácilmente aisladas de médula ósea y otros tejidos adultos, y expresan marcadores de superficie típicos tales como CD90, CD105, CD73 1. Además, pueden diferenciarse en varios tipos de células, tales como osteoblastos, condrocitos y adipocitos 3. Sus efectos terapéuticos se atribuyen a su propiedades regeneradoras y tróficos 4. hMSCs se podrían utilizar en la cirugía ortopédica, así como en otras aplicaciones clínicas regenerativas. Se combinan preferiblemente con andamios, para mejorar el resultado clínico 5.
En comparación con otros materiales, el gel de fibrina muestra propiedades interesantes tales como adhesividad, la resorción y el transporte eficiente de los nutrientes, que lo hacen muy útil para una variedad de aplicaciones de ingeniería de tejidos 6,7.
El principal reto en la traducción de un enfoque de la ingeniería de tejidos en aplicaciones clínicas es la obtención de un andamio biocompatible y totalmente biosafe y un medio de cultivo libre de xeno que evita cualquier efecto infeccioso o reactiva.
En nuestro método, gel de fibrina, derivado de la propia sangre del paciente, y el suero autólogo, para el cultivo in vitro hMSCs, fueron empleados como una posible solución terapéutica en el campo de la ortopedia 8.
Para fines clínicos, hMSCs generalmente se administran a través de dos procedimientos principales: (i) el procedimiento de "un solo paso" (es decir, la manipulación mínima), que permite que el trasplante de auto de la médula ósea, ya sea total o concentrado (es decir, células mononucleares), durante la cirugía; y (ii) el procedimiento de "dos etapas" (es decir, una extensa manipulación), que se basa en la expansión ex vivo de hMSC para aumentar su rendimiento antes de la implantación, y requiere GInstalaciones MP 9. Curiosamente, el cultivo de células con suero humano adulto en lugar de suero de ternera bovina permite la recuperación, junto con hMSCs, de un subconjunto de células (1 - 10% en cultivos mononucleares) llamados células mesodérmicas progenitoras (PSM), capaz de diferenciación in vitro en fresco hMSCs 10,11. Por lo tanto, hMPCs pueden jugar un papel significativo en el proceso de regeneración cuando se compara con hMSCs solo 12,13. Por último, empuja a corto plazo osteo-inducción hMSCs para comenzar su diferenciación en el linaje osteogénico sin perder su potencial de proliferación y viabilidad 12. Estos resultados confirman estudios previos que han informado mejorada en la formación de hueso in vivo por hMSCs, seguido de un precultivo en un medio osteogénico 14. Por otra parte, un coágulo de plasma autólogo como un andamio para la entrega celular puede ser fácilmente manipulado por el cirujano y moldeado para adaptarse a la forma de la cavidad del hueso 13.
Therefore, este método puede ser de gran utilidad para aquellos investigadores y clínicos que apuntan a traducir su terapia basada en hMSC desde el banco a la cabecera en las aplicaciones ortopédicas.
Protocolo
El presente protocolo fue desarrollado de acuerdo con la Declaración de Helsinki de la Asociación Médica Mundial en relación con la conducta ética de la investigación con seres humanos. Fue aprobado por el Comité Ético de la Azienda Ospedaliero-Universitaria Pisana.
NOTA:
La médula ósea se obtuvo de los pacientes sometidos a cirugía de reemplazo total de cadera rutina (según el paso 1.1) 15; plasma para la preparación de coágulos se obtuvo de la sangre periférica autóloga 13; suero autólogo, como un suplemento para medio de cultivo, se recogió de una aféresis de sangre entera autóloga. Todos los pacientes recibieron información detallada sobre el procedimiento y firmaron un formulario de consentimiento por escrito.
1. Recogida de la muestra de médula ósea
- Recoger la médula ósea del canal medular del fémur después de una cirugía de reemplazo total de cadera (para estudios de investigación). Brevemente, durante la preparación quirúrgica del canal medular a house el vástago protésico, recoger la sangre de la médula que se desborda (alrededor de 10 a 15 ml, dependiendo del tamaño de la prótesis) 15.
O - Recoger aspirado de médula ósea de la cresta ilíaca con anestesia local, siguiendo el procedimiento estándar acerca hematológica 20 - 30 d por adelantado (para aplicaciones clínicas) 16.
NOTA: En ambos casos jeringas heparinizadas (para prevenir la formación de coágulos) debe ser utilizado para la recuperación de la médula ósea.
2. Preparación de plasma autólogo
- Recoger 20 ml de sangre periférica del paciente en tubos de recogida de sangre al vacío que contienen K3 EDTA (5,4 mg en 3 tubos ml) y se centrifuga a 2400 xg durante 15 min.
- Aspirar el componente de plasma en un tubo de 15 ml y se congelan a -20 ° C hasta su uso.
3. Preparación del suero autólogo
- La transferencia de la unidad de plasma en una bolsa de transferencia utilizando una espiga. Desconectar la bolsa llena por soldadura y el weigh la bolsa para calcular el volumen de plasma (Figura 1A).
- Coagular el plasma autólogo mediante la inyección de gluconato de calcio 100 mg / ml al 10% w / v a través del conector del puerto (Figura 1B). Después de mezclar la bolsa, lo coloca a 4 ° CO / N sin agitación para facilitar la formación de coágulos.
- Centrifugar la bolsa a 4.900 × g durante 15 min a TA. Tome el cubo de centrífuga de la centrifugadora y retirar la bolsa con cuidado (siga las instrucciones del fabricante para la preparación de lisado de plaquetas) (Figura 1C).
- Aislar el coágulo justo por encima de la abrazadera para facilitar la filtración. Conectar el kit de filtración a la bolsa de transferencia usando un pico colocado en el orificio de salida del kit de filtración.
- Colgar la bolsa y abrir la pinza azul para permitir que el flujo de suero por gravedad. No aplique presión en el filtro para evitar la transferencia de la fibrina en la bolsa. Después de la filtración, sellar el tubo y retirar la bolsa (seguir la fabridirectrices del fabri- para la preparación de lisado de plaquetas).
- Conectar una línea dedicada a la bolsa y la transferencia final del suero en tubos de 50 ml bajo un banco de flujo laminar para evitar la contaminación microbiana.
- Tomar una muestra con una jeringa para probar la ausencia de fibrinógeno y realizar una prueba de esterilidad para cultivos de bacterias aerobias y anaerobias 17. Etiquetar los tubos de manera adecuada y congelarlos a - 20 ° C hasta su uso.
4. Preparación del medio de expansión
- Preparar 500 ml de medio de proliferación completa. Para de Eagle modificado por Dulbecco - bajo en glucosa (DMEM-LG), añadir un 10% de suero autólogo (obtenido como se describe en la sección 3), glutamina 2 mM, solución antibiótica 1% y una solución antimicótica 1%. Estéril-filtro el medio proliferación completa.
5. Aislamiento de hMSC de la médula ósea
- Transferir la muestra de médula ósea (5-10 ml) de la jeringa en un ml cónica 50 tuser y diluir con solución salina estéril (relación 1: 4). Vortex el tubo de 50 ml durante 30 s para desagregar los grupos de células.
- Calentar el gradiente de densidad (densidad 1,077 g / L; véase la Tabla de Materiales) a RT antes de su uso y la capa de la médula ósea diluida suavemente (para evitar que se mezclen las dos capas) en el gradiente de densidad mediante la adición de 20 ml de la muestra a 15 ml de la densidad gradiente para cada tubo de 50 ml (Figura 2A).
- Centrifugar a 400 x g sin frenos a 25 ° C durante 30 min, y luego recoger la fracción mononuclear en la interfase líquido-líquido y la transferencia a un nuevo tubo de 50 ml utilizando un 5 ml pipeta estéril.
- Lavar la fracción mononuclear recogido dos veces con medio de proliferación completa y centrifugar los tubos a 400 xg durante 10 min a 25 ° C para obtener gránulos de las células.
- Eliminar el sobrenadante y resuspender suavemente cada sedimento de células en 5 ml de medio de proliferación completa. Diluir a una proporción de 1: 100 para el recuento celular.
- Contar las células usando un hemocitómetro después de una dilución 1: 1 con la tinción de azul de tripano para evaluar la viabilidad celular.
6. cultivo de hMSC en presencia de suero autólogo
- Llenar dos o más frascos (TC) 75 cm 2 de cultivo de tejidos con 15 ml de medio de proliferación completo fresco y transferirlos a una incubadora de cultivo celular a 37 ° C y 5% de CO 2 hasta su uso.
- semilla 0,3 - 0,5 x 10 6 células / cm2 (37,5 x 10 6 células / 15 ml de medio de proliferación completo fresco) y se incuba a 37 ° C y 5% de CO2 durante 48 h.
- Al mismo tiempo, la semilla 1 x 10 6 células en un 25 cm matraz de 2 TC con 5 ml de medio de proliferación completo fresco para la unidad formadora de colonias - fibroblastos (CFU-F) de ensayo. Cultivo durante 2 semanas (continuará en la sección 12).
- Descartar el medio y lavar suavemente los frascos desde el paso 6.2 con el medio de proliferación completa a remove células no adherentes y los escombros. Añadir medio fresco a los matraces y reemplazar medio de dos veces a la semana, hasta 70-80% de confluencia (cultivo primario, Passage 0 (P0)) (Figura 2B).
- Recuperar las células mediante el uso de un animal recombinante libre de proteasa específica (véase la Tabla de materiales, el uso de 3 ml de la solución por frasco según lo recomendado por el fabricante) y se incuba a 37 ° C y 5% de CO2 durante 10 min. Añadir 6 ml de medio de proliferación completa por matraz y se juntan en un tubo de 50 ml. Repita el paso 5.6.
NOTA: IMPORTANTE: El uso de esta proteasa en lugar de tripsina permite la recuperación de algunas células mesodérmicas progenitores (PSM) presentes en la cultura, que es resistente a la tripsina. - Para una mayor expansión, replate la suspensión celular a 2.000 - 3.000 células / cm2 en nueva 75 cm 2 frascos de TC (P1) (Figura 2C).
- Use alícuotas de células para evaluar el potencial de diferenciación de las MSChacia osteogénico, adipogénico y linajes condrogénicas. Realizar ensayos de diferenciación siguiendo las recomendaciones del fabricante (Figura 2D).
NOTA: Diferentes métodos de tinción se pueden utilizar para evaluar la diferenciación multilinaje.
7. Preparación de un medio osteogénico con suplementos farmacéuticos
- Diluir la solución de ácido ascórbico (Solución 1A:. Ácido ascórbico 200 mg / ml (véase la Tabla de Materiales) 1:10 con DMEM-LG, para obtener una solución 20 mg / ml (Solución 1B, solución de trabajo) alícuotas de archivo de soluciones 1A y 1B a -20 ° C hasta su uso.
- Resuspender 1 g de hidrocortisona en 10 ml de agua estéril (Solución 2A: hidrocortisona 100 mg / ml (Véase la Tabla de Materiales) una solución diluida de 2A a 1:. 1000 con DMEM-LG para obtener una solución / mL 100 mg (Solución 2B, trabajando solución). alícuotas de archivo de soluciones 2A y 2B a -20 ° C hasta su uso.
- Tras el uso de prepare medio osteogénico fresco como sigue: añadir DMEM-LG con suero autólogo al 10%, ácido ascórbico 50 mg / ml y 0,4 mg / ml de hidrocortisona. Esterilizada por el filtro del medio osteogénico.
8. osteogénico Pre-inducción y recuperación de hMSCs
- Eliminar completamente el medio de proliferación y añadir osteogénicas medianas 96 h antes de la cosecha de células (es decir, 80-90% de confluencia se alcanza generalmente en 7 d). Proporcionar un cambio de medio osteogénico adicional de 24 h antes de la recolección de células.
- Separar las células como se describe en el paso 6.5 y volver a suspender suavemente el sedimento de la adición de 2 ml de medio de proliferación completa en un tubo de 50 ml.
NOTA: La viabilidad celular se puede reducir (aproximadamente 10%) como un resultado de la osteoinducción. agregados celulares pueden ser observados. - Después de contar, lavar las células con medio de proliferación completa y centrifugar a 300 xg durante 5 min. Resuspender el precipitado suavemente a 1 - 2 x 10 6 células viables / 2ml de plasma autólogo (véase la sección 2) por un tubo de 50 ml.
9. Preparación de hMSC / coágulo de fibrina Constructos
- Añadir 150 l de gluconato de calcio a 100 mg / ml a cada tubo 50 ml obtenido en la etapa 8.3. y resuspender las células bajo agitación suave.
- Se incuban las células a 37 ° C y 5% de CO 2 durante 15 - 30 min para obtener / fibrina construcciones coágulo de hMSC (Figura 3A). Preparar una construcción de coágulo de fibrina sin células para ser utilizado como un control.
NOTA: IMPORTANTE: Es recomendable para preparar este coágulo de control de al menos 2 h antes de que el ensayo de viabilidad celular, ya que toma 30 min o más para reticulación.
Ensayo de viabilidad de la célula 10.
- Retire el líquido de los tubos de 50 ml y se añade 1 ml de medio de proliferación completo que contiene 10% v reactivo de la viabilidad celular / v (AB; véase la Tabla de Materiales), de acuerdo con las instrucciones del fabricante.
- incubar THtubos electrónicos a 37 ° C y 5% de CO 2 durante 3 h. Medir la absorbancia a 570 nm con una longitud de onda de referencia de 600 nm (AB en el tiempo 0; t0).
- Eliminar el sobrenadante y añadir 2 ml de medio de proliferación completo fresco. Se incuba a 37 ° C, 5% de CO 2 O / N. Al día siguiente (AB en horario de 24 h; t24), repita los pasos 10.1 a 10.3 (Figura 3B).
11. La evaluación histológica de la viabilidad celular y la deposición de calcio en el interior del coágulo de fibrina constructos
- Fijar los / las construcciones de fibrina del coágulo hMSC en 4% w / v de formalina neutra tamponada O / N a 4 ° C. Lave 4 veces en D-PBS durante 15 min y almacenar en un 70% de etanol.
- Deshidratar las muestras a 40 ° C en una serie de etanol graduado: 80% de una vez por 30 min, 95% dos veces durante 45 min y 3 x 100% durante 1 h. Aclarar dos veces en xileno durante 45 min a 40 ° C.
- Enjuague las muestras en parafina líquida a 60 ° C durante 2 h, y incrustarlos. Cortar el bloque de parafina con un microtomo y monte tél secciones (5 micras) sobre portaobjetos de vidrio.
- Teñir los cortes desparafinados utilizando el eosina (H & E) método (Figura 3C) estándar de hematoxilina.
- Realizar tinción de von Kossa por el tratamiento de las secciones con 1% de nitrato de plata durante 15 minutos, 0,5% de pirogalol para 2 min, y tiosulfato de sodio al 5% durante 2 min. CONTRATINCIÓN las secciones con 0,1% de rojo nuclear diluido en una solución que contiene 5 g de sulfato de aluminio durante 5 minutos y enjuague con agua del grifo durante 5 minutos. Montar las secciones con un agente de montaje.
- Evaluar la deposición de minerales en forma de gránulos negros bajo microscopio óptico (400 aumentos) (Figura 3D).
Ensayo 12. CFU-F
- Lavar el matraz de 25 cm2 (desde el paso 6.3.) Con D-PBS. Teñir utilizando el método estándar May-Grunwald / Giemsa. Cuantificar visualmente número hMSC al anotar colonias individuales (Figura 4) con un microscopio óptico.
NOTA: Sila médula ósea se toma como en el paso 1.2. y las secciones 2 - 9 se realizan en Buenas Prácticas de Fabricación (BPF) con la aprobación regulatoria necesaria, los / las construcciones de fibrina del coágulo hMSC se pueden implantar para aplicaciones ortopédicas.
Resultados
Preparación de suero autólogo
coagulación de plasma, realizado mediante la adición de gluconato de calcio a la bolsa de transferencia, permite la recuperación de suero autólogo en grandes cantidades, como se requiere para el cultivo hMSC. De hecho, con esta técnica, es posible alcanzar hasta 200 ml de suero (Figura 1).
HMSC aislamiento, cultivo y diferenciación utilizando suero autólogo
Células mononucleares de médula ósea se aíslan usando un gradiente de densidad, lo que da lugar a una capa anillo intermedio (Figura 2A). Por chapado estas células y la eliminación de los no adherentes con el lavado, es posible aislar hMSC (Figura 2B). En condiciones de cultivo autólogo, un subconjunto de células, llamado PSM, se detectan en P0 y en porcentajes de hasta to 10%, dependiendo de la variabilidad de paciente (Figura 2B). PSM todavía están presentes después de resiembra (es decir, P1) si la proteasa se utiliza para los pases de células (Figura 2C). hMSCs aislado y se cultivaron en un entorno autólogo mantienen su capacidad de diferenciarse hacia las tres linajes mesodérmicos bien conocidos (osteogénico, adipogénico y condrogénicas). Se llevaron a cabo los ensayos de diferenciación para comparar la identidad de la población de hMSC con los obtenidos usando (no autólogos) condiciones de cultivo estándar. Como se eligieron los ensayos de funcionalidad de este protocolo, la tinción de von Kossa, tinción con tetróxido de osmio, y tinción con azul Alcian a pH 1 en lugar de las sugeridas por el fabricante de medios de diferenciación (véase la Tabla de Materiales) (Figura 2D).
Preparación, la viabilidad y la caracterización histológica de MSC / fibrina construcciones coágulo
Los hMSCs se dispersan en plasma, que se reticula por gluconato de calcio en un tubo de 50 ml, lo que lleva a la formación de un disco jalea rodeado de su sobrenadante (Figura 3A). Dentro de estos coágulos de plasma, los hMSCs son viables, como lo demuestra el cambio de color del colorante t24 viabilidad celular de azul (control sin células) a rosa (coágulo cellularized) (Figura 3B). La viabilidad celular en el interior del coágulo se confirmó mediante tinción con H & E, que muestra una morfología celular bien conservada (Figura 3C). Además, una osteoinducción mínimo justo antes de la segunda cosecha de células da lugar a la deposición de calcio preliminar por hMSCs estimuladas (Figura 3D).
Unidad de formación de Colonia
La presencia de colonias hMSC después de 2 semanas en cultivo se muestra mediante el ensayo de CFU-F (Figura 4).
s = "jove_step" fo: keep-together.within-page = "1"> Aplicación de MSC coágulo / fibrina construir en el hueso no unión
Construcciones HMSC / coágulo de fibrina obtenidos como se describe en este método (paso 1.1) se aplicaron con éxito para tratar graves faltas de unión de las extremidades superiores en 8 casos compasivos 13. Evaluación a largo plazo (máximo 7,6 meses) confirmó los resultados clínicos y funcionales satisfactorios para todas las pacientes, sin evidencia de crecimiento excesivo de tejido o de la formación de tumores.

Figura 1. Preparación de suero autólogo.
(A) La unidad de plasma se transfiere en una bolsa de transferencia utilizando la espiga; (B) El plasma se coagula mediante la inyección de gluconato de calcio a través del conector del puerto; (C) Una centrífuga-bolsa de sangre se usa para separar el suero./files/ftp_upload/54845/54845fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
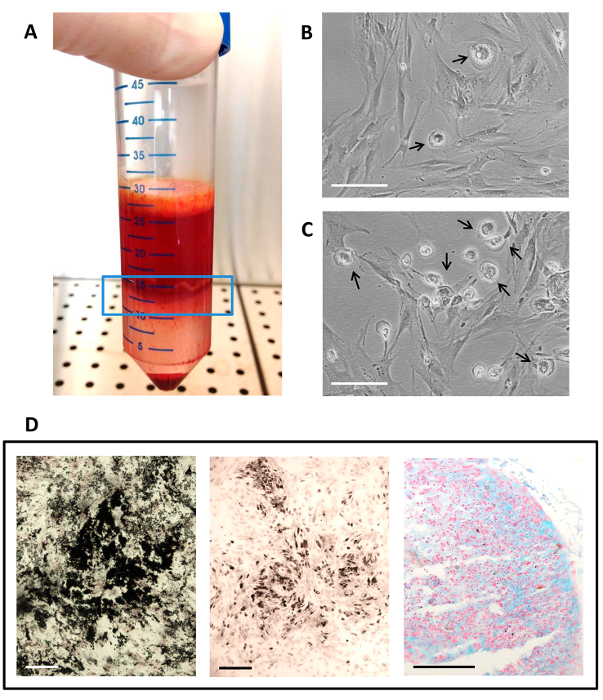
Figura 2. Aislamiento hMSC, cultura y diferenciación utilizando suero autólogo.
(A) La capa de células mononucleares (en la ventana de línea azul) obtenido después de la centrifugación de la médula ósea con un gradiente de densidad; (B) El cultivo de células tal como aparece en P1; (C) Cultivo de células tal como aparece en P0 (cultivo primario); (B - C) Las flechas indican la presencia de PSM en la cultura del MSC. La barra de escala es de 100 micras; (D) los resultados histoquímicos de ensayos de diferenciación multilinaje. La diferenciación osteogénica se evaluó mediante tinción de von Kossa para la deposición de la matriz mineral en negro, la diferenciación adipogénica se muestra por la presencia de vacuolas grasos, teñido de negro por tetroxi de osmiode, y la diferenciación condrogénica se muestra por la presencia de glicosaminoglicanos sulfatados, que son de colores en cian por tinción con azul de Alcian a pH 1. La barra de escala es de 50 micras. Haga clic aquí para ver una versión más grande de esta figura.
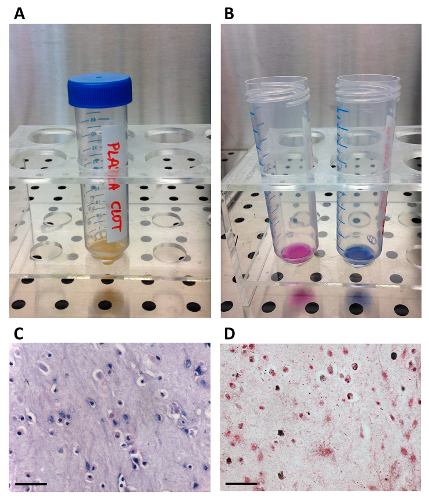
Figura 3. Preparación, Viabilidad y histológico Caracterización de MSC / coágulo de fibrina constructos.
(A) El / coágulo de fibrina hMSC construir tal como aparece después de la reticulación; (B) Los resultados del ensayo de AB: los CSM son viables dentro coágulo de fibrina, como lo demuestra el cambio de color del tinte de viabilidad celular (T24), desde el azul (control sin células, a la derecha) a rosa (coágulo cellularized, en el izquierda). (C - D) resultados histoquímicos de construcciones coágulo / fibrina hMSC. La barra de escala es50 micras. (C) con hematoxilina y eosina que muestra células viables incrustados en la matriz de fibrina; Deposición (D) de la matriz mineral teñido de negro por la tinción de von Kossa, lo que confirma una osteogénesis inicial. Haga clic aquí para ver una versión más grande de esta figura.
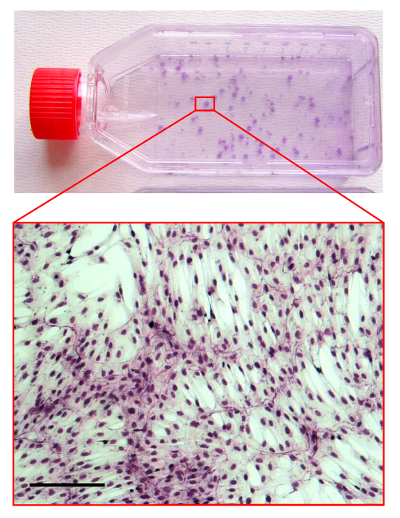
Figura 4. CFU-F Ensayo.
Foto de un frasco con hMSCs cultivadas teñidas por el método May-Grunwald / Giemsa. El área de zoom en la es una micrografía óptica que muestra la morfología de una colonia hMSC. La barra de escala es de 100 micras. Haga clic aquí para ver una versión más grande de esta figura.
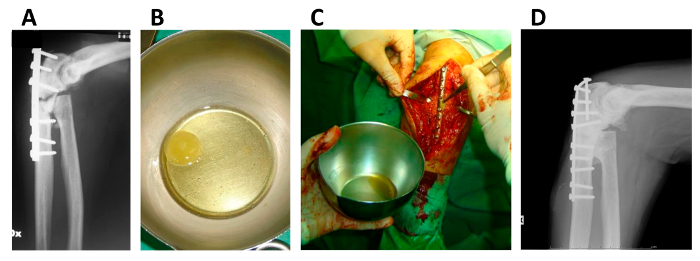
Figura 5. Aplicación de hMSC Clot / fibrina construir en hueso La falta de unión.
(A) de la radiografía de la extremidad superior de un paciente afectado por la pseudoartrosis; (B) hMSC / coágulo de fibrina constructo justo antes del implante; (C) la aplicación quirúrgica de la construcción de coágulos hMSC / fibrina; (D) de rayos X de la extremidad superior del mismo paciente después de 5 años. Esta cifra se vuelve a publicar a partir Giannotti S. et al. con modificaciones mínimas 13. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los pasos críticos de este protocolo se refieren al uso de suero humano adulto y la proteasa, lo que permite obtener una terapia hMSC biosafe. En particular, el suero humano adulto permite el aislamiento y mantenimiento, mientras que la proteasa se asegura de la cosecha, de PSM. Estos son células inmaduras presentes en la médula ósea que pueden dar lugar a hMSCs frescas, asegurando así un depósito de hMSCs viables a lo largo del tiempo de cultivo. No todos los PSM se pueden recoger, ya que al aumentar el tiempo de exposición a la actividad de la proteasa es perjudicial para hMSC viabilidad. Por esta razón, de una incubación de la proteasa 10 min fue seleccionado como compromiso óptimo entre la recuperación de PSM y la viabilidad de los hMSCs. Otro paso crítico es el tiempo osteodifferentiation. De hecho, en una extensa osteodifferentiation vitro reduciría considerablemente la viabilidad celular, afectando así a la formación de hueso final en vivo. El último paso crítico consiste en hacer uso de un andamio biorreabsorbible autólogo, which se obtiene mediante la incorporación de las células (hMSC y PSM) en un gel de fibrina a partir de la coagulación de plasma.
Un paso clave para mejorar el rendimiento de los PSM es sembrar las células mononucleares en mayor concentración. El uso de procedimientos de aféresis para obtener plasma y tratamiento con gluconato de calcio hace que sea posible lograr suero autólogo en grandes cantidades. Se ha observado que el suero humano como un suplemento de medio es comparable al suero bovino fetal (FBS) en cultivos de hMSC. Sin embargo, en nuestra experiencia, un medio completo suplementado con FBS contribuye a la senescencia más rápido que el suero humano adulto. Un paso importante es el de la administración de una osteoinducción mínimo para hMSCs. De hecho, este tratamiento conduce a las células para diferenciar fácilmente hacia el linaje osteogénico, siendo por lo tanto útil para evitar aún más la transformación de células in vivo. Para mantener una buena viabilidad de hMSCs mínimamente osteoinduced, se recomienda seguir cuidadosamente las recomendaciones descritas en los pasos 6.5. und 8.2., incluyendo su manipulación, la centrifugación y medianas cantidades que se añade. Si un procedimiento de aféresis no está disponible, todavía es posible llevar a cabo este protocolo mediante la realización de múltiples sorteos de sangre para el paciente o, como alternativa, mediante la compra de una mezcla de sueros AB. Obviamente, con el fin de lograr este protocolo de la cabecera banco a, que es obligatorio tener fábricas de células GMP, o sus equivalentes, disponible.
Las limitaciones a la aplicación de esta técnica se refieren a la anémica, hematológicos-oncología y pacientes ortopédicos afectada por osteomielitis., Dibujo grandes cantidades de sangre de pacientes anémicos, deben ser evitados. En pacientes oncológicos, la calidad de las muestras de células se ve afectada por los tratamientos de quimioterapia, mientras que en los pacientes osteomielitis la infección puede afectar el resultado final. En todos los casos en los que el suero autólogo es insuficiente o inadecuada, combinada masculina AB sueros representan una buena alternativa.
El uso de células / clo de fibrinat construcciones para posibles aplicaciones clínicas es crucial para liberar una terapia celular autóloga por completo, lo que podría ser fácil de manejar y el molde durante la cirugía, lo que resulta en excelentes resultados para tratar el hueso no uniones 13. Para fines clínicos, hMSCs se administran normalmente a través de dos procedimientos principales: una manipulación mínima y una extensa manipulación 9. Para superar los problemas relacionados con una extensa cultivo ex vivo, tales como anormalidades en la morfología y el tamaño de 18 células, se realizó un breve periodo de tiempo la expansión de células in vivo y osteo-diferenciación (sólo 4 d) ex.
El protocolo libre de xeno se describe en este documento, junto con los cortos de expansión celular y osteodifferentiation veces, demostró ser relevante en las clínicas con el fin de obtener una producción de hueso rápida in vivo, sin evidencia de sobrecrecimiento y transformación de tejidos, confirmando así su eficacia y larga -term seguridad en la reparación ósea (Figura 5) 13.
La metodología presentada en este informe tiene como objetivo demostrar la eficacia y seguridad de hMSC la expansión in vitro en condiciones autólogas para su posible uso en cirugía ortopédica. Este protocolo emplea hMSCs aisladas de la médula ósea y se cultivaron en un medio suplementado con suero autólogo y embebidos en coágulos de fibrina autóloga, asegurando así una terapia celular completamente autólogo. La inducción osteogénica de dos veces, justo antes de la segunda separación, mejora la capacidad de hMSC a diferenciarse en osteoblastos. Como resultado de ello, esta técnica es particularmente adecuada para aplicaciones en defectos óseos, ya que no se limita a la pseudoartrosis. Las posibles aplicaciones futuras podrían implicar quiste astrágalo y la gestión de la pérdida de hueso.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
This study was funded by the Tuscany Region (grant number 539999_2014_Petrini_CUCCS). The authors would like to thank Prof. S. Berrettini for authorizing the use of the Otolab laboratory and instruments, and the surgery staff from the Orthopedic Clinic II of the University of Pisa, for the fundamental cooperation in sample harvesting. The support provided by Dr. F. Scatena is gratefully acknowledged. Finally, many thanks are due to Mr. J.G. De La Ossa for his precious contribution to histologic processing.
Materiales
| Name | Company | Catalog Number | Comments |
| Triple Select (1x) | GIBCO, LIFE TECHNOLOGIES | 12563-029 | cell culture |
| Trypan blue stain | GIBCO, LIFE TECHNOLOGIES | 15250061 | cell culture |
| DMEM-LG, no glutamine, no phenol red | GIBCO, LIFE TECHNOLOGIES | 11880-028 | cell culture |
| Glutamax (100x) | Gibco, Life Technologies | 35050038 | cell culture |
| Penicillin/Streptomycin sol. | Gibco, Life Technologies | 15140122 | cell culture |
| Alamar Blue (AB) | Gibco, Life Technologies | DAL1025 | proliferation/viability assay |
| Ficoll-Paque Plus | GE Healthcare | 17-14440-02 | cell culture |
| D-PBS | Gibco, Life Technologies | 14190-094 | cell culture |
| StemMACS AdipoDiff Media | Miltenyi Biotech | 130-091-677 | cell culture |
| StemMACS ChondroDiff Media | Miltenyi Biotech | 130-091-679 | cell culture |
| hMSC Osteogenicdiff BulletKit | Euroclone | LOPT3002 | cell culture |
| Vitamin C (ascorbic acid) | Bayer | ATC Code: A11GA01 | Pharmaceutical grade drug |
| Flebocortid Richter (hydrocortisone) | Aventis Pharma | ATC Code: H02AB09 | Pharmaceutical grade drug |
| Victor X3, reader | PerkinElmer | 2030 multilabel reader | proliferation/viability assay |
| Silver nitrate | Sigma Aldrich | 209139 | histological assay |
| Pyrogallol | Sigma Aldrich | 16040 | histological assay |
| Sodium Thiosulphate | Sigma Aldrich | S8503 | histological assay |
| Histoplast LP | Thermo Scientific | 8332 | histological assay |
| Methanol | Sigma Aldrich | 32213 | histological assay |
| Ethanol | Sigma Aldrich | 2860 | histological assay |
| Nuclear fast red | Sigma Aldrich | 60700 | histological assay |
| Formalin | Bio-optica | 05-K01009-X40 | histological assay |
| Eosin B | Sigma Aldrich | 45260 | histological assay |
| DPX | Sigma Aldrich | 6522 | histological assay |
| Haematoxylin | Sigma Aldrich | H3136 | histological assay |
| Aluminium Sulphate | Sigma Aldrich | 202614 | histological assay |
| Xylol | Sigma Aldrich | 534056 | histological assay |
| Microtome | Leika | histological assay | |
| May Grunwald | Sigma Aldrich | MG1L-1L | histological assay |
| Giemsa | Sigma Aldrich | 32884-250ML | histological assay |
| Transfer bag | Biomérieux | BC0300031 | cell culture |
| Filtration kit | Macopharma | BC0800010 | cell culture |
| Calcium Gluconate | Galenica Senese | Pharmaceutical grade drug | |
| Bact Alert | Biomérieux | 259790 anaerobic | microbiological assay |
| Bact Alert | Biomérieux | 259789 aerobic | microbiological assay |
| Steryle Luer-Lok Syringe 50 mL | BD Plastipak | 300865 | cell processing |
| Heraeus Cryofuge 6000i | Thermo Scientific | blood bag centrifuging | |
| SL16R Centrifuge | Thermo Scientific | blood tube centrifuging |
Referencias
- Horwitz, E. M., et al. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy. 7, 393-395 (2005).
- Kassem, M., Abdallah, B. M. Human bone marrow-derived mesenchymal stem cells: biological characteristics and potential role in therapy of degenerative diseases. Cell Tissue Res. 331, 157-163 (2008).
- Pittenger, M. F., et al. Multilineage potential of adult human mesenchymal stem cells. Science. 284, 143-147 (1999).
- Bonfield, T. L., Nolan Koloze, M. T., Lennon, D. P., Caplan, A. I. Defining human mesenchymal stem cells efficacy in vivo. J Inflamm. (Lond). 25 (7), 51 (2010).
- Pneumaticos, S. G., Triantafyllopoulos, G. K., Chatziioannou, S., Basdra, E. K., Papavassiliou, A. G. Biomolecular strategies of bone augmentation in spinal surgery. Trends Mol. Med. 17 (4), 215-222 (2011).
- Amhed, T. A. E., Dare, E. V., Hincke, M. Fibrin: A versatile scaffold for tissue engineering applications. Tissue Engineering Part B. 14 (2), 199-215 (2008).
- Silbertein, L. E., Williams, L. J., Huglett, M. A., Magee, D. A., Weisman, R. A. An autologous fibrinogen-based adhesive for use in oncologic surgery. Transfusion. 28 (4), 319-321 (1988).
- Jockenhoevel, S., et al. Fibrin gel advantages of a new scaffold in cardiovascular tissue engineering. Eur. J. Cardiothorac Surg. 19 (4), 424-430 (2001).
- Veronesi, F., et al. Clinical use of bone marrow, bone marrow concentrate, and expanded bone marrow mesenchymal stem cells in cartilage disease. Stem Cells Dev. 22 (2), 181-192 (2013).
- Petrini, M., et al. Identification and purification of mesodermal progenitor cells from human adult bone marrow. Stem Cells Dev. 18 (6), 857-866 (2009).
- Trombi, L., et al. Selective culture of mesodermal progenitor cells. Stem Cells Dev. 18 (8), 1227-1234 (2009).
- Trombi, L., et al. Human autologous plasma-derived clot as a biological scaffold for mesenchymal stem cells in treatment of orthopedic healing. J. Orthop. Res. 26 (2), 176-183 (2008).
- Giannotti, S., et al. Use of autologous human mesenchymal stromal cell/fibrin clot constructs in upper limb non-unions: long term assessment. PlosOne. 8 (8), 73893 (2013).
- Castano-Izquierdo, H., et al. Pre-culture period of mesenchymal stem cells in osteogenic media influences their in vivo bone forming potential. J. Biomed. Mater. Res. A. 82 (1), 129-138 (2007).
- Malkani, A. L., Fitzgerald, R. H., Kaufer, H. . Orthopaedics. , (2002).
- Lee, S. H., et al. ICSH guidelines for the standardization of bone marrow specimens and reports. Int J Lab Hematol. 30 (5), 349-364 (2008).
- Bugno, A., et al. Application of the BacT/ALERTR 3D system for sterility testingof injectable products. Braz J Microbiol. 46 (3), 743-747 (2015).
- Bonab, M. M., et al. Aging of mesenchymal stem cells in vitro. BMC Cell Biology. 7, 14 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados