Method Article
Mesenchymale Stromazellen Zellkultur und Lieferung in Autologe Bedingungen: Ein intelligenter Ansatz für orthopädische Anwendungen
In diesem Artikel
Zusammenfassung
Die Kultivierung von humanen mesenchymalen Stromazellen (hMSCs) mit autologem Serum, reduziert das Risiko der Abstoßung durch xenogene Material und andere negative Auswirkungen. Es ermöglicht auch die Rückgewinnung von einer Untergruppe von mesodermalen Vorläufern, die frische hMSCs liefern kann. hMSCs in einem Eigen Fibringerinnsels Einbetten ermöglicht eine einfache Handhabung und effektive chirurgische Implantation.
Zusammenfassung
Humane mesenchymale Stromazellen (hMSCs) werden kultiviert in vitro mit unterschiedlichen Medien. Limits auf ihre Verwendung in der klinischen Einstellungen hängen jedoch hauptsächlich auf mögliche Biohazard und Entzündungen, die durch xenogene Nährstoffe für ihre Kultur ausgeübt Risiken. Menschliche Derivate oder rekombinante Materialien sind die erste Wahl Kandidaten, diese Reaktionen zu reduzieren. Daher Kultur Ergänzungen und Materialien autologer Herkunft stellen die besten Nährstoffe und die sichersten Produkte.
Hier beschreiben wir ein neues Protokoll für die Isolierung und Kultur von hMSCs Knochenmark in autologe Bedingungen - nämlich Patienten stammenden Serum als Ergänzung für das Kulturmedium und Fibrin als Gerüst für die hMSC Verwaltung. Tatsächlich könnte hMSC / Fibringerinnsel Konstrukten für mehrere klinische Anwendungen sehr nützlich sein. Insbesondere konzentrieren wir uns auf ihre Verwendung in der orthopädischen Chirurgie, wo die Fibringerinnsel aus dem eigenen Blut des Spenders abgeleitet erlaubteffektive Zellabgabe und Nährstoff / Abfallbörsen. Um eine optimale Sicherheitsbedingungen zu gewährleisten, ist es von äußerster Wichtigkeit, um die Risiken von hMSC-Transformation und Gewebeüberwucherung zu vermeiden. Aus diesen Gründen zeigt die Vorgehensweise in diesem Papier beschrieben auch eine minimal ex vivo hMSC Expansion, Zellseneszenz und morphologischen Veränderungen, und kurzfristige osteo-Differenzierung vor der Implantation zu verringern, osteogenen Linie Spezifikation zu induzieren, wodurch das Risiko einer nachfolgenden unkontrollierten abnehm Proliferation.
Einleitung
Humanen mesenchymalen Stromazellen (hMSCs) stellen eine der besten Zellquellen für technische Anwendungen in der Gewebe für 1,2 Förderung der Osteogenese. Sie lassen sich leicht aus dem Knochenmark und anderen adulten Geweben isoliert und Express typischen Oberflächenmarker wie CD90, CD105, CD73 1. Darüber hinaus können sie in verschiedene Zelltypen zu differenzieren, wie beispielsweise Osteoblasten, Chondrozyten und Adipozyten 3. Ihre therapeutische Wirkungen zugeschrieben , um ihre regenerative und trophische Eigenschaften 4. hMSCs könnte in der orthopädischen Chirurgie verwendet werden, sowie in anderen regenerativen klinische Anwendungen. Sie werden vorzugsweise mit Gerüsten kombiniert, 5 das klinische Ergebnis zu verbessern.
Im Vergleich zu anderen Materialien, zeigt das Fibrin - Gel interessante Eigenschaften wie Klebrigkeit, Resorption und effizienten Transport von Nährstoffen, die für eine Vielzahl von Tissue - Engineering - Anwendungen 6,7- es äußerst nützlich machen.
Die größte Herausforderung ein Tissue-Engineering-Ansatz in die klinische Anwendung bei der Übersetzung ist eine voll biokompatibel und biosicherem Gerüst und ein Xeno-freien Kulturmedium zu erhalten, die alle infektiösen oder reaktive Wirkung vermeidet.
In unserem Verfahren Fibrin - Gel, aus dem eigenen Blut des Patienten abgeleitet und autologem Serum, für in vitro hMSCs Kultur wurden als mögliche therapeutische Lösung in orthopädischen Bereich 8 verwendet.
Für klinische Zwecke werden hMSCs in der Regel über zwei Hauptverfahren verwaltet: (i) die "Ein-Schritt" -Verfahren (dh minimale Manipulation), die die Autotransplantation von Knochenmark ermöglicht, entweder ganz oder konzentriert (dh einkernigen Zellen), während der Operation; und (ii) die "Zwei-Schritt" -Verfahren (dh umfangreiche Manipulation), die auf der ex vivo Expansion von hMSCs beruht ihre Ausbeute vor der Implantation zu erhöhen, und erfordert GMP Einrichtungen 9. Interessanterweise ermöglicht Kultivieren von Zellen mit humanen adulten Serum anstelle von Rinderkälberserum die Rückgewinnung zusammen mit hMSCs, einer Teilmenge von Zellen (1 bis 10% in mononukleären Kulturen) genannt mesodermalen Progenitor Cells (MPCs), fähig ist , in vitro Differenzierung in frischem hMSCs 10,11. So kann hMPCs eine bedeutende Rolle bei den regenerativen Prozess spielen im Vergleich mit hMSCs allein 12,13. Schließlich hMSCs kurzfristige Osteo-Induktion schiebt ihre Differenzierung in die osteogenen Linie zu starten , ohne ihre proliferative Potential zu verlieren und die Lebensfähigkeit 12. Diese Ergebnisse bestätigen frühere Studien, die von hMSCs in vivo Knochenbildung berichtet , verbessert haben, gefolgt von einer Vorkultur in osteogenen Medium 14. Darüber hinaus kann ein autologem Plasma clot als Gerüst für die Zellabgabe leicht durch den Chirurgen und geformt manipuliert werden , um die Form des Knochenhohlraums 13 zu passen.
therefore, kann diese Methode für die Forscher und Kliniker sehr nützlich sein, die bei der Übersetzung wollen ihre hMSC-basierte Therapie von der Bank auf dem Bett in orthopädischen Anwendungen.
Protokoll
Das vorliegende Protokoll wurde im Einklang mit der World Medical Association Deklaration von Helsinki über die ethischen Grundsätze in der Forschung am Menschen entwickelt. Es wurde von der Ethikkommission der Azienda Ospedaliero-Universitaria Pisana genehmigt.
HINWEIS:
Das Knochenmark von Patienten erhalten wurde unterziehen Routine insgesamt Hüftoperation (nach 1.1 zu Schritt) 15; Plasma für das Gerinnsel Präparat wurde aus autologem peripheren Blut 13 erhalten wird ; autologem Serum, als Ergänzung für das Kulturmedium wurde von autologem Vollblut-Apherese gesammelt. Alle Patienten erhielten eine detaillierte Information über das Verfahren und unterzeichneten eine schriftliche Einverständniserklärung.
1. Sammlung der Knochenmarkprobe
- Sammeln Knochenmark aus dem Oberschenkelmarkkanal nach einer Hüft-TEP Operation (für Forschungsstudien). Kurz gesagt, während des chirurgischen Vorbereitung des Markkanals zu hOuse die Prothesenschafts, sammeln das Mark Blut , das überläuft (etwa 10 bis 15 ml, in Abhängigkeit von der Prothesengröße) 15.
ODER - Sammeln Sie Knochenmarkaspirat aus dem Beckenkamm unter örtlicher Betäubung, nach Standard hämatologischen Verfahren etwa 20 - 30 d im Voraus (für klinische Anwendungen) 16.
HINWEIS: In beiden Fällen heparinisierte Spritzen (Gerinnselbildung zu vermeiden) müssen für Knochenmarkwiederherstellung verwendet werden.
2. Herstellung von autologem Plasma
- Sammle 20 ml peripheres Blut von dem Patienten in Vakuum-Blutsammelröhrchen mit K3 EDTA (5,4 mg in 3 ml Röhrchen) und Zentrifugation bei 2.400 × g für 15 min.
- Aspirieren der Plasmakomponente in einem 15 ml-Röhrchen und gefrier bei -20 ° C bis zur Verwendung.
3. Herstellung der Autologe Serum
- Übertragen Sie die Einheit von Plasma in einen Transferbeutel ein Dorn verwendet wird. Ziehen Sie den gefüllten Beutel durch Schweißen und weigh der Beutel das Volumen an Plasma (1A) zu berechnen.
- Koagulieren der autologem Plasma von Calciumgluconat 100 Injizieren mg / ml bei 10% w / v durch den Anschluss - Stecker (1B). Nach dem Mischbeutel, legen Sie sie bei 4 ° CO / N ohne Schütteln Gerinnselbildung zu erleichtern.
- Zentrifugieren Sie den Beutel bei 4.900 × g für 15 min bei RT. Nehmen Sie die Zentrifugenbecher aus der Zentrifuge und entfernen Sie den Beutel vorsichtig (folgen Sie den Richtlinien des Herstellers für die Herstellung von Blutplättchenlysat) (1C).
- Isolieren Sie das Gerinnsel knapp oberhalb der Klemme Filtration zu erleichtern. Schließen Sie das Filtrations-Kit an den Transferbeutel mit einem Dorn platziert in die Austrittsöffnung des Filtrations-Kit.
- Hängen Sie die Tasche und öffnen Sie die blaue Klemme des Serums Fluss durch die Schwerkraft zu lassen. Üben Sie keinen Druck auf den Filter anwenden Übertragung von Fibrin in die Tasche zu vermeiden. den Schlauch Nach der Filtration versiegeln und den Beutel (folgen Sie dem Herstel entfernenlers Richtlinien zur Herstellung von Blutplättchenlysat).
- Schließen Sie eine Standleitung zum Endsacks und Transfer Serum in 50 ml-Röhrchen unter einer Laminar-Flow-Bank mikrobielle Kontamination zu vermeiden.
- Nehmen Sie eine Probe mit einer Spritze , die die Abwesenheit von Fibrinogen zu testen und eine Sterilitätstest für aerobe und anaerobe Bakterienkulturen 17 durchführen. Beschriften Sie die Rohre in geeigneter Weise und frieren sie bei - 20 ° C bis zur Verwendung.
4. Vorbereitung der Expansion Medium
- Bereiten Sie 500 ml vollständigen Proliferationsmedium. Um Dulbecco modifiziertem Eagle Medium - Low Glucose (DMEM-LG), mit 10% autologem Serum (erhalten wie in Abschnitt 3 beschrieben), 2 mM Glutamin, 1% Antibiotika-Lösung und 1% Antimykotika-Lösung. Sterile-Filter die vollständige Proliferationsmedium.
5. Isolierung von hMSCs aus dem Knochenmark
- Übertragung der Knochenmarkprobe (von 5 bis 10 ml) aus der Spritze in ein konisches 50 ml-tuund verdünnen Sie es mit steriler Kochsalzlösung (Verhältnis 1: 4). Vortex, um die 50-ml-Röhrchen für 30 s die Zellcluster aufzuschlüsseln.
- Erwärmen Sie die Dichte - Gradienten (Dichte 1,077 g / l; siehe Tabelle der Materialien) auf RT vor dem Gebrauch und der Schicht des verdünnten Knochenmark sanft (zu verhindern , dass beide Schichten Mischen) auf den Dichtegradienten durch Zugabe von 20 ml der Probe zu 15 ml Dichte Gradienten für jede 50 - ml - Rohr (2A).
- Zentrifuge bei 400 × g ohne Bremse bei 25 ° C für 30 min, dann sammeln die einkernigen Fraktion an der Flüssig-Flüssig-Grenzfläche und übertragen sie auf ein neues 50-ml-Röhrchen mit einer sterilen 5 ml Pipette.
- Waschen Sie die gesammelten einkernigen Fraktion zweimal mit komplettem Proliferationsmedium und Zentrifugieren Sie die Röhrchen bei 400 × g für 10 min bei 25 ° C Zellpellets zu erhalten.
- Überstand verwerfen und resuspendieren sanft jedes Zellpellet in 5 ml vollständigen Proliferationsmedium. Verdünnte bei einer 1: 100-Verhältnis für die Zellzählung.
- Zähle die Zellen mit einem Hämozytometer nach einer 1: 1-Verdünnung mit Trypan-Blau-Färbung der Zelllebensfähigkeit zu bewerten.
6. Kultur von hMSCs in Gegenwart von autologem Serum
- Füllen Sie zwei oder mehr 75 cm 2 Gewebekultur (TC) Fläschchen mit 15 ml frisches Vollproliferationsmedium und übertragen sie auf eine Zellkultur - Inkubator bei 37 ° C und 5% CO 2 bis zur Verwendung.
- Seed 0.3 - 0,5 x 10 6 Zellen / cm 2 (37,5 x 10 6 Zellen / 15 ml frisches Vollproliferationsmedium) und bei 37 ° C und 5% CO 2 für 48 h inkubiert.
- Zur gleichen Zeit, seed 1 x 10 6 Zellen in einem 25 cm 2 TC - Kolben mit 5 ml frischem Komplettproliferationsmedium für die Colony Forming Unit - Fibroblast (CFU-F) Assays. Kultur für 2 Wochen (in § 12 fortgesetzt werden).
- Entsorgen Sie das Medium und vorsichtig waschen die Flaschen aus dem Schritt 6.2 mit komplettem Proliferationsmedium zu remove nonadherent Zellen und Trümmer. Fügen Sie frisches Medium in die Kolben und ersetzen die Hälfte davon zweimal in der Woche, bis 70-80% Konfluenz (Primärkultur, Passage 0 (P0)) (2B).
- Gewinnen Sie die Zellen mit einem spezifischen rekombinanten Tier freie Protease (siehe Tabelle der Materialien, verwendet werden 3 ml der Lösung pro Kolben , wie vom Hersteller empfohlen) und Inkubation bei 37 ° C und 5% CO 2 für 10 min. In 6 ml vollständigen Proliferationsmedium pro Kolben und sammeln sich in einem 50 ml-Röhrchen. Wiederholen Sie Schritt 5.6.
Hinweis: Wichtig: Die Verwendung dieser Protease anstelle von Trypsin ermöglicht die Wiederherstellung einiger mesodermalen Vorläuferzellen (MPL) in der Kultur, die resistent ist Trypsin. - Für die weitere Expansion, Ausstrich der Zellsuspension bei 2.000 - 3.000 Zellen / cm 2 in neue 75 cm 2 TC - Flaschen (P1) (Abbildung 2C).
- Verwenden Sie Teilmengen von Zellen, die die Differenzierungspotenziale von MSCs zu bewertenin Richtung osteogenen, adipogenetische und chondrogenen Abstammungslinien. Führen Sie Differenzierungsassays folgenden Empfehlungen des Herstellers (2D).
HINWEIS: Unterschiedliche Färbungsmethoden können verwendet werden , multilineage Differenzierung zu bewerten.
7. Herstellung eines osteogenen Medium mit Pharmazie
- Verdünnte Ascorbinsäure-Lösung (Lösung 1A. Ascorbinsäure 200 mg / ml (Siehe Tabelle der Materialien) 1:10 mit DMEM-LG, erhalten eine 20 mg / ml Lösung (Lösung 1B, Arbeitslösung) Stock Aliquots von Lösungen 1A und 1B bei -20 ° C bis zur Verwendung.
- Resuspendieren 1 g Hydrocortison in 10 ml sterilem Wasser (Lösung 2A: Hydrocortison 100 mg / ml (Siehe Tabelle der Materialien) Verdünnen Sie die Lösung 2A bei . 1: 1000 mit DMEM-LG 100 ug / ml - Lösung (Lösung 2B zu erhalten, arbeiten Lösung). auf Aliquots von Lösungen 2A und 2B bei -20 ° C bis zur Verwendung.
- Bei Nutzung prepare frisch osteogenen Medium wie folgt: in DMEM-LG mit 10% autologem Serum, 50 ug / ml Ascorbinsäure und 0,4 ug / ml Hydrocortison. Sterile-Filter das osteogene Medium.
8. Osteogenisches Pre-Induktion und Gewinnung von hMSCs
- Vollständig das Proliferationsmedium entfernen und osteogenen Medium 96 h vor der Zellernte hinzufügen (dh 80 bis 90% Konfluenz in der Regel in 7 d erreicht ist). Einen zusätzlichen osteogenen Mediumwechsel 24 Stunden vor der Zellernte.
- Lösen Sie die Zellen wie in Schritt 6.5 beschrieben und resuspendieren sanft das Pellet Zugabe von 2 ml vollständigen Proliferationsmedium in einem 50 ml-Röhrchen.
HINWEIS: Die Lebensfähigkeit der Zellen kann (ca. 10%) reduziert werden kann als Ergebnis der Osteoinduktion. Zellaggregaten beobachtet werden. - Nach dem Zählen, wasche die Zellen mit vollständigen Proliferationsmedium und Zentrifugation bei 300 × g für 5 min. Das Pellet vorsichtig mit einem 1 - 2 x 10 6 lebensfähigen Zellen / 2ml autologem Plasma pro 50 ml-Röhrchen (siehe Abschnitt 2).
9. Herstellung von hMSC / Fibringerinnsels Konstrukten
- Zugabe von 150 & mgr; l Calciumgluconat bei 100 mg / ml zu jedem Röhrchen 50 ml, erhalten aus Schritt 8.3. und Resuspendieren der Zellen unter leichtem Schütteln.
- Inkubieren der Zellen bei 37 ° C und 5% CO 2 für 15 - 30 min hMSC / Fibringerinnsel Konstrukten (3A) zu erhalten. Vorbereiten eines Fibringerinnsels Konstrukt ohne Zellen als Kontrolle verwendet werden.
HINWEIS: WICHTIG: Es ist empfehlenswert , diese Steuer Gerinnsel mindestens 2 Stunden vor der Zelllebensfähigkeitstest herzustellen, wie es 30 Minuten oder mehr zur Vernetzung stattfindet.
10. Zell Viability Assay
- Entfernen Sie die Flüssigkeit aus den 50 ml - Röhrchen und 1 mL vollständigen Proliferationsmedium , das 10% v / v die Lebensfähigkeit der Zellen Reagenz (AB; siehe Tabelle der Materialien), nach den Richtlinien des Herstellers.
- inkubieren the Röhrchen bei 37 ° C und 5% CO 2 für 3 Stunden. Messen der Extinktion bei 570 nm mit einer Referenzwellenlänge von 600 nm (AB zum Zeitpunkt 0; t0).
- Überstand verwerfen und mit 2 ml frischem vollständigen Proliferationsmedium. Inkubieren bei 37 ° C, 5% CO 2 O / N. Am nächsten Tag (AB zum Zeitpunkt 24 h; t24), wiederholen Sie die Schritte 10.1 bis 10.3 (3B).
11. histologische Auswertung der Lebensfähigkeit der Zellen und Kalkablagerung innen Fibringerinnsels Konstrukten
- Befestigen Sie die hMSC / Fibringerinnsels Konstrukte in 4% w / v neutral gepuffertem Formalin O / N bei 4 ° C. Waschen Sie 4x in D-PBS für 15 min und Speicher in 70% Ethanol.
- Dehydratisieren der Proben bei 40 ° C in einer Serie von abgestuften Ethanol: 80% einmal für 30 min, 95% zweimal für 45 min und 100% für 1 h 3x. Klären zweimal in Xylol für 45 min bei 40 ° C.
- Spülen Sie die Proben in flüssigem Paraffin bei 60 ° C für 2 h und diese einbetten. Schneiden Sie den Paraffinblock mit einem Mikrotom und montieren ter Abschnitte (5 & mgr; m) auf Glasplatten.
- Stain die deparaffinisiert Abschnitte mit dem Standard - Hämatoxylin und Eosin (H & E) Verfahren (3C).
- Führen von Kossa-Färbung durch die Abschnitte mit 1% Silbernitrat für 15 min Behandlung, 0,5% Pyrogallol für 2 min und 5% Natriumthiosulfat für 2 min. Gegenfärbung der Schnitte mit 0,1% Kernechtrot in einer Lösung verdünnt, die 5 g Aluminiumsulfat für 5 Minuten und spülen Sie sie in Leitungswasser für 5 min. Montieren Sie die Abschnitte mit einem Befestigungsmittel.
- Bewerten Sie die Mineralabscheidung als schwarze Granulat unter dem Lichtmikroskop (400 - facher Vergrößerung) (3D).
12. CFU-F Assay
- Waschen Sie die 25 cm 2 Kolben (aus Schritt 6.3.) Mit D-PBS. Stain durch die Standard-May-Grunwald / Giemsa-Methode. HMSC Anzahl von einzelnen Kolonien Scoring (Abbildung 4) unter einem Lichtmikroskop visuell zu quantifizieren.
HINWEIS: Wenndas Knochenmark ist, wie in Schritt 1.2 gemacht. und die Abschnitte 2 - 9 sind in der Good Manufacturing Practice (GMP) mit der notwendigen behördlichen Genehmigung durchgeführt, die hMSC / Fibringerinnsels Konstrukte können für orthopädische Anwendungen implantiert werden.
Ergebnisse
Herstellung von autologem Serum
Plasma-Koagulation, durchgeführt von Calciumgluconat zum Transferbeutel Hinzufügen ermöglicht die Gewinnung von autologem Serum in großen Mengen, wie für die hMSC Kultur erforderlich. Tatsächlich mit dieser Technik ist es möglich , bis 200 ml Serum zu erzielen (Abbildung 1).
HMSC Isolierung, Kultur und Differenzierung unter Verwendung von autologem Serum
Die Knochenmark einkernigen Zellen werden isoliert eine Dichte - Gradienten, die zu einem Zwischenring Schicht gibt (2A). Durch diese Zellen Plattierung und die nicht - adhärenten diejenigen mit Waschen entfernt wird , ist es möglich , hMSCs (2B) zu isolieren. Unter autologe Kulturbedingungen, eine so genannte Untergruppe von Zellen, MPL, werden bei P0 erfasst und in Prozenten bis to 10%, je nach Patientenvariabilität (2B). MPCs sind noch nach Replattierung (dh P1) , wenn die Protease für die Zell Passagierung (2C) verwendet wird. hMSCs isoliert und kultiviert in einem Eigen Einstellung behalten ihre Fähigkeit zu den drei bekannten mesodermalen Abstammungslinien (osteogene, adipogenetische und chondrogene) zu unterscheiden. Die Differenzierungsassays wurden durchgeführt, die hMSC Bevölkerung Identität mit denen unter Verwendung von Standard (nonautologous) Kulturbedingungen erhalten zu vergleichen. Als Funktionalität Assays für dieses Protokoll, von Kossa - Färbung, Osmiumtetroxid - Färbung und Alcianblaufärbung bei pH 1 derjenigen , an Ort und Stelle ausgewählt wurden , durch die Differenzierung Medienhersteller vorgeschlagen (siehe Tabelle der Materialien) (2D).
Vorbereitung, Lebensfähigkeit und histologische Charakterisierung von MSC / Fibringerinnsels Konstrukte
Die hMSCs in Plasma dispergiert sind, die von Calciumgluconat in einem 50 - ml - Röhrchen vernetzt wird, was zur Bildung einer Gallerte Scheibe durch seinen Überstand umgeben (3A). Innerhalb dieser Plasmagerinnsel werden die hMSCs lebensfähig , wie durch die Farbänderung des Zellebensfähigkeit Farbstoff t24 von blau (Kontrolle ohne Zellen) nachgewiesen pink (cellularized Gerinnsel) (3B). Die Lebensfähigkeit der Zellen im Inneren des Gerinnsels wird durch H & E - Färbung bestätigt, eine gut erhaltene Zellmorphologie (3C) zeigt. Darüber hinaus nur ein minimaler osteoinduktiven vor der zweiten Zellernte führt zu vorläufigen Kalkablagerung durch stimulierte hMSCs (3D).
Koloniebildende Einheit
Die Anwesenheit von hMSC Kolonien nach 2 Wochen in Kultur durch den CFU-F - Test (4) gezeigt ist .
s = "jove_step" fo: keep-together.within-page = "1"> Anwendung von MSC / Fibringerinnsels in nicht gewerkschaftlich Knochen konstruieren
HMSC / Fibringerinnsels Konstrukte erhalten , wie in diesem Verfahren beschrieben (Schritt 1.1) wurden erfolgreich angewendet schwere Pseudoarthrosen oberen Extremität in 8 mitfühlend Fällen 13 zu behandeln. Langfristig (maximal 7,6 Monate) Beurteilung bestätigt erfolgreiche klinische und funktionelle Ergebnisse für alle Patienten ohne Nachweis von Gewebewucherung oder Tumorbildung.

Abbildung 1. Herstellung von autologem Serum.
(A) Die Plasmaeinheit ist in einem Transferbeutel mit der Spitze übertragen; (B) Das Plasma wird geronnen durch Calciumgluconat durch den Port - Anschluss Injektion; (C) Ein Blutbeutel Zentrifuge verwendet , um das Serum zu trennen./files/ftp_upload/54845/54845fig1large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
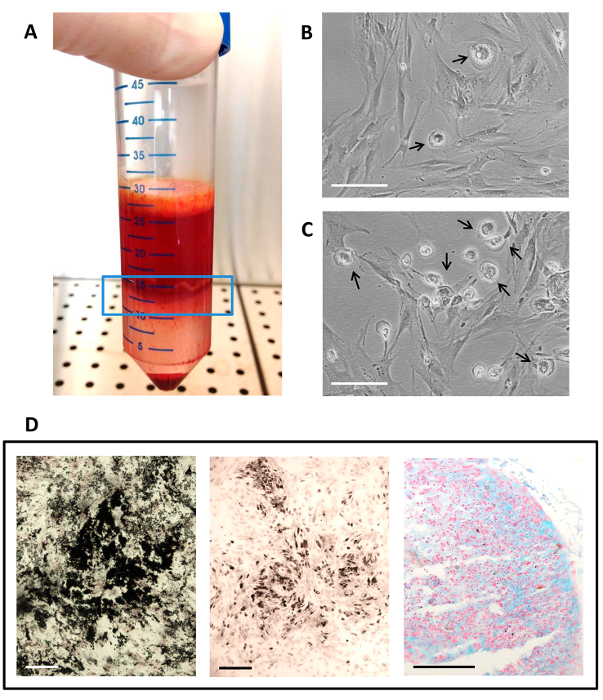
Abbildung 2. hMSC Isolierung, Kultur und Differenzierung unter Verwendung von autologem Serum.
(A) Die mononukleäre Zellschicht (in der blauen Linie Fenster) , erhalten nach Knochenmark mit einem Dichtegradienten Zentrifugation; (B) Die Zellkultur , wie es auf P1 erscheint; (C) die Zellkultur , wie es bei P0 (Primärkultur) erscheint; (B - C) Die Pfeile zeigen Präsenz von MPL in der MSC - Kultur. Maßstabsbalken ist 100 & mgr; m; (D) Histochemischer Ergebnisse multilineage Differenzierungsassays. Osteogenen Differenzierung ist für Mineralmatrixabscheidung unter Verwendung von Kossa-Färbung beurteilt in schwarz, adipogenetische Differenzierung wird durch Osmium tetroxi in schwarz durch die Anwesenheit von Fett Vakuolen, gefärbt gezeigtde, und chondrogene Differenzierung wird durch die Anwesenheit von sulfatierten Glykosaminoglykanen angezeigt, die von Alcian-Blau-Färbung bei pH 1. Maßstabsbalken in cyan gefärbt werden, ist 50 um. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
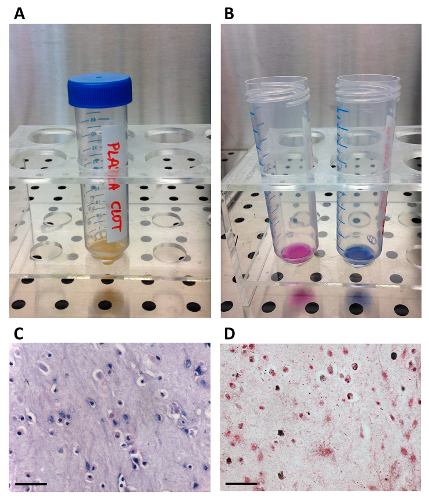
Abbildung 3. Vorbereitung, Viability und histologische Charakterisierung von MSC / Fibringerinnsels Konstrukten.
(A) Die hMSC / Fibringerinnsel - Konstrukt , wie es scheint , nach der Vernetzung; (B) Ergebnisse der AB - Test: Die MSCs sind lebensfähig innerhalb Fibringerinnsel, wie durch die Farbänderung der Lebensfähigkeit der Zellen Farbstoff (t24) gezeigt, von blau (Kontrolle ohne Zellen, auf der rechten Seite ) bis rosa (cellularized Gerinnsel, auf die links). (C - D) Histochemischer Ergebnisse von hMSC / Fibringerinnsels Konstrukte. Maßstabsbalken ist50 um. (C) Hämatoxylin und Eosin - Färbung zeigt lebensfähige Zellen in der Fibrinmatrix eingebettet ist ; (D) Mineralmatrixablagerung in schwarz gefärbt durch von Kossa - Färbung, die eine anfängliche Osteogenesis bestätigt. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
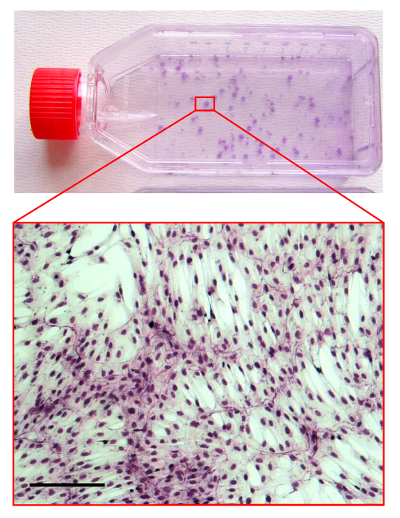
Abbildung 4. CFU-F - Test.
Bild von einem Kolben kultiviert mit hMSCs befleckt von May-Grunwald / Giemsa-Methode. Der gezoomte-in-Bereich ist eine lichtmikroskopische Aufnahme der Morphologie einer hMSC Kolonie zeigt. Maßstabsbalken ist 100 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
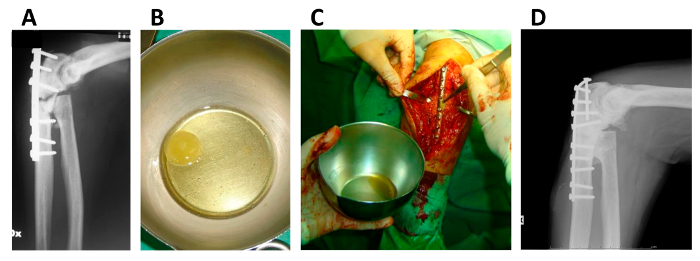
Abbildung 5. Anwendung von hMSC / Fibringerinnsel Konstrukt in Knochen Pseudarthrose.
(A) X-ray der oberen Extremität eines Patienten durch Pseudoarthrose betroffen; (B) hMSC / Fibringerinnsel Konstrukt kurz vor der Implantation; (C) Die chirurgische Anwendung des hMSC / Fibringerinnsel Konstrukt; (D) X-ray der oberen Extremität desselben Patienten nach 5 Jahren. Diese Zahl wird von Giannotti S. et al erneut veröffentlicht. mit minimalen Modifikationen 13. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Die kritischen Schritte dieses Protokolls betreffen die Verwendung von humanen adulten Serum und Protease, die eine Biosafe hMSC-Therapie zu erhalten erlauben. Insbesondere ermöglicht die erwachsenen Menschen Serum Isolierung und Wartung, während Protease die Ernte gewährleistet, von MPL. Dies sind unreife Zellen, die in Knochenmark, die zu frischem hMSCs geben kann, so dass ein Reservoir von lebensfähigem hMSCs entlang der Kulturzeit gewährleistet. Nicht alle MPCs können gesammelt werden, da auf die Protease-Aktivität, die Belichtungszeit zu erhöhen, um hMSC Lebensfähigkeit schädlich ist. Aus diesem Grund ist eine 10 min Protease Inkubation wurde als optimaler Kompromiss zwischen der Gewinnung von MPL und die Lebensfähigkeit von hMSCs ausgewählt. Ein weiterer wichtiger Schritt ist osteodifferentiation Zeit. Tatsächlich würde eine umfangreiche In - vitro - osteodifferentiation wesentlich die Lebensfähigkeit der Zellen zu reduzieren, so dass die endgültige Knochenbildung in vivo zu beeinflussen. Der letzte entscheidende Schritt besteht in Bung eines autologe biologisch resorbierbares Gerüst, which wird durch Einbetten der Zellen (hMSCs und MPCs) in einem Fibrin-Gel von Plasmagerinnungs erhalten.
Ein wichtiger Schritt, die Ausbeute an MPCs zu verbessern, ist einkernigen Zellen bei höherer Konzentration auf Saatgut. Apherese-Verfahren unter Verwendung von Plasma zu erhalten und es mit Calciumgluconat Behandlung ermöglicht es, autologem Serum in großen Mengen zu erzielen. Es wurde beobachtet, daß humanes Serum als Medium-Ergänzung ist vergleichbar mit fötalem Rinderserum (FBS) in hMSC Kulturen. Doch in unserer Erfahrung, ein komplettes Medium mit FBS trägt zu einer schnelleren Seneszenz als erwachsenen Menschen Serum. Ein wichtiger Schritt besteht darin, eine minimale Osteoinduktion zu hMSCs Verabreichung. Tatsächlich führt diese Behandlung die Zellen leicht in Richtung der osteogenen Linie zu differenzieren und somit nützlich sind in vivo weitere Zelltransformation zu vermeiden. Um eine gute Lebensfähigkeit der minimal osteoinduced hMSCs halten, wird empfohlen, sorgfältig die Empfehlungen in den Schritten 6.5 beschrieben zu folgen. eind 8.2., einschließlich Handhabung, Zentrifugieren und mittlere Mengen hinzugefügt werden. Wenn ein Apherese nicht verfügbar ist, ist es noch möglich, dieses Protokoll zur Durchführung von mehreren Blut Durchführung zieht an den Patienten oder in alternativen, durch gebündelte Einkaufs AB Seren. Offensichtlich, um dieses Protokoll von der Bank-zu-Bett zu bringen, ist es zwingend notwendig, GMP Zellfabriken zu haben, oder Äquivalente, zur Verfügung.
Einschränkungen bei der Anwendung dieser Technik betreffen die anämisch, hämatologische-Onkologie und Orthopädie von Osteomyelitis betroffenen Patienten., Zeichnung große Mengen an Blut von anämischen Patienten, sollten vermieden werden. In onkologischen Patienten wird die Qualität der Zellproben von Chemotherapie-Behandlungen betroffen, während bei Osteomyelitis Patienten kann die Infektion auf das Endergebnis auswirken. In allen Fällen, in denen die autologe Serum unzureichend oder ungeeignet ist, repräsentieren gepoolte männlich AB Seren eine gute Alternative.
Mit Zell / Fibrin Clot - Konstrukte für mögliche klinische Anwendungen ist entscheidend , um eine vollständig autologe Zelltherapie zu lösen, die leicht sein könnte , während der Operation zu behandeln und Formenbau, in hervorragende Ergebnisse daraus resultierende Knochen Pseudarthrosenbildung 13 zu behandeln. Minimale Manipulation und umfangreiche Manipulation 9: Für klinische Zwecke werden hMSCs in der Regel über zwei Hauptverfahren verabreicht werden . Um die Probleme im Zusammenhang mit einer umfassenden Ex - vivo - Kultur, wie Anomalien in der Zellmorphologie und Größe zu überwinden 18, führten wir eine kurze Zeit ex vivo Zellexpansion und Osteo-Differenzierung (nur 4 d).
Das Xeno-freies Protokoll in diesem Papier beschrieben, zusammen mit den kurzen Zellexpansion und osteodifferentiation mal, demonstriert in Kliniken , um relevant sein schnell Knochen - Produktion in vivo zu erhalten, ohne Anzeichen von Gewebewucherung und Transformation, wodurch bestätigt seine Wirksamkeit und lange -term Sicherheit in Knochenreparatur (Figur 5) 13.
Die Methodik in diesem Bericht wird zum Nachweis der Wirksamkeit und Sicherheit von hMSC in vitro - Expansion in autologe Bedingungen für eine mögliche Verwendung in der orthopädischen Chirurgie ausgerichtet. Dieses Protokoll verwendet hMSCs isoliert aus Knochenmark und in einem Medium mit autologem Serum ergänzt und in autologem Fibrin-Gerinnsel eingebettet, wodurch eine vollständig autologe Zelltherapie gewährleistet wird. Die zweifache osteogene Induktions, kurz vor dem zweiten Ablösung, verbessert hMSC Fähigkeit zu Osteoblasten zu differenzieren. Als Ergebnis ist diese Technik besonders für Anwendungen geeignet, in Knochendefekte, da es nicht zu Pseudarthrose beschränkt ist. Mögliche zukünftige Anwendungen könnten Talus Zyste und Knochenschwund-Management beinhalten.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
This study was funded by the Tuscany Region (grant number 539999_2014_Petrini_CUCCS). The authors would like to thank Prof. S. Berrettini for authorizing the use of the Otolab laboratory and instruments, and the surgery staff from the Orthopedic Clinic II of the University of Pisa, for the fundamental cooperation in sample harvesting. The support provided by Dr. F. Scatena is gratefully acknowledged. Finally, many thanks are due to Mr. J.G. De La Ossa for his precious contribution to histologic processing.
Materialien
| Name | Company | Catalog Number | Comments |
| Triple Select (1x) | GIBCO, LIFE TECHNOLOGIES | 12563-029 | cell culture |
| Trypan blue stain | GIBCO, LIFE TECHNOLOGIES | 15250061 | cell culture |
| DMEM-LG, no glutamine, no phenol red | GIBCO, LIFE TECHNOLOGIES | 11880-028 | cell culture |
| Glutamax (100x) | Gibco, Life Technologies | 35050038 | cell culture |
| Penicillin/Streptomycin sol. | Gibco, Life Technologies | 15140122 | cell culture |
| Alamar Blue (AB) | Gibco, Life Technologies | DAL1025 | proliferation/viability assay |
| Ficoll-Paque Plus | GE Healthcare | 17-14440-02 | cell culture |
| D-PBS | Gibco, Life Technologies | 14190-094 | cell culture |
| StemMACS AdipoDiff Media | Miltenyi Biotech | 130-091-677 | cell culture |
| StemMACS ChondroDiff Media | Miltenyi Biotech | 130-091-679 | cell culture |
| hMSC Osteogenicdiff BulletKit | Euroclone | LOPT3002 | cell culture |
| Vitamin C (ascorbic acid) | Bayer | ATC Code: A11GA01 | Pharmaceutical grade drug |
| Flebocortid Richter (hydrocortisone) | Aventis Pharma | ATC Code: H02AB09 | Pharmaceutical grade drug |
| Victor X3, reader | PerkinElmer | 2030 multilabel reader | proliferation/viability assay |
| Silver nitrate | Sigma Aldrich | 209139 | histological assay |
| Pyrogallol | Sigma Aldrich | 16040 | histological assay |
| Sodium Thiosulphate | Sigma Aldrich | S8503 | histological assay |
| Histoplast LP | Thermo Scientific | 8332 | histological assay |
| Methanol | Sigma Aldrich | 32213 | histological assay |
| Ethanol | Sigma Aldrich | 2860 | histological assay |
| Nuclear fast red | Sigma Aldrich | 60700 | histological assay |
| Formalin | Bio-optica | 05-K01009-X40 | histological assay |
| Eosin B | Sigma Aldrich | 45260 | histological assay |
| DPX | Sigma Aldrich | 6522 | histological assay |
| Haematoxylin | Sigma Aldrich | H3136 | histological assay |
| Aluminium Sulphate | Sigma Aldrich | 202614 | histological assay |
| Xylol | Sigma Aldrich | 534056 | histological assay |
| Microtome | Leika | histological assay | |
| May Grunwald | Sigma Aldrich | MG1L-1L | histological assay |
| Giemsa | Sigma Aldrich | 32884-250ML | histological assay |
| Transfer bag | Biomérieux | BC0300031 | cell culture |
| Filtration kit | Macopharma | BC0800010 | cell culture |
| Calcium Gluconate | Galenica Senese | Pharmaceutical grade drug | |
| Bact Alert | Biomérieux | 259790 anaerobic | microbiological assay |
| Bact Alert | Biomérieux | 259789 aerobic | microbiological assay |
| Steryle Luer-Lok Syringe 50 mL | BD Plastipak | 300865 | cell processing |
| Heraeus Cryofuge 6000i | Thermo Scientific | blood bag centrifuging | |
| SL16R Centrifuge | Thermo Scientific | blood tube centrifuging |
Referenzen
- Horwitz, E. M., et al. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy. 7, 393-395 (2005).
- Kassem, M., Abdallah, B. M. Human bone marrow-derived mesenchymal stem cells: biological characteristics and potential role in therapy of degenerative diseases. Cell Tissue Res. 331, 157-163 (2008).
- Pittenger, M. F., et al. Multilineage potential of adult human mesenchymal stem cells. Science. 284, 143-147 (1999).
- Bonfield, T. L., Nolan Koloze, M. T., Lennon, D. P., Caplan, A. I. Defining human mesenchymal stem cells efficacy in vivo. J Inflamm. (Lond). 25 (7), 51 (2010).
- Pneumaticos, S. G., Triantafyllopoulos, G. K., Chatziioannou, S., Basdra, E. K., Papavassiliou, A. G. Biomolecular strategies of bone augmentation in spinal surgery. Trends Mol. Med. 17 (4), 215-222 (2011).
- Amhed, T. A. E., Dare, E. V., Hincke, M. Fibrin: A versatile scaffold for tissue engineering applications. Tissue Engineering Part B. 14 (2), 199-215 (2008).
- Silbertein, L. E., Williams, L. J., Huglett, M. A., Magee, D. A., Weisman, R. A. An autologous fibrinogen-based adhesive for use in oncologic surgery. Transfusion. 28 (4), 319-321 (1988).
- Jockenhoevel, S., et al. Fibrin gel advantages of a new scaffold in cardiovascular tissue engineering. Eur. J. Cardiothorac Surg. 19 (4), 424-430 (2001).
- Veronesi, F., et al. Clinical use of bone marrow, bone marrow concentrate, and expanded bone marrow mesenchymal stem cells in cartilage disease. Stem Cells Dev. 22 (2), 181-192 (2013).
- Petrini, M., et al. Identification and purification of mesodermal progenitor cells from human adult bone marrow. Stem Cells Dev. 18 (6), 857-866 (2009).
- Trombi, L., et al. Selective culture of mesodermal progenitor cells. Stem Cells Dev. 18 (8), 1227-1234 (2009).
- Trombi, L., et al. Human autologous plasma-derived clot as a biological scaffold for mesenchymal stem cells in treatment of orthopedic healing. J. Orthop. Res. 26 (2), 176-183 (2008).
- Giannotti, S., et al. Use of autologous human mesenchymal stromal cell/fibrin clot constructs in upper limb non-unions: long term assessment. PlosOne. 8 (8), 73893 (2013).
- Castano-Izquierdo, H., et al. Pre-culture period of mesenchymal stem cells in osteogenic media influences their in vivo bone forming potential. J. Biomed. Mater. Res. A. 82 (1), 129-138 (2007).
- Malkani, A. L., Fitzgerald, R. H., Kaufer, H. . Orthopaedics. , (2002).
- Lee, S. H., et al. ICSH guidelines for the standardization of bone marrow specimens and reports. Int J Lab Hematol. 30 (5), 349-364 (2008).
- Bugno, A., et al. Application of the BacT/ALERTR 3D system for sterility testingof injectable products. Braz J Microbiol. 46 (3), 743-747 (2015).
- Bonab, M. M., et al. Aging of mesenchymal stem cells in vitro. BMC Cell Biology. 7, 14 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten