Method Article
중간 엽 기질자가 조건에서 세포 배양 배송 : 정형 외과 응용 프로그램에 대한 스마트 접근
요약
자가 혈청 인간 중간 엽 기질 세포 (중배엽 줄기 세포)를 배양, 이종 재료 및 기타 부정적인 영향에 의한 거부 반응의 위험을 줄일 수 있습니다. 또한 신선한 중배엽 줄기 세포를 제공 할 수 중배엽 전구 세포의 부분 집합의 복구 할 수 있습니다. 자가 섬유소 응고에 중배엽 줄기 세포를 포함하면 취급이 용이하고 효과적인 수술 주입을 할 수 있습니다.
초록
인간 중간 엽 기질 세포 (중배엽 줄기 세포는) 다른 미디어와 체외에서 배양한다. 임상에서의 사용에 대한 제한은, 그러나, 주로 그들의 문화에 대한 이종 영양소에 의해 가해지는 잠재적 생물과 염증 위험에 따라 달라집니다. 인간 유도체 또는 재조합 물질이 반응을 줄이기 위해 먼저 선택 후보이다. 따라서, 문화 보충 및자가 원산지 재료는 최고의 영양과 안전한 제품을 나타냅니다.
여기, 우리는자가 조건의 분리 및 골수 중배엽 줄기 세포의 배양을위한 새로운 프로토콜을 설명하는 - 즉, 환자 유래 혈청을 hMSC 관리를위한 발판으로 문화 매체와 섬유소를위한 보충 교재로. 사실, hMSC / 섬유소 응고 구조는 여러 임상 적용에 매우 유용 할 수있다. 특히, 우리는 기증자의 자신의 혈액에서 파생 된 섬유소 응고 허용 정형 외과에서의 사용에 초점효과적인 세포 전달 및 영양 / 폐기물 교환. 최적의 안전 조건을 보장하기 위해, hMSC 변태 조직 과증식의 위험을 방지하기 위해 매우 중요하다. 이러한 이유로,이 문서에서 설명하는 방식은 이에 후속 제어되지 않은 위험을 감소, 주입 전에 세포 노화 및 형태 학적 변화 및 단기 골관절염 분화를 감소시키는 골 형성 혈통 사양을 유도하는 최소한의 생체 hMSC 확장을 나타낸다 분아 증식.
서문
중배엽 간질 세포 (중배엽 줄기 세포)가 골 형성을 촉진 1,2- 조직 공학에서의 사용을위한 최적의 셀 소스 중 하나를 나타낸다. 그들은 쉽게 골수 및 기타 성인 조직에서 분리, 및 CD90, CD105, CD73 한 전형적인 표면 마커를 표현하고 있습니다. 또한, 이들은 예 골아, 연골 세포 및 지방 세포 (3)와 같은 여러 종류의 세포로 분화 할 수있다. 이들의 치료 효과들은 재생과 영양 특성 (4)에 기인한다. 중배엽 줄기 세포는 다른 회생 임상 응용 프로그램에서뿐만 아니라, 정형 외과 수술에 사용할 수 있습니다. 이들은 바람직하게는 임상 적 결과 (5)을 개선하기 위해, 발판과 결합된다.
다른 재료에 비해, 피브린 겔은 접착 성, 재 흡수 및 조직 공학 응용 -6,7- 다양한 것이 매우 유용한 영양소의 효율적인 전송 흥미로운 특성을 나타낸다.
완전 생체 적합성 및 biosafe 비계 및 감염성 또는 반응성 효과를 피하는 이종없는 배지를 획득한다 임상 응용 프로그램에 조직 공학적 접근 방법을 번역의 주요 과제.
우리 환자 자신의 혈액으로부터 유래있어서, 피브린 겔, 및자가 혈청, 체외 중배엽 줄기 세포 배양, 정형 외과 분야 8 가능한 치료 용액으로 사용 하였다.
임상 목적을 위해, 중배엽 줄기 세포는 일반적으로 두 가지 절차를 통해 투여된다 : (ⅰ) 중 전부 또는 (즉, 단핵 세포) 농축 골수의 자동 이식을 허용하는 "한 단계"절차 (즉, 최소한의 조작),, 수술 중; 및 (ii) 주입 전에 수율을 증가시키는 중배엽 줄기 세포의 생체 외 팽창을 기반으로하는 "은 두 단계의"절차 (즉, 광범위한 조작), 및 G를 필요MP 시설 (9). 신선한에 체외 분화 할 수있는, - (단핵 문화 10 % 1)라고 중배엽 전구 세포 (MPC와) 흥미롭게도, 대신 소 혈청의 인간 성인의 혈청 배양 세포는 세포의 부분 집합의 함께 중배엽 줄기 세포로 복구 할 수 있습니다 중배엽 줄기 세포 10, 11. 따라서 hMPCs는 중배엽 줄기 세포 형 (12, 13)와 비교할 때 회생 과정에서 중요한 역할을 할 수있다. 마지막으로, 단기 골관절염 유도 잠재적 자신의 증식을 잃고 12 생존 않고 골 형성 혈통으로 분화를 시작하는 중배엽 줄기 세포를 푸시합니다. 이러한 결과는 골 형성 매체 (14)의 예비 배양 한 다음 중배엽 줄기 세포로 생체 내 골 형성에 향상된보고 한 이전의 연구를 확인합니다. 또한, 세포 전달을위한 지지체로서자가 혈장 응고 쉽게 의사에 의해 조작 뼈 공동 (13)의 형상에 맞춰 성형 될 수있다.
일erefore,이 방법은 정형 외과 분야에서 침대 옆에 벤치에서 자신 hMSC 기반 치료를 번역을 목표로하는 연구자와 임상의를위한 매우 유용 할 수 있습니다.
프로토콜
본 프로토콜은 연구와 관련된 인간의 윤리적 행위에 관한 헬싱키 세계 의학 협회의 선언에 따라 개발되었다. 그것은 AZIENDA Ospedaliero-Universitaria Pisana 지역의 윤리위원회에 의해 승인되었다.
노트:
골수 일상 고관절 교체 수술을받은 환자로부터 얻은 15 (1.1 단계에 따라); 응고 준비를위한 플라즈마자가 말초 혈액 (13)로부터 얻은 것입니다; 자가 혈청 배양액에 대한 보충제 등의자가 전체 혈액 성분 채집에서 수집 하였다. 모든 환자는 절차에 대한 자세한 정보를받은 서면 동의서에 서명했다.
뼈 골수 샘플 1. 컬렉션
- (조사 연구) 총 고관절 교체 수술 후 대퇴 뼈 속질에서 골수를 수집합니다. 시간에 뼈 속질의 수술 준비하는 동안 간단히,(- 보철물의 크기에 따라 15 mL의 약 10) (15) 보철 줄기를 여러개, 오버 플로우 골수의 혈액을 수집합니다.
또는 - (임상 응용 프로그램에 대한) 사전에 30 D 16-20에 대한 표준 혈액 절차에 따라, 국소 마취하에 장골에서 골수 흡인를 수집합니다.
주 : 주사기 헤파린 두 경우 (혈전 형성을 방지하기 위해) 골수 회복을 위해 사용되어야한다.
자가 플라즈마 2. 준비
- 15 분 동안 2,400 × g에서의 K3 EDTA를 함유하는 진공 혈액 수집 튜브 환자 (3 ㎖ 튜브에 5.4 mg) 및 원심 분리기에서 말초 혈액 20 ㎖를 수집한다.
- 15 ㎖의 튜브의 플라즈마 성분 대기음 사용 때까지 -20 ℃에서 동결.
자가 혈청 3. 준비
- 스파이크를 사용하는 전사 가방에 플라즈마의 부 옮긴다. 용접 및 weig에 의해 채워진 가방을 분리H 가방 플라즈마 (도 1a)의 체적을 계산한다.
- 포트 커넥터 (도 1b)을 통해 / V w는 10 % 글루 콘산 칼슘 100 ㎎ / ㎖를 주입하여자가 혈장 응고. 가방을 혼합 한 후, 혈전 형성을 촉진하기 위해 흔들림없이 4 ° CO / N에 놓습니다.
- 실온에서 15 분 동안 4,900 × g에서 가방을 원심 분리기. 원심 분리기에서 원심 분리기의 버킷을 가지고 (그림 1C) (혈소판 해물의 제조를위한 제조업체의 지침을 따르십시오) 신중하게 가방을 제거합니다.
- 여과을 용이하게하기 위해 단지 클램프 위의 응고를 분리합니다. 여과 키트의 출구에 배치 된 스파이크를 사용하여 전송 가방 여과 키트를 연결한다.
- 가방을 걸고 중력에 의해 혈청 흐르게하는 푸른 클램프를 엽니 다. 가방에 섬유소의 전송을 방지하기 위해 필터에 압력을 가하지 마십시오. 여과 후, 튜브를 밀봉하고, 제조용를 따라 (가방을 제거혈소판 해물의 준비를위한 turer의 가이드 라인).
- 미생물 오염을 방지하기 위해 층류 벤치에서 50 ㎖ 튜브에 최종 가방 및 전송 혈청에 전용 회선을 연결합니다.
- 피브리노겐의 유무를 검사하고 호기성 및 혐기성 세균 배양 물 (17)에 대한 멸균 테스트를 수행하기 위해 주사기로 샘플을 취. 적절 튜브 라벨과 그들을 동결 - 20 ° C까지 사용.
확장 중간 4. 준비
- 완전한 확산 매체의 500 ㎖를 준비합니다. 둘 베코의 변형 이글 중간 - 낮은 포도당 (DMEM-LG), (3 절에 설명 된대로 획득) 10 %자가 혈청, 2 mM의 글루타민, 1 % 항생제 용액 1 % 항진균제 솔루션을 추가 할 수 있습니다. 살균 필터 전체 확산 매체.
뼈 골수에서 중배엽 줄기 세포의 분리 (5)
- 50 ML 원뿔 TU에 주사기로 - (10 ㎖ 5) 골수 샘플 전송하고 멸균 식염수에 희석 (비율 1 : 4). 30 (S)은 셀 클러스터들을 분해하기 위해 50 ㎖ 튜브 소용돌이.
- 밀도의 15 mL의 샘플을 20 ㎖를 첨가하여 농도 구배 상으로 (양 층을 혼합하는 것을 방지하기 위해) 사용하기 전에 실온으로 서서히 희석 골수 층과, 밀도 구배 (원료의 표를 참조 밀도 1.077 g / L)을 따뜻하게 각 50ml의 튜브 (그림 2A) 그라데이션.
- 30 분 동안 25 ° C에서 브레이크가없는 400 × g에서 원심 분리 한 후, 액체 - 액체 계면의 단핵구 분획을 수집하고 멸균 5 ㎖ 피펫을 사용하여 새 50 ㎖ 튜브에 옮긴다.
- 완전 증식 배지 회 수집 된 단핵구 분획을 세척하고 세포 펠렛을 얻기 위해 25 ° C에서 10 분 동안 400 × g에서 원심 분리 튜브.
- 뜨는을 취소하고 부드럽게 완전한 확산 매체의 5 ㎖의 각 세포 펠렛을 재현 탁. 세포 계수 100 비율 : 1로 희석.
- 세포 생존 능력을 평가하기 위해 트리 판 블루 염색 한 희석 : 1 후 혈구를 사용하여 세포를 계산합니다.
자가 혈청의 존재에 중배엽 줄기 세포의 6. 문화
- 신선한 완전 증식 배지 15 mL로 두 개 이상의 75cm 2 조직 배양 (TC) 플라스크를 작성 및 사용까지 CO 2, 37 ℃ 세포 배양 인큐베이터로 옮기고 5 %.
- 종자 0.3 - 0.5 × 106 세포 / ㎠ (37.5 × 106 세포를 신선한 완전 증식 배지 / 15 ㎖)을 48 시간 동안 CO 2, 37 ℃에서 5 % 부화.
- 동시에, 집락 형성 단위 신선한 완전 증식 배지 5 ㎖와 25cm 2 TC 플라스크 시드 1 × 106 세포 - 섬유 아세포 (CFU-F) 분석. 2 주 문화 ((12)에서 계속된다).
- 매체를 취소하고 부드럽게 렘 완전한 확산 매체 단계 6.2에서 플라스크를 씻어비 접착 세포와 파편을 비켜. , 플라스크에 신선한 매체를 추가하고 일주일에 두 번 그것의 절반을 교체 70까지 - 80 % 컨 플루 (주 문화, 항로 0 (P0)) (그림 2B).
- 10 분 동안 CO 2, 37 ℃에서 배양한다, 5 %, 특정 재조합 동물 자유 프로테아제를 사용하여 균체를 회수 (제조사 권장 플라스크 당 용액 3 ㎖를 사용하여 재료의 도표 참조). 플라스크 당 전체 확산 매체의 6 mL를 넣고 한 50 ㎖ 튜브에 수집합니다. 단계를 반복 5.6.
참고 : 중요 : 대신 트립신이 단백질 분해 효소의 사용은 내성 트립신 된 문화에 존재하는 일부 중배엽 조상 세포 (MPC와)의 복구를 할 수 있습니다. - 3000 세포의 새로운 75cm 2 TC 플라스크 (P1)에 / cm 2 (그림 2C) - 추가 확장을 위해, 2,000에서 세포 현탁액을 replate.
- 중간 엽 줄기 세포의 분화 잠재력을 평가하기 위해 세포의 분취 액을 사용하여골 형성, 지방 세포와 연골 계통으로. 제조업체의 권장 (그림 2D)를 다음과 분화 분석을 수행합니다.
주의 : 다른 염색 방법 multilineage 분화를 평가하기 위해 사용될 수있다.
제약 보조 식품과 함께 골 형성 중간 7. 준비
- 아스코르브 산 용액 (희석 솔루션 1A :. 아스코르브 산 200 mg을 / ㎖가 (), 20 ㎎ / ㎖ 용액 (용액 1B를 수득 DMEM-LG 작업 용액 자재 테이블) 1:10 참조 용액 (1A)의 스톡 분취하고 사용 때까지 -20 ° C에서 (1B).
- 멸균 물 10 ㎖에 재현 탁 1g의 하이드로 코르티손 (솔루션 2A : 하이드로 코티손 100 ㎎ / ㎖ (재료의 표 참조) (1)에 희석 용액 (2A) :. DMEM-LG와 1,000 일, 100 μg의 / mL의 용액 (솔루션 (2B)을 얻었다 용액). 사용 전까지 -20 ℃에서 용액 2a 및도 2b의 스톡 분취.
- 사용 P시다음과 같이 새로운 골 형성 매체 repare : 10 %자가 혈청, 50 μg의 / ML의 아스 코르 빈산 및 0.4 μg의 / ML의 하이드로 코르티손과 DMEM-LG를 추가합니다. 살균 필터 골 형성 매체.
8. 골 형성 전 유도 및 중배엽 줄기 세포의 복구
- 완전 확산 매체를 제거하고 세포 수확하기 전에 골 형성 매체 96 시간을 추가합니다 (즉, 80-90%의 합류는 일반적으로 7 일 이내에 도달). 추가 골 형성 매체 변화를 세포 수확 전에 24 시간을 제공합니다.
- 단계 6.5에 기재된 부드럽게 50 ㎖ 튜브에 완전 증식 배지 2ml를 첨가 펠렛을 재현 탁으로 세포를 분리.
주 : 생존율 osteoinduction의 결과 (10 %)을 저감 할 수있다. 세포 응집체가 관찰 될 수있다. - 계산 한 후, 5 분 동안 300 × g에서 완전한 확산 매체와 원심 분리기로 세포를 씻어. 2 × 10 6 가능한 세포 / 2-1에서 부드럽게 펠렛을 재현 탁자가 혈장 mL를 50 mL의 튜브 당 (섹션 2 참조).
hMSC / 섬유소 응고를 구축 9. 준비
- 단계 8.3에서 얻은 각 50 ㎖ 튜브에 100 ㎎ / ㎖에서 칼슘 글루코 네이트의 150 μl를 추가합니다. 부드러운 진탕 세포를 재현 탁.
- hMSC / 섬유소 응괴 구조 (도 3a)를 얻기 위해 30 분 - 15 CO 2, 37 ℃에서 세포를 인큐베이션하고, 5 %. 세포없이 섬유소 응괴 구조체를 준비가 대조군으로 사용한다.
참고 : 중요 : 가교에 30 분 이상 소요로 적어도 2 시간 세포 생존 분석하기 전에이 제어 혈전을 준비하기를 권장합니다.
10. 세포 생존 분석
- 50 ㎖의 튜브에서 액체를 제거하고 10 % v / V를 세포 생존 시약을 포함하는 완전한 증식 배지 1 mL를 넣어 (AB를, 재료의 표 참조), 제조업체의 지침에 따라.
- 일을 품어전자의 37 ° C에서 튜브 및 5 % CO 3 시간 동안 2. (; T0 시간 0 AB) 600 nm의 참조 파장 570 nm에서의 흡광도를 측정한다.
- 뜨는을 취소하고 신선한 완전한 확산 매체의 2 mL를 넣고. 5 %, 37 ° C에서 품어 CO 2 O / N. 다음 날 (AB 시간이 24 시간에, T24)를 반복 10.1 10.3 (그림 3B) 단계를 반복합니다.
섬유소 응고를 구축 내부 세포 생존과 칼슘 증착 11. 조직 학적 평가
- 중성 완충 포르말린 O V / / N에서 4 ℃로 승 4 %에서 hMSC / 섬유소 응고 구조를 수정합니다. 70 % 에탄올에 15 분 및 저장을위한 D-PBS에 세척 4 배.
- 45 분 동안 두 번, 30 분, 95 % 번씩 80 % 및 1 시간 동안 100 % 배 : 등급 에탄올 일련의 40 ° C에서 샘플 탈수. 40 ° C에서 45 분 동안 크실렌에 두 번 명확히.
- 2 시간 동안 60 ° C에서 유동 파라핀의 샘플을 씻어들을 포함. t 마이크로톰으로 파라핀 블록을 잘라 마운트유리 슬라이드에 그 부분 (5 μm의).
- 표준 Hematoxylin & Eosin 염색 방법 (도 3C)을 사용하여 탈 파라핀 섹션 얼룩.
- 15 분, 2 분, 0.5 % 피로 갈롤, 2 분 동안 5 % 티오 황산나트륨 1 % 질산은과 섹션을 처리하여 폰 코사 염색을 수행한다. 5 분 동안 5g의 황산 알루미늄을 함유하는 용액으로 희석하여 0.1 % 핵 패스트 레드 섹션을 Counterstain과 5 분 동안 수돗물로 헹구어. 장착 에이전트 섹션을 탑재합니다.
- 광학 현미경 (400X 배율) (그림 3D) 아래 검은 과립과 미네랄 침착을 평가합니다.
12 CFU-F의 분석
- (단계 6.3.)을 25cm 2 플라스크를 씻어 D-PBS로. 표준 5 월 그룬 왈드 / 김사 방법을 사용하여 얼룩. 시각적으로 광학 현미경 하에서 개별 식민지 (그림 4) 득점으로 hMSC 번호를 정량화.
참고 : 경우골수 단계 1.2로한다. 2 절 - 9 필요한 규제 당국의 승인과 우수 제조 기준 (GMP)에서 수행은 hMSC / 섬유소 응고 구조는 정형 외과 애플리케이션에 이식 할 수 있습니다.
결과
자가 혈청의 제조
hMSC 배양에 필요한 전송 가방 칼슘 글루코 네이트를 첨가함으로써 수행 혈장 응고는, 다량의 혈청자가 복구를 허용한다. 실제로,이 방법으로는 혈청 200 ㎖ (도 1)까지 달성하는 것이 가능하다.
자가 혈청을 사용하여 HMSC 분리, 배양 및 분화
골수 단핵 세포는 중간 링 층 (도 2a)을 일으킨다 밀도 구배를 이용하여 분리된다. 이들 세포를 판 및 세정하여 부착되지 것들을 제거함으로써, 중배엽 줄기 세포 (도 2b)을 분리 할 수있다. 자가 배양 조건에서 호출 된 MPC 셀의 서브 세트, 및 t P0에서 최대 비율로 검출10 % O를, 환자 변동성 (그림 2B)에 따라 다릅니다. MPC와 여전히 프로테아제 세포 계대 (도 2c)에 이용되는 경우 (즉, P1) replating 후 존재한다. 중배엽 줄기 세포는 격리 및자가 설정에서 배양 세 가지 잘 알려진 중배엽 계통 (골 형성, 지방 세포 및 연골)으로 구별하기 위해 자신의 능력을 유지한다. 분화 세이 표준 (nonautologous) 배양 조건을 사용하여 얻은 결과와 hMSC 인구 ID를 비교 하였다. pH를 1에서이 프로토콜, 폰 코사 염색, 산화 오스뮴 염색하고, 알 시안 블루 염색에 대한 기능 분석은 차별화 미디어 제조업체에서 권장하는 대신에 선정됐다으로 (그림 2D) (재료의 표 참조).
준비, 생존 및 MSC / 섬유소 응고 구조의 조직 학적 특성
는 중배엽 줄기 세포는 그 상등액 (도 3a)에 의해 둘러싸여 젤리 디스크의 형성을 초래 한 50㎖ 튜브에서 칼슘 글루코 의해 가교 플라즈마에 분산된다. (cellularized 응고) (도 3b)을 핑크 (세포가없는 대조군) 청색으로부터 세포 생존율 염료 T24의 색상 변화에 의해 입증 된 바와 같이 이러한 혈장 응고 내부에서 중배엽 줄기 세포는 실용적이다. 응고 내부 세포 생존 능력은 잘 보존 된 세포 형태 (그림 3C)를 보여주는, H & E 염색으로 확인된다. 또한, 단지 제 2 셀 수확하기 전에 최소한의 osteoinduction는 자극 중배엽 줄기 세포 (그림 3D)에 의한 예비 칼슘 침착을 발생시킨다.
콜로니 형성 단위
문화 2 주 후 hMSC 식민지의 존재는 CFU-F 분석 (그림 4)으로 표시됩니다.
S = "jove_step"fo를 : 유지-together.within 페이지를 = "1"> MSC / 섬유소 혈전의 응용 프로그램 뼈 비 연합 구성
이 방법 (단계 1.1)에 설명 된대로 얻을 HMSC / 섬유소 응고 구조가 성공적으로 8 동정의 경우 13 심각한 상지의 불유합의 치료에 적용되었다. 장기 (최대 7.6 개월) 평가는 조직의 증식 또는 종양 형성의 증거도없이, 모든 환자에 대한 성공적인 임상 적, 기능적 결과를 확인했다.

자가 혈청 1. 준비 그림.
(A)을 플라즈마 장치는 스파이크를 사용한 전사 백에 전달된다; (B) 플라즈마가 포트 커넥터를 통해 칼슘 글루코 네이트를 주입하여 응고; (C) 혈액 백을 원심 혈청을 분리하는 데 사용된다./files/ftp_upload/54845/54845fig1large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
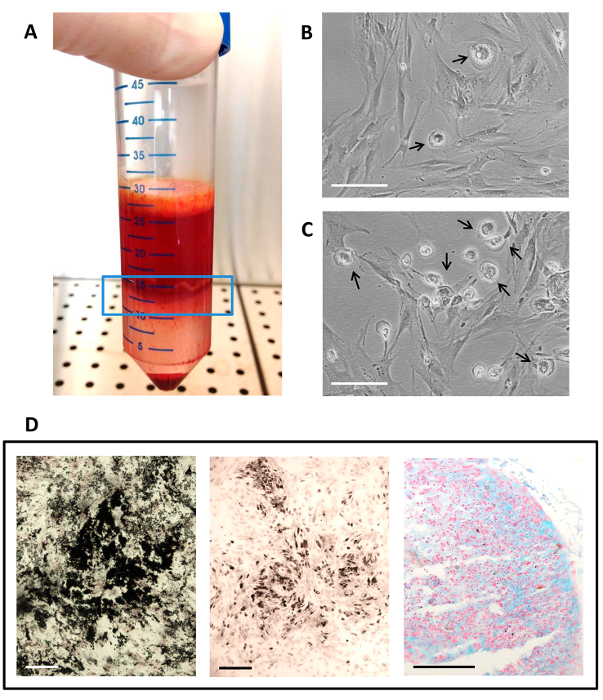
자가 혈청을 사용하여 그림 2 hMSC 격리, 문화 및 차별화.
골수는 밀도 구배 원심 한 후의 (A) (청색 라인 창) 단핵 세포 층; (B)는 P1에서 나타나는 세포 배양; (C) 세포 배양을가 P0 (주 문화)에 나타나는; (B - C) 화살표는 MSC 문화 MPC와의 존재를 보여줍니다. 스케일 바는 100 μm의입니다; (D) multilineage 차별화 분석의 조직 화학적 결과. 블랙, 지방 세포 분화에 미네랄 매트릭스 증착 폰 코사 염색을 사용하여 평가됩니다 골 형성 분화는 오스뮴 tetroxi에 의해 검은 색으로 염색, 지방 공포의 존재에 의해 표시됩니다드 및 연골 분화는 pH를 1 스케일 바에서 알 시안 블루 염색에 의해 시안에 염색 황산 글리코 사 미노 글리 칸의 존재에 의해 표시된다 50 μm의입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
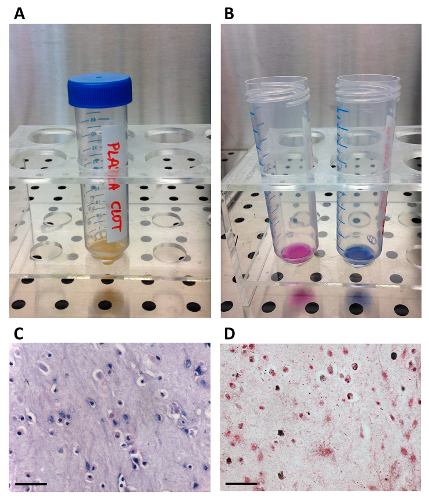
그림 3. 준비, MSC / 섬유소 응고를 구축의 생존 및 조직 학적 특성.
이 가교 후 표시되는 (가) hMSC / 섬유소 응고가 구성; (B) AB 분석의 성과 (오른쪽, 제어 세포없이) 파란색에서, 세포 생존 염료 (T24)의 색 변화에 의해 입증으로 중간 엽 줄기 세포는 섬유소 응고 내부 가능한이다는에 (cellularized 응고 핑크합니다 왼쪽). (C - D) hMSC / 섬유소 응고 구조의 조직 화학적 결과. 스케일 바는50 μm의. (C) 헤 마톡 실린 및 피브린 매트릭스에 매립 생세포를 도시 에오신 염색; 초기 골 형성을 확인 폰 코사 염색에 의해 검은 색으로 염색 (D) 미네랄 매트릭스 증착. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
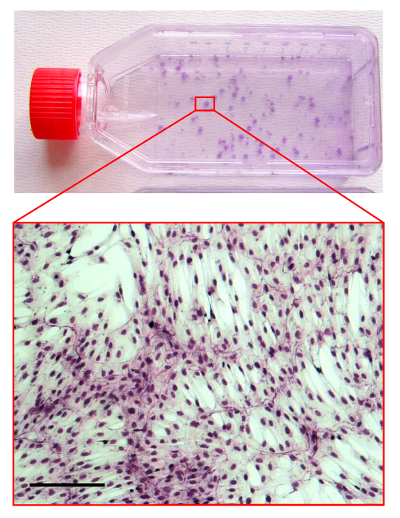
4. CFU-F 분석 그림.
5 월 그룬 왈드 / 김사 방법으로 얼룩진 중배엽 줄기 세포 배양 플라스크의 그림입니다. 확대 된 인 영역은 hMSC 식민지의 형태를 보여주는 광 현미경 사진이다. 스케일 바는 100 μm의입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
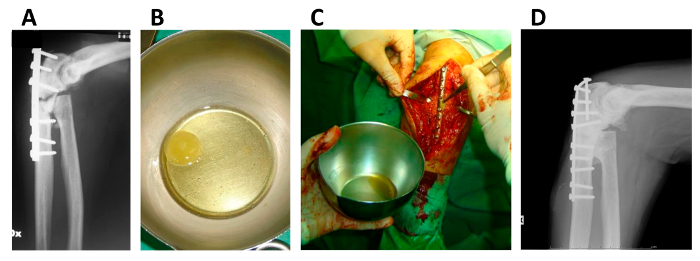
hMSC / 섬유소 응고 그림 5. 응용 프로그램은 뼈 불유합에 구축합니다.
불유합 영향 환자의 상지의 (A) X 선; (B) 바로 주입하기 전에 hMSC / 섬유소 응고 구조; (C)이 hMSC / 섬유소 응고 구조의 외과 응용 프로그램; 오년 후 같은 환자의 상지의 (D) X 선. 이 수치는 Giannotti S. 등의 알에서 게시됩니다. 최소한의 수정 13. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜의 우려가있는 중요한 단계 biosafe hMSC 치료를 얻을 수 있도록 인간 성인 혈청 프로테아제의 용도. 단백질 분해 효소가 된 MPC의, 수확을 보장하면서 특히, 인간 성인의 혈청, 격리 및 유지 보수를 할 수 있습니다. 다음은 이와 같이 배양 시간에 따라 생존 중배엽 줄기 세포의 저장을 보장 신선한 중배엽 줄기 세포를 야기 할 수있는 골수에 존재 미숙 세포이다. 프로테아제 활성에 대한 노출 시간을 증가 시키면 hMSC 생존에 불리하기 때문에하지 모든 된 MPC가 수집 될 수있다. 이러한 이유로, 10 분간 프로테아제 인큐베이션 된 MPC의 회수 및 중배엽 줄기 세포의 생존 사이의 최적의 절충으로서 선택 하였다. 또 다른 중요한 단계는 osteodifferentiation 시간입니다. 실제로, 생체 osteodifferentiation의 광범위한 상당히 따라서 생체 내에서 최종 골 형성에 영향을 미치는 세포 생존을 감소시킬 것이다. 마지막으로 중요한 단계가자가 생 흡수성 지지체의 쓸모가에있다, whicH 혈장 응고에서 피브린 겔에서 세포 (중배엽 줄기 세포 및 된 MPC)를 매립함으로써 얻어진다.
MPC와 수율을 향상시키기 위해 필요한 주요 단계는 높은 농도에서 단핵 세포를 시드한다. 혈장을 얻기 위해 성분 채집 절차를 사용하여, 칼슘 글루코 네이트로 처리하는 것이 가능 다량자가 혈청을 달성 할 수있다. 중간 보충 인간 혈청 hMSC 배양 태아 소 혈청 (FBS)에 필적하는 것으로 관찰되었다. 그러나, 우리의 경험에서, FBS와 보충 전체 매체는 인간의 성인 혈청보다 더 빨리 노화에 기여한다. 중요한 단계는 중배엽 줄기 세포에 대한 최소한의 osteoinduction 관리이다. 사실,이 치료는 따라서 생체 내에서 추가로 세포 변형을 방지하는 데 유용되고, 쉽게 골 형성 혈통으로 차별화하는 세포를 이끈다. 최소 osteoinduced 중배엽 줄기 세포의 좋은 생존을 유지하기 위해서는 신중하게 단계 6.5에 설명 된 권장 사항을 준수하는 것이 좋습니다.D 8.2., 처리, 원심 분리 및 중간 금액을 포함하는 추가합니다. 성분 채집 방법을 사용할 수없는 경우, 풀링 된 AB 혈청을 구입하여, 다른 방법으로, 환자에게 무 또는 여러 혈액을 수행하여 프로토콜을 수행하는 것이 여전히 가능하다. 물론, 벤치 투 맡에서이 프로토콜을 가지고 위해서는 가능한 GMP 세포 공장 또는 등가물을 갖도록 강제된다.
골수염의 영향이 기술에 관심 빈혈, 혈액 - 종양 및 정형 외과 환자의 적용에 한계., 빈혈 환자에서 혈액의 많은 양의 그림은 피해야한다. 골수염 환자의 감염의 최종 결과에 영향을 미칠 수있는 반면, 환자의 종양 학적, 세포 샘플의 품질, 화학 요법 치료제에 의해 영향을 받는다. 자가 혈청 부족하거나 부적합 인 모든 경우에서, 풀링 남성 AB 혈청 좋은 대안을 나타낸다.
셀 / 섬유소 클리오 사용가능한 임상 응용 프로그램에 대한 t 구조는 뼈가 아닌 노동 조합 (13)을 치료하기 위해 우수한 성과의 결과로, 수술 중 처리 및 금형 쉽게 될 수있는 완전히자가 세포 치료를 발표 할 중요합니다. 최소한의 조작 및 광범위한 조작 9 : 임상 목적을 위해, 중배엽 줄기 세포는 일반적으로 두 가지 절차를 통해 관리됩니다. 이러한 세포 형태와 크기가 18 이상으로서 광범위한 생체 외 배양과 관련된 문제를 극복하기 위해, 우리는 생체 세포의 확장 및 분화 골관절염 (단지 4 d) 단시간을 수행 하였다.
보여 짧은 셀 확장 및 osteodifferentiation 시간과 함께,이 문서에서 설명하는 이종없는 프로토콜, 조직과 성장과 변화의 증거없이, 생체 내에서 빠른 골 생성을 얻기 위해 병원에 관련하는, 따라서 확인의 효과와 긴 뼈 수리 -term 안전 (그림 5) 13.
이 보고서에 제시된 방법론은 정형 외과에서 가능한 사용을위한자가 조건 체외 확장에 hMSC의 효능과 안전성을 입증 대상으로합니다. 이 프로토콜은 매체자가 혈청 따라서 완전히자가 세포 치료를 보장하는자가 피브린 응고에 포함 된 골수로부터 분리 배양 중배엽 줄기 세포를 사용한다. 두 배의 골 형성 유도, 그냥 두 번째 분리하기 전에, 조골 세포로 분화 할 수 hMSC 능력을 향상시킵니다. 이 불유합에 한정되지 않기 때문에, 결과적으로,이 기술은, 골 결손 애플리케이션에 특히 적합하다. 가능한 미래 응용 프로그램은 거골 낭종과 뼈 손실 관리를 포함 할 수있다.
공개
저자는 공개 아무것도 없어.
감사의 말
This study was funded by the Tuscany Region (grant number 539999_2014_Petrini_CUCCS). The authors would like to thank Prof. S. Berrettini for authorizing the use of the Otolab laboratory and instruments, and the surgery staff from the Orthopedic Clinic II of the University of Pisa, for the fundamental cooperation in sample harvesting. The support provided by Dr. F. Scatena is gratefully acknowledged. Finally, many thanks are due to Mr. J.G. De La Ossa for his precious contribution to histologic processing.
자료
| Name | Company | Catalog Number | Comments |
| Triple Select (1x) | GIBCO, LIFE TECHNOLOGIES | 12563-029 | cell culture |
| Trypan blue stain | GIBCO, LIFE TECHNOLOGIES | 15250061 | cell culture |
| DMEM-LG, no glutamine, no phenol red | GIBCO, LIFE TECHNOLOGIES | 11880-028 | cell culture |
| Glutamax (100x) | Gibco, Life Technologies | 35050038 | cell culture |
| Penicillin/Streptomycin sol. | Gibco, Life Technologies | 15140122 | cell culture |
| Alamar Blue (AB) | Gibco, Life Technologies | DAL1025 | proliferation/viability assay |
| Ficoll-Paque Plus | GE Healthcare | 17-14440-02 | cell culture |
| D-PBS | Gibco, Life Technologies | 14190-094 | cell culture |
| StemMACS AdipoDiff Media | Miltenyi Biotech | 130-091-677 | cell culture |
| StemMACS ChondroDiff Media | Miltenyi Biotech | 130-091-679 | cell culture |
| hMSC Osteogenicdiff BulletKit | Euroclone | LOPT3002 | cell culture |
| Vitamin C (ascorbic acid) | Bayer | ATC Code: A11GA01 | Pharmaceutical grade drug |
| Flebocortid Richter (hydrocortisone) | Aventis Pharma | ATC Code: H02AB09 | Pharmaceutical grade drug |
| Victor X3, reader | PerkinElmer | 2030 multilabel reader | proliferation/viability assay |
| Silver nitrate | Sigma Aldrich | 209139 | histological assay |
| Pyrogallol | Sigma Aldrich | 16040 | histological assay |
| Sodium Thiosulphate | Sigma Aldrich | S8503 | histological assay |
| Histoplast LP | Thermo Scientific | 8332 | histological assay |
| Methanol | Sigma Aldrich | 32213 | histological assay |
| Ethanol | Sigma Aldrich | 2860 | histological assay |
| Nuclear fast red | Sigma Aldrich | 60700 | histological assay |
| Formalin | Bio-optica | 05-K01009-X40 | histological assay |
| Eosin B | Sigma Aldrich | 45260 | histological assay |
| DPX | Sigma Aldrich | 6522 | histological assay |
| Haematoxylin | Sigma Aldrich | H3136 | histological assay |
| Aluminium Sulphate | Sigma Aldrich | 202614 | histological assay |
| Xylol | Sigma Aldrich | 534056 | histological assay |
| Microtome | Leika | histological assay | |
| May Grunwald | Sigma Aldrich | MG1L-1L | histological assay |
| Giemsa | Sigma Aldrich | 32884-250ML | histological assay |
| Transfer bag | Biomérieux | BC0300031 | cell culture |
| Filtration kit | Macopharma | BC0800010 | cell culture |
| Calcium Gluconate | Galenica Senese | Pharmaceutical grade drug | |
| Bact Alert | Biomérieux | 259790 anaerobic | microbiological assay |
| Bact Alert | Biomérieux | 259789 aerobic | microbiological assay |
| Steryle Luer-Lok Syringe 50 mL | BD Plastipak | 300865 | cell processing |
| Heraeus Cryofuge 6000i | Thermo Scientific | blood bag centrifuging | |
| SL16R Centrifuge | Thermo Scientific | blood tube centrifuging |
참고문헌
- Horwitz, E. M., et al. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy. 7, 393-395 (2005).
- Kassem, M., Abdallah, B. M. Human bone marrow-derived mesenchymal stem cells: biological characteristics and potential role in therapy of degenerative diseases. Cell Tissue Res. 331, 157-163 (2008).
- Pittenger, M. F., et al. Multilineage potential of adult human mesenchymal stem cells. Science. 284, 143-147 (1999).
- Bonfield, T. L., Nolan Koloze, M. T., Lennon, D. P., Caplan, A. I. Defining human mesenchymal stem cells efficacy in vivo. J Inflamm. (Lond). 25 (7), 51 (2010).
- Pneumaticos, S. G., Triantafyllopoulos, G. K., Chatziioannou, S., Basdra, E. K., Papavassiliou, A. G. Biomolecular strategies of bone augmentation in spinal surgery. Trends Mol. Med. 17 (4), 215-222 (2011).
- Amhed, T. A. E., Dare, E. V., Hincke, M. Fibrin: A versatile scaffold for tissue engineering applications. Tissue Engineering Part B. 14 (2), 199-215 (2008).
- Silbertein, L. E., Williams, L. J., Huglett, M. A., Magee, D. A., Weisman, R. A. An autologous fibrinogen-based adhesive for use in oncologic surgery. Transfusion. 28 (4), 319-321 (1988).
- Jockenhoevel, S., et al. Fibrin gel advantages of a new scaffold in cardiovascular tissue engineering. Eur. J. Cardiothorac Surg. 19 (4), 424-430 (2001).
- Veronesi, F., et al. Clinical use of bone marrow, bone marrow concentrate, and expanded bone marrow mesenchymal stem cells in cartilage disease. Stem Cells Dev. 22 (2), 181-192 (2013).
- Petrini, M., et al. Identification and purification of mesodermal progenitor cells from human adult bone marrow. Stem Cells Dev. 18 (6), 857-866 (2009).
- Trombi, L., et al. Selective culture of mesodermal progenitor cells. Stem Cells Dev. 18 (8), 1227-1234 (2009).
- Trombi, L., et al. Human autologous plasma-derived clot as a biological scaffold for mesenchymal stem cells in treatment of orthopedic healing. J. Orthop. Res. 26 (2), 176-183 (2008).
- Giannotti, S., et al. Use of autologous human mesenchymal stromal cell/fibrin clot constructs in upper limb non-unions: long term assessment. PlosOne. 8 (8), 73893 (2013).
- Castano-Izquierdo, H., et al. Pre-culture period of mesenchymal stem cells in osteogenic media influences their in vivo bone forming potential. J. Biomed. Mater. Res. A. 82 (1), 129-138 (2007).
- Malkani, A. L., Fitzgerald, R. H., Kaufer, H. . Orthopaedics. , (2002).
- Lee, S. H., et al. ICSH guidelines for the standardization of bone marrow specimens and reports. Int J Lab Hematol. 30 (5), 349-364 (2008).
- Bugno, A., et al. Application of the BacT/ALERTR 3D system for sterility testingof injectable products. Braz J Microbiol. 46 (3), 743-747 (2015).
- Bonab, M. M., et al. Aging of mesenchymal stem cells in vitro. BMC Cell Biology. 7, 14 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유