Method Article
Mésenchymateuses stromales Culture cellulaire et livraison dans des conditions autologues: Une approche intelligente pour les applications orthopédiques
Dans cet article
Résumé
Culture de cellules humaines mésenchymateuses stromales (CSMh) avec du sérum autologue, réduit les risques de rejet par un matériau xénogénique et d'autres effets négatifs. Elle permet aussi la récupération d'un sous-ensemble de progéniteurs mésodermiques, qui peut délivrer CSMh frais. Incorporation CSMh dans un caillot de fibrine autologue permet une manipulation facile et l'implantation chirurgicale efficace.
Résumé
Les cellules humaines mésenchymateuses stromales (CSMh) sont cultivées in vitro avec différents médias. Limites sur leur utilisation dans les milieux cliniques, cependant, dépendent principalement de biohazard et de l'inflammation des risques potentiels exercées par les éléments nutritifs xénogéniques pour leur culture. dérivés humaines ou matériaux recombinants sont les premiers candidats de choix pour réduire ces réactions. Par conséquent, les suppléments et les matériaux d'origine autologue culture représentent les meilleurs éléments nutritifs et les produits les plus sûrs.
Ici, nous décrivons un nouveau protocole pour l'isolement et la culture de CSMh de moelle osseuse autologue dans des conditions - à savoir, du sérum dérivé du patient en tant que supplément pour le milieu de culture et de fibrine comme échafaudage pour une administration hMSC. En effet, CSMh constructions / fibrine caillot pourrait être extrêmement utile pour plusieurs applications cliniques. En particulier, nous nous concentrons sur leur utilisation en chirurgie orthopédique, où le caillot de fibrine dérivé de sang du donneur a permislivraison effective des cellules et des éléments nutritifs / déchets échanges. Afin de garantir des conditions de sécurité optimales, il est de la plus haute importance pour éviter les risques de CSMh transformation et de surcroissance des tissus. Pour ces raisons, l'approche décrite dans le présent document indique également un ex vivo CSMh l' expansion minimale, pour réduire la sénescence cellulaire et les changements morphologiques, et à court terme ostéo-différenciation avant l' implantation, pour induire la spécification de la lignée ostéogénique, diminuant ainsi le risque de incontrôlée subséquente prolifération.
Introduction
Cellules humaines mésenchymateuses stromales (CSMh) représentent l' une des meilleures sources de cellules pour une utilisation dans l' ingénierie tissulaire pour la promotion de l' ostéogenèse 1,2. Ils sont facilement isolés à partir d' os d' autres tissus adultes moelle et, et expriment des marqueurs de surface typiques tels que CD90, CD105, CD73 1. En outre, elles peuvent se différencier en différents types de cellules, telles que des ostéoblastes, des chondrocytes et des adipocytes 3. Leurs effets thérapeutiques sont attribués à leur propriétés régénératrices et trophiques 4. CSMh pourraient être utilisées en chirurgie orthopédique, ainsi que dans d'autres applications cliniques de régénération. Ils sont de préférence combinés avec des échafaudages, afin d' améliorer le résultat clinique 5.
Par rapport à d' autres matériaux, le gel de fibrine présente des propriétés intéressantes telles que l' adhésivité, la résorption et le transport efficace des nutriments, ce qui rend extrêmement utile pour une variété d'applications d'ingénierie tissulaire 6,7.
Le principal défi en traduisant une approche d'ingénierie tissulaire dans des applications cliniques est l'obtention d'un échafaudage entièrement biocompatible et biosécuritaire et un milieu de culture sans xéno-qui évite tout effet infectieux ou réactive.
Dans notre procédé, le gel de fibrine, dérivé du propre sang du patient, et du sérum autologue, pour la culture in vitro CSMh, ont été utilisés comme une solution thérapeutique possible dans le domaine orthopédique 8.
Pour des raisons cliniques, CSMh sont généralement administrés par deux procédures principales: (i) la procédure "une étape" (ie, manipulation minimale), qui permet la greffe automatique de la moelle osseuse, soit tout ou concentré (c. -à- cellules mononucléaires), pendant l'intervention chirurgicale; et (ii) la procédure « en deux étapes» (c. -à- extensive manipulation), qui est basé sur l'expansion ex vivo de CSMh à augmenter leur rendement avant l' implantation, et nécessite GInstallations MP 9. Fait intéressant, la culture de cellules avec du sérum humain adulte au lieu de sérum de veau bovin permet la récupération, conjointement avec les CSMh, d'un sous - ensemble de cellules (1 - 10% dans les cultures mononucléaires) appelées cellules mésodermiques progénitrices (PPM), capables de différenciation in vitro en fraîches CSMh 10,11. Ainsi, hMPCs peuvent jouer un rôle important dans le processus de régénération par rapport à seulement 12,13 CSMh. Enfin, à court terme ostéo-induction pousse CSMh à démarrer leur différenciation dans la lignée ostéogénique sans perdre leur potentiel prolifératif et la viabilité 12. Ces résultats confirment les études précédentes qui ont rapporté améliorée in vivo la formation d'os par CSMh, suivie d'une préculture dans un milieu ostéogénique 14. En outre, un caillot de plasma autologue comme un échafaudage pour la livraison de cellules peut être facilement manipulé par le chirurgien et moulé pour épouser la forme de la cavité osseuse 13.
therefore, cette méthode peut être extrêmement utile pour les chercheurs et les cliniciens qui visent à traduire leur thérapie à base de CSMh du banc au chevet dans des applications orthopédiques.
Protocole
Le présent protocole a été élaboré conformément à la Déclaration d'Helsinki de l'Association médicale mondiale en ce qui concerne la conduite éthique des humains de recherche impliquant. Il a été approuvé par le Comité d'éthique de l'Azienda Ospedaliero-Universitaria Pisana.
REMARQUE:
La moelle osseuse a été obtenue à partir de patients subissant une chirurgie de remplacement total de la hanche de routine (selon l'étape 1.1) 15; plasma pour la préparation d' un caillot a été obtenu à partir du sang périphérique autologue 13; sérum autologue, comme un supplément pour le milieu de culture, a été recueilli à partir d'une aphérèse-sang autologue. Tous les patients ont reçu des informations détaillées sur la procédure et ont signé un formulaire de consentement écrit.
1. Collection de l'échantillon de moelle osseuse
- Recueillir la moelle osseuse du canal médullaire du fémur après une chirurgie de remplacement total de la hanche (pour les études de recherche). En bref, lors de la préparation chirurgicale du canal médullaire à l'étape house la tige de prothèse, de recueillir le sang de la moelle osseuse qui déborde (environ 10 - 15 ml, en fonction de la taille de la prothèse) 15.
OU - Collecter aspirée de moelle osseuse de la crête iliaque sous anesthésie locale, suivant la procédure standard hématologique environ 20 - 30 d à l' avance (pour des applications cliniques) 16.
NOTE: Dans les deux cas des seringues héparinés (pour empêcher la formation de caillots) doit être utilisé pour la récupération de la moelle osseuse.
2. Préparation du autologue plasma
- Recueillir 20 ml de sang périphérique du patient dans des tubes de prélèvement sanguin sous vide contenant de l'EDTA K3 (5,4 mg dans les tubes 3 ml) et on centrifuge à 2400 x g pendant 15 min.
- Aspirer le composant de plasma dans un tube de 15 ml et congeler à -20 ° C jusqu'à utilisation.
3. Préparation du sérum autologue
- Transfert de l'unité de plasma dans un sac de transfert à l'aide d'un pic. Déconnecter le sac rempli par soudage et weigh , le sac pour calculer le volume de plasma (figure 1A).
- Coaguler le plasma autologue en injectant gluconate de calcium 100 mg / mL à 10% p / v à travers le connecteur de port (figure 1B). Après avoir mélangé le sac, placez-le à 4 ° CO / N sans agitation pour faciliter la formation de caillots.
- Centrifuger le sac à 4900 × g pendant 15 min à température ambiante. Prenez le seau de centrifugation sur la centrifugeuse et enlever le sac avec précaution (suivre les directives du fabricant pour la préparation de lysat plaquettaire) (figure 1C).
- Isoler le caillot juste au-dessus de la pince pour faciliter la filtration. Connectez le kit de filtration pour le sac de transfert en utilisant une pointe placée dans l'orifice de sortie du kit de filtration.
- Accrochez le sac et ouvrir la pince bleue pour laisser couler le sérum par gravité. Ne pas appliquer une pression sur le filtre pour éviter le transfert de la fibrine dans le sac. Après filtration, sceller le tube et retirer le sac (suivre la fabriles lignes directrices de fabri- pour la préparation des plaquettes lysat).
- Connectez une ligne dédiée au sérum de sac et transfert final dans des tubes de 50 ml sous un banc de flux laminaire pour éviter toute contamination microbienne.
- Prélever un échantillon avec une seringue pour vérifier l'absence de fibrinogène et d' effectuer un test de stérilité pour les cultures bactériennes aérobie et anaérobie 17. Etiqueter les tubes de manière appropriée et les congeler à - 20 ° C jusqu'à utilisation.
4. Préparation du milieu d'extension
- Préparer 500 ml de milieu de prolifération totale. Pour milieu de Eagle modifié Dulbecco - Faible glucose (DMEM-LG), ajouter 10% de sérum autologue (obtenu comme décrit dans la section 3), 2 mM de glutamine, solution à 1% d'antibiotique et antimycosique solution 1%. Stérile filtre le milieu de prolifération complète.
5. Isolement des CSMh de la moelle osseuse
- Transférer l'échantillon de moelle osseuse (5 à 10 ml) de la seringue dans une fiole conique de 50 tusoit et le diluer avec du sérum physiologique stérile (rapport 1: 4). Vortex du tube de 50 ml pendant 30 s pour désagréger les amas de cellules.
- Chauffer le gradient de densité (densité 1,077 g / L; voir le tableau des matériaux) à la température ambiante avant l' utilisation et la couche doucement l'os diluée osseuse (pour empêcher le mélange des deux couches) sur le gradient de densité en ajoutant 20 mL de l'échantillon à 15 mL de la densité gradient pour chaque tube de 50 ml (figure 2A).
- Centrifuger à 400 x g sans frein à 25 ° C pendant 30 min, puis recueillir la fraction mononucléaire à l'interface liquide-liquide et de le transférer à un nouveau tube de 50 ml en utilisant une solution stérile 5 ml pipette.
- Laver la fraction mononucléaire recueilli deux fois avec un milieu de prolifération complet et centrifuger les tubes à 400 x g pendant 10 min à 25 ° C pour obtenir des culots cellulaires.
- Jeter le surnageant et remettre en suspension doucement chaque culot de cellules dans 5 ml de milieu de prolifération totale. Diluer à un rapport 1: 100 pour le comptage des cellules.
- Compter les cellules à l'aide d'un hémocytomètre après une dilution 1: 1 avec coloration au bleu Trypan pour évaluer la viabilité cellulaire.
6. Culture de CSMh en présence de sérum autologue
- Remplir deux ou plus de 75 cm 2 culture de tissu (TC) flacons avec 15 ml de milieu de prolifération complet frais et de les transférer à un incubateur de culture de cellules à 37 ° C et 5% de CO 2 jusqu'à l' utilisation.
- Seed 0.3 - 0,5 x 10 6 cellules / cm 2 (37,5 x 10 6 cellules / 15 ml de milieu complet frais prolifération) et incuber à 37 ° C et 5% de CO2 pendant 48 heures.
- Dans le même temps, les graines 1 x 10 6 cellules dans un flacon de 25 cm 2 TC avec 5 ml de milieu de prolifération complet frais pour l'unité de formation de colonie - fibroblaste (CFU-F) dosage. Culture pendant 2 semaines (à suivre à l'article 12).
- Jeter le moyen et lavez doucement les flacons de l'étape 6.2 avec un milieu de prolifération complet pour remove cellules non adhérentes et les débris. Ajouter un milieu frais aux flacons et remplacer la moitié de celui - ci deux fois par semaine, jusqu'à 70 - 80% de confluence (culture primaire, Passage 0 (P0)) (figure 2B).
- Récupérer les cellules en utilisant un animal recombinant protéase libre spécifique (voir le tableau des matériaux; utiliser 3 ml de la solution par flacon tel que recommandé par le fabricant) et incuber à 37 ° C et 5% de CO 2 pendant 10 min. Ajouter 6 mL de milieu complet de prolifération par flacon et recueillir dans un tube de 50 ml. Répétez l'étape 5.6.
NOTE: IMPORTANT: L'utilisation de cette protéase au lieu de trypsine permet la récupération de certaines cellules mésodermiques progéniteurs (PPM) présentes dans la culture, qui est la trypsine résistant. - Pour plus d' expansion, replate la suspension cellulaire à 2.000 - 3.000 cellules / cm 2 dans la nouvelle 75 cm 2 TC flacons (P1) (figure 2C).
- Utilisez aliquotes de cellules pour évaluer les potentiels de différenciation des cellules souches mésenchymateusesvers ostéogénique adipogénique et lignées chondrogéniques. Effectuer des essais de différenciation selon les recommandations du fabricant (figure 2D).
NOTE: Différentes méthodes de coloration peuvent être utilisés pour évaluer la différenciation multilignée.
7. Préparation d'un moyen ostéogénique avec suppléments pharmaceutiques
- Diluer la solution d'acide ascorbique (Solution 1A:. Acide ascorbique 200 mg / ml (voir le tableau des matériaux) 1:10 avec de DMEM-LG, pour obtenir une solution à 20 mg / ml (Solution 1B, solution de travail) aliquotes Stock de solutions 1A et 1B à -20 ° C jusqu'à utilisation.
- Remettre en suspension 1 g d' hydrocortisone dans 10 ml d'eau stérile (2A de la solution: l' hydrocortisone 100 mg / ml (voir le tableau des matériaux) de solution diluée 2A à 1. 1000 avec du DMEM-LG pour obtenir une solution / ml à 100 ug (solution 2B, travaillant solution). aliquotes Stock de solutions 2A et 2B à -20 ° C jusqu'à utilisation.
- Lors de l'utilisation pRepare milieu ostéogénique frais comme suit: Ajouter du DMEM-LG avec 10% de sérum autologue, 50 pg / ml d'acide ascorbique et 0,4 pg / ml d'hydrocortisone. Stérile-filtre, le milieu ostéogénique.
8. ostéogénique pré-induction et de récupération de CSMh
- Retirez complètement le milieu de prolifération et ajouter ostéogéniques moyenne 96 h avant la récolte des cellules (ie, 80 - 90% de confluence est généralement atteint en 7 d). Fournir un changement de milieu ostéogénique supplémentaire 24 h avant la récolte des cellules.
- Détacher les cellules de la manière décrite dans l'étape 6.5 et doucement resuspendre le culot en ajoutant 2 ml de milieu de prolifération complet dans un tube de 50 ml.
REMARQUE: La viabilité des cellules peut être réduite (environ 10%) en raison de l' induction osseuse. agrégats cellulaires peuvent être observés. - Après comptage, laver les cellules avec un milieu de prolifération complète et centrifuger à 300 g pendant 5 min. Reprendre le culot doucement à 1 - 2 x 10 6 cellules viables / 2ml de plasma autologue (voir la section 2) par 50 ml tube.
9. Préparation de CSMh / caillot de fibrine Constructs
- Ajouter 150 ul de gluconate de calcium à raison de 100 mg / ml dans chaque tube 50 ml obtenu à l'étape 8.3. et remettre les cellules sous agitation douce.
- Incuber les cellules à 37 ° C et 5% de CO 2 pendant 15 - 30 minutes pour obtenir CSMh / caillot de fibrine d' assemblage (figure 3A). Préparer un caillot de fibrine construction sans cellules à utiliser comme témoin.
NOTE: IMPORTANT: Il est recommandé de préparer ce contrôle caillot au moins 2 h avant le test de viabilité cellulaire, car il faut 30 min ou plus pour réticuler.
Viabilité 10. Cellule Assay
- Retirer le liquide des tubes de 50 ml et ajouter 1 ml de milieu de prolifération complet contenant 10% de réactif v / v cellule de viabilité (AB; voir le tableau des matériaux), selon les directives du fabricant.
- Incuber ee tubes à 37 ° C et 5% de CO 2 pendant 3 h. Mesurer l'absorbance à 570 nm avec une longueur d'onde de 600 nm de référence (AB au temps 0; t0).
- Jeter le surnageant et ajouter 2 mL de milieu de prolifération complet frais. Incuber à 37 ° C, 5% de CO 2 O / N. Le lendemain (AB au moment 24 h; t24), répétez les étapes 10.1 à 10.3 (figure 3B).
11. histologiques Évaluation de la viabilité cellulaire et de calcium à l'intérieur des dépôts de fibrine Clot Constructs
- Fixer les / fibrine constructions caillot CSMh à 4% p / v du formol neutre tamponné O / N à 4 ° C. Laver 4x dans D-PBS pendant 15 min et magasin dans 70% d'éthanol.
- Déshydrater les échantillons à 40 ° C dans une série graduée d'éthanol: 80% après 30 min, 95% deux fois pendant 45 min et 3 fois 100% pendant 1 h. Clarifier deux fois dans le xylène pendant 45 min à 40 ° C.
- Rincer les échantillons dans de la paraffine liquide à 60 ° C pendant 2 h et on peut les incorporer. Couper le bloc de paraffine avec un microtome et monter til sections (5 um) sur des lames de verre.
- Colorer les coupes déparaffinées en utilisant l'hématoxyline standard et méthode éosine (H & E) (figure 3C).
- Effectuer une coloration de von Kossa en traitant les sections avec 1% de nitrate d'argent pendant 15 min, 0,5% de pyrogallol pendant 2 min, et le thiosulfate de sodium 5% pendant 2 min. Counterstain les sections avec 0,1% de rouge nucléaire rapide diluée dans une solution contenant 5 g de sulfate d'aluminium pendant 5 minutes et rincez-les dans de l'eau du robinet pendant 5 min. Monter les sections avec un agent de montage.
- Évaluer le dépôt minéral sous forme de granulés noirs sous microscope optique (grossissement 400X) (Figure 3D).
12. Dosage de CFU-F
- Laver le flacon de 25 cm2 (étape 6.3.) Avec du D-PBS. Colorer en utilisant la méthode de May-Grunwald / Giemsa standard. Visuellement quantifier nombre CSMh en marquant des colonies individuelles (figure 4) sous un microscope optique.
NOTE: Sila moelle osseuse est prise à l'étape 1.2. et les sections 2-9 sont effectuées dans les bonnes pratiques de fabrication (BPF) avec l'approbation réglementaire nécessaire, les CSMh / fibrine constructions de caillots peuvent être implantés pour des applications orthopédiques.
Résultats
Préparation d'un sérum autologue
la coagulation du plasma, réalisée par l'addition de gluconate de calcium à la poche de transfert, permet la récupération du sérum autologue en grandes quantités, comme requis pour la culture de hMSC. En effet, avec cette technique, il est possible d'atteindre jusqu'à 200 ml de sérum (figure 1).
HMSC l'isolement, la culture et la différenciation en utilisant du sérum autologue
Des cellules mononucléaires de la moelle osseuse sont isolés à l' aide d' un gradient de densité, ce qui donne naissance à une couche de noyau intermédiaire (figure 2A). En plaquant ces cellules et en éliminant celles non adhérentes avec lavage, il est possible d'isoler les CSMh (figure 2B). Dans des conditions de culture autologues, un sous-ensemble de cellules, appelé PPMs, sont détectés à P0 et en pourcentage jusqu'à to 10%, en fonction de la variabilité du patient (figure 2B). PPMs sont toujours présents après les plaquant (c. -à- P1) si la protéase est utilisée pour repiquage de cellules (figure 2C). CSMh isolé et mis en culture dans un milieu autologue conservent leur capacité à se différencier vers les trois lignées mésodermiques bien connues (osteogene, adipogénique et chondrogéniques). Les dosages de différenciation ont été effectuées pour comparer l'identité de la population de hMSC avec ceux obtenus en utilisant (non autologue) des conditions de culture standard. Comme les essais de fonctionnalité de ce protocole, coloration de von Kossa, tétroxyde d' osmium coloration et coloration au bleu alcian à pH 1 ont été choisis à la place de ceux suggérés par le fabricant de supports de différenciation (voir le tableau des matériaux) (figure 2D).
Préparation, la viabilité et la caractérisation histologique du MSC / fibrine constructions caillot
Les CSMh sont dispersés dans le plasma, qui est réticulé par du gluconate de calcium dans un tube de 50 ml, ce qui conduit à la formation d'un disque de gelée entouré de son surnageant (figure 3A). A l' intérieur de ces caillots de plasma, les CSMh sont viables, comme le démontre le changement de couleur du colorant t24 de la viabilité des cellules du bleu (contrôle sans cellules) au rose (caillot cellularisée) (figure 3B). La viabilité des cellules à l' intérieur du caillot est confirmée par coloration H & E, montrant une morphologie cellulaire bien conservée (figure 3C). En outre, une ostéoinduction minimale juste avant la deuxième récolte de cellules donne lieu à préliminaire dépôt de calcium par CSMh stimulées (Figure 3D).
Colony Forming Unit
La présence de colonies de CSMh après 2 semaines de culture est représenté par le dosage de CFU-F (figure 4).
s = "jove_step" fo: keep-together.within-page = "1"> Application du MSC / caillot de fibrine construire dans l'os non-union
Constructions HMSC / fibrine caillot obtenu comme décrit dans cette méthode (étape 1.1) ont été appliquées avec succès pour traiter de graves pseudarthroses des membres supérieurs dans 8 cas de compassion 13. Évaluation à long terme (au maximum de 7,6 mois) a confirmé les résultats cliniques et fonctionnels efficaces pour tous les patients, sans preuve d'une prolifération tissulaire ou une formation de tumeur.

Figure 1. Préparation du autologue Sérum.
(A) L'unité de plasma est transféré dans un sac de transfert en utilisant la pointe; (B) Le plasma est coagulé par injection gluconate de calcium par l'intermédiaire du connecteur de port; (C) un sac de sang centrifugeuse est utilisée pour séparer le sérum./files/ftp_upload/54845/54845fig1large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
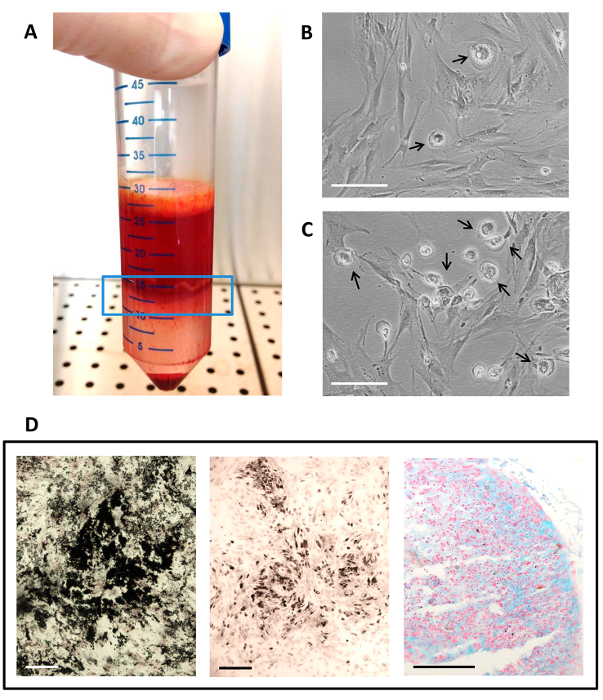
Figure 2. CSMh Isolation, Culture et Différenciation utilisant autologue Sérum.
(A) La couche de cellules mononucléaires (dans la fenêtre de ligne bleue) obtenue après centrifugation de la moelle osseuse avec un gradient de densité; (B) La culture cellulaire telle qu'elle figure à P1; (C) La culture cellulaire telle qu'elle figure à P0 (culture primaire); (B - C) Les flèches indiquent la présence des PPM dans la culture MSC. La barre d'échelle est de 100 um; (D) des résultats histochimiques des tests de différenciation multilignée. différenciation ostéogénique est évaluée à l'aide de von Kossa coloration pour le dépôt de matrice minérale en noir, la différenciation adipocytaire est indiquée par la présence de vacuoles gras, teinté en noir par osmium tetroxide, et la différenciation chondrogénique est affiché par la présence de glycosaminoglycanes sulfatés, qui sont colorées en cyan par coloration au bleu Alcian à pH 1. La barre d'échelle représente 50 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
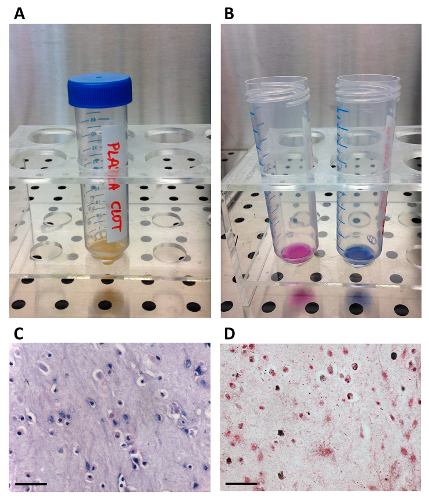
Figure 3. Préparation, Viabilité et histologiques Caractérisation du MSC / fibrine Clot Constructs.
(A) Le CSMh / caillot de fibrine construire tel qu'il apparaît après réticulation; (B) Les résultats du test AB: l'MSCs sont viables à l' intérieur du caillot de fibrine, comme le démontre le changement de couleur du colorant de viabilité cellulaire (t24), du bleu (contrôle sans cellules, sur la droite) au rose (caillot cellularisée, sur la à gauche). (C - D) résultats histochimiques de CSMh / fibrine constructions de caillot. La barre d'échelle est50 um. (C) et coloration à l' éosine hématoxyline montrant des cellules viables intégrées dans la matrice de fibrine; Dépôt (D) de la matrice minérale teinté en noir par coloration de von Kossa, qui confirme une ostéogenèse initiale. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
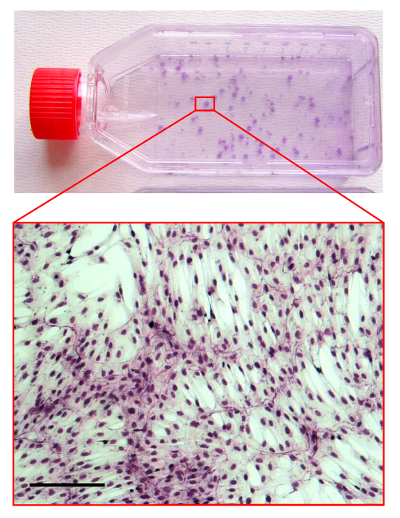
Figure 4. CFU-F Assay.
Image d'un flacon de culture avec CSMh colorées par la méthode de May-Grunwald / Giemsa. La zone zoomée est une lumière micrographie montrant la morphologie d'une colonie CSMh. La barre d'échelle est de 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
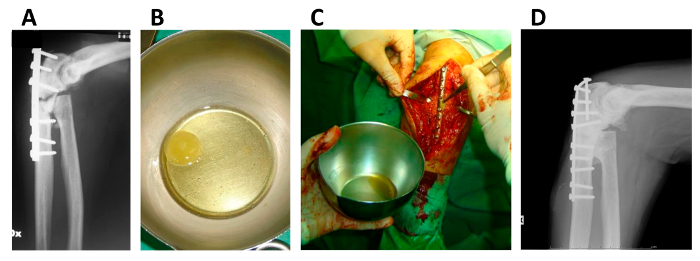
Figure 5. Application de CSMh / fibrine Clot Construct dans l' os pseudarthrose.
(A) X-ray du membre supérieur d'un patient affecté par pseudarthrose; (B) CSMh / caillot de fibrine construction juste avant l' implantation; (C) de l' application chirurgicale de la CSMh / caillot de fibrine construction; (D) des rayons X de la branche supérieure du même patient après 5 ans. Ce chiffre est republié de Giannotti S. et al. avec des modifications minimes 13. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Les étapes essentielles de ce protocole concernent la utilisation de sérum humain adulte et de la protéase, qui permettent d'obtenir une thérapie CSMh de biosécuritaire. En particulier, le sérum humain adulte permet l'isolement et la maintenance, tandis que la protéase assure la récolte, des PPM. Ce sont des cellules immatures présentes dans la moelle osseuse qui peut donner lieu à des CSMh fraîches, assurant ainsi un réservoir de CSMh viables au cours du temps de culture. Ne sont pas tous les PPM peuvent être collectées, étant donné que l'augmentation du temps d'exposition à l'activité de la protéase est préjudiciable à la viabilité hMSC. Pour cette raison, une protéase incubation de 10 minutes a été choisie comme un compromis optimal entre la récupération des PPM et la viabilité des CSMh. Une autre étape importante est le temps de osteodifferentiation. En effet, une étendue dans osteodifferentiation in vitro réduirait considérablement la viabilité des cellules, ce qui affecte la formation d'os in vivo finale. La dernière étape cruciale consiste à prévaloir d'un échafaudage biorésorbable autologue, which est obtenue en noyant les cellules (CSMh et PPM) dans un gel de fibrine à partir de la coagulation du plasma.
Une étape clé pour améliorer le rendement des PPM est d'ensemencer des cellules mononucléaires à une concentration plus élevée. En utilisant des procédures d'aphérèse pour obtenir le plasma et en le traitant avec du gluconate de calcium permet d'obtenir un sérum autologue en grandes quantités. Il a été observé que le sérum humain en tant que supplément de milieu est comparable à celle de sérum bovin fœtal (FBS) dans des cultures de CSMh. Cependant, dans notre expérience, un milieu complet additionné de FBS contribue à la sénescence plus rapide que le sérum humain adulte. Une étape importante est celle de l'administration d'une ostéoinduction minimale à CSMh. En effet, ce traitement conduit les cellules à se différencier facilement vers la lignée ostéogénique, étant ainsi utile pour éviter une nouvelle transformation cellulaire in vivo. Pour maintenir une bonne viabilité des CSMh peu osteoinduced, il est recommandé de suivre attentivement les recommandations décrites dans les étapes 6.5. und 8.2., y compris la manutention, la centrifugation et des quantités moyennes à ajouter. Si une procédure d'aphérèse ne sont pas disponibles, il est encore possible de réaliser ce protocole en effectuant sang multiples tirages au patient ou, en variante, par l'achat de sérums AB commun. De toute évidence, dans le but d'apporter ce protocole de chevet banc à, il est obligatoire d'avoir des usines cellulaires GMP, ou équivalents, disponibles.
Limitations à l'application de cette technique concernent l'anémie, hématologique-oncologie et les patients orthopédiques touchés par l'ostéomyélite., Dessin de grandes quantités de sang provenant de patients anémiques, devraient être évités. Chez les patients souffrant oncologiques, la qualité des échantillons de cellules est affecté par les traitements de chimiothérapie, alors que chez les patients atteints ostéomyélite, l'infection peut affecter le résultat final. Dans tous les cas dans lesquels le sérum autologue est insuffisante ou inadaptée, mâle commun AB sérums représentent une bonne alternative.
Utilisation de cellules / fibrine clot constructions pour les applications cliniques possibles est cruciale pour libérer une thérapie cellulaire autologue complètement, ce qui pourrait être facile à manipuler et moule pendant la chirurgie, ce qui entraîne d' excellents résultats pour le traitement des os non-syndicats 13. À des fins cliniques, les CSMh sont habituellement administrés par l' intermédiaire de deux procédures principales: une manipulation minimale et la manipulation extensive 9. Pour surmonter les problèmes liés à une culture extensive ex vivo, comme des anomalies dans la morphologie des cellules et de la taille 18, nous avons réalisé un court laps de temps l' expansion in vivo de cellules et ostéo-différenciation (seulement 4 d) ex.
Le protocole libre xéno-décrit dans le présent document, ainsi que l'expansion des cellules et osteodifferentiation des temps courts, démontré être pertinent dans les cliniques afin d'obtenir la production d'os rapide in vivo, sans preuve d'surcroissance des tissus et de la transformation, confirmant ainsi son efficacité et à long sécurité -terme dans la réparation osseuse (Figure 5) 13.
La méthodologie présentée dans le présent rapport vise à démontrer l'efficacité et la sécurité des CSMh dans l' expansion in vitro dans des conditions autologues pour une utilisation possible en chirurgie orthopédique. Ce protocole utilise CSMh isolées à partir de moelle osseuse et cultivés dans un milieu supplémenté avec du sérum autologue et incorporé dans le caillot de fibrine autologue, assurant ainsi une thérapie cellulaire complètement autologue. Le double induction ostéogénique, juste avant le second détachement, améliore la capacité CSMh à se différencier en ostéoblastes. Par conséquent, cette technique est particulièrement adaptée pour des applications dans des défauts osseux, étant donné qu'il ne se limite pas à la pseudarthrose. applications futures possibles pourraient impliquer astragale kyste et la gestion de la perte osseuse.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
This study was funded by the Tuscany Region (grant number 539999_2014_Petrini_CUCCS). The authors would like to thank Prof. S. Berrettini for authorizing the use of the Otolab laboratory and instruments, and the surgery staff from the Orthopedic Clinic II of the University of Pisa, for the fundamental cooperation in sample harvesting. The support provided by Dr. F. Scatena is gratefully acknowledged. Finally, many thanks are due to Mr. J.G. De La Ossa for his precious contribution to histologic processing.
matériels
| Name | Company | Catalog Number | Comments |
| Triple Select (1x) | GIBCO, LIFE TECHNOLOGIES | 12563-029 | cell culture |
| Trypan blue stain | GIBCO, LIFE TECHNOLOGIES | 15250061 | cell culture |
| DMEM-LG, no glutamine, no phenol red | GIBCO, LIFE TECHNOLOGIES | 11880-028 | cell culture |
| Glutamax (100x) | Gibco, Life Technologies | 35050038 | cell culture |
| Penicillin/Streptomycin sol. | Gibco, Life Technologies | 15140122 | cell culture |
| Alamar Blue (AB) | Gibco, Life Technologies | DAL1025 | proliferation/viability assay |
| Ficoll-Paque Plus | GE Healthcare | 17-14440-02 | cell culture |
| D-PBS | Gibco, Life Technologies | 14190-094 | cell culture |
| StemMACS AdipoDiff Media | Miltenyi Biotech | 130-091-677 | cell culture |
| StemMACS ChondroDiff Media | Miltenyi Biotech | 130-091-679 | cell culture |
| hMSC Osteogenicdiff BulletKit | Euroclone | LOPT3002 | cell culture |
| Vitamin C (ascorbic acid) | Bayer | ATC Code: A11GA01 | Pharmaceutical grade drug |
| Flebocortid Richter (hydrocortisone) | Aventis Pharma | ATC Code: H02AB09 | Pharmaceutical grade drug |
| Victor X3, reader | PerkinElmer | 2030 multilabel reader | proliferation/viability assay |
| Silver nitrate | Sigma Aldrich | 209139 | histological assay |
| Pyrogallol | Sigma Aldrich | 16040 | histological assay |
| Sodium Thiosulphate | Sigma Aldrich | S8503 | histological assay |
| Histoplast LP | Thermo Scientific | 8332 | histological assay |
| Methanol | Sigma Aldrich | 32213 | histological assay |
| Ethanol | Sigma Aldrich | 2860 | histological assay |
| Nuclear fast red | Sigma Aldrich | 60700 | histological assay |
| Formalin | Bio-optica | 05-K01009-X40 | histological assay |
| Eosin B | Sigma Aldrich | 45260 | histological assay |
| DPX | Sigma Aldrich | 6522 | histological assay |
| Haematoxylin | Sigma Aldrich | H3136 | histological assay |
| Aluminium Sulphate | Sigma Aldrich | 202614 | histological assay |
| Xylol | Sigma Aldrich | 534056 | histological assay |
| Microtome | Leika | histological assay | |
| May Grunwald | Sigma Aldrich | MG1L-1L | histological assay |
| Giemsa | Sigma Aldrich | 32884-250ML | histological assay |
| Transfer bag | Biomérieux | BC0300031 | cell culture |
| Filtration kit | Macopharma | BC0800010 | cell culture |
| Calcium Gluconate | Galenica Senese | Pharmaceutical grade drug | |
| Bact Alert | Biomérieux | 259790 anaerobic | microbiological assay |
| Bact Alert | Biomérieux | 259789 aerobic | microbiological assay |
| Steryle Luer-Lok Syringe 50 mL | BD Plastipak | 300865 | cell processing |
| Heraeus Cryofuge 6000i | Thermo Scientific | blood bag centrifuging | |
| SL16R Centrifuge | Thermo Scientific | blood tube centrifuging |
Références
- Horwitz, E. M., et al. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy. 7, 393-395 (2005).
- Kassem, M., Abdallah, B. M. Human bone marrow-derived mesenchymal stem cells: biological characteristics and potential role in therapy of degenerative diseases. Cell Tissue Res. 331, 157-163 (2008).
- Pittenger, M. F., et al. Multilineage potential of adult human mesenchymal stem cells. Science. 284, 143-147 (1999).
- Bonfield, T. L., Nolan Koloze, M. T., Lennon, D. P., Caplan, A. I. Defining human mesenchymal stem cells efficacy in vivo. J Inflamm. (Lond). 25 (7), 51 (2010).
- Pneumaticos, S. G., Triantafyllopoulos, G. K., Chatziioannou, S., Basdra, E. K., Papavassiliou, A. G. Biomolecular strategies of bone augmentation in spinal surgery. Trends Mol. Med. 17 (4), 215-222 (2011).
- Amhed, T. A. E., Dare, E. V., Hincke, M. Fibrin: A versatile scaffold for tissue engineering applications. Tissue Engineering Part B. 14 (2), 199-215 (2008).
- Silbertein, L. E., Williams, L. J., Huglett, M. A., Magee, D. A., Weisman, R. A. An autologous fibrinogen-based adhesive for use in oncologic surgery. Transfusion. 28 (4), 319-321 (1988).
- Jockenhoevel, S., et al. Fibrin gel advantages of a new scaffold in cardiovascular tissue engineering. Eur. J. Cardiothorac Surg. 19 (4), 424-430 (2001).
- Veronesi, F., et al. Clinical use of bone marrow, bone marrow concentrate, and expanded bone marrow mesenchymal stem cells in cartilage disease. Stem Cells Dev. 22 (2), 181-192 (2013).
- Petrini, M., et al. Identification and purification of mesodermal progenitor cells from human adult bone marrow. Stem Cells Dev. 18 (6), 857-866 (2009).
- Trombi, L., et al. Selective culture of mesodermal progenitor cells. Stem Cells Dev. 18 (8), 1227-1234 (2009).
- Trombi, L., et al. Human autologous plasma-derived clot as a biological scaffold for mesenchymal stem cells in treatment of orthopedic healing. J. Orthop. Res. 26 (2), 176-183 (2008).
- Giannotti, S., et al. Use of autologous human mesenchymal stromal cell/fibrin clot constructs in upper limb non-unions: long term assessment. PlosOne. 8 (8), 73893 (2013).
- Castano-Izquierdo, H., et al. Pre-culture period of mesenchymal stem cells in osteogenic media influences their in vivo bone forming potential. J. Biomed. Mater. Res. A. 82 (1), 129-138 (2007).
- Malkani, A. L., Fitzgerald, R. H., Kaufer, H. . Orthopaedics. , (2002).
- Lee, S. H., et al. ICSH guidelines for the standardization of bone marrow specimens and reports. Int J Lab Hematol. 30 (5), 349-364 (2008).
- Bugno, A., et al. Application of the BacT/ALERTR 3D system for sterility testingof injectable products. Braz J Microbiol. 46 (3), 743-747 (2015).
- Bonab, M. M., et al. Aging of mesenchymal stem cells in vitro. BMC Cell Biology. 7, 14 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon