Method Article
Mesenchimali stromali coltura cellulare e la consegna in autologhi Condizioni: un approccio intelligente per applicazioni ortopediche
In questo articolo
Riepilogo
Coltura umane cellule mesenchimali stromali (hMSCs) con siero autologo, riduce i rischi di rigetto di materiale xenogenico e altri effetti negativi. Esso permette inoltre il recupero di un sottoinsieme di progenitori mesodermici, che può trasportare hMSCs freschi. Incorporare hMSCs in un coagulo di fibrina autologa consente una facile maneggevolezza ed efficace impianto chirurgico.
Abstract
Le cellule umane mesenchimali stromali (hMSCs) sono coltivate in vitro con diversi media. Limiti sul loro uso in ambito clinico, tuttavia, dipendono principalmente sui potenziali rischi a rischio biologico e l'infiammazione esercitate da sostanze nutritive xenogene per la loro cultura. derivati umani o materiali ricombinanti sono i primi candidati di scelta per ridurre queste reazioni. Pertanto, gli integratori e materiali di origine autologa cultura rappresentano i migliori nutrienti e prodotti più sicuri.
Qui, descriviamo un nuovo protocollo per l'isolamento e la coltura di hMSCs midollo osseo autologo in condizioni - vale a dire, il siero del paziente di derivazione come un supplemento per il terreno di coltura e di fibrina come impalcatura per l'amministrazione hMSC. Infatti, hMSC costrutti / coagulo di fibrina potrebbe essere estremamente utile per diverse applicazioni cliniche. In particolare, ci concentriamo sul loro uso in chirurgia ortopedica, dove il coagulo di fibrina derivato dal sangue del donatore di permessoefficace di consegna delle cellule e dei nutrienti / rifiuti scambi. Per garantire condizioni ottimali di sicurezza, è di fondamentale importanza per evitare i rischi di hMSC trasformazione e la crescita eccessiva di tessuto. Per queste ragioni, l'approccio descritto nel presente documento indica anche minimamente ex vivo hMSC espansione, per ridurre la senescenza cellulare e cambiamenti morfologici e breve termine osteo-differenziazione prima dell'impianto, per indurre specifica linea osteogenica, diminuendo così il rischio di successiva incontrollata proliferazione.
Introduzione
Le cellule umane mesenchimali stromali (hMSCs) rappresentano una delle migliori fonti di cellule per uso in ingegneria dei tessuti per la promozione di osteogenesi 1,2. Sono facilmente isolate dal midollo osseo e altri tessuti adulti, ed esprimono marcatori di superficie tipici come CD90, CD105, CD73 1. Inoltre, possono differenziarsi in diversi tipi cellulari quali osteoblasti, condrociti e adipociti 3. I loro effetti terapeutici sono attribuiti a loro rigeneranti e trofici 4. hMSCs possono essere usati nella chirurgia ortopedica, così come in altre applicazioni cliniche rigenerative. Essi sono preferibilmente combinati con impalcature, per migliorare l'esito clinico 5.
Rispetto ad altri materiali, il gel di fibrina mostra interessanti proprietà quali adesività, riassorbimento e trasporto efficiente dei nutrienti, che rendono estremamente utile per una varietà di applicazioni di ingegneria tissutale 6,7.
La sfida principale nella traduzione di un approccio di ingegneria tissutale in applicazioni cliniche è l'ottenimento di un ponteggio completamente biocompatibili e BIOSAFE e un terreno di coltura privo di xeno che evita qualsiasi effetto infettiva o reattiva.
Nel nostro metodo, gel di fibrina, derivato dal sangue del paziente, e siero autologo, per la cultura in vitro hMSCs, sono stati impiegati come possibile soluzione terapeutica nel campo ortopedico 8.
Per scopi clinici, hMSCs sono solitamente somministrati tramite due procedure principali: (i) la procedura "one-step" (cioè, minima manipolazione), che consente il trapianto automatico di midollo osseo, sia interi o concentrata (cioè cellule mononucleate), durante l'intervento chirurgico; e (ii) la procedura "two-step" (cioè, estesa manipolazione), che si basa sulla espansione ex vivo di hMSCs migliorare la resa prima dell'impianto, e richiede GStrutture MP 9. È interessante notare che le cellule di coltura con siero umano adulto invece di siero di vitello bovina permette il recupero, insieme con hMSCs, di un sottogruppo di cellule (1-10% nelle culture mononucleari) chiamati cellule mesodermiche progenitrici (PPM), in grado di differenziazione in vitro in fresco hMSCs 10,11. Così, hMPCs possono svolgere un ruolo significativo nel processo rigenerativo se confrontato con i soli 12,13 hMSCs. Infine, a breve termine osteo-induzione spinge hMSCs per iniziare la loro differenziazione in linea osteogenica senza perdere la loro potenziale proliferativo e la vitalità 12. Questi risultati confermano studi precedenti che hanno segnalato rafforzata in formazione ossea vivo da hMSCs, seguita da una precoltura in terreno osteogenico 14. Inoltre, un coagulo di plasma autologo come impalcatura per la consegna cella può essere facilmente manipolata dal chirurgo e modellato per adattarsi alla forma della cavità ossea 13.
therefore, questo metodo può essere estremamente utile per quei ricercatori e medici che mirano a tradurre la loro terapia a base di hMSC dalla panchina al capezzale in applicazioni ortopediche.
Protocollo
Il presente protocollo è stato sviluppato secondo la dichiarazione dell'Associazione medica mondiale la di Helsinki per quanto riguarda la condotta etica degli esseri umani di ricerca che coinvolge. E 'stato approvato dal Comitato Etico dell'Azienda Ospedaliero-Universitaria Pisana.
NOTA:
Il midollo osseo è stato ottenuto da pazienti sottoposti a intervento chirurgico di routine totale sostituzione dell'anca (in base al punto 1.1) 15; plasma per la preparazione coagulo è stato ottenuto da sangue periferico autologo 13; siero autologo, come un supplemento per il terreno di coltura, è stato raccolto da un autologo aferesi di sangue intero. Tutti i pazienti hanno ricevuto informazioni dettagliate sulla procedura e hanno firmato un modulo di consenso per iscritto.
1. Raccolta del campione di midollo osseo
- Raccogliere il midollo osseo dal canale midollare del femore dopo un intervento chirurgico di sostituzione totale dell'anca (per studi di ricerca). Brevemente, durante la preparazione chirurgica del canale midollare di hOuse stelo protesico, raccogliere il sangue osseo che trabocca (circa 10 - 15 mL, a seconda delle dimensioni della protesi) 15.
O - Raccogliere aspirato midollare dalla cresta iliaca in anestesia locale, seguendo la procedura standard ematologica circa 20 - 30 d in anticipo (per applicazioni cliniche) 16.
NOTA: In entrambi i casi le siringhe eparinizzate (per prevenire la formazione di coaguli) devono essere utilizzati per il recupero del midollo osseo.
2. Preparazione di autologo Plasma
- Raccogliere 20 ml di sangue periferico del paziente in provette per la raccolta di sangue sotto vuoto contenenti K3 EDTA (5,4 mg in 3 mL) e centrifugare a 2400 g per 15 min.
- Aspirare il componente del plasma in una provetta da 15 ml e congelare a -20 ° C fino al loro utilizzo.
3. Preparazione del autologo Serum
- Trasferire l'unità di plasma in una sacca di trasferimento mediante un picco. Scollegare il sacco riempito da saldatura e Weigh il sacchetto per calcolare il volume di plasma (Figura 1A).
- Coagulare il plasma autologo iniettando gluconato di calcio 100 mg / ml a 10% w / v attraverso il connettore della porta (Figura 1B). Dopo la miscelazione la borsa, metterlo a 4 ° CO / N senza agitazione per facilitare la formazione di coaguli.
- Centrifugare la borsa a 4.900 xg per 15 minuti a RT. Prendere il secchio centrifuga fuori della centrifuga e rimuovere il sacchetto attenzione (seguire le linee guida del produttore per la preparazione di lisato piastrinico) (Figura 1C).
- Isolare il coagulo appena sopra il morsetto per facilitare la filtrazione. Collegare il kit di filtrazione alla sacca di trasferimento usando un picco posizionato nella porta di uscita del kit di filtrazione.
- Appendere la borsa ed aprire il morsetto blu per lasciare che il flusso di siero per gravità. Non applicare una pressione al filtro per evitare il trasferimento di fibrina nel sacchetto. Dopo filtrazione, sigillare il tubo e rimuovere il sacchetto (seguire la produzionle linee guida pre- scrizioni per la preparazione di lisato piastrinico).
- Collegare una linea dedicata alla sacca e trasferimento siero finale in 50 mL sotto un banco a flusso laminare per evitare la contaminazione microbica.
- Prendere un campione con una siringa per verificare l'assenza di fibrinogeno ed eseguire un test di sterilità per colture batteriche aerobiche e anaerobiche 17. Etichettare i tubi in modo appropriato e congelarli a - 20 ° C fino a quando l'utilizzo.
4. Preparazione del Piano di espansione
- Preparare 500 ml di terreno di proliferazione completo. Per Modified Eagle Medium di Dulbecco - basso livello di glucosio (DMEM-LG), aggiungere il 10% di siero autologo (ottenuto come descritto nella sezione 3), 2 mM glutammina, 1% soluzione antibiotica e l'1% soluzione antimicotica. Sterile-filtro del mezzo di proliferazione completo.
5. Isolamento di hMSCs dal midollo osseo
- Trasferire il campione di midollo osseo (5 - 10 mL) dalla siringa in un ml conica 50 tuessere e diluire con soluzione fisiologica sterile (rapporto 1: 4). Agitare il tubo da 50 ml per 30 s di disaggregare i gruppi di cellule.
- Riscaldare il gradiente di densità (densità 1.077 g / L; vedere Tabella dei materiali) per RT prima dell'uso e sovrapporre il midollo osseo diluito delicatamente (per evitare la miscelazione entrambi gli strati) sul gradiente di densità aggiungendo 20 mL di campione 15 mL di densità gradiente per ogni tubo da 50 ml (Figura 2A).
- Centrifugare a 400 xg senza freno a 25 ° C per 30 minuti, quindi recuperare la frazione mononucleare all'interfaccia liquido-liquido e trasferirlo in un tubo da 50 ml usando una sterile 5 mL pipetta.
- Lavare la frazione mononucleare raccolti due volte con il mezzo proliferazione completo e centrifugare le provette a 400 × g per 10 min a 25 ° C per ottenere pellet cellulari.
- Eliminare il surnatante e risospendere delicatamente ogni pellet di cellule in 5 ml di terreno di proliferazione completo. Diluire in un rapporto di 1: 100 per la conta cellulare.
- Contare le cellule utilizzando un emocitometro dopo una diluizione 1: 1 con Trypan Blue colorazione per valutare la vitalità cellulare.
6. Cultura del hMSCs in presenza di siero autologo
- Riempire due o più flaconi (TC) 75 cm 2 di coltura tissutale con 15 ml di terreno di proliferazione completo fresco e trasferirli ad un incubatore di coltura cellulare a 37 ° C e 5% CO 2 fino utilizzo.
- Seed 0.3 - 0.5 x 10 6 cellule / cm 2 (37,5 x 10 6 cellule / 15 ml di mezzo completo proliferazione fresca) e incubare a 37 ° C e 5% CO 2 per 48 ore.
- Allo stesso tempo, seme 1 x 10 6 cellule in cm 25 pallone da 2 TC con 5 ml di terreno di proliferazione completa fresche Unità Formanti Colonia - Fibroblast (CFU-F) dosaggio. Cultura per 2 settimane (Continua nella sezione 12).
- Eliminare il medio e lavare delicatamente i flaconi dal punto 6.2 con mezzo completo proliferazione di remil sobrio cellule non aderenti e detriti. Aggiungere mezzo fresco nei flaconi e sostituire la metà di due volte a settimana, fino 70 - 80% di confluenza (coltura primaria, Passaggio 0 (P0)) (Figura 2B).
- Recupero delle celle utilizzando una specifica proteasi animale ricombinante (vedere Tabella dei materiali; utilizzare 3 mL della soluzione per bombola come raccomandato dal produttore) e incubare a 37 ° C e 5% CO 2 per 10 min. Aggiungere 6 ml di terreno di proliferazione completo per bombola e raccogliere in un tubo da 50 ml. Ripetere il punto 5.6.
NOTA: IMPORTANTE: L'uso di questo proteasi invece di tripsina permette il recupero di alcune cellule mesodermal progenitori (PPM) presenti nella cultura, che è tripsina resistente. - Per ulteriore espansione, replate la sospensione cellulare a 2.000 - 3.000 cellule / cm 2 nel nuovo 75 centimetri 2 TC palloni (P1) (Figura 2C).
- Utilizzare aliquote di cellule per valutare le potenzialità di differenziazione delle cellule staminali mesenchimaliverso osteogenico, adipogenico e lignaggi condrogeniche. Effettuare test di differenziazione seguenti raccomandazioni del produttore (Figura 2D).
NOTA: Diversi metodi di colorazione possono essere utilizzati per valutare la differenziazione multilineare.
7. Preparazione di un mezzo osteogenico con complementi farmaceutici
- Diluire soluzione di acido ascorbico (Soluzione 1A:. Acido ascorbico 200 mg / ml (vedi tabella dei materiali) 1:10 con DMEM-LG, per ottenere una soluzione di 20 mg / ml (Soluzione 1B, soluzione di lavoro) aliquote fotografici di soluzioni 1A e 1B a -20 ° C fino al loro utilizzo.
- Risospendere 1 g idrocortisone in 10 ml di acqua sterile (soluzione 2A: idrocortisone 100 mg / ml (vedere tabella dei materiali) diluita 2A a 1:. 1.000 con DMEM-LG per ottenere una soluzione / mL 100 mg (Solution 2B, lavorando soluzione). aliquote fotografici di soluzioni 2A e 2B a -20 ° C fino al loro utilizzo.
- Su utilizzo prepare fresco mezzo osteogenico come segue: aggiungere DMEM-LG con 10% di siero autologo, acido ascorbico / ml 50 mg e 0,4 mg / ml idrocortisone. Sterile-filtro del mezzo osteogenico.
8. Osteogenic pre-induzione e recupero di hMSCs
- Completamente rimuovere il supporto di proliferazione e aggiungere osteogeniche media 96 h prima della raccolta delle cellule (ad esempio, l'80 - 90% confluenza di solito è raggiungibile in 7 d). Fornire un secondo cambio medio osteogenico 24 ore prima raccolta di cellule.
- Staccare le cellule come descritto al punto 6.5 e delicatamente risospendere il pellet aggiungendo 2 mL di terreno proliferazione completa in un tubo da 50 ml.
NOTA: La vitalità cellulare può essere ridotta (circa il 10%) come risultato di osteoinduzione. aggregati cellulari possono essere osservati. - Dopo il conteggio, lavare le cellule con mezzo proliferazione completo e centrifugare a 300 g per 5 min. Risospendere il pellet delicatamente a 1 - 2 x 10 6 cellule vitali / 2ml di plasma autologo (vedere paragrafo 2) per tubo da 50 ml.
9. Preparazione di hMSC / coagulo di fibrina costrutti
- Aggiungere 150 ml di gluconato di calcio a 100 mg / ml per ogni provetta 50 mL ottenuta dalla fase 8.3. e risospendere le cellule sotto agitando delicatamente.
- Incubare le cellule a 37 ° C e 5% CO 2 per 15 - 30 min per ottenere hMSC / fibrina costrutti coagulo (Figura 3A). Preparare un coagulo di fibrina costrutto senza cellule da utilizzare come controllo.
NOTA: IMPORTANTE: Si raccomanda di preparare questo coagulo di controllo almeno 2 ore prima del test vitalità cellulare, come ci vogliono 30 minuti o più per reticolazione.
10. vitalità cellulare Assay
- Rimuovere il liquido dai tubi da 50 ml e aggiungere 1 ml di terreno di proliferazione completo contenente il 10% di reagente v / v vitalità cellulare (AB; vedi Tabella dei Materiali), secondo le linee guida del produttore.
- incubare °e provette a 37 ° C e 5% di CO 2 per 3 h. Misurare l'assorbanza a 570 nm con una lunghezza d'onda di riferimento a 600 nm (AB al tempo 0; t0).
- Eliminare il surnatante e aggiungere 2 ml di terreno di proliferazione completo fresco. Incubare a 37 ° C, 5% CO 2 O / N. Il giorno successivo (AB in fase di 24 ore, T24), ripetere i passaggi 10,1-10,3 (Figura 3B).
11. istologica Valutazione della vitalità cellulare e deposizione di calcio all'interno di coagulo di fibrina costrutti
- Fissare le / fibrina costrutti coagulo hMSC a 4% w / v formalina neutra tamponata O / N a 4 ° C. Lavare 4x in D-PBS per 15 min e conservare in etanolo al 70%.
- Disidratare i campioni a 40 ° C in una serie di etanolo graduata: 80% una volta per 30 min, 95% per due volte per 45 min e 3x 100% per 1 h. Chiarire due volte in xilene per 45 min a 40 ° C.
- Risciacquare i campioni in paraffina liquida a 60 ° C per 2 h ed integrarli. Tagliare il blocco di paraffina con un microtomo e montare tegli sezioni (5 micron) su vetrini.
- Macchiare le sezioni deparaffinate utilizzando lo standard ematossilina e il metodo eosina (H & E) (Figura 3C).
- Eseguire von Kossa colorazione trattando le sezioni con 1% di nitrato d'argento per 15 min, 0,5% Pyrogallol per 2 min e 5% di sodio tiosolfato per 2 min. Controcolorare sezioni con 0,1% di rosso nucleare diluito in una soluzione contenente 5 g di solfato di alluminio per 5 minuti e sciacquare in acqua corrente per 5 min. Montare le sezioni con un agente di montaggio.
- Valutare la deposizione di minerali sotto forma di granuli neri sotto microscopio ottico (400X ingrandimento) (Figura 3D).
12. CFU-F Assay
- Sciacquare il pallone 25 centimetri 2 (dal punto 6.3.) Con D-PBS. Macchia utilizzando il metodo May-Grunwald / Giemsa standard. Visivamente quantificare il numero hMSC segnando singole colonie (Figura 4) sotto un microscopio ottico.
NOTA: Seil midollo osseo è preso come al punto 1.2. e le sezioni 2-9 sono eseguiti in Good Manufacturing Practice (GMP) con la necessaria approvazione normativa, i / fibrina costrutti coagulo hMSC possono essere impiantati per applicazioni ortopediche.
Risultati
Preparazione del siero autologo
coagulazione del plasma, eseguita aggiungendo gluconato di calcio alla sacca di trasferimento, permette il recupero di siero autologo in grandi quantità, come richiesto per la cultura hMSC. Infatti, con questa tecnica, è possibile ottenere fino a 200 mL di siero (Figura 1).
HMSC isolamento, la cultura e la differenziazione utilizzando siero autologo
Cellule mononucleate del midollo ossee sono isolate utilizzando un gradiente di densità, che dà luogo ad uno strato anello intermedio (Figura 2A). Con placcatura queste cellule e rimuovendo quelle non aderenti con il lavaggio, è possibile isolare hMSCs (Figura 2B). In condizioni di coltura autologhe, un sottogruppo di cellule, chiamato PPM, vengono rilevati a P0 e in percentuali fino to 10%, a seconda della variabilità del paziente (Figura 2B). PPM sono ancora presenti dopo replating (cioè, P1) se la proteasi è utilizzato per passaging cellule (Figura 2C). hMSCs isolati e coltivati in un ambiente autologo mantengono la loro capacità di differenziare verso le tre linee mesodermiche noti (osteogenico, adipogenico e condrogeniche). I saggi di differenziazione sono stati eseguiti per confrontare l'identità della popolazione hMSC con quelli ottenuti usando (nonautologous) condizioni di coltura standard. Come test di funzionalità di questo protocollo, von Kossa colorazione, tetrossido di osmio colorazione, e Alcian Blu colorazione a pH 1 sono stati scelti al posto di quelli suggeriti dal produttore dei supporti differenziazione (vedi Tabella dei Materiali) (Figura 2D).
Preparazione, vitalità e istologico caratterizzazione di MSC / fibrina costrutti coagulo
I hMSCs sono dispersi nel plasma, che è reticolati con gluconato di calcio in un tubo da 50 ml, portando alla formazione di un disco gelatina circondato dal suo supernatante (Figura 3A). All'interno di questi grumi di plasma, i hMSCs sono vitali, come dimostra il cambiamento di colore della vitalità cellulare tintura T24 dal blu (controllo senza cellule) al rosa (coagulo cellularized) (Figura 3B). La vitalità cellulare all'interno del coagulo è confermata dalla colorazione H & E, che mostra una morfologia cellulare ben conservato (Figura 3C). Inoltre, un osteoinduzione minimo appena prima del secondo raccolto di cellule dà luogo alla deposizione preliminare di calcio da hMSCs stimolati (Figura 3D).
Unità formanti colonia
La presenza di colonie hMSC dopo 2 settimane in coltura è indicata mediante il saggio CFU-F (figura 4).
s = "jove_step" fo: keep-together.within-page = "1"> Applicazione di MSC / coagulo di fibrina costrutto nel midollo non sindacale
Costrutti hMSC / coagulo di fibrina ottenuti come descritto in questo metodo (passo 1,1) sono state applicate con successo per il trattamento di gravi pseudoartrosi degli arti superiori in 8 casi compassionevoli 13. A lungo termine (massimo 7,6 mesi) valutazione ha confermato i risultati clinici e funzionali di successo per tutti i pazienti, senza evidenza di crescita eccessiva di tessuto o di formazione del tumore.

Figura 1. Preparazione del autologo Serum.
(A) L'unità di plasma viene trasferito in un sacchetto di trasferimento usando il picco; (B) Il plasma viene coagulato per iniettando gluconato di calcio attraverso il connettore della porta; (C) Una centrifuga sangue-bag è utilizzato per separare il siero./files/ftp_upload/54845/54845fig1large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
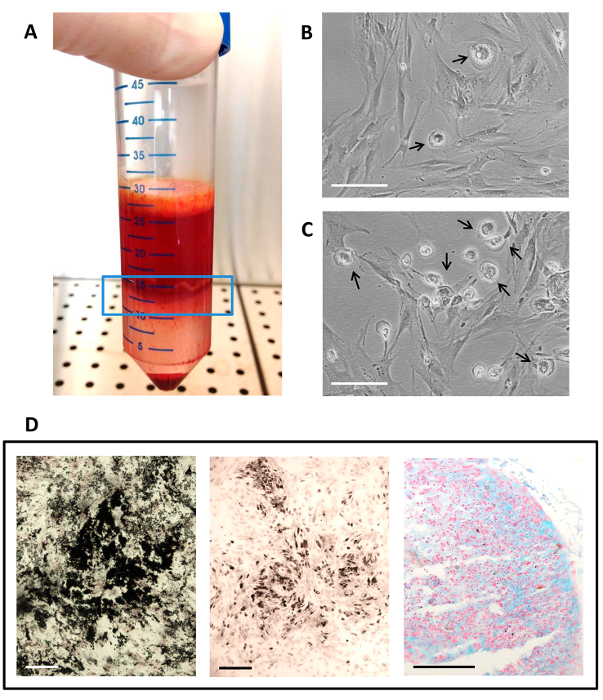
Figura 2. hMSC Isolamento, cultura e differenziazione utilizzando autologo Serum.
(A) lo strato di cellule mononucleari (nella finestra linea blu) ottenuto dopo midollo osseo centrifugazione con gradiente di densità; (B) La coltura cellulare come appare a P1; (C) la cultura cellulare come appare a P0 (coltura primaria); (B - C) Le frecce indicano la presenza di PPM nella cultura MSC. barra della scala è di 100 micron; (D) risultati istochimici dei dosaggi di differenziazione multilineage. differenziazione osteogenica viene valutata utilizzando von Kossa colorazione per la deposizione di matrice minerale in nero, la differenziazione adipogenico è indicato da presenza di vacuoli grassi, macchiato di nero da osmio tetroxide, e la differenziazione condrogenico viene visualizzato dalla presenza di glicosaminoglicani solfati, che sono macchiati in ciano da Alcian colorazione blu a pH 1. Barra di scala è di 50 micron. Clicca qui per vedere una versione più grande di questa figura.
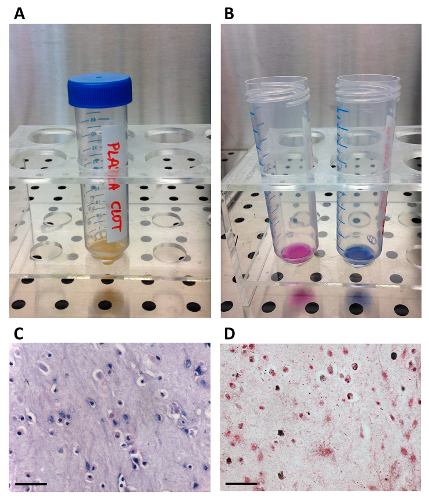
Figura 3. Preparazione, Viabilità e istologico Caratterizzazione di MSC / coagulo di fibrina costrutti.
(A) La hMSC / coagulo di fibrina costruire come appare dopo cross-linking; (B) Risultati del test AB: la MSC sono vitali all'interno coagulo di fibrina, come dimostra il cambiamento di colore del colorante vitalità cellulare (T24), dal blu (controllo senza celle, a destra) di colore rosa (coagulo cellularized, sulla sinistra). (C - D) risultati istochimici di hMSC / fibrina costrutti coagulo. Barra di scala è50 micron. (C) ematossilina ed eosina mostra cellule vitali inglobate nella matrice di fibrina; La deposizione (D) a matrice minerale colorato in nero da von Kossa colorazione, che conferma l'osteogenesi iniziale. Clicca qui per vedere una versione più grande di questa figura.
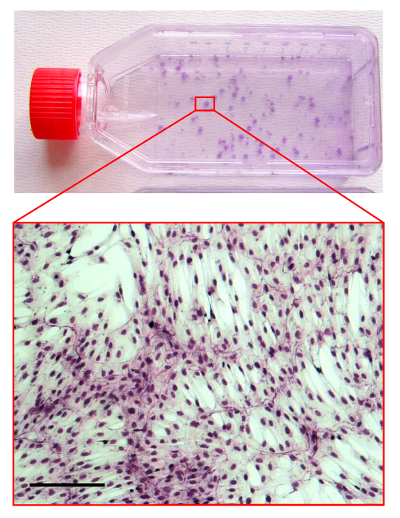
Figura 4. CFU-F Assay.
Immagine di un pallone in coltura con hMSCs colorati con il metodo May-Grunwald / Giemsa. L'area di zoom-in è una luce-microfotografia che mostra la morfologia di una colonia hMSC. Barra della scala è di 100 micron. Clicca qui per vedere una versione più grande di questa figura.
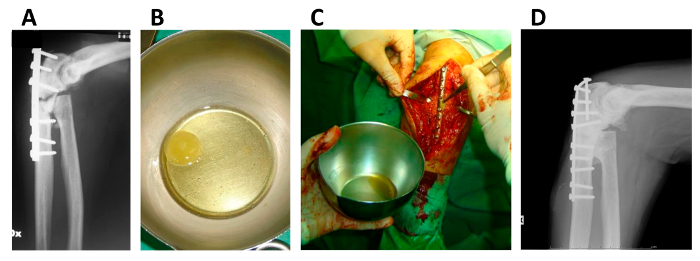
Figura 5. Applicazione di hMSC / coagulo di fibrina Construct in Bone pseudoartrosi.
(A) a raggi X dell'arto superiore di un paziente affetto da pseudoartrosi; (B) hMSC / coagulo di fibrina costrutto poco prima dell'impianto; (C) applicazione chirurgica del hMSC / coagulo di fibrina costrutto; (D) X-ray dell'arto superiore dello stesso paziente dopo 5 anni. Questa cifra viene ripubblicato da Giannotti S. et al. con modifiche minime 13. Clicca qui per vedere una versione più grande di questa figura.
Discussione
I passaggi critici di questo protocollo riguardano l'uso di siero umano adulto e proteasi, che permettono di ottenere una terapia hMSC BIOSAFE. In particolare, il siero umano adulto consente l'isolamento e la manutenzione, mentre proteasi assicura il raccolto, di PPM. Queste sono cellule immature presenti nel midollo osseo che può dare origine a hMSCs freschi, assicurando così una riserva di hMSCs vitali lungo il tempo di coltura. Non tutti i PPM possono essere raccolti, poiché aumentando il tempo di esposizione al attività proteasica è dannoso per hMSC redditività. Per questo motivo, una incubazione proteasi 10 min è stato scelto come compromesso ottimale tra il recupero del PPM e la vitalità delle hMSCs. Un altro punto critico è il tempo osteodifferentiation. In effetti, in una vasta osteodifferentiation vitro ridurrebbe considerevolmente la vitalità cellulare, influenzando così la formazione di osso in vivo finale. L'ultimo passo fondamentale consiste nel avvalendosi di una impalcatura bioassorbibile autologo, which si ottiene inserendo le cellule (hMSCs e PPM) in un gel di fibrina coagulazione del plasma.
Un passo fondamentale per migliorare il rendimento del PPM è quello di seminare cellule mononucleari a concentrazione più elevata. Utilizzando procedure aferesi per ottenere plasma e trattandolo con calcio gluconato rende possibile il raggiungimento di siero autologo in grandi quantità. È stato osservato che il siero umano come supplemento medium è paragonabile al siero fetale bovino (FBS) in colture hMSC. Tuttavia, nella nostra esperienza, un terreno completo integrato con FBS contribuisce alla senescenza più veloce di siero umano adulto. Un passo significativo è quello di somministrare un osteoinduzione minimo per hMSCs. Infatti, questo trattamento porta le cellule a differenziarsi facilmente verso la linea osteogenica, essendo quindi utile per evitare ulteriore trasformazione cellulare in vivo. Per mantenere una buona vitalità di hMSCs minimamente osteoinduced, si raccomanda di seguire attentamente le raccomandazioni descritte nei passi 6.5. und 8.2., inclusa la manipolazione, centrifugazione e gli importi medi da aggiungere. Se una procedura di aferesi non è disponibile, è ancora possibile effettuare questo protocollo eseguendo sangue multipla richiama al paziente o, in alternativa, acquistando pool di sieri AB. Ovviamente, al fine di portare questo protocollo dal comodino panca-to-, è obbligatorio avere le fabbriche di cellule GMP, o equivalenti, a disposizione.
Limitazioni per l'applicazione di questa tecnica riguardano il anemico, ematologiche-oncologia e pazienti ortopedici affetti da osteomielite., Disegno grandi quantità di sangue di pazienti anemici, dovrebbero essere evitati. Nei pazienti oncologici, la qualità dei campioni di cellule è influenzato dai trattamenti chemioterapici, mentre nei pazienti osteomielite l'infezione può influenzare il risultato finale. In tutti i casi in cui il siero autologo è insufficiente o non idoneo, maschio pool AB sieri rappresentano una valida alternativa.
L'utilizzo delle cellule / fibrina CLOt costrutti per le possibili applicazioni cliniche è fondamentale per rilasciare una terapia cellulare completamente autologhe, che potrebbe essere facile da maneggiare e muffe durante l'intervento chirurgico, con conseguente risultati eccellenti per il trattamento delle ossa non-unioni 13. Per scopi clinici, hMSCs sono di solito somministrati tramite due procedure principali: la manipolazione minima e ampie manipolazioni 9. Per superare i problemi legati ad una vasta coltura ex vivo, come anomalie nella morfologia e dimensioni 18 celle, abbiamo eseguito un breve periodo ex espansione delle cellule in vivo e osteo-differenziazione (solo 4 d).
Il protocollo senza xeno descritto in questo documento, insieme ai brevi tempi di espansione delle cellule e osteodifferentiation, ha dimostrato di essere rilevanti nelle cliniche al fine di ottenere la produzione di osso veloce in vivo, senza evidenza di proliferazione del tessuto e della trasformazione, confermando così la sua efficacia e la lunga sicurezza -term nella riparazione ossea (Figura 5) 13.
La metodologia presentata in questo rapporto ha lo scopo di dimostrare l'efficacia e la sicurezza di hMSC espansione in vitro in condizioni autologhe per un eventuale impiego in chirurgia ortopedica. Questo protocollo impiega hMSCs isolate dal midollo osseo e coltivate in un mezzo integrato con siero autologo ed inclusi in autologo coagulo di fibrina, garantendo così una terapia cellulare completamente autologhe. L'induzione osteogenic duplice, poco prima del secondo distacco, migliora la capacità hMSC di differenziarsi in osteoblasti. Di conseguenza, questa tecnica è particolarmente adatta per applicazioni in difetti ossei, in quanto non si limita alla pseudoartrosi. Le possibili applicazioni future potrebbero coinvolgere astragalo cisti e gestione perdita di tessuto osseo.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
This study was funded by the Tuscany Region (grant number 539999_2014_Petrini_CUCCS). The authors would like to thank Prof. S. Berrettini for authorizing the use of the Otolab laboratory and instruments, and the surgery staff from the Orthopedic Clinic II of the University of Pisa, for the fundamental cooperation in sample harvesting. The support provided by Dr. F. Scatena is gratefully acknowledged. Finally, many thanks are due to Mr. J.G. De La Ossa for his precious contribution to histologic processing.
Materiali
| Name | Company | Catalog Number | Comments |
| Triple Select (1x) | GIBCO, LIFE TECHNOLOGIES | 12563-029 | cell culture |
| Trypan blue stain | GIBCO, LIFE TECHNOLOGIES | 15250061 | cell culture |
| DMEM-LG, no glutamine, no phenol red | GIBCO, LIFE TECHNOLOGIES | 11880-028 | cell culture |
| Glutamax (100x) | Gibco, Life Technologies | 35050038 | cell culture |
| Penicillin/Streptomycin sol. | Gibco, Life Technologies | 15140122 | cell culture |
| Alamar Blue (AB) | Gibco, Life Technologies | DAL1025 | proliferation/viability assay |
| Ficoll-Paque Plus | GE Healthcare | 17-14440-02 | cell culture |
| D-PBS | Gibco, Life Technologies | 14190-094 | cell culture |
| StemMACS AdipoDiff Media | Miltenyi Biotech | 130-091-677 | cell culture |
| StemMACS ChondroDiff Media | Miltenyi Biotech | 130-091-679 | cell culture |
| hMSC Osteogenicdiff BulletKit | Euroclone | LOPT3002 | cell culture |
| Vitamin C (ascorbic acid) | Bayer | ATC Code: A11GA01 | Pharmaceutical grade drug |
| Flebocortid Richter (hydrocortisone) | Aventis Pharma | ATC Code: H02AB09 | Pharmaceutical grade drug |
| Victor X3, reader | PerkinElmer | 2030 multilabel reader | proliferation/viability assay |
| Silver nitrate | Sigma Aldrich | 209139 | histological assay |
| Pyrogallol | Sigma Aldrich | 16040 | histological assay |
| Sodium Thiosulphate | Sigma Aldrich | S8503 | histological assay |
| Histoplast LP | Thermo Scientific | 8332 | histological assay |
| Methanol | Sigma Aldrich | 32213 | histological assay |
| Ethanol | Sigma Aldrich | 2860 | histological assay |
| Nuclear fast red | Sigma Aldrich | 60700 | histological assay |
| Formalin | Bio-optica | 05-K01009-X40 | histological assay |
| Eosin B | Sigma Aldrich | 45260 | histological assay |
| DPX | Sigma Aldrich | 6522 | histological assay |
| Haematoxylin | Sigma Aldrich | H3136 | histological assay |
| Aluminium Sulphate | Sigma Aldrich | 202614 | histological assay |
| Xylol | Sigma Aldrich | 534056 | histological assay |
| Microtome | Leika | histological assay | |
| May Grunwald | Sigma Aldrich | MG1L-1L | histological assay |
| Giemsa | Sigma Aldrich | 32884-250ML | histological assay |
| Transfer bag | Biomérieux | BC0300031 | cell culture |
| Filtration kit | Macopharma | BC0800010 | cell culture |
| Calcium Gluconate | Galenica Senese | Pharmaceutical grade drug | |
| Bact Alert | Biomérieux | 259790 anaerobic | microbiological assay |
| Bact Alert | Biomérieux | 259789 aerobic | microbiological assay |
| Steryle Luer-Lok Syringe 50 mL | BD Plastipak | 300865 | cell processing |
| Heraeus Cryofuge 6000i | Thermo Scientific | blood bag centrifuging | |
| SL16R Centrifuge | Thermo Scientific | blood tube centrifuging |
Riferimenti
- Horwitz, E. M., et al. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy. 7, 393-395 (2005).
- Kassem, M., Abdallah, B. M. Human bone marrow-derived mesenchymal stem cells: biological characteristics and potential role in therapy of degenerative diseases. Cell Tissue Res. 331, 157-163 (2008).
- Pittenger, M. F., et al. Multilineage potential of adult human mesenchymal stem cells. Science. 284, 143-147 (1999).
- Bonfield, T. L., Nolan Koloze, M. T., Lennon, D. P., Caplan, A. I. Defining human mesenchymal stem cells efficacy in vivo. J Inflamm. (Lond). 25 (7), 51 (2010).
- Pneumaticos, S. G., Triantafyllopoulos, G. K., Chatziioannou, S., Basdra, E. K., Papavassiliou, A. G. Biomolecular strategies of bone augmentation in spinal surgery. Trends Mol. Med. 17 (4), 215-222 (2011).
- Amhed, T. A. E., Dare, E. V., Hincke, M. Fibrin: A versatile scaffold for tissue engineering applications. Tissue Engineering Part B. 14 (2), 199-215 (2008).
- Silbertein, L. E., Williams, L. J., Huglett, M. A., Magee, D. A., Weisman, R. A. An autologous fibrinogen-based adhesive for use in oncologic surgery. Transfusion. 28 (4), 319-321 (1988).
- Jockenhoevel, S., et al. Fibrin gel advantages of a new scaffold in cardiovascular tissue engineering. Eur. J. Cardiothorac Surg. 19 (4), 424-430 (2001).
- Veronesi, F., et al. Clinical use of bone marrow, bone marrow concentrate, and expanded bone marrow mesenchymal stem cells in cartilage disease. Stem Cells Dev. 22 (2), 181-192 (2013).
- Petrini, M., et al. Identification and purification of mesodermal progenitor cells from human adult bone marrow. Stem Cells Dev. 18 (6), 857-866 (2009).
- Trombi, L., et al. Selective culture of mesodermal progenitor cells. Stem Cells Dev. 18 (8), 1227-1234 (2009).
- Trombi, L., et al. Human autologous plasma-derived clot as a biological scaffold for mesenchymal stem cells in treatment of orthopedic healing. J. Orthop. Res. 26 (2), 176-183 (2008).
- Giannotti, S., et al. Use of autologous human mesenchymal stromal cell/fibrin clot constructs in upper limb non-unions: long term assessment. PlosOne. 8 (8), 73893 (2013).
- Castano-Izquierdo, H., et al. Pre-culture period of mesenchymal stem cells in osteogenic media influences their in vivo bone forming potential. J. Biomed. Mater. Res. A. 82 (1), 129-138 (2007).
- Malkani, A. L., Fitzgerald, R. H., Kaufer, H. . Orthopaedics. , (2002).
- Lee, S. H., et al. ICSH guidelines for the standardization of bone marrow specimens and reports. Int J Lab Hematol. 30 (5), 349-364 (2008).
- Bugno, A., et al. Application of the BacT/ALERTR 3D system for sterility testingof injectable products. Braz J Microbiol. 46 (3), 743-747 (2015).
- Bonab, M. M., et al. Aging of mesenchymal stem cells in vitro. BMC Cell Biology. 7, 14 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon