Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Determinación de la potencia relativa de un Anti-TNF Anticuerpo Monoclonal (mAb) por neutralizante utilizando un método de bioanalítica In Vitro TNF
En este artículo
Resumen
Aquí se presenta un protocolo para la determinación de la actividad anti-apoptótica relativa de un mAb anti-TNFα mediante un mecanismo de neutralización con células WEHI 164. Este protocolo es útil para comparar la fuerza de la neutralización de diferentes moléculas con la misma funcionalidad biológica.
Resumen
Este protocolo indica la medida de la neutralización de actividad apoptótica de TNFα en un modelo de celular de la fibroblastos de ratón (WEHI 164) con un mAb anti-TNFα. Además, este protocolo puede utilizarse para evaluar otras moléculas anti-TNFα, tales como proteínas de fusión. El modelo de celular utilizado aquí es sensible a la apoptosis mediada por el TNFα cuando es inducida por un factor de estrés adicional en las condiciones de cultivo celular (p. ej., privación de suero). Este procedimiento es un ejemplo de cómo ejecutar este ensayo analítico, destacando las operaciones claves relativas a la preparación de la muestra, dilución celular, inducción de apoptosis y medidas espectrofotométricas que son críticas para garantizar resultados exitosos. Este protocolo revela las condiciones de mejor rendimiento relacionados con la inducción de apoptosis y eficiente de señal de grabación, llevando a valores bajo incertidumbre.
Introducción
Potencia biológica es la medida cuantitativa de la actividad biológica basada en los atributos del producto ensayado que están vinculados a las propiedades biológicas pertinentes, considerando que la cantidad (expresada en masa) es una medida fisicoquímica del contenido de proteínas. Pruebas de potencia, junto con otras metodologías analíticas, se realizan como parte de estudios de comparabilidad, la estabilidad y la conformidad del producto. En este sentido, las mediciones de potencia se utilizan para demostrar que los lotes de producto cumplen los atributos de calidad críticos (CQAs) o criterios de aceptación durante todas las fases de ensayos clínicos y después de la aprobación del mercado.
La apoptosis es muerte celular programada, que naturalmente ocurre cuando las células se infectan con un virus o cuando las células son tensionadas por un medio ambiente factor compromisos celular viabilidad y función1,2. Entre otros, inhibición de la apoptosis, o neutralización biológica, es uno de los mecanismos terapéuticos principalmente conocidos de mAbs, particularmente en el tratamiento de enfermedades crónicas, como trastornos inflamatorias inmune-mediada. Moléculas anti-TNFα ejercen sus propiedades terapéuticas mediante el bloqueo de la interacción del factor de necrosis tumoral alfa (TNFα) con el p55 y el p75 celular receptores de la superficie3, evitando vías de señales que finalmente conducen a la apoptosis celular.
TNFα puede producir inflamación en las enfermedades crónicas4. TNFα es secretada cifra en el medio extracelular por los macrófagos, que son los centinelas del sistema inmune innato y los principales actores en este tipo de enfermedad5. Como un camino común, desregulación del TNFα se asocia con la patogenia de estas enfermedades. Sin control y bajo inducción constante y estrés celular, TNFα induce la degeneración de tejido y muerte celular, en última instancia conducen a la artritis reumatoide, enfermedad de Crohn y otros perfiles patológicos6.
Antagonistas del TNF que bloqueen la interacción entre TNF y sus receptores se han utilizado cada vez más como una terapia eficaz para reducir la sintomatología y dificultar la progresión de estas enfermedades. En la actualidad, medicamentos anti-TNFα son ampliamente utilizados para el control de la concentración sistémica de esta citoquina, además evitando la degeneración de los tejidos involucrados. En este sentido, es imprescindible proporcionar una prueba reproducible y robusto para describir la capacidad específica de un fármaco para lograr su efecto biológico.
En este protocolo, crítico pasos identificados durante el desarrollo de un ensayo de neutralización-para la medida acertada de la potencia biológica destacan, con particular énfasis en las habilidades necesarias para ejecutar el método bio-analíticos. Este método bio-analítica proporciona información útil comparabilidad entre diferentes lotes o anti-TNFα medicamentos en comparación con una sustancia de referencia clínicamente probado.
Protocolo
1. preparación de las soluciones y los medios de comunicación
- preparar el medio de cultivo: RPMI-1640 con 10% FBS, pH 7.4.
- Preparar medio de cultivo de ensayo: RPMI-1640 sin rojo de fenol con 1% FBS, pH 7.4.
- Preparar la solución de lavado celular: solución de DPBS libre de Ca y Mg con EDTA 0.02%, pH 7,4.
- Preparar la solución de separación celular: tripsina 0,125% con EDTA 1 mM.
- Descongelar 100 mL de una solución al 0,25% de tripsina-EDTA y transferir a un matraz de 500 mL estéril.
- Mezcla con 100 mL de célula solución de lavado y dispensa alícuotas de 15 mL en tubos estériles de 15 mL. Almacenar a -70 a-80 ° C hasta su uso.
- Filtro de estas soluciones a través de una membrana de 0.22 μm y caliente a 37 ° C durante al menos 30 minutos antes de usar.
- Prepare apoptosis-inducción solución solución TNFα a 3,3 μg/mL.
- Disolver 20 μg de TNFα con 500 μl de agua filtro esterilizados en su envase primario y mezcle hasta disolución completa.
- Transferir a un tubo de 15 mL estéril y agregar 5,5 mL de DPBS libre de Ca y Mg solución a este tubo. Mezclar suavemente con un mezclador de tipo vórtex.
- Alícuota de la solución en 70 porciones μl. Dispense cada alícuota en microtubos de 0.5 mL y conservar a -80 ° C.
- Preparar solución de inducción a apoptosis: solución TNFα en 40 ng/mL.
- Descongele una alícuota de la solución madre inducción de apoptosis, incubar en un baño de agua a 25 ° c durante 10 minutos
- Diluir la solución madre de inducción de apoptosis a 40 ng/mL mediante la adición de 61 μl de 3.3 μg/mL de solución de TNFα a 4,939 mL de medio de cultivo de ensayo en un tubo estéril de 15 mL.
- Mix de vórtex durante 10 s; esta solución debe ser preparada recientemente antes de su uso.
- Calentar la solución a 37 ° C durante al menos 30 minutos antes de utilizar en análisis de eneutralization th.
- Preparación de la solución sustrato: caspasas 3/7 Glo solución 7 , 8.
- Descongelar el caspasa tampón (tampón de Glo de caspasas 3/7) 12 h antes de su uso.
- Dejó el tampón de caspasas y el sustrato (sustrato de Glo de caspasas 3/7) sentarse por separado a 25 ± 5 ° C por 30 min antes de la mezcla de.
- Transferir 10 mL de la solución tampón de caspasa al substrato vial y mezclar por inversión.
- Mantener a 25 ± 5 ° C, protegido de luz hasta uso.
Nota: La solución es estable por 6 horas a temperatura ambiente.
2. Cultivo y recuento de células
- celular descongelar y el primer subcultivo.
- Retire un vial de células WEHI 164 9 de un congelador a-80 ° c y transferirlos a un baño de hielo.
- Pipeta hacia arriba y hacia abajo con 1 mL de medio de cultivo previamente calentado hasta que las células congeladas descongelación completamente.
- Distribuir 9 mL de medio de cultivo previamente calentado en un tubo estéril de 15 mL.
- Transferir la suspensión de células en el tubo de 15 mL estéril y mezclar suavemente cinco veces por inversión.
- Centrifugar la suspensión celular en 125 x g durante 3 min descartar el sobrenadante y separar el sedimento celular.
- Añadir 5 mL de medio de cultivo en el tubo. Mezclar hasta que las células son suspendidas completamente.
- Para el recuento celular, transferir 50 μl de la suspensión de células a un 500 μl microtubo y mezclar con 50 μl de azul de tripán de 0,4%. Contar las células y ajuste a 0,5 x 10 6 células/mL. Consulte el paso 2.2, por debajo de.
- Añadir 13 mL de medio de cultivo precalentada a un matraz de cultivo celular de 75 mL.
- Distribuir suficiente volumen de suspensión celular de paso 2.1.6 para alcanzar 0,5 x 10 6 células/mL en el frasco de cultivo celular e incubar a 37 ° C y 5% CO 2 durante la noche.
- Conteo celular.
Nota: Ver referencia 10.- Usando la solución del paso 2.1.6, transfiera 0.05 mL a un hemocitómetro y determinar la densidad de células en un microscopio mediante exclusión del azul tripán.
- Cuantificar el número total de células viables y.
- Ajustar las suspensiones celulares a 0,5 x 10 6 células/mL.
Ecuación 1
V medio de cultivo (mL) =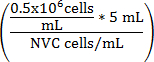
V medio de cultivo (mL) = (5 mL - V suspensión de la célula)
V medio de cultivo (mL) = volumen ajustado de WEHI 164 suspensión de la célula
NVC = número de células viables/mL: WEHI 164
V medio de cultivo (mL) = volumen de medio de cultivo de ensayo añadido a la suspensión de células para alcanzar 0,5 x 10 6 células/mL
0.5 x 10 6 = densidad celular de destino
- Celular la separación y el segundo y tercer subcultivo.
Nota: Un sistema de vacío puede utilizarse para eliminar las soluciones de los frascos. Pueden utilizarse pipetas estériles desechables o de vidrio. Si la pipeta tiene una obstrucción de algodón en la parte superior, debe ser retirado antes de su uso.- Retire el medio de cultivo de cultivo celular frasco de T utilizando una pipeta estéril 1 mL y un vacío de. Solución
- dispensar 5 mL de lavado de células en la cultura T-frasco, mezclar suavemente y deseche la solución. Repita este paso dos veces.
Nota: El retiro completo del medio de cultivo es fundamental para la separación eficiente celular. - Añadir 15 mL de solución de la separación de células T-matraz y dejar reposar 3 minutos en una incubadora a 37 ° C y 5% CO 2.
- Verificar la ausencia de células adjuntas en la pared interna del frasco bajo el microscopio. Eliminar las células de la cultura T-matraz con una pipeta estéril de 20 mL y dispensar en un tubo estéril de 50 mL.
- Centrifugar la suspensión celular en 125 x g durante 3 min descartar el sobrenadante y resuspender el precipitado con otros 5 mL de medio de cultivo.
- Contar las células y añadir suficiente medio de cultivo para alcanzar la concentración deseada de la célula según la ecuación 1.
- Añadir esta suspensión a 72 cm 2 frasco de T e incubar durante la noche a 37 ° C y 5% CO 2.
- Subcultivo de las células por lo menos dos veces antes de usarlos en la neutralización ensayo. Repita los pasos 2.3.1-2.3.8 para los próximos dos días.
- Ensayo de suspensión celular.
- Seleccionar un WEHI 164 subcultura que tiene por lo menos tres pasadas. Consulte el paso 2.1.
- Separar y contar las células siguiendo pasos 2.2 y 2.3 del presente Protocolo.
- Diluir la suspensión de células según la ecuación 1 a 0,5 x 10 6 células/mL.
- Utilice esta suspensión celular para el ensayo de neutralización. Mezclar todo suspensiones celulares por antes del Mezclador vortex uso.
3. Anticuerpo y diluciones
- cuantificación de los mAbs.
- Determine la concentración de sustancia de referencia, muestras control y analítica muestra a través de la absorción UV a 280 nm usando su extinción masiva coeficiente (1.39) 11.
Nota: Original concentraciones podrían tomarse de las etiquetas del producto de droga. Sin embargo, esto debe ser verificado por absorción UV.
- Determine la concentración de sustancia de referencia, muestras control y analítica muestra a través de la absorción UV a 280 nm usando su extinción masiva coeficiente (1.39) 11.
- mAb diluciones.
- Diluir todas las muestras independientemente por triplicado, con solución de DPBS libre de Mg y Ca en microtubos de 2 mL, hasta 2 mg/mL. Para confirmar esta concentración absorción de UV por triplicado, utilizando solución DPBS libre de Ca y Mg como el blanco.
- Mezclar las soluciones de proteínas comunes para 5 s usando un mezclador de tipo vórtex.
- Diluir 100 μl de cada solución de 2 mg/mL mAb con 0,9 mL de medio de cultivo análisis.
- Mezcla para 5 s por mezclador de tipo vórtex.
Nota: Estas soluciones tienen una concentración de 200 μg/mL. Las diluciones deben hacerse para cada triplicado. - Diluir 10 & #181; L de cada solución de mAb de 200 μg/mL con 0,99 mL de medio de cultivo de ensayo. Mezcla de 5 s, utilizando un mezclador de tipo vórtex. Estas soluciones tienen una concentración de 2 μg/mL. Realizar diluciones seriadas de cada triplicado antes de utilizar en el ensayo de neutralización.
- Hacer anti-TNFα mAb diluciones en tres microplacas independiente. Hacer un duplicado de cada triplicado independiente y les dispensan en una microplaca, tal como se indica en la tabla 1. Sustancia de referencia < tabla fo:keep-together.within-página = «1» fo:keep-con-next.within-página = "siempre" fo:text-align = "center" > plato 1 plato 2 placa de 3 De pozos de pozos muestra pozos muestra muestra B2:B11 sustancia de referencia B2:B11 Control muestra B2:B11 muestra analítica C2:C11 C2:C11 C2:C11 D2:D11 muestra analítica D2:D11 sustancia de referencia D2:D11 ejemplo de Control de E2:E11 E2:E11 E2:E11 F2:F11 Control muestra F2:F11 muestra analítica F2:F11 sustancia de referencia G2:G11 G2:G11 G2:G11 Tabla 1: matrices de muestras microplacas. Un ensayo de neutralización completa debe realizarse en tres microplacas dentro de coordenadas B2 G11. Al azar de referencia, análisis y muestras de control permiten a los investigadores a verificar cualquier sesgo en el análisis.
- Realizar diluciones de mAb de cada referencia, la muestra o control, como se muestra en la tabla 2.
Nota: Las concentraciones de mAb anti-TNFα que se describe en esta tabla no son las concentraciones finales en el ensayo de neutralización. < td > 250
T 2 capaz: diluciones de mAb Anti-TNFα. Diluciones seriadas de mAbs anti-TNFα se han demostrado en esta tabla. Concentraciones finales descritas en esta tabla no son las concentraciones en el ensayo, donde mAbs anti-TNFα se diluyeron por un factor de 3 (dilución mAb + medio de cultivo + suspensión de células). Las líneas en negrita representan las diluciones de las líneas 3, 5, 7, 9 y 10; no en negrita las líneas representan la dilución de las líneas 3, 4 y 6. Estas diluciones seriadas se realizan justo antes de realizar el ensayo de neutralización. Debe tener cuidado al mezclar mediante pipeteo hacia arriba y hacia abajo tres veces antes de preparar las diluciones.Columna de placa de medio de cultivo de volumen del ensayo (μL) volumen de la sustancia de referencia, análisis de la muestra o Control Muestra (uL) la concentración en la placa de ensayo (ng/mL) 2 0 230 2000 3 150 150 de línea 2 1000 4 75 75 de la línea 3 500 5 100 50 de la línea 3 333 6 75 75 de la línea 4 7 75 75 de la línea 5 166 8 75 75 de la línea 6 125 9 75 75 para línea m 7 83 10 75 75 de la línea 9 41 11 150 75 de línea 10 13 - No las placas a 25 ± 5 ° C hasta su uso.
4. Ensayo de neutralización con las células WEHI 164
- mezclar con un vórtex todos celular suspensiones (0,5 x 10 6 células/mL) antes de la dispensación en cualquier paso de este protocolo de.
Nota: En esta sección, caliente cada solución a 37 ° C por 30 min antes del uso. - Transferir 50 μl de la suspensión celular en cada uno de los 60 pocillos de microplacas, pasar de la columna 2 a la 11 y la línea B a G.
- Transferir 50 μl de control, muestra y referencia de mAb diluciones en microplacas. Sigue el patrón representado en la figura 1.
- Añadir 50 μl de la solución de la inducción de apoptosis a cada pocillo. Células
- controles celulares de 50 μl de WEHI 164, dispensadas en tres pozos. Traer cada bien a un volumen final de 150 μL con medio de cultivo de ensayo.
- Utilizar un control de la citotoxicidad de una mezcla de 50 μl de células WEHI 164 más 50 μl de solución de la inducción de apoptosis. Traer cada bien a un volumen final de 150 μL con medio de cultivo de ensayo.
- Control para el TNFα, usar 50 μl de la solución de la inducción de apoptosis y llevarlo a 150 μL con el medio de cultivo análisis.
- Para el espacio en blanco, utilice 150 μL de medio de cultivo de ensayo solo.
- Llenar los pozos restantes con 150 μL de medio de cultivo para evitar efectos de evaporación placa. 4.1.1-4.1.9
- Repita los pasos dos veces en dos otras microplacas.
Nota: Las concentraciones finales de mAb en las microplacas son: 0.666, 0.333 0.167, 0.111, 0.083, 0,056, 0.042, 0.028, 0.014 y 0.004 μg/mL. - Cargar las muestras en microplacas, tal como se indica en la figura 1.
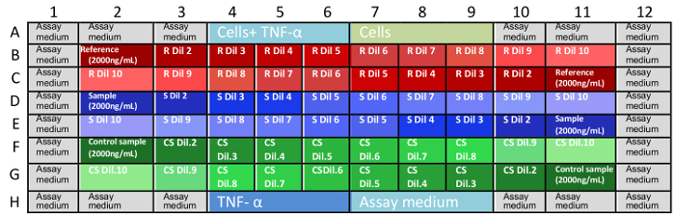
figura 1: disposición de muestras en las placas de ensayo. B1 a la G11 son coordenadas bien en las microplacas y describir las posiciones donde se colocan las diluciones de la muestra. Coordenadas que faltan son los pozos llenados de controles y análisis de medio de cultivo (A1-A12 y H1 H12). Esta distribución al azar de muestras (diluciones de avance y retroceso en las microplacas) ayuda a eliminar el sesgo en los resultados debido a la evaporación del medio o de otras variables. Es mejor que cada microplaca es hecho por un analista en un momento. R:, S: contramuestra, CS: ejemplo de control, Dil: dilución. haga clic aquí para ver una versión más grande de esta figura. - Incubar las tres placas a 37 ° C y 5% CO 2 para 16 ± 2 h.
- Déjelo el reactivo de Glo de caspasas 3/7 a 25 ± 5 ° C por 30 min antes de su uso.
- Agregar 100 μl de este reactivo en todos los pocillos, incluyendo los controles y las muestras de.
- Agitar las placas usando un mezclador de tipo vórtex de microplacas durante 3 min a 25 ± 5 ° C inmediatamente después de dispensar en los pocillos.
- Incubar las placas de 2.5 ± 0.5 h a 25 ± 5 ° C, protegido de la luz.
- Colocar el micrófonoroplates en el luminómetro y completar la sección siguiente.
5. Análisis de resultados
- usando un software para detección de luminiscencia, seleccionar la función de modo y punto final de la luminescencia.
- Seleccionar un fondo claro de 96 pocillos de la placa y sus 80 pozos internas, excluyendo las columnas 1 y 12.
- Seleccionar un tiempo de integración de 1.250 ms y 10 s para mezclar la microplaca antes de leer.
- Seleccionar los pozos donde sustancia de referencia, sustancia analítica muestra de control se colocará y se identifican con sus correspondientes concentraciones de.
- Leer las muestras en microplacas con el luminómetro.
- Utilizar una cuarta ecuación del parámetro para el análisis de resultados. Gráfico de una curva dosis-respuesta, como se muestra en la figura 2.
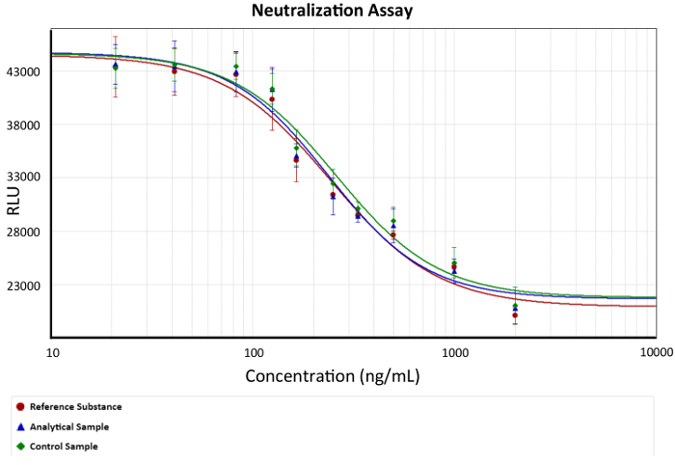
figura 2: curva dosis-respuesta. Se representa la concentración de mAb anti-TNFα versus luminiscencia (viabilidad celular). Una cuarta ecuación de parámetro que describe la protección anti-TNFα de mAbs se utilizó como modelo. EC50 es la concentración de mAb que puede neutralizar la cantidad de TNFα que causan la muerte celular 50% en cada análisis, ejemplificado en la gráfica como el cambio en la pendiente. Barras de describen la desviación estándar de luminiscencia para cada concentración de mAb. x representa la concentración de Ab anti-TNFα y es representado como una función logarítmica en ng/mL, mientras que y representa la respuesta de luminiscencia en unidades arbitrarias de la luminescencia. haga clic aquí para ver una versión más grande de esta figura.
Nota: En la cuarta ecuación de parámetro, C es la concentración efectiva 50 (CE50). Este valor se utilizará para comparar la sustancia de referencia analítica muestra y ejemplo de control mediante la función effector. - Para el cálculo de las potencias relativas, arreglar la sustancia de referencia a 100% y calcular las potencias de la muestra y control por consiguiente.
Nota: Estos valores son representados en la figura 3.
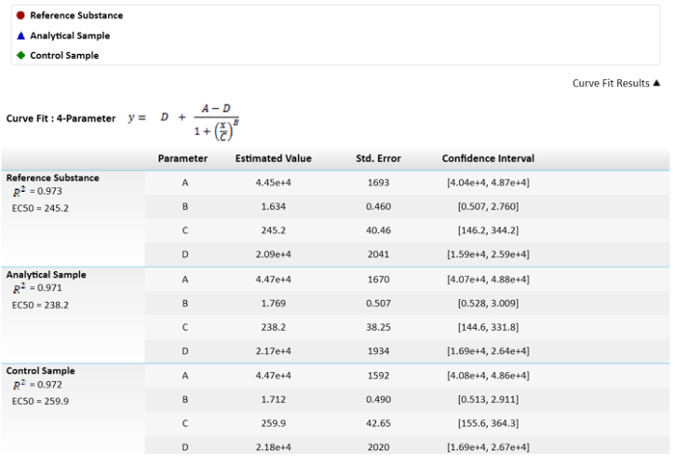
figura 3: ecuación matemática utilizada para el cálculo de la EC50s y sus valores. Valores de EC50 o los parámetros C, tienen su incertidumbre como error estándar. También se muestra una comparación de EC50s entre los resultados de la muestra y la referencia de potencia relativa. Se calcula el intervalo de confianza con un α = 0.05. haga clic aquí para ver una versión más grande de esta figura.
Resultados
Gráfico de la respuesta a la dosis (con controles)
La figura 1 representa la respuesta de luminiscencia frente a concentración de mAb. Esta función sigmoidal es un ejemplo de liberación de la caspasa 3 y 7 en el medio de cultivo de ensayo debido a la lisis celular. Muerte celular es realzada por inanición de suero además de TNFα inducción de señalización. Por lo tanto, la molécula anti-TNFα (mAb) interactúa con la citocina, i...
Discusión
Esta caracterización ayuda a determinar a priori el comportamiento biológico de una molécula en desarrollo antes de que se llevan a cabo ensayos clínicos costosos y desperdiciadores de tiempo. También es útil para la liberación de lote a lote de un producto de droga aprobado. Cabe destacar que estos análisis son útiles para determinar si una molécula tiene un efecto biológico adecuado en cuanto a su mecanismo de acción. El método bio-analítico presentado en este tutorial es muy importante que la co...
Divulgaciones
Los autores no tienen nada que revelar
Agradecimientos
Este trabajo fue apoyado por el Consejo Nacional de ciencia y tecnología (CONACYT), México otorgar PEI CONACYT 2015 220333, sin participación en el diseño del estudio.
Materiales
| Name | Company | Catalog Number | Comments |
| WEHI 164 | ATCC | CRL-1751 | Fibrosarcoma cells from Mus musculus |
| RPMI-1640 Medium | ATCC | 30-2001 | Store medium at 2 °C to 8 °C |
| RPMI 1640 Medium, no phenol red | GIBCO | 11835-030 | Store medium at 2 °C to 8 °C |
| Trypsin-EDTA(0.25%),phenol red | GIBCO | 25200-056 | Store medium at -10 °C to -20 °C |
| DPBS, no calcium, no magnesium | GIBCO | 14190-136 | Store medium at 2 °C to 8 °C |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | Store at -20 °C to -70 °C |
| Fetal Bovine Serum (U.S), Super Low IgG | HyClone | SH3089803 | Store at -10 °C to -20 °C |
| Fetal Bovine Serum (U.S.), Characterized | HyClone | SH3007103 | Store at -10 °C to -20 °C |
| Caspase-Glo 3/7 Assay kit | Promega | G8093 | Store the Caspase-Glo. 3/7 Substrate and Caspase-Glo. 3/7 Buffer at –20 ºC protected fromLight |
| EDTA, Disodium Salt, Dihydrate, Crystal, A.C.S. Reagent | J.T.Baker | 8993-01 | -- |
| Sample mAb Adalimumab | Probiomed | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Reference and Control mAb Adalimumab | Abbvie | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Microplate Reader | Molecular Devices | 89429-536 | SpectraMax M3 Multi-Mode |
| Microplate reader Software | Molecular Devices | -- | SoftMax Pro 6.3 GxP |
| Incubator | Revco | 30482 | Revco RNW3000TABB Forced-Air CO2 |
| Laminar Flow Hood | The Baker Company | 200256 | Baker SG603A-HE | High Efficiency, Class II Type A2 |
Referencias
- Elmore, S. Apoptosis: A Review of programmed cell death. Toxicol Patho. 35 (4), 495-516 (2007).
- Darwish, R. S. Regulatory mechanisms of apoptosis in regularly dividing cells. Cell Health Cytoskelet. 2 (1), 59-68 (2010).
- Tracey, D., et al. Tumor necrosis factor antagonist mechanism of action: A comprehensive review. Pharmacol Ther. 117 (2), 244-279 (2008).
- Körner, H., Sedgwick, J. Tumour necrosis factor and lymphotoxin: Molecular aspects and role in tissue-specific autoimmunity. Immunol Cell Biol. 74 (5), 465-472 (1996).
- Wong, M., et al. TNFa blockade in human diseases: Mechanisms and future directions. Clin Immunol. 126 (2), 121-136 (2008).
- Furst, D. E., Wallis, R., Broder, M., Beenhouwer, D. O. Tumor necrosis factor antagonists: different kinetics and/or mechanisms of action may explain differences in the risk for developing granulomatous infection. Semin Arthritis Rheum. 36 (3), 159-167 (2006).
- Karvinen, J., et al. Homogeneous time-resolved fluorescence quenching assay (LANCE) for caspase-3. J Biomol Screen. 7 (3), 223-231 (2002).
- Ren, Y. G., et al. Differential regulation of the TRAIL death receptors DR4 and DR5 by the signal recognition particle. Mol Biol Cell. 15 (11), 5064-5074 (2004).
- Sud, D., Bigbee, C., Flynn, J. L., Kirschner, D. E. Contribution of CD8+ T cells to control of Mycobacterium tuberculosis infection. J Immunol. 176 (7), 4296-4314 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Curr Protoc Immunol. Apendix 3, 3 (2001).
- Ramasubramanyan, N., et al. . Low acidic species compositions and methods for producing and using the same. 1, (2014).
- Masters, J. R., Stacey, G. N. Changing medium and passaging cell lines. Nat Protoc. 2 (9), 2276-2284 (2007).
- Eskandari, M. K., Nguyen, D. T., Kunkel, S. L., Remick, D. G. WEHI 164 subclone 13 assay for TNF: sensitivity, specificity, and reliability. Immunol Invest. 19 (1), 69-79 (1990).
- Hora, M. S., Rana, R. K., Smith, F. W. Lyophilized formulations of recombinant tumor necrosis factor. Pharm Res. 9 (1), 33-36 (1992).
- Ponnappan, S., Ponnappan, U. Aging and immune function: molecular mechanisms to interventions. Antiox Redox Signal. 14 (8), 1551-1585 (2011).
- Matsumaru, K., Ji, C., Kaplowitz, N. Mechanisms for sensitization to TNF-induced apoptosis by acute glutathione depletion in murine hepatocytes. Hepatology. 37 (6), 1425-1434 (2003).
- Camacho-Villegas, T., Mata-Gonzalez, T., Paniagua-Solis, J., Sanchez, E., Licea, A. Human TNF cytokine neutralization with a vNAR from Heterodontus francisci shark: a potential therapeutic use. mAbs. 5 (1), 80-85 (2013).
- Männel, D. N., Falk, W. Optimal induction of tumor necrosis factor production in human monocytes requires complete S-form lipopolysaccharide. Infect Immun. 57 (7), 1953-1958 (1989).
- Lis, K., Kuzawińska, O., Bałkowiec-Iskra, E. Tumor necrosis factor inhibitors-state of knowledge. Arch Med Sci. 10 (6), 1175-1185 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados