JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
상대적인 힘의 안티-TNF 단 클론 항 체 (mAb) 중화 방 청 TNF는 시험관에서 생물 메서드를 사용 하 여의 결정
요약
프로토콜 WEHI 164 셀 중립화 메커니즘을 사용 하는 안티-TNFα mAb의 상대 안티-apoptotic 활동의 결정에 대 한 여기에 제공 됩니다. 이 프로토콜은 같은 생물 학적 기능을 가진 다른 분자의 중립화 강도 비교 하는 데 유용.
초록
이 프로토콜 안티 TNFα mAb를 사용 하 여 마우스 fibroblast 세포 모델 (WEHI 164)에서 TNFα의 apoptotic 활동 중립화의 측정을 보여줍니다. 또한,이 프로토콜 융해 단백질 등 다른 안티 TNFα 분자를 평가 하기 위해 사용할 수 있습니다. 여기 고용 셀룰러 모델 TNFα 중재 된 apoptosis에 민감한 때 추가 스트레스 요소가 셀 문화 조건 (예: 혈 부족)에서 유도 된다. 이 절차 실행이 분석 분석 결과, 샘플 준비, 셀 희석, apoptosis 유도, 성공적인 결과 보장 하기 위해 중요 한 spectrophotometric 측정에 관련 된 주요 작업을 강조 표시 하는 방법을 예로 보여주. 이 프로토콜 apoptosis 유도 및 효율적인 신호 기록, 낮은 불확실성 값을 선도 하는 최고 성능 조건을 보여준다.
서문
생물 학적 힘 수량 (대량 표현)는 단백질 함량의 물리 화학적 측정 관련 생물 속성에 연결 된 분석 제품 특성에 따라 생물 학적 활동의 양적 척도 이다. 다른 분석 방법론을 함께 힘 테스트 제품 적합성, 안정성, 및 comparability 연구의 일부로 수행 됩니다. 이런이 의미에서 힘 측정 제품 배치에 맞는지 중요 한 품질 특성 (CQAs) 또는 승인 기준 및 시장 승인 후 임상 시험의 모든 단계를 설명 하는 데 사용 됩니다.
Apoptosis는 프로그램된 한 세포 죽음, 그 타협 세포 생존 능력 및 기능1,2요소 바이러스 또는 세포는 환경에 의해 스트레스 세포 감염 때 자연스럽 게 발생. 다른 가운데, apoptosis 억제, 또는 생물 학적 중화 면역 중재 염증 성 질환 등 만성 질환의 치료에 특히 mAbs의 주로 알려진된 치료 메커니즘 중 하나입니다. 안티 TNFα 분자는 p55 p75 세포 표면 수용 체3, 마지막으로 세포 apoptosis 이어질 신호 경로 방지와 종양 괴 사 인자 알파 (TNFα)의 상호 작용을 차단 하 여 그들의 치료 속성을 발휘 한다.
TNFα 일부 만성 질환4에 염증을 일으킬 수 있다. TNFα 쓰레드가 extracellular 환경에 타고 난 면역 체계와 질병5의이 종류에 있는 주요 배우의 보초는 대 식 세포에 의해 은닉 된다. 일반적인 경로로 TNFα 규제 완화는 이러한 질병의 병 인 연결 됩니다. 제어 없이 및 지속적인 유도 및 세포 스트레스, TNFα 궁극적으로 류 마티스 관절염, Crohn의 질병, 그리고 다른 병 적인 프로필6로 이어지는 세포 죽음 및 조직 변성을 유도 합니다.
TNF와 그것의 수용 체 사이 상호 작용을 차단 하는 TNF 길 항 제는 점점 징후를 줄이고 이들이 질병의 진행을 방해 하는 효과적인 치료로 사용 되었습니다. 요즘, 안티 TNFα 약 제품 추가 참여 조직의 변성 방지이 cytokine의 조직 농도 제어를 널리 사용 됩니다. 이런이 의미에서 재현 하 고 강력한 생물의 생물 학적 효과 달성 하는 약물의 특정 능력을 설명 하기 위해 제공은 필수적입니다.
이 프로토콜, 중요 한 중화 분석 결과의 개발 단계 식별-생물 학적 힘의 성공적인 측정에 대 한 강조 표시 됩니다, 바이오 분석 메서드를 실행 하는 데 필요한 기술에 특히 강조와 함께. 이 바이오 분석 방법 마약 제품을 임상 시험된 기준 물질에 비해 다른 배치 또는 안티-TNFα 사이 유용한 comparability 정보를 제공 합니다.
프로토콜
1. 미디어와 솔루션의 준비
- 문화 매체를 준비: RPMI-1640 10 %FBS, pH 7.4.
- 준비 분석 결과 문화 매체: RPMI-1640 페 놀 레드 하지 않고 있지만 1 %FBS, pH 7.4.
- 세포 세척 솔루션 준비: DPBS Mg 및 Ca 무료 솔루션 0.02 %EDTA, pH 7.4.
- 세포 분리 솔루션 준비: 1 mm EDTA 0.125 %trypsin.
- 녹여 100 mL의 트립 신-EDTA와 메 마른 500 mL 플라스 크에 0.25% 솔루션.
- 믹스 셀의 100 mL와 함께 솔루션을 세척 하 고 15 mL 무 균 튜브에 15 mL aliquots 분배. -70-80 ° C까지 사용 하 게.
- 0.22 μ m 멤브레인 통해 이러한 솔루션을 필터링 하 고 사용 하기 전에 적어도 30 분 동안 37 ° C 까지의 따뜻한.
- Apoptosis 유도 재고 솔루션 TNFα 솔루션 3.3 µ g/mL에서 준비.
- 500 µ L의 기본 컨테이너와 완전 한 해체까지 믹스에 필터 살 균 물과 TNFα의 분해 20 µ g.
- 15 mL 무 균 튜브에 전송 하 고이 관에 DPBS Mg 및 Ca 무료 솔루션의 5.5 mL를 추가 합니다. 와 동 믹서를 사용 하 여 부드럽게 혼합.
- 약 70 µ L 부분으로 수입니다. 0.5 mL microtubes-80에서 저장소에 각 약 수를 분배 ° c.
- 준비 apoptosis 유도 솔루션: 40 ng/mL에서 TNFα 솔루션.
- 10 분에 대 한 25 ˚C에서 물 욕조에 그것을 잠복기 apoptosis 유도 재고 솔루션의 약 수를 해 동
- 15 mL 무 균 튜브에 분석 결과 문화 매체의 4.939 mL을 3.3 µ g/mL TNFα 솔루션의 61 µ L을 추가 하 여 40 ng/mL을 apoptosis 유도 재고 솔루션을 희석.
- 10 소용돌이 믹서로 혼합 s;이 솔루션은 사용 하기 전에 갓 준비 해야 합니다.
- 회 eneutralization 분석 결과에서 사용 하기 전에 적어도 30 분 동안 37 ° C에 솔루션을 따뜻한.
- 기판 솔루션 준비: caspase 3/7 저런 솔루션 7 , 8.
- 녹여 caspase 버퍼 솔루션 (caspase 3/7 Glo 버퍼) 사용 하기 전에 12 h.
- Caspase 버퍼 솔루션 및 기판 (caspase 3/7 Glo 기판) 앉아 별도로 25 ± 5 ° C에서 혼합 전에 30 분 동안 하자.
- 반전 하 여 기판 유리병 및 혼합 caspase 버퍼 솔루션의 10 mL 전송할.
- 계속 25 ± 5 ° C, 사용까지 빛 보호.
참고:이 솔루션은 실 온에서 6 h에 대 한 안정적인.
2. 세포 Culturing 및 계산
- 셀 해빙 하 고 첫 번째 subculture.
- WEHI 164 셀 9 한 유리병-80 ˚C에 냉장고에서 제거 하 고 얼음 목욕에 그들을 전송.
- 냉동된 세포는 완전히 해 동 때까지 미리 데워 진된 문화 매체의 1 mL와 함께 아래로 플라스틱.
- 분배 15 mL 무 균 튜브에 미리 데워 진된 문화 매체의 9 mL.
- 15 mL 무 균 튜브에 세포 현 탁 액을 전송 하 고 반전 5 번 부드럽게 혼합.
- 원심 125 x g 3 분 삭제에 세포 현 탁 액은 상쾌한 고 셀 펠 릿 세분화.
- 튜브를 문화 매체의 5 mL을 추가합니다. 세포는 완전히 resuspended 때까지 혼합.
- 셀 카운팅을 위한 500 µ L microtube 및 50 µ L 0.4 %trypan 파랑의 혼합 세포 현 탁 액의 50 µ L을 전송. 셀을 계산 하 고 10 6 셀/mL x 0.5를 조정 합니다. 아래 단계 2.2를 참조 하십시오.
- 75 mL 세포 배양 플라스 크를 미리 데워 진된 문화 매체의 13 mL을 추가.
- 단계 2.1.6 셀 문화 플라스 크에서 10 6 셀/mL x 0.5를 달성 하 고 37 ° C, 5% CO 2에서 밤새 품 어 충분 한 셀 서 스 펜 션 볼륨 분배.
- 셀 세.
참고: 참조 참조 10.- 솔루션을 사용 하 여 단계의 2.1.6, 0.05 mL는 hemocytometer를 전송과 trypan 블루 제외를 사용 하 여 현미경으로 세포 밀도 결정.
- 셀과 가능한 셀의 총 수를 계량.
- 10 6 셀/mL x 0.5 셀 정지 조정.
방정식 1
V 문화 매체 (mL) =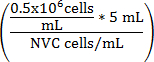
V 문화 매체 (mL) = (5 mL-V 세포 현 탁 액)
V 문화 매체 (mL) = 조정 된 양의 WEHI 164 현 탁 액 셀
NVC 가능한 WEHI 164 셀/mL의 수 =
V 문화 매체 (mL) = 0.5 x 10 6 셀/mL를 달성 하기 위해 세포 현 탁 액에 추가 분석 결과 문화 매체 볼륨
0.5 x 10 6 = 대상 셀 밀도
- 세포 분리 및 두 번째 및 세 번째 subculture.
참고:는 플라스 크에서 솔루션을 제거 하는 진공 시스템을 사용할 수 있습니다. 일회용 또는 유리 살 균 펫을 사용할 수 있습니다. 피펫으로 목화 덩어리 있으면 상단에, 그것은 사용 하기 전에 제거 해야 합니다.- 세포 배양 1 mL 균 피 펫 및 진공을 사용 하 여 T-플라스 크에서에서 문화 매체를 제거.
- 셀 세척의 분배 5 mL 솔루션 T-플라스 크, 문화에 부드럽게, 혼합 하 고 솔루션을 삭제. 이 단계를 반복 하 여 두 번.
참고: 문화 매체의 완전 한 제거는 효율적인 전지 분리에 대 한 중요. - T-플라스 크에 세포 분리 솔루션의 15 mL를 추가 하 고 37 ° C, 5% CO 2 배양 기에서 3 분 서 보자.
- 는 현미경 아래 플라스 크 내부 벽에 연결 된 셀의 부재를 확인합니다. 문화 20 mL의 멸 균 피 펫을 사용 하 여 T-플라스 크에서에서 셀을 제거 하 고 살 균 50 mL 튜브에 그들을 분배.
- 원심 125 x g 3 분 삭제에 세포 현 탁 액은 상쾌한 고 문화 매체의 또 다른 5 mL와 펠 릿 resuspend.
- 셀을 계산 하 고 식 1에 따라 원하는 셀 농도 도달 충분 한 문화 매체를 추가.
- 72 cm 2 T-플라스 크에이 정지를 추가 하 고 37 ° C, 5% CO 2에서 밤새 품 어.
- Subculture 최소한 두 번 중립화에 그들을 사용 하기 전에 셀 시험. 다음 2 일에 대 한 단계 2.3.1-2.3.8 반복.
- 세포 현 탁 액을 시험.
적어도 3 개의 패스를
- 선택 WEHI 164 subculture 2.1 단계를 참조 하십시오.
- 분리와 2.2와 2.3이이 프로토콜의 단계에 따라 셀.
- 10 6 셀/mL x 0.5 식 1에 따라 세포 현 탁 액 희석.
- 중화 분석 결과 대 한이 세포 현 탁 액을 사용합니다. 믹스와 동 믹서 사전 사용 하 여 모든 셀 정지.
3. 항 체 준비 및 희석
- 는 mAbs의 정량.
그들의 대량 멸종의 계수 (1.39) 11를 사용 하 여
- 결정 참조 물질, 컨트롤 샘플 및 280에 UV 흡수를 통해 분석 샘플의 농도 nm.
참고: 원래 농도 약 제품 라벨에서 가져온 수 있습니다. 그러나,이 자외선 흡수 하 여 확인 해야 합니다.
- 결정 참조 물질, 컨트롤 샘플 및 280에 UV 흡수를 통해 분석 샘플의 농도 nm.
- mAb 희석.
DPBS 2 mL microtubes, 2 mg/mL까지 Mg 및 Ca 무료 솔루션 3 중에서 독립적으로
- Dilute 모든 샘플. 빈으로 DPBS Mg 및 Ca 무료 솔루션을 사용 하 여 3 중에 UV 흡수이 농도 확인.
- 5 재고 단백질 솔루션을 믹스와 동 믹서를 사용 하 여 s.
- 분석 결과 문화 매체의 0.9 mL으로 각 2 mg/mL mAb 솔루션의 희석 100 µ L. 와 동 믹서에 의해
- 믹스 5 s.
참고:이 솔루션 200 µ g/mL의 농도 있다. 각 3 중의 희석은 이루어져야 합니다. - 희석 10 & #181. L 각 200 µ g/mL mAb 솔루션의 분석 결과 문화 매체의 0.99 mL와 함께. 5에 대 한 믹스와 동 믹서를 사용 하 여 s. 이러한 솔루션 2 µ g/mL의 농도 있다. 각 3 중 직렬 희석 중화 분석 결과에서 그들을 사용 하기 전에 수행.
- 는 MAb 희석 3 개의 독립적인 microplates에 안티 TNFα 확인합니다. 각 독립 3 중에서 중복을 확인 하 고 표 1에 표시 된 대로 한 microplate에 그들을 분배 한다. 물질 참조 < 테이블 fo:keep-together.within-페이지 "1" fo:keep =-와-next.within-페이지 "항상" fo:text =-정렬 = "센터" > 접시 1 접시 2 플레이트 3 웰 스 샘플 웰 스 샘플 웰 스 샘플 B2:B11 참조 물질이 B2:B11 컨트롤 샘플 B2:B11 분석 샘플 C2:C11 C2:C11 C2:C11 D2:D11 분석 샘플 D2:D11 참조 물질이 D2:D11 컨트롤 샘플 E2:E11 E2:E11 E2:E11 F2:F11 컨트롤 샘플 F2:F11 분석 샘플 F2:F11 기준 물질 G2:G11 G2:G11 G2:G11 표 1: Microplate 샘플 배열. 완전 한 무력화 분석 결과 g 11을 좌표 B2 내 3 microplates에서 실행 되어야 합니다. 임의의 참조, 분석, 및 제어 샘플의 분배 수 연구원 분석 결과에 어떤 편견을 확인 하.
- 각 참조의 수행 mAb 희석 샘플, 또는 제어, 표 2에서 같이.
참고:이 표에 설명 된 안티-TNFα mAb 농도 중립화 시험에서 최종 농도 되지 않습니다. < td > 250
T 수 2: 안티-TNFα mAb 희석. 안티 TNFα mAbs의 직렬 희석을이 테이블에서 보여 줍니다. 이 표에 설명 된 최종 농도 되지 않습니다 분석 결과, 농도 안티 TNFα mAbs (mAb 희석 + 배양 세포 현 탁 액) 3 배 희석 했다. 선은 굵게 나타냅니다 희석을 3, 5, 7, 9, 및 10; 라인에서 오는 굵은 비 줄 라인 3, 4 및 6에서 희석을 나타냅니다. 이러한 직렬 희석 중화 분석 결과 수행 하기 전에 그냥 할 수 있습니다. 주의 희석을 분배 하기 전에 세 번 아래로 pipetting으로 혼합 해야 합니다.플레이트 열 분석 결과 볼륨 문화 매체 (μ) 볼륨의 참조 물질, 분석 샘플 또는 제어 샘플 (uL) 농도 분석 결과 플레이트 (ng/mL)에서 2 0 230 2000 3 150 선에서 2 150 1000 4 75 75 선 3에서에서 500 5 100 선 3에서에서 50 333 6 75 75 선 4에서에서 7 75 75 선 5에서에서 166 8 75 선 6에서에서 75 125 9 75 75 이리저리 m 라인 7 83 10 75 75 선 9에서에서 41 11 150 선 10에서에서 75 13 - 사용까지 25 ± 5 ° C에서 번호판을 유지.
4. WEHI 164 세포 분석 결과 중화
- vortexing 모든이 프로토콜의 모든 단계에서 분배 이전 정지 (0.5 x 10 6 셀/mL)를 셀에 의해
- 믹스.
참고:이 섹션에서 따뜻하게 사용 하기 30 분 전에 대 한 37 ° C에 각 솔루션. - 열 2 11, 선 B g.를 이동 하는 microplates의 60 우물의 각 세포 현 탁 액의 전송 50 µ l
- MAb 참조, 샘플 및 컨트롤 전송 50 µ L 희석 microplates로. 그림 1에 표시 된 패턴을 따릅니다.
- 각 잘 apoptosis 유도 솔루션의 추가 50 µ L.
- WEHI 164의 50 µ L의 셀룰러 컨트롤 사용 세포, 3 개의 우물에 적절. 분석 결과 문화 매체와 150 µ L의 최종 볼륨을 각 잘가지고.
- 는 WEHI 164 셀의 50 µ L의 혼합물의 세포 독성 제어 플러스 apoptosis 유도 솔루션의 50 µ L을 사용합니다. 분석 결과 문화 매체와 150 µ L의 최종 볼륨을 각 잘가지고.
- TNFα에 대 한 제어, apoptosis 유도 솔루션의 50 µ L를 사용 하 고 분석 결과 문화 매체와 150 µ L에 가져다.
- 빈, 혼자 분석 결과 문화 매체의 150 µ L 사용.
- 접시 증발 효과 피하기 위해 문화 매체의 150 µ L을 채울 나머지 우물.
- 반복 단계 4.1.1-4.1.9 2 개의 다른 microplates에 두 번.
참고: mAb 최종 농도에 미 판 있습니다: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014, 및 0.004 µ g/mL. - 그림 1에 표시 된 대로 microplates에서 샘플 로드.
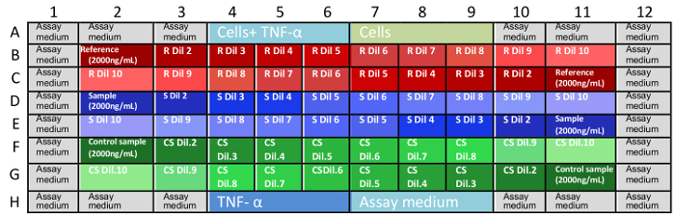
그림 1: 시험 접시에서 샘플의 처리. B1 G11 ~ 잘 좌표는 microplates에 있으며 샘플 희석 배치 됩니다 위치 설명. 누락 된 좌표는 웰 스 컨트롤 및 분석 결과 문화 매체 (A1-A12 및 H1 H12)으로 가득 합니다. 샘플 (는 microplates에서 앞으로 역 희석)의이 무작위 배포 매체 또는 다른 변수의 증발 때문에 결과에서 바이어스를 제거에 도움이 됩니다. 그것은 최고의 각 미 판 한 번에 한 애 널 리스트에 의해 수행 됩니다. R: 참조, s: 샘플, CS: 컨트롤 샘플, Dil: 희석. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오. - 16 ± 37 ° C, 5% CO 2 세 접시를 품 어 2 헤
- Caspase 3/7 저런 형광 시 약 25 ± 5 ° C에서 사용 하기 전에 30 분 동안 서 보자.
- 샘플 및 컨트롤을 포함 하 여 모든 웰 스에이 시 약의 추가 100 µ L.
- 즉시 우물으로 분배 후 25 ± 5 ° C에서 3 분 microplate 소용돌이 믹서를 사용 하 여 번호판을 흔들.
- 2.5 ± 0.5 h 25 ± 5 ° C, 빛 으로부터 보호에 대 한 번호판을 품 어.
- 마이크 삽입roplates는 루미 노에 다음 섹션을 완료 하 고.
5. 분석 결과의
- 발광 모드 및 기능을 선택 발광 검출을 위한 소프트웨어를 사용 하 여.
- 선택 96 잘 클리어-하단 플레이트 및 열 1 및 12를 제외 하 고 그것의 80 내부 우물.
- 1250 ms 및 10의 통합 시간 선택 읽기 전에 microplate 혼합에 대 한 s.
- 우물 참조 물질, 분석 물질 및 컨트롤 샘플 배치 됩니다 및 그들의 대응 농도와 식별을 선택 합니다.
- 는 루미 노와 microplates에 배치 샘플 읽기.
- 결과의 분석에 대 한 네 번째 매개 변수 방정식을 사용합니다. 그림 2에서 같이 복용량 응답 곡선 그래프.
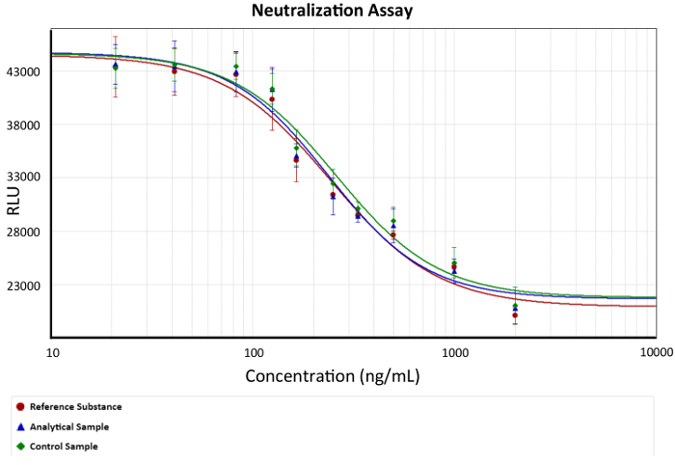
그림 2: 복용량 응답 곡선. 발광 (세포 생존 능력) 대 안티 TNFα mAb 농도 그려져 있습니다. 네 번째 매개 변수 방정식 mAbs의 안티 TNFα 보호를 설명 하는 모델으로 사용 되었다. EC50은 슬로프에 변화 그래프에서 궁 행 각 분석 결과에 50% 세포 죽음을 일으키는 원인이 되는 TNFα의 양을 중화 시킬 수 mAb의 농도 이다. 바 각 mAb 농도 대 한 발광의 표준 편차를 설명합니다. x 안티 TNFα Ab 농도 나타내고 y 나타내는 반면 ng/ml, 로그 기능으로 묘사 된다 임의의 발광 단위에서 발광 반응. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
참고: 네 번째 매개 변수 방정식에 C 효과적인 농도 50 (EC50) 이다. 이 값 effector 기능에 의하여 참조 물질, 분석 샘플, 및 제어 샘플을 비교 하는 데 사용 됩니다. - 상대 potencies 계산, 기준 물질을 100%로 수정 하 고 샘플의 potencies 계산 하 고 적절 하 게 제어.
참고: 이러한 값 그림 3에서 묘사 된다.
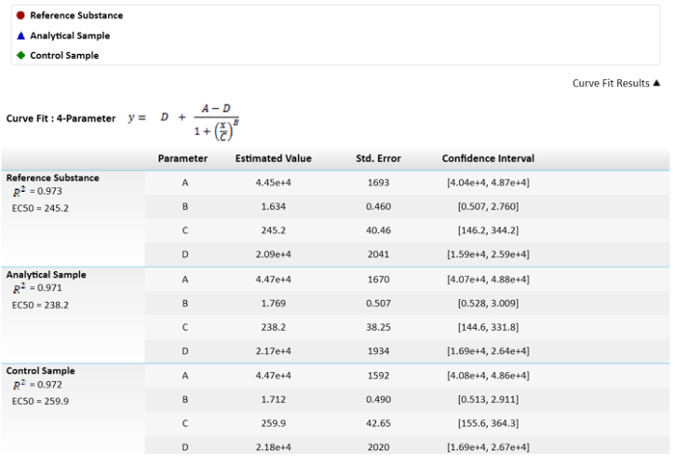
그림 3: 사용 하는 EC50s 및 그들의 값을 계산 하는 수학 방정식. EC50 값, 또는 C 매개 변수를 표준 오류로 묘사 그들의 불확실성을가지고 있다. 상대적인 힘의 샘플 및 참조 결과 EC50s의 비교도 그려져 있습니다. α와 신뢰 구간 계산 = 0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
결과
(컨트롤)와 복용량 응답 그래프
그림 1 mAb 농도 대 발광 응답을 나타냅니다. 이 자형 기능 분석 결과 배양 세포 세포의 용 해 때문에 caspase 3 및 7 릴리스를 예로 보여주. 세포 죽음은 혈 청 기아 플러스 TNFα 유도 신호에 의해 향상 됩니다. 따라서, 안티-TNFα 분자 (mAb)는 TNF 세포 수용 체와의 상호 작용 (입체 방해)에 의해 억제 사이토카인 ...
토론
이 특성화 비싸고 시간이 많이 걸리는 임상 시험 실시 전에 선험적으로 개발 중인 분자의 생물 학적 행동 결정에 도움이 됩니다. 승인 된 약 제품의 일괄 처리를 일괄 처리 릴리스도 유용합니다. 이 분석 실험 분자는 그것의 행동의 메커니즘에 대 한 적절 한 생물학적 효과 여부를 확인 하는 데 유용은 언급 가치가 있다. 이 자습서에 바이오 분석 방법은 다른 안티-TNFα 분자의 비교에 매우 중...
공개
저자 공개할 게 없다
감사의 말
이 작품은 과학의 국가 위원회에 의해 지원 되었다 고 기술 (CONACYT), 멕시코 연구의 설계에 참여 하지 않고 페이 CONACYT 2015 220333를 부여 합니다.
자료
| Name | Company | Catalog Number | Comments |
| WEHI 164 | ATCC | CRL-1751 | Fibrosarcoma cells from Mus musculus |
| RPMI-1640 Medium | ATCC | 30-2001 | Store medium at 2 °C to 8 °C |
| RPMI 1640 Medium, no phenol red | GIBCO | 11835-030 | Store medium at 2 °C to 8 °C |
| Trypsin-EDTA(0.25%),phenol red | GIBCO | 25200-056 | Store medium at -10 °C to -20 °C |
| DPBS, no calcium, no magnesium | GIBCO | 14190-136 | Store medium at 2 °C to 8 °C |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | Store at -20 °C to -70 °C |
| Fetal Bovine Serum (U.S), Super Low IgG | HyClone | SH3089803 | Store at -10 °C to -20 °C |
| Fetal Bovine Serum (U.S.), Characterized | HyClone | SH3007103 | Store at -10 °C to -20 °C |
| Caspase-Glo 3/7 Assay kit | Promega | G8093 | Store the Caspase-Glo. 3/7 Substrate and Caspase-Glo. 3/7 Buffer at –20 ºC protected fromLight |
| EDTA, Disodium Salt, Dihydrate, Crystal, A.C.S. Reagent | J.T.Baker | 8993-01 | -- |
| Sample mAb Adalimumab | Probiomed | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Reference and Control mAb Adalimumab | Abbvie | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Microplate Reader | Molecular Devices | 89429-536 | SpectraMax M3 Multi-Mode |
| Microplate reader Software | Molecular Devices | -- | SoftMax Pro 6.3 GxP |
| Incubator | Revco | 30482 | Revco RNW3000TABB Forced-Air CO2 |
| Laminar Flow Hood | The Baker Company | 200256 | Baker SG603A-HE | High Efficiency, Class II Type A2 |
참고문헌
- Elmore, S. Apoptosis: A Review of programmed cell death. Toxicol Patho. 35 (4), 495-516 (2007).
- Darwish, R. S. Regulatory mechanisms of apoptosis in regularly dividing cells. Cell Health Cytoskelet. 2 (1), 59-68 (2010).
- Tracey, D., et al. Tumor necrosis factor antagonist mechanism of action: A comprehensive review. Pharmacol Ther. 117 (2), 244-279 (2008).
- Körner, H., Sedgwick, J. Tumour necrosis factor and lymphotoxin: Molecular aspects and role in tissue-specific autoimmunity. Immunol Cell Biol. 74 (5), 465-472 (1996).
- Wong, M., et al. TNFa blockade in human diseases: Mechanisms and future directions. Clin Immunol. 126 (2), 121-136 (2008).
- Furst, D. E., Wallis, R., Broder, M., Beenhouwer, D. O. Tumor necrosis factor antagonists: different kinetics and/or mechanisms of action may explain differences in the risk for developing granulomatous infection. Semin Arthritis Rheum. 36 (3), 159-167 (2006).
- Karvinen, J., et al. Homogeneous time-resolved fluorescence quenching assay (LANCE) for caspase-3. J Biomol Screen. 7 (3), 223-231 (2002).
- Ren, Y. G., et al. Differential regulation of the TRAIL death receptors DR4 and DR5 by the signal recognition particle. Mol Biol Cell. 15 (11), 5064-5074 (2004).
- Sud, D., Bigbee, C., Flynn, J. L., Kirschner, D. E. Contribution of CD8+ T cells to control of Mycobacterium tuberculosis infection. J Immunol. 176 (7), 4296-4314 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Curr Protoc Immunol. Apendix 3, 3 (2001).
- Ramasubramanyan, N., et al. . Low acidic species compositions and methods for producing and using the same. 1, (2014).
- Masters, J. R., Stacey, G. N. Changing medium and passaging cell lines. Nat Protoc. 2 (9), 2276-2284 (2007).
- Eskandari, M. K., Nguyen, D. T., Kunkel, S. L., Remick, D. G. WEHI 164 subclone 13 assay for TNF: sensitivity, specificity, and reliability. Immunol Invest. 19 (1), 69-79 (1990).
- Hora, M. S., Rana, R. K., Smith, F. W. Lyophilized formulations of recombinant tumor necrosis factor. Pharm Res. 9 (1), 33-36 (1992).
- Ponnappan, S., Ponnappan, U. Aging and immune function: molecular mechanisms to interventions. Antiox Redox Signal. 14 (8), 1551-1585 (2011).
- Matsumaru, K., Ji, C., Kaplowitz, N. Mechanisms for sensitization to TNF-induced apoptosis by acute glutathione depletion in murine hepatocytes. Hepatology. 37 (6), 1425-1434 (2003).
- Camacho-Villegas, T., Mata-Gonzalez, T., Paniagua-Solis, J., Sanchez, E., Licea, A. Human TNF cytokine neutralization with a vNAR from Heterodontus francisci shark: a potential therapeutic use. mAbs. 5 (1), 80-85 (2013).
- Männel, D. N., Falk, W. Optimal induction of tumor necrosis factor production in human monocytes requires complete S-form lipopolysaccharide. Infect Immun. 57 (7), 1953-1958 (1989).
- Lis, K., Kuzawińska, O., Bałkowiec-Iskra, E. Tumor necrosis factor inhibitors-state of knowledge. Arch Med Sci. 10 (6), 1175-1185 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유