Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Определение относительной силы из анти-ФНО моноклональных антител (МАБ), Neutralizing ФНО, с помощью метода Биоаналитические In Vitro
В этой статье
Резюме
Здесь представлены протокол для определения относительной анти apoptotic активности анти TNFα МАБ, с помощью механизма нейтрализации с WEHI 164 клеток. Этот протокол полезно для сравнения нейтрализации прочности различных молекул с той же биологической функциональности.
Аннотация
Этот протокол показывает измерение нейтрализации деятельности apoptotic TNFα мыши модели клетки фибробластов (WEHI 164) с помощью анти TNFα МАБ. Кроме того этот протокол может использоваться для оценки других анти TNFα молекул, таких как синтез белков. Сотовая модель, работающих здесь чувствителен к TNFα-опосредованной апоптоза, когда дополнительный стресс-фактор индуцируется в условиях культуры клеток (например, лишение сыворотки). Эта процедура является примером того, как выполнить этот аналитический assay, подчеркнув основные операции, относящиеся к пробоподготовки, клетки разрежения, индукции апоптоза и спектрофотометрические измерения, которые имеют решающее значение для обеспечения успешных результатов. Этот протокол показывает лучшее исполнение условий, касающихся индукции апоптоза и эффективный сигнал записи, что приводит к низкой неопределенности значений.
Введение
Биологическая потенции является количественная мера биологической активности на основе атрибутов Оксиметрический анализ продукта, которые связаны с соответствующими биологическими свойствами, тогда как количество (выраженное в массе) — физико-химические измерения содержания белка. Потенция испытания, наряду с другой аналитической методологии, выполняются как часть соответствия продукции, стабильности и сопоставимости исследований. В этом смысле потенции измерения используются для демонстрации продукта пакеты удовлетворения критических качества атрибутов (CQAs) или критерии приемки на всех этапах клинических испытаний и после утверждения рынка.
Apoptosis запрограммированная смерть клетки, естественно происходит когда клетки заражены вирусом или когда клетки подчеркнули экологической фактор что компромиссы клеточной жизнеспособности и функция1,2. Среди прочего ингибирование апоптоза, или биологического обезвреживания, является одним из главным образом известные терапевтические механизмы mAbs, особенно в лечении хронических заболеваний, таких как воспалительные заболевания иммунной системы. Анти-TNFα молекул прилагать свои лечебные свойства, блокируя взаимодействие фактора некроза опухоли альфа (TNFα) с p55 и Р75 клеток поверхности рецепторы3, таким образом предотвращая пути сигнала, которые в итоге привести к сотовой апоптоз.
TNFα могут производить воспаления в некоторых хронических заболеваний4. Ложный TNFα выделяется во внеклеточных среды макрофагами, которые являются часовых иммунной системы и основных субъектов в такого рода заболевания5. Как общий путь TNFα дерегулирование ассоциируется с патогенез этих болезней. Без контроля и под постоянным индукции и клетки стресс TNFα индуцирует смерти и тканей дегенерация клетки, в конечном счете приводит к ревматоидный артрит, болезнь Крона и другие патологические профили6.
Антагонисты ФНО, которые блокируют взаимодействие между ФНО и его рецепторов все чаще используются в качестве эффективной терапии для снижения симптоматики и препятствовать прогрессирование этих заболеваний. В настоящее время анти TNFα наркотиков продукты широко используются для управления системного концентрация этого цитокина, таким образом предотвращая дальнейшее дегенерацию связанные тканей. В этом смысле обеспечивая воспроизводимость и надежные биопроб для описания конкретных способность препарата для достижения его биологического эффекта является императивом.
В этом протоколе, критические шаги определены в ходе разработки нейтрализации пробирного-для успешного измерения биологических потенции выделяются, с особым упором на развитие навыков, необходимых для выполнения био аналитического метода. Этот био аналитический метод обеспечивает полезные сопоставимости информации между различными партиями или анти TNFα лекарственных средств по сравнению с клинически проверенных ссылка вещество.
протокол
1. подготовка средств массовой информации и решения
- подготовить питательной среды: RPMI 1640 с 10% FBS, рН 7,4.
- Подготовка анализа питательной среды: RPMI 1640 без фенола красного, но с 1% FBS, рН 7,4.
- Подготовка клетки промывочный раствор: DPBS мг и Ca бесплатно раствор с 0,02% ЭДТА, рН 7,4.
- Подготовить мобильный отряд решение: 0,125% трипсина с 1 мм ЭДТА.
- Оттепель 100 мл 0,25% раствора трипсина ЭДТА и передачи стерильный флакон 500 мл.
- Смесь с 100 мл ячейки промывочный раствор и отказаться от 15 мл аликвоты в 15 мл стерильные пробирки. Магазин на -70-80 ° c до использования.
- Фильтр эти решения через мембрану 0,22 мкм и тепло до 37 ° C для по крайней мере 30 минут до использования.
- Подготовить индукции апоптоза запасов раствор TNFα на 3,3 мкг/мл.
- Растворяют 20 мкг TNFα с 500 мкл фильтр стерилизации воды в его первичного контейнера и перемешать до полного растворения.
- Передача в 15 мл стерильной пробирке и добавьте 5,5 мл раствора DPBS мг и Ca бесплатно эту трубку. Перемешать аккуратно с помощью вихревой смеситель.
- Алиготе решение порционно 70 мкл. Отказаться от каждого Алиготе в 0,5 мл пробирок и хранить на -80 ° C.
- Подготовить апоптоз индукции решение: TNFα раствор 40 нг/мл.
- ,
- Оттепель Алиготе Стоковый раствор индукции апоптоза, инкубации его в водяной бане при 25 ° c на 10 мин
- Развести индукции апоптоза запасов решение 40 нг/мл, добавив 61 мкл раствора TNFα 3,3 мкг/мл 4.939 мл пробы питательной среды в 15 мл стерильной пробирке.
- Смесь, вихревой смеситель для 10 s; это решение должны быть готовы свежезаваренным перед использованием.
- Разогреть решение до 37 ° C для по крайней мере 30 минут до использовать th eneutralization пробирного.
- Для приготовления раствора субстрата: каспазы-3/7 Glo решения 7 ,- 8.
- Оттепель 12 h перед использованием caspase буферного раствора (буфер Glo каспазы-3/7).
- Пусть caspase буферного раствора и субстрата (каспазы-3/7 гло субстрате) сидеть отдельно при температуре 25 ± 5 ° C за 30 мин до смешивания.
- Передачи 10 мл буферного раствора caspase субстрат флакона и перемешать путем инверсии.
- Держать на 25 ± 5 ° C, защищены свет до использования.
Примечание: Решение сохраняет стабильность в течение 6 ч при комнатной температуре.
2. Клетки Culturing и подсчета
- клеток оттаивания и первый субкультура.
- Удалить один флакон с WEHI 164 клетки 9 из морозильника в-80 градусов и передавать их на ледяной бане.
- Вверх и вниз Пипетка с 1 мл раствора подогретым питательной среды, до тех пор, пока полностью разморозить замороженные клетки.
- Обойтись 9 мл подогретым питательной среды на 15 мл стерильной пробирке.
- Передача суспензию клеток в 15 мл стерильной пробирке и смешайте нежно пять раз путем инверсии.
- Центрифуга суспензию клеток в 125 x g на 3 мин удалить супернатант и разбить ячейки Пелле.
- Добавить 5 мл питательной среды на трубу. Перемешать до тех пор, пока клетки полностью высокомобильна.
- Для подсчета клеток, передачи 50 мкл суспензии клеток к 500 мкл Микропробирка и смешивают с 50 мкл 0,4% Трипановый синий. Подсчитать количество ячеек и приспособиться к 0,5 х 10 6 клеток/мл. Ниже шаг 2,2,.
- Добавить 13 мл подогретым питательной среды в колбе культуры клеток 75 мл.
- Обойтись достаточно подвеска объем ячейки от шага 2.1.6 для достижения 0,5 х 10 6 клеток/мл в колбу культуры клеток и Инкубируйте на 37 ° C и 5% CO 2 на ночь.
- Клеток подсчета.
Примечание: См. ссылку 10.- С помощью решения от шага 2.1.6, передача 0,05 мл Горяева и определить плотность клеток под микроскопом, с помощью исключения Трипановый синий.
- Подсчитать общее количество клеток и жизнеспособных клеток.
- Настроить клеточных суспензий 0,5 x 10 6 клеток/мл.
Уравнение 1
V питательной среды (мл) =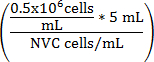
V питательной среды (мл) = (5 мл - V суспензию клеток)
V питательной среды (мл) = скорректированный объем WEHI 164 Сотовый подвеска
NVC = количество жизнеспособных клеток/мл WEHI 164
V питательной среды (мл) = Assay объем культуры среднего добавлен в суспензию клеток для достижения 0,5 х 10 6 клеток/мл
0,5 x 10 6 = плотность клеток целевой
- Сотовый отряда и второй и третий субкультура.
Примечание: Вакуумная система может использоваться для удаления решения из колбы. Может быть использован стекла или одноразовые стерильные пипетки. Если дозатор имеет хлопок забивают на вершине, он должен быть удален перед использованием.- Удалить питательной среды из клеточной культуры T-колбу с использованием 1 мл стерильной пипеткой и вакууме. Решение
- обойтись 5 мл мыть ячейки в культуру T-колба, осторожно перемешать и отменить решение. Повторите этот шаг дважды.
Примечание: Полное удаление питательной среды имеет решающее значение для эффективного клеток отряда. - Добавить 15 мл раствора отряд клеток T-колбу и дать постоять 3 мин в инкубаторе при 37 ° C и 5% CO 2.
- Проверить отсутствие прилагаемый клеток в колбу внутренней стене под микроскопом. Удаление ячеек из культуры T-колбу с помощью 20 мл стерильной пипеткой и распределять их в 50-мл стерильной пробирке.
- Центрифуга суспензию клеток в 125 x g на 3 мин удалить супернатант и Ресуспензируйте лепешка с другой 5 мл питательной среды.
- Подсчитать количество ячеек и добавить достаточно питательной среды для достижения желаемой клетки концентрация согласно уравнение 1.
- Добавить Эта подвеска в 72 см 2 T-колбу и инкубировать на ночь при 37 ° C и 5% CO 2 и.
- Субкультура assay клетки по крайней мере два раза перед их использованием в нейтрализации. Повторите шаги 2.3.1-2.3.8 для следующих двух дней.
- Assay суспензию клеток.
- Выберите WEHI 164 субкультуры, имеющий по крайней мере три пропуска. Шаг 2.1.
- Отсоединение и подсчитать количество ячеек согласно шаги 2.2 и 2.3 настоящего Протокола.
- Разбавления суспензии клеток согласно уравнение 1 до 0,5 х 10 6 клеток/мл.
- Использовать этот сотовых подвеска для нейтрализации assay. Смешайте все клеточных суспензий, вихревой смеситель до использования.
3. Подготовка антител и разведения
- Quantitation mAbs.
- Определить концентрацию вещества ссылка, образец элемента управления и аналитической пробы через поглощения УФ на 280 Нм, используя коэффициент (1.39) их массового вымирания 11.
Примечание: Оригинальный концентрации могут быть взяты из наркотиков этикетках. Однако, это должна быть подтверждена УФ поглощения.
- Определить концентрацию вещества ссылка, образец элемента управления и аналитической пробы через поглощения УФ на 280 Нм, используя коэффициент (1.39) их массового вымирания 11.
- МАБ разведениях.
- Все развести образцы независимо друг от друга в трех экземплярах, мг - и Ca свободно раствором DPBS в 2 мл пробирок, вплоть до 2 мг/мл. Подтвердите этот концентрации, УФ поглощения в трех экземплярах, с помощью DPBS мг и Ca бесплатно решения как пустые.
- Смесь фондовых белка решения для 5 s с помощью вихревой смеситель.
- Разбавляют 100 мкл каждого решения МАБ 2 мг/мл 0,9 мл пробы питательной среды с.
- Смесь для 5 s, вихревой смеситель.
Примечание: Эти решения имеют концентрацию 200 мкг/мл. Разведений должно быть сделано для каждого экземплярах. - Развести 10 & #181; L каждое решение МАБ 200 мкг/мл с 0.99 мл пробы питательной среды. Смесь для 5 s с помощью вихревой смеситель. Эти решения имеют концентрацию 2 мкг/мл. Выполнение серийных разведений для каждого экземплярах перед их использованием в нейтрализации assay.
- Сделать анти TNFα МАБ разведений в трех независимых планшет. Сделать дубликат из каждой независимой экземплярах и распределять их в одном микроплиты, как указано в таблице 1. Ссылка вещество < таблица fo:keep-together.within-страницы = «1» fo:keep-с-next.within-страницы = «всегда» fo:text-выравнивание = «center» > пластина 1 2 пластины пластина 3 Уэллс образец скважин образца скважин образца B2:B11 ссылка вещество B2:B11 Образец элемента управления B2:B11 аналитической пробы C2:C11 C2:C11 C2:C11 D2:D11 аналитической пробы D2:D11 ссылка вещество D2:D11 Пример элемента управления E2:E11 E2:E11 E2:E11 F2:F11 Образец элемента управления F2:F11 аналитической пробы F2:F11 вещество ссылки G2:G11 G2:G11 G2:G11 Таблица 1: Гонав образец массивы. Полной нейтрализации пробирного должна выполняться в трех планшетов в пределах координат B2 для G11. Случайные дозирования ведения, аналитические и контрольные образцы позволяют исследователям для проверки каких-либо отклонений в assay.
- Выполнять МАБ разведений каждой ссылки, образец, или управления, как показано в таблице 2.
Примечание: Концентрации МАБ анти TNFα, описанные в этой таблице являются не окончательный концентрации в assay нейтрализации. < td > 250
Т возможность 2: анти-TNFα МАБ разведениях. Серийных разведений анти TNFα mAbs демонстрируются в этой таблице. Окончательный концентрации, описанные в этой таблице являются не концентрации в assay, где анти TNFα mAbs разводили с коэффициентом 3 (МАБ разрежения + культура среднего + подвеска клетки). Линии жирным шрифтом представляют разведениях от линии 3, 5, 7, 9 и 10; линии не жирным шрифтом представляют разрежения от линии 3, 4 и 6. Эти серийных разведений выполняются перед выполнением нейтрализации assay. Необходимо позаботиться mix закупорить вверх и вниз три раза перед подачей разведениях.Плиты столбца объем пробы питательной среды (мкл) объем справочных вещество, аналитической пробы или управления Пример (uL) концентрация в Assay пластины (нг/мл) 2 0 230 2000 3 150 150 из строки 2 1000 4 75 75 от линии 3 500 5 100 50 от линии 3 333 6 75 75 из строки 4 7 75 75 от линии 5 166 8 75 75 от линии 6 125 9 75 75 сюда m линия 7 83 10 75 75 из строки 9 41 11 150 75 от линии 10 13 - Держите пластины 25 ± 5 ° C до использования.
4. Нейтрализация проба с WEHI 164 клетки
- микс, vortexing, все клетки суспензий (0,5 х 10 6 клеток/мл) до выдачи на любом этапе данного протокола.
Примечание: В этом разделе, теплый каждое решение до 37 ° C за 30 мин до использования. - Передача 50 мкл суспензии клеток каждого из 60 скважин планшет, переход от столбца 2-11 и линии B-G.
- Передачи 50 мкл МАБ, образец, и управления разведений в планшет. Следуйте схеме изображен на рисунке 1.
- Добавьте 50 мкл раствора индукции апоптоза для каждой скважины.
- Использование клеточных элементов 50 мкл WEHI 164 клетки, обойтись в трех скважинах. Принесите каждой скважины в окончательный объем 150 мкл с Пробирной культуры среднего.
- Использовать элемент управления цитотоксичность смеси 50 мкл WEHI 164 клеток плюс 50 мкл раствора индукции апоптоза. Принесите каждой скважины в окончательный объем 150 мкл с Пробирной культуры среднего.
- Управления для TNFα, использовать 50 мкл раствора индукции апоптоза и довести его до 150 мкл с питательной среды пробирного.
- Для заготовки, используйте 150 мкл пробирного питательной среды одиночку.
- Заполнить оставшиеся скважин с 150 мкл питательной среды, чтобы избежать испарения эффектов пластина. 4.1.1-4.1.9
- повторите шаги дважды в двух других планшетов.
Примечание: Окончательный концентрации МАБ в являются: 0.666 микроплиты, 0.333 0,167, 0,111, 0,083, 0,056, 0,042, 0,028, 0,014 и 0,004 мкг/мл. - Загрузить образцы в планшет, как указано на рис. 1.
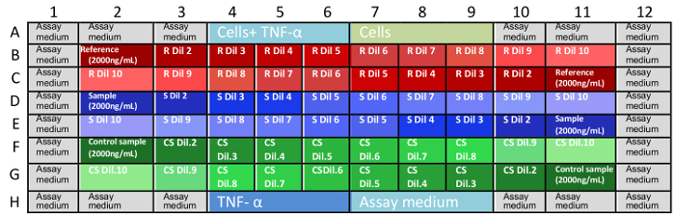
Рисунок 1: расположения образцов в пластинах пробирного. B1 G11 хорошо координаты в планшет и описания позиции, где размещены разведения образца. Отсутствующие координаты являются колодцы, заполненные с элементами управления и анализа питательной среды (A1-A12 и H1-H12). Это случайное распределение образцов (прямого и обратного разведений в планшет) помогает устранить предвзятость в результатах из-за испарения среднего или других переменных. Это лучшее, что каждый Гонав делается один аналитик одновременно. R: ссылку, S: пример, CS: образец элемента управления, Дил: разрежения. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры. - Инкубировать три пластины при 37 ° C и 5% CO 2 для 16 ± 2 ч.
- Пусть стоять на 25 ± 5 ° C 30 мин перед использованием реагента Glo каспазы-3/7.
- Добавить 100 мкл этого реагента для всех скважин, включая примеры и элементы управления.
- Shake пластины Гонав вихревой смеситель для 3 мин при температуре 25 ± 5 ° C сразу же после подачи в скважины.
- Инкубировать пластин для 2,5 ± 0,5 ч при температуре 25 ± 5 ° C, защищать от света.
- Вставить микрофонroplates в Люминометр и завершить следующий раздел.
5. Анализ результатов
- с помощью программного обеспечения для обнаружения люминесценции, выберите функцию, режим и конечной люминесценции.
- Выберите 96-луночных ясно нижней пластины и его 80 внутренних скважины, за исключением колонки 1 и 12.
- Выберите время интеграции 1250 ms и 10 s для смешивания микроплиты перед чтением.
- Выберите скважин, где ссылка вещество, аналитической вещество и образец элемента управления будут размещены и идентифицировать себя с их соответствующими концентрациями.
- Читать образцов, размещенных в планшет с люминометра.
- Использовать четвертый параметр уравнение для анализа результатов. График кривой доза реакция, как показано на рис. 2.
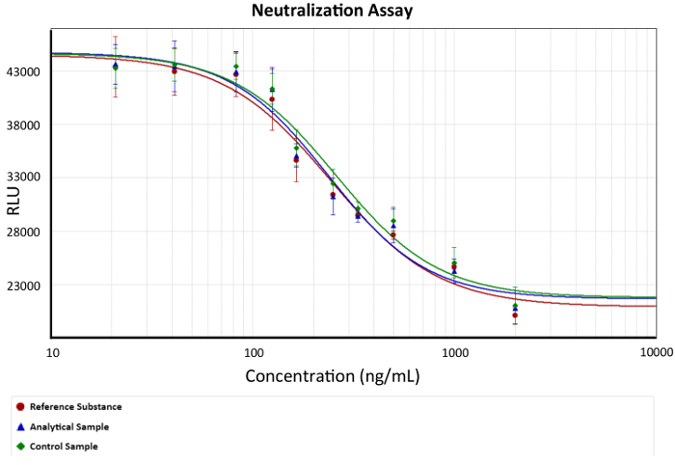
Рисунок 2: кривая доза реакция. Изображен анти-TNFα МАБ концентрации по сравнению с люминесценции (жизнеспособность клеток). Четвертый параметр уравнение, описывающее анти TNFα защиты mAbs использовался в качестве модели. ЭК50 является концентрация МАБ, которые могут нейтрализовать количество TNFα, которые вызывают гибель клеток 50% в калибровочных, примером в графе как изменения в склон. Бары описывают стандартное отклонение свечения для каждого МАБ концентрации. x представляет анти TNFα Ab концентрацию и изображается как логарифмическая функция в нг/мл, а y представляет люминесценции ответ в единицах произвольных люминесценции. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Примечание: В уравнении четвертый параметр C является эффективная концентрация 50 (ЭК50). Это значение будет использоваться для сравнения ссылка вещество, аналитической пробы и пример элемента управления с помощью функции эффекторных. - Для расчета относительных потенции, исправить ссылку вещества до 100% и рассчитать потенции образца и контроля соответственно.
Примечание: Эти значения изображены на рис. 3.
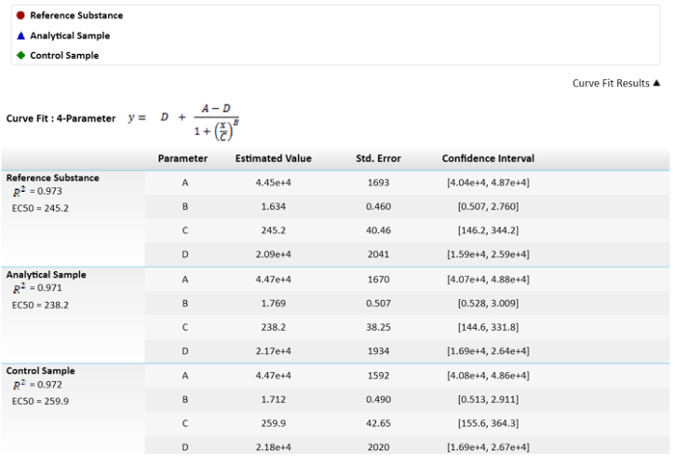
Рисунок 3: математические уравнения, используемые для расчета EC50s и их значения. Значения ЭК50, или C параметры, имеют их неопределенности, изображается как стандартная ошибка. Изображен также сравнение EC50s между результатами выборки и ссылки относительной силы. Доверительный интервал вычисляется с α = 0,05. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Результаты
Доза реакция граф (с элементами управления)
Рисунок 1 представляет люминесценции ответ против концентрации МАБ. Эта функция сигмоид олицетворяет caspase 3 и 7 релиз в среде культуры пробирного благодаря лизис клеток. Гибель клеток усиливается с?...
Обсуждение
Эта характеристика позволяет определить априори биологическое поведение молекулы стадии разработки прежде чем дорогим и трудоемким клинические испытания проводятся. Это также полезно для выпуска партии партии утвержденный препарат. Стоит отметить, что эти анализы являются пол?...
Раскрытие информации
Авторы не имеют ничего сообщать
Благодарности
Эта работа была поддержана Национального Совета по науке и технике (КОНАСИТ), Мексика Грант PEI КОНАСИТ 2015 220333, без участия в разработке исследования.
Материалы
| Name | Company | Catalog Number | Comments |
| WEHI 164 | ATCC | CRL-1751 | Fibrosarcoma cells from Mus musculus |
| RPMI-1640 Medium | ATCC | 30-2001 | Store medium at 2 °C to 8 °C |
| RPMI 1640 Medium, no phenol red | GIBCO | 11835-030 | Store medium at 2 °C to 8 °C |
| Trypsin-EDTA(0.25%),phenol red | GIBCO | 25200-056 | Store medium at -10 °C to -20 °C |
| DPBS, no calcium, no magnesium | GIBCO | 14190-136 | Store medium at 2 °C to 8 °C |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | Store at -20 °C to -70 °C |
| Fetal Bovine Serum (U.S), Super Low IgG | HyClone | SH3089803 | Store at -10 °C to -20 °C |
| Fetal Bovine Serum (U.S.), Characterized | HyClone | SH3007103 | Store at -10 °C to -20 °C |
| Caspase-Glo 3/7 Assay kit | Promega | G8093 | Store the Caspase-Glo. 3/7 Substrate and Caspase-Glo. 3/7 Buffer at –20 ºC protected fromLight |
| EDTA, Disodium Salt, Dihydrate, Crystal, A.C.S. Reagent | J.T.Baker | 8993-01 | -- |
| Sample mAb Adalimumab | Probiomed | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Reference and Control mAb Adalimumab | Abbvie | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Microplate Reader | Molecular Devices | 89429-536 | SpectraMax M3 Multi-Mode |
| Microplate reader Software | Molecular Devices | -- | SoftMax Pro 6.3 GxP |
| Incubator | Revco | 30482 | Revco RNW3000TABB Forced-Air CO2 |
| Laminar Flow Hood | The Baker Company | 200256 | Baker SG603A-HE | High Efficiency, Class II Type A2 |
Ссылки
- Elmore, S. Apoptosis: A Review of programmed cell death. Toxicol Patho. 35 (4), 495-516 (2007).
- Darwish, R. S. Regulatory mechanisms of apoptosis in regularly dividing cells. Cell Health Cytoskelet. 2 (1), 59-68 (2010).
- Tracey, D., et al. Tumor necrosis factor antagonist mechanism of action: A comprehensive review. Pharmacol Ther. 117 (2), 244-279 (2008).
- Körner, H., Sedgwick, J. Tumour necrosis factor and lymphotoxin: Molecular aspects and role in tissue-specific autoimmunity. Immunol Cell Biol. 74 (5), 465-472 (1996).
- Wong, M., et al. TNFa blockade in human diseases: Mechanisms and future directions. Clin Immunol. 126 (2), 121-136 (2008).
- Furst, D. E., Wallis, R., Broder, M., Beenhouwer, D. O. Tumor necrosis factor antagonists: different kinetics and/or mechanisms of action may explain differences in the risk for developing granulomatous infection. Semin Arthritis Rheum. 36 (3), 159-167 (2006).
- Karvinen, J., et al. Homogeneous time-resolved fluorescence quenching assay (LANCE) for caspase-3. J Biomol Screen. 7 (3), 223-231 (2002).
- Ren, Y. G., et al. Differential regulation of the TRAIL death receptors DR4 and DR5 by the signal recognition particle. Mol Biol Cell. 15 (11), 5064-5074 (2004).
- Sud, D., Bigbee, C., Flynn, J. L., Kirschner, D. E. Contribution of CD8+ T cells to control of Mycobacterium tuberculosis infection. J Immunol. 176 (7), 4296-4314 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Curr Protoc Immunol. Apendix 3, 3 (2001).
- Ramasubramanyan, N., et al. . Low acidic species compositions and methods for producing and using the same. 1, (2014).
- Masters, J. R., Stacey, G. N. Changing medium and passaging cell lines. Nat Protoc. 2 (9), 2276-2284 (2007).
- Eskandari, M. K., Nguyen, D. T., Kunkel, S. L., Remick, D. G. WEHI 164 subclone 13 assay for TNF: sensitivity, specificity, and reliability. Immunol Invest. 19 (1), 69-79 (1990).
- Hora, M. S., Rana, R. K., Smith, F. W. Lyophilized formulations of recombinant tumor necrosis factor. Pharm Res. 9 (1), 33-36 (1992).
- Ponnappan, S., Ponnappan, U. Aging and immune function: molecular mechanisms to interventions. Antiox Redox Signal. 14 (8), 1551-1585 (2011).
- Matsumaru, K., Ji, C., Kaplowitz, N. Mechanisms for sensitization to TNF-induced apoptosis by acute glutathione depletion in murine hepatocytes. Hepatology. 37 (6), 1425-1434 (2003).
- Camacho-Villegas, T., Mata-Gonzalez, T., Paniagua-Solis, J., Sanchez, E., Licea, A. Human TNF cytokine neutralization with a vNAR from Heterodontus francisci shark: a potential therapeutic use. mAbs. 5 (1), 80-85 (2013).
- Männel, D. N., Falk, W. Optimal induction of tumor necrosis factor production in human monocytes requires complete S-form lipopolysaccharide. Infect Immun. 57 (7), 1953-1958 (1989).
- Lis, K., Kuzawińska, O., Bałkowiec-Iskra, E. Tumor necrosis factor inhibitors-state of knowledge. Arch Med Sci. 10 (6), 1175-1185 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены