A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
קביעת העוצמה היחסית של Anti-TNF חד-שבטיים נוגדן (mAb) על ידי Neutralizing TNF באמצעות שיטת וביו-אנליטיות וואלידציה , חוץ גופית
In This Article
Summary
פרוטוקול מצפני פעילות נגד יחסית-מוות mAb אנטי-TNFα באמצעות מנגנון ניטרול עם תאי ה-וואי 164 מוצג כאן. פרוטוקול זה שימושי השוואת כוח ניטרול של מולקולות שונות אותה פונקציונליות ביולוגי.
Abstract
פרוטוקול זה מראה את המדידה של הניטרול פעילות מוות של TNFα במודל של עכברים פיברובלסט תא (ה-וואי 164) באמצעות mAb אנטי-TNFα. בנוסף, פרוטוקול זה יכול לשמש כדי להעריך את מולקולות אנטי-TNFα אחרות, כגון חלבונים פיוז'ן. המודל הסלולר המועסקים כאן הוא רגיש אפופטוזיס בתיווך TNFα כאשר גורם מתח נוסף הוא המושרה תא תרבות בתנאים (למשל, מניעת סרום). פרוצדורה זו מדגימה את אופן ביצוע וזמינותו אנליטית זו, המדגיש את פעולות המפתח הנוגעות הכנת הדוגמא תא דילול, אפופטוזיס, מדידות spectrophotometric כי הם קריטיים כדי להבטיח תוצאות מוצלחות. פרוטוקול זה חושף את התנאים הטובים ביצועים הנוגעים אפופטוזיס ושידור יעיל הקלטה, מובילים לערכים אי הוודאות נמוכה.
Introduction
עוצמת הביולוגי היא מדד כמותי של פעילות ביולוגית המבוססת על התכונות המוצר לבדיקה המקושרות הביולוגי במאפיינים הרלוונטיים, ואילו כמות (המתבטא בנפח גדול) הוא מדד physicochemical של תכולת החלבון. בדיקות מינון, יחד עם שיטות אנליטיות אחרות, מבוצעות כחלק המוצר עמידה ויציבות מחקרים comparability. במובן זה, העוצמה מדידות משמשים כדי להדגים כי המוצר אצוות לפגוש את תכונות איכות קריטיים (CQAs) או קריטריוני קבלה במהלך כל שלבי של ניסויים קליניים, לאחר אישור שוק.
אפופטוזיס הוא מוות תאים מתוכנת, באופן טבעי כאשר תאים נגועים בווירוס, או כאשר התאים לחוצים על ידי סביבתית גורם זה פשרות הסלולר הכדאיות ותפקוד1,2. בין היתר, אפופטוזיס עיכוב או נטרול הביולוגי, הוא אחד ממנגנוני טיפולית הידוע בעיקר mAbs, במיוחד בטיפול במחלות כרוניות, כגון הפרעות דלקתיות בתיווך החיסון. מולקולות אנטי-TNFα להפעיל תכונות טיפוליות שלהם על ידי חסימת האינטראקציה של הגידול נקרוזה מקדם אלפא (TNFα) עם p55 ו p75 התא קולטנים משטח3, ובכך למנוע מסלולים אות לבסוף להוביל אפופטוזיס הסלולר.
TNFα יכול לייצר דלקת כמה מחלות כרוניות4. TNFα מופרש spuriously לתוך חצרו חוץ-תאית על ידי מקרופאגים, אשר זקיפים של מערכת החיסון המולדת והשחקנים העיקרי בסוג זה של המחלה5. כנתיב נפוצות, ורשות TNFα משויכת בפתוגנזה של מחלות אלה. ללא שליטה, תחת אינדוקציה קבוע ומתח תא, TNFα גורם ניוון המוות ואת הרקמה תא, בסופו של דבר שמוביל דלקת מפרקים שגרונית, קרוהן ו- פרופילים פתולוגיים אחרים6.
היריבים TNF לחסום את האינטראקציה בין TNF רצפטורים שלו היו בשימוש יותר ויותר כדי להפחית התנסותו לעכב את התקדמות המחלות האלה כמו טיפול יעיל. כיום, אנטי-TNFα סמים המוצרים נמצאים בשימוש נרחב כדי לשלוט הריכוז מערכתית של ציטוקין, עוד יותר ובכך למנוע ניוון של רקמות מעורב. במובן זה, מתן של bioassay חזקים הדירים לתאר את יכולת ספציפית של תרופה כדי להשיג את האפקט הביולוגי שלו הכרחי.
ב פרוטוקול זה, קריטי צעדים-שזוהו במהלך התפתחות וזמינותו ניטרול-לשקילת מוצלחת העוצמה ביולוגי מודגשים, עם דגש על הכישורים הדרושים כדי לבצע את פעולת השירות ביו-אנליטית. שיטה זו ביו-אנליטי מספקת מידע שימושי comparability בין קבוצות שונות או אנטי-TNFα מוצרי התרופה לעומת חומר עזר קליניות.
Protocol
1. הכנה פתרונות ומדיה
- להכין את המדיום התרבות: RPMI-1640 עם 10% FBS, pH 7.4.
- הכן assay תרבות בינוני: RPMI-1640 ללא פנול אדום אבל עם 1% FBS, pH 7.4.
- להכין פתרון שטיפת תא: DPBS Mg, Ca-ללא פתרון עם EDTA 0.02%, pH 7.4.
- להכין פתרון ניתוק התא: 0.125% טריפסין עם 1 מ מ EDTA.
- הפשרת 100 מ של 0.25% פתרון של טריפסין-EDTA והעברה אל בקבוק 500-mL סטרילי. לוותר על aliquots 15 mL לתוך צינורות סטרילי 15 מ"ל, וקונטה פתרון
- לערבב עם 100 מ של התא. החנות בפעולה-80 ° C עד שימוש.
- לסנן את הפתרונות הללו דרך קרום 0.22-מיקרומטר וחם עד 37 מעלות צלזיוס במשך לפחות 30 דקות לפני השימוש.
- להכין אפופטוזיס מניות פתרון פתרון TNFα µg 3.3/mL-
- µG 20 התמוססות של TNFα עם 500 µL עיקור מסנן מים המכל הראשי שלה, לערבב עד התפרקות מוחלטת.
- להעביר לתוך צינור סטרילי 15 מ"ל ולהוסיף 5.5 mL של DPBS Mg, Ca-ללא פתרון הצינור הזה. מערבבים בעדינות בעזרת מערבל מערבולת.
- Aliquot הפתרון 70 חלקים µL. לוותר על כל aliquot לתוך microtubes 0.5 mL וחנות ב-80 מעלות צלזיוס
- להכין אפופטוזיס אינדוקציה פתרון: פתרון TNFα 40 ng/mL-
- להפשיר aliquot של אפופטוזיס אינדוקציה מניות הפתרון, המקננת אותו באמבט מים-25 הלעפה תרוטרפמט במשך 10 דקות
- אפופטוזיס של אינדוקציה הפתרון מניות 40 ng/mL מדולל על-ידי הוספת µL 61 של 3.3 פתרון TNFα µg/mL mL 4.939 assay בינוני תרבות בשפופרת סטרילי 15 mL-
- מיקס על ידי מערבולת מיקסר 10 s; זה הפתרון חייב להיות מוכן טרי לפני השימוש.
- לחמם הפתרון 37 מעלות צלזיוס במשך לפחות 30 דקות לפני השימוש ב- th eneutralization assay.
- להכין את הפתרון המצע: קספאז 3/7 גלו פתרון 7 , 8-
- להפשיר את קספאז בופר (מאגר גלו קספאז 3/7) 12 שעות לפני השימוש.
- לתת את קספאז בופר המצע (המצע גלו קספאז 3/7) לשבת בנפרד-25 ± 5 מעלות צלזיוס למשך 30 דקות לפני ערבוב.
- להעביר 10 מ"ל של הפתרון מאגר קספאז המצע המבחנה, מיקס על ידי היפוך.
- שמור בגיל 25 ± 5 ° C, המוגנים אור עד שימוש.
הערה: הפתרון הוא יציבים במשך 6 שעות בטמפרטורת החדר.
2. התא Culturing ספירת
- תא מפשיר ו את תת-תרבות הראשונה.
- להסיר בקבוקון אחד עם תאי ה-וואי 164 9 מקפיא ב-80 הלעפה תרוטרפמט ולהעביר אותם לאמבטיית קרח.
- פיפטה למעלה ולמטה עם 1 מ"ל מראש ומחוממת תרבות בינוני עד התאים קפואים להפשיר לחלוטין.
- לוותר על 9 מיליליטר בינוני תרבות ומחוממת מראש על גבי צינור סטרילי 15 mL-
- להעביר התליה תא לתוך הצינור סטרילי 15-mL ומערבבים בעדינות חמש פעמים על-ידי היפוך.
- Centrifuge התליה תא ב x 125 גרם במשך 3 דקות להשליך את תגובת שיקוע, disaggregate בגדר תא.
- הוסף 5 מ של תרבות בינוני ברכבת התחתית. מערבבים עד התאים הם לגמרי resuspended.
- לספירת תאים, להעביר µL 50 של התליה תא 500 µL microtube, לערבב עם µL 50 של 0.4% trypan blue. לספור את התאים ולהתאים את 0.5 x 10 6 תאים למ"ל. ראה שלב 2.2, מתחת.
- להוסיף 13 מיליליטר בינוני תרבות מראש ומחוממת בקבוקון תרבות תא 75 מ ל.
- לוותר על מספיק נפח ההשעיה התאים מהשלב 2.1.6 דגירה-37 מעלות צלזיוס ו-5% CO 2 בן לילה ושאיפה 0.5 x 10 6 תאים/מ ל. הבקבוק התרבות התא.
- תא ספירת.
הערה: ראה הפניה 10.- באמצעות הפתרון משלב 2.1.6, להעביר 0.05 mL hemocytometer ולקבוע צפיפות תא תחת מיקרוסקופ באמצעות trypan blue הדרה.
- לכמת את המספר הכולל של תאים, התאים קיימא.
- להתאים את המתלים תא ל 0.5 x 10 6 תאים למ"ל.
משוואה 1
V התרבות בינוני (mL) =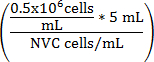
V התרבות בינוני (mL) = (5 מ"ל - V תא השעיה)
V התרבות בינוני (mL) = נפח מותאמת של ה-וואי 164 תא הבולם
NVC = מספר תאי ה-וואי 164 קיימא/mL
V התרבות בינוני (mL) = נפח בינוני תרבות Assay נוספו התליה תא כדי להשיג 0.5 x 10 6 תאים למ"ל
0.5 x 10 6 = צפיפות תא היעד
- התא ניתוק את תת-תרבות השני והשלישי.
פתק: ניתן להשתמש במערכת ואקום להסיר את הפתרונות המבחנות. פיפטות חד פעמיות או זכוכית סטריליים יכול לשמש. אם פיפטה יש להדביק כותנה בחלק העליון, יש להסירו לפני השימוש.- להסיר המדיום התרבות התרבות תאי T-הבקבוק באמצעות פיפטה עקר 1 מ ל וואקום- פתרון
- לוותר על 5 מ של שטיפת תא לתוך התרבות T-הבקבוק, מערבבים בעדינות, ולמחוק את הפתרון. חזור על שלב זה פעמיים.
הערה: הסרה מלאה של המדיום תרבות הוא קריטי עבור ניתוק היעילה תא. - להוסיף 15 מ"ל של פתרון ניתוק התא. הבקבוק T, משהים 3 דקות באינקובטור 37 ° C ו- 5% CO 2.
- לוודא העדר של תאים המחוברים בקיר הפנימי הבקבוק תחת המיקרוסקופ. להסיר התאים התרבות T-הבקבוק באמצעות פיפטה סטרילי 20 מ"ל, לוותר על אותם לתוך צינור סטרילי 50-mL-
- Centrifuge התליה תא ב x 125 גרם במשך 3 דקות להשליך את תגובת שיקוע, resuspend בגדר עם עוד 5 מ"ל של תרבות בינונית.
- לספור את התאים ולהוסיף בינוני תרבות מספיק כדי להגיע את הריכוז התא הרצוי על פי משוואה 1.
- להוסיף ההשעייה 72 ס 2 T-הבקבוק, דגירה בין לילה-CO של 37 ° C ו- 5%-2-
- תת-תרבות התאים לפחות פעמיים לפני השימוש בניטרול וזמינותו. חזור על צעדים 2.3.1-2.3.8 היומיים הבאים.
- Assay התליה תא.
תת-תרבות
- בחר 164 ה-וואי שיש לו לפחות שלושה מעברים. ראה שלב 2.1.
- ניתוק ולספור את התאים לפי שלבים 2.2 ו- 2.3 של פרוטוקול זה.
- לדלל התליה תא משוואה 1 ל 0.5 x 10 6 תאים למ"ל.
- השתמש ההשעייה הסלולר וזמינותו ניטרול. לערבב כל המתלים תא על-ידי מערבולת מיקסר לפני השימוש.
3. נוגדן והכנה דילולים
- כימות של mAbs.
- לקבוע הריכוז של חומר עזר, דגימת הבקרה מדגם אנליטי באמצעות UV הקליטה ב- 280 ננומטר באמצעות מקדם (1.39) שלהם הכחדה המונית 11.
הערה: ריכוזי המקורי יכול להילקח מן תוויות המוצר סמים. אולם, זה חייב להיות מאומת על ידי UV הקליטה.
- לקבוע הריכוז של חומר עזר, דגימת הבקרה מדגם אנליטי באמצעות UV הקליטה ב- 280 ננומטר באמצעות מקדם (1.39) שלהם הכחדה המונית 11.
- דילולים mAb-
- Dilute כל דגימות בצורה עצמאית שהפקידים, עם DPBS Mg, Ca-ללא פתרון microtubes 2 מ"ל, עד 2 מ"ג/מ"ל. לאשר את הריכוז על ידי UV הקליטה דולר, באמצעות DPBS Mg, Ca-ללא פתרון כמו הריק.
- לערבב את הפתרונות חלבון מניות עבור 5 s באמצעות מערבל מערבולת.
- µL 100 לדלל של כל פתרון mAb 2 מ"ג/מ"ל 0.9 מ של המדיום תרבות assay.
- מיקס 5 s על ידי מערבולת מיקסר-
הערה: פתרונות אלו יש ריכוז של 200 µg/mL. דילולים חייב להיעשות עבור כל דולר. - לדלל 10 & #181; L של כל פתרון mAb µg 200/mL 0.99 מ של המדיום תרבות וזמינותו. מיקס 5 s באמצעות מערבל מערבולת. פתרונות אלה יש ריכוז של 2 µg/mL. ביצוע דילולים טורי עבור כל שהפקידים לפני השימוש בהם וזמינותו ניטרול.
- להפוך אנטי-TNFα mAb דילולים שלושה microplates עצמאית. לשכפל מן כל שהפקידים עצמאית, לוותר על אותם ב microplate אחד, כמצוין בטבלה 1. הפניה לחומר < שולחן fo:keep-together.within-דף = "1" fo:keep-עם-next.within-דף = "תמיד" fo:text-יישור = "המרכז" > 1 צלחת צלחת 2 צלחת 3 וולס דוגמת בארות מדגם בארות מדגם B2:B11 חומר עזר B2:B11 הבקרה מדגם B2:B11 מדגם אנליטית C2:C11 C2:C11 C2:C11 D2:D11 אנליטית מדגם D2:D11 הפניה לחומר D2:D11 שליטה לדוגמה E2:E11 E2:E11 E2:E11 F2:F11 הבקרה מדגם F2:F11 אנליטית מדגם F2:F11 חומר עזר G2:G11 G2:G11 G2:G11 טבלה 1: מערכים מדגם Microplate. יש להפעיל וזמינותו ניטרול מלאה ב- microplates שלושה בתוך קואורדינטות B2 כדי G11. אקראי dispensing של הפניה, אנליטית, ודוגמאות הבקרה לאפשר לחוקרים לוודא כל הטיה ב וזמינותו.
- ביצוע דילולים mAb של כל הפניה, לטעום, או בשליטתך, כפי שמוצג בטבלה מס ' 2-
הערה: ריכוז mAb אנטי-TNFα המתוארים בטבלה זו אינם ריכוז סופי ב וזמינותו ניטרול... ------------ < td > 250------------
T אפשרות 2: אנטי-TNFα mAb דילולים. דילולים טורי של אנטי-TNFα mAbs מודגמות בטבלה זו. ריכוזי הסופי שתואר בטבלה זו אינם הריכוזים ב וזמינותו, איפה אנטי-TNFα mAbs היו מדולל פי 3 (mAb דילול + תרבות בינוני + תאים השעיה). השורות המודגשות מייצגים דילולים בא שורות 3, 5, 7, 9 ו- 10; קווים שאינם מודגשים מייצגים דילול מתוך שורות 3, 4 ו- 6. אלה דילולים טורי נעשים רק לפני ביצוע וזמינותו ניטרול. חייבים להקפיד לערבב על-ידי pipetting למעלה ולמטה שלוש פעמים לפני מחלק את דילולים.עמודה צלחת בינונית תרבות נפח של Assay (μL) נפח של הפניה לחומר, דוגמת אנליטית או פקד לדוגמה (uL) ריכוז בצלחת Assay (ng/mL) 2 0 230 2000 3 150 150 מ קו 2 1000 4 75 75 מקו 3 500 5 100 50 מקו 3 333 6 75 75 מ קו 4 7 75 75 מ קו 5 166 8 75 75 מ קו 6 125 9 75 75 הלוך ושוב ז קו 7 83 10 75 75 מ קו 9 41 11 150 75 מקו 10 13 - לשמור את הצלחות ב 25 ± 5 ° C עד שימוש.
4. ניטרול Assay עם ה-וואי 164 תאים
- מיקס על ידי vortexing תא כל המתלים (0.5 x 10 6 תאים למ"ל) לפני dispensing בשלב כלשהו של פרוטוקול זה.
הערה: בחלק זה, לחמם כל פתרון 37 מעלות במשך 30 דקות לפני השימוש,. - µL 50 העברה של התליה תא לכל אחת הבארות 60 של microplates, להזיז עמודה 2 עד 11 ו קו B ל- G.
- µL 50 העברה של הפניה mAb, לדוגמה ובקרה דילולים לתוך microplates. לעקוב אחר דפוס מתואר באיור 1.
- µL להוסיף 50 של הפתרון אינדוקציה אפופטוזיס מכל קידוח. תאים
- השתמש בפקדים הסלולר של 50 µL של ה-וואי 164, ויתרו בבארות שלוש. להביא מכל קידוח נפח סופי של 150 µL assay תרבות בינונית.
- השתמש פקד cytotoxicity של תערובת של 50 µL של ה-וואי 164 תאים בתוספת 50 µL של פתרון אינדוקציה אפופטוזיס. להביא מכל קידוח נפח סופי של 150 µL assay תרבות בינונית.
- עבור TNFα שליטה, להשתמש µL 50 של הפתרון אינדוקציה אפופטוזיס ולהביא אותו µL 150 עם המדיום תרבות assay.
- לשימוש הריק, 150 µL של המדיום תרבות assay לבד.
- למלא את הבארות הנותרים 150 µL של תרבות מדיום כדי למנוע תופעות אידוי הלוח. 4.1.1-4.1.9
- חזור על צעדים פעמיים ב 2 microplates אחרים.
הערה: ריכוז סופי mAb ב microplate הם: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 ו- 0.004 µg/mL. - לטעון את הדגימות ב microplates, כמצוין באיור 1.
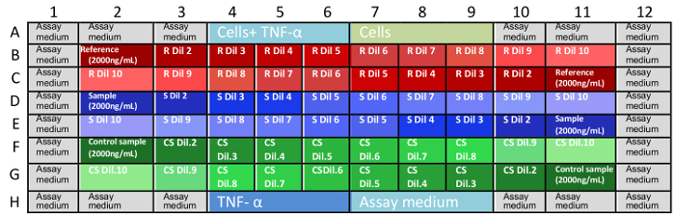
איור 1: הוצאת דגימות לוחית assay. B1 ועד G11 קואורדינטות טוב ב microplates, לתאר את העמדות היכן ממוקמים דילולים הדגימה. חסרים הקואורדינטות הן בארות מלא עם פקדים ואת וזמינותו תרבות בינוני (A1-A12 ו H1-H12). זו הפצה אקראית של דגימות (דילולים ואחורה ב microplates) מסייעת לחסל את הטיית תוצאות בשל האידוי בינוני או משתנים אחרים. מומלץ כי כל microplate נעשית על ידי אנליסט אחד בכל פעם. R: הפניה, s: לדוגמה, CS: שליטה לדוגמה, דיל: דילול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת. - דגירה הלוחות 3-37 מעלות צלזיוס ו-5% CO 2 16 ± ח' 2
- תן הכימית גלו קספאז 3/7 עמוד 25 ± 5 מעלות צלזיוס למשך 30 דקות לפני השימוש.
- µL להוסיף 100 של ריאגנט הזה את כל בארות, כולל דוגמאות, פקדים.
- לנער את הצלחות באמצעות מערבל מערבולת microplate למשך 3 דקות ב 25 ± 5 ° C מיד לאחר dispensing לתוך הבארות.
- דגירה של הלוחות עבור ± 2.5 h 0.5 25 ± 5 ° C, מוגן מפני אור.
- להוסיף את המיקרופוןroplates לתוך luminometer להשלים את הסעיף הבא.
5. ניתוח של תוצאות
- באמצעות תוכנה לגילוי הפריה חוץ גופית, בחר בפונקציה ומצב קצה של הפריה חוץ גופית-
- צלחת בחר 96-ובכן ברור-תחתון ושלה וולס פנימי 80, הכללה של עמודות 1 ו- 12.
- בחר מועד אינטגרציה של 1,250 ms ו 10 s עבור ערבוב את microplate לפני קריאתה.
- בחר הבארות איפה החומר הפניה לחומר אנליטי, שליטה לדוגמה יוצב ולזהות עם ריכוזים המתאימים שלהם.
- לקרוא את הדגימות להציב את microplates עם luminometer.
- השתמש משוואה הפרמטר הרביעי עבור הניתוחים של תוצאות. גרף העקומה מנה-תגובה, כפי שהיא מתוארת באיור 2.
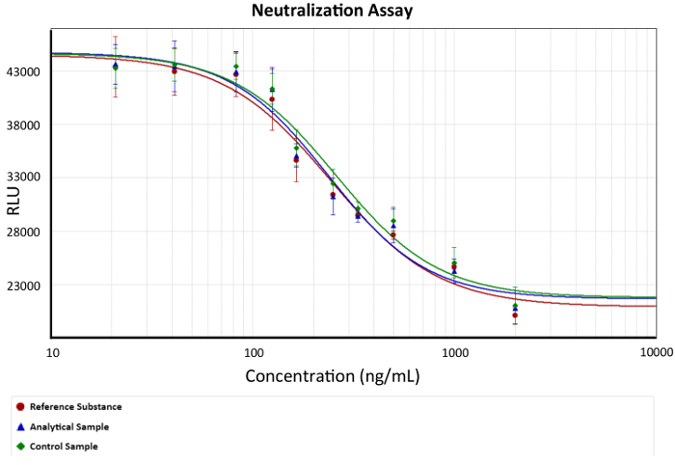
איור 2: עקומת מנה-תגובה- אנטי-TNFα mAb ריכוז לעומת הפריה חוץ גופית (תא הכדאיות) מתואר. משוואה הפרמטר הרביעי מתאר הגנה אנטי-TNFα על mAbs שימשה כמודל. EC50 הוא ריכוז mAb אשר ניתן לנטרל את כמות TNFα לגרום מוות של תאים 50% לכל assay, שהודגם ב הגרף כמו השינוי במדרון. ברים לתאר את סטיית התקן של הפריה חוץ גופית עבור כל הריכוז mAb. x מייצג אנטי-TNFα Ab ריכוז, מתואר פונקציה לוגריתמי ב ng/mL, בעוד y מייצג התגובה הפריה חוץ גופית יחידות הפריה חוץ גופית שרירותי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
הערה: המשוואה הפרמטר הרביעי, C הוא ריכוז אפקטיבי 50 (EC50). ערך זה ישמש כדי להשוות את הפניה לחומר אנליטי מדגם, דגימת הבקרה באמצעות הפונקציה אפקטור. - לחישוב את הלוחמים היחסי, לתקן את החומר הפניה ל- 100%, לחשב את הלוחמים של המדגם ולשלוט בהתאם.
הערה: ערכים אלה מתוארים באיור 3.
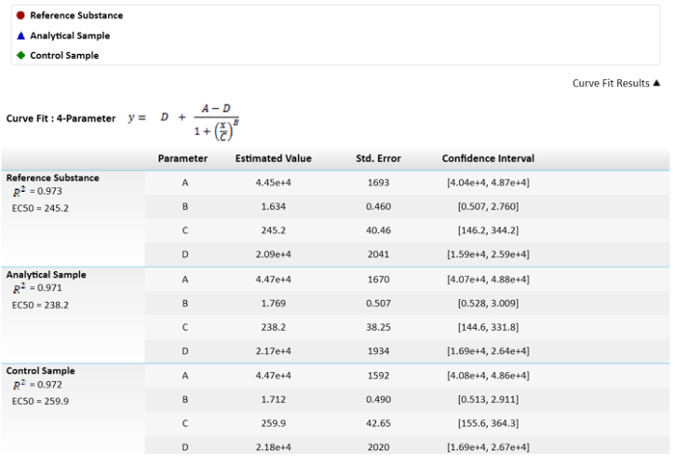
איור 3: המתמטי המשמש לחישוב את EC50s ואת ערכיהם. EC50 ערכים או C פרמטרים, יש חוסר הבהירות ו"כדור שגיאה סטנדרטית. השוואה בין EC50s בין תוצאות המדגם והפניה העוצמה היחסית מתואר גם. מרווח הביטחון מחושבת של α = 0.05. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
תוצאות
מנה-תגובה גרף (עם פקדים)
איור 1 מייצג את התגובה הפריה חוץ גופית לעומת mAb ריכוז. פונקציה sigmoidal זו מדגימה קספאז 3 ו-7 במהדורה המדיום תרבות assay עקב פירוק התא. מוות של תאים מוגברת על ידי הרעבה סרום פלוס TNFα איתות אינדוקציה. לכן, מולקולת אנטי-TNFα (mAb) מקיים א...
Discussion
אפיון זה מסייע לקבוע א-פריורי התנהגות ביולוגית של מולקולה בפיתוח לפני נערכים ניסויים קליניים יקרים ולגזול. זה שימושי גם לשחרור אצווה-כדי-אצווה של מוצר סמים שאושרו. ראוי להזכיר כי אלה מבחני שימושיות לקביעה אם מולקולה יש השפעה ביולוגית נאותה לגבי מנגנון הפעולה שלה. שיטת ביו-אנליטי המוצ...
Disclosures
המחברים אין לחשוף
Acknowledgements
עבודה זו נתמכה על ידי המועצה הלאומית של המדע ולהעניק טכנולוגיה (CONACYT), מקסיקו פיי CONACYT 2015 220333, ללא השתתפות בעיצוב של המחקר.
Materials
| Name | Company | Catalog Number | Comments |
| WEHI 164 | ATCC | CRL-1751 | Fibrosarcoma cells from Mus musculus |
| RPMI-1640 Medium | ATCC | 30-2001 | Store medium at 2 °C to 8 °C |
| RPMI 1640 Medium, no phenol red | GIBCO | 11835-030 | Store medium at 2 °C to 8 °C |
| Trypsin-EDTA(0.25%),phenol red | GIBCO | 25200-056 | Store medium at -10 °C to -20 °C |
| DPBS, no calcium, no magnesium | GIBCO | 14190-136 | Store medium at 2 °C to 8 °C |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | Store at -20 °C to -70 °C |
| Fetal Bovine Serum (U.S), Super Low IgG | HyClone | SH3089803 | Store at -10 °C to -20 °C |
| Fetal Bovine Serum (U.S.), Characterized | HyClone | SH3007103 | Store at -10 °C to -20 °C |
| Caspase-Glo 3/7 Assay kit | Promega | G8093 | Store the Caspase-Glo. 3/7 Substrate and Caspase-Glo. 3/7 Buffer at –20 ºC protected fromLight |
| EDTA, Disodium Salt, Dihydrate, Crystal, A.C.S. Reagent | J.T.Baker | 8993-01 | -- |
| Sample mAb Adalimumab | Probiomed | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Reference and Control mAb Adalimumab | Abbvie | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Microplate Reader | Molecular Devices | 89429-536 | SpectraMax M3 Multi-Mode |
| Microplate reader Software | Molecular Devices | -- | SoftMax Pro 6.3 GxP |
| Incubator | Revco | 30482 | Revco RNW3000TABB Forced-Air CO2 |
| Laminar Flow Hood | The Baker Company | 200256 | Baker SG603A-HE | High Efficiency, Class II Type A2 |
References
- Elmore, S. Apoptosis: A Review of programmed cell death. Toxicol Patho. 35 (4), 495-516 (2007).
- Darwish, R. S. Regulatory mechanisms of apoptosis in regularly dividing cells. Cell Health Cytoskelet. 2 (1), 59-68 (2010).
- Tracey, D., et al. Tumor necrosis factor antagonist mechanism of action: A comprehensive review. Pharmacol Ther. 117 (2), 244-279 (2008).
- Körner, H., Sedgwick, J. Tumour necrosis factor and lymphotoxin: Molecular aspects and role in tissue-specific autoimmunity. Immunol Cell Biol. 74 (5), 465-472 (1996).
- Wong, M., et al. TNFa blockade in human diseases: Mechanisms and future directions. Clin Immunol. 126 (2), 121-136 (2008).
- Furst, D. E., Wallis, R., Broder, M., Beenhouwer, D. O. Tumor necrosis factor antagonists: different kinetics and/or mechanisms of action may explain differences in the risk for developing granulomatous infection. Semin Arthritis Rheum. 36 (3), 159-167 (2006).
- Karvinen, J., et al. Homogeneous time-resolved fluorescence quenching assay (LANCE) for caspase-3. J Biomol Screen. 7 (3), 223-231 (2002).
- Ren, Y. G., et al. Differential regulation of the TRAIL death receptors DR4 and DR5 by the signal recognition particle. Mol Biol Cell. 15 (11), 5064-5074 (2004).
- Sud, D., Bigbee, C., Flynn, J. L., Kirschner, D. E. Contribution of CD8+ T cells to control of Mycobacterium tuberculosis infection. J Immunol. 176 (7), 4296-4314 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Curr Protoc Immunol. Apendix 3, 3 (2001).
- Ramasubramanyan, N., et al. . Low acidic species compositions and methods for producing and using the same. 1, (2014).
- Masters, J. R., Stacey, G. N. Changing medium and passaging cell lines. Nat Protoc. 2 (9), 2276-2284 (2007).
- Eskandari, M. K., Nguyen, D. T., Kunkel, S. L., Remick, D. G. WEHI 164 subclone 13 assay for TNF: sensitivity, specificity, and reliability. Immunol Invest. 19 (1), 69-79 (1990).
- Hora, M. S., Rana, R. K., Smith, F. W. Lyophilized formulations of recombinant tumor necrosis factor. Pharm Res. 9 (1), 33-36 (1992).
- Ponnappan, S., Ponnappan, U. Aging and immune function: molecular mechanisms to interventions. Antiox Redox Signal. 14 (8), 1551-1585 (2011).
- Matsumaru, K., Ji, C., Kaplowitz, N. Mechanisms for sensitization to TNF-induced apoptosis by acute glutathione depletion in murine hepatocytes. Hepatology. 37 (6), 1425-1434 (2003).
- Camacho-Villegas, T., Mata-Gonzalez, T., Paniagua-Solis, J., Sanchez, E., Licea, A. Human TNF cytokine neutralization with a vNAR from Heterodontus francisci shark: a potential therapeutic use. mAbs. 5 (1), 80-85 (2013).
- Männel, D. N., Falk, W. Optimal induction of tumor necrosis factor production in human monocytes requires complete S-form lipopolysaccharide. Infect Immun. 57 (7), 1953-1958 (1989).
- Lis, K., Kuzawińska, O., Bałkowiec-Iskra, E. Tumor necrosis factor inhibitors-state of knowledge. Arch Med Sci. 10 (6), 1175-1185 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved