É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Determinação da potência relativa de um anti-TNF anticorpo Monoclonal (mAb) por neutralizando TNF usando um método de Bioanalytical In Vitro
Neste Artigo
Resumo
Um protocolo para a determinação da atividade anti-apoptotic relativo de um mAb anti-TNFa usando um mecanismo de neutralização com células WEHI 164 é aqui apresentado. Este protocolo é útil para comparar a força de neutralização das moléculas diferentes com a mesma funcionalidade biológica.
Resumo
Este protocolo mostra a medição de neutralização atividade apoptotic de TNFa em um modelo de célula de fibroblasto do rato (WEHI 164) usando um mAb anti-TNFa. Além disso, este protocolo pode ser usado para avaliar outras moléculas anti-TNFa, tais como proteínas da fusão. O modelo celular empregado aqui é sensível a apoptose mediada por TNFa quando um fator de estresse adicional é induzido em condições de cultura celular (por exemplo, privação de soro). Esse procedimento exemplifica como executar este ensaio analítico, destacando as principais operações relativas a preparação da amostra, diluição de celular, indução de apoptose e medições espectrofotométricas que são críticas para garantir resultados de sucesso. Este protocolo revela as condições de melhor desempenho relativas à indução de apoptose e eficiente sinal de gravação, levando a valores de baixa incerteza.
Introdução
Actividade biológica é a medida quantitativa da atividade biológica baseada os atributos de qualidade do produto que estão relacionados com as propriedades biológicas relevantes, Considerando que a quantidade (expressada em massa) é uma medida de físico-química de teor de proteínas. Testes de potência, juntamente com outras metodologias analíticas, são executadas como parte dos estudos de comparabilidade, estabilidade e conformidade do produto. Neste sentido, medições de potência são usadas para demonstrar que lotes do produto conhecer os atributos de qualidade críticos (CQAs) ou critérios de aceitação durante todas as fases dos ensaios clínicos e após aprovação do mercado.
Apoptose morte celular programada, naturalmente ocorrem quando as células estão infectadas com um vírus, ou quando as células estão estressadas por um ambiente fator que compromissos celular viabilidade e função1,2. Entre outros, inibição de apoptose, ou neutralização biológica, é um dos mecanismos terapêuticos principalmente conhecidos de mAbs, particularmente no tratamento de doenças crônicas, tais como desordens inflamatórias imune-mediada. Moléculas de anti-TNFa exercem suas propriedades terapêuticas, bloqueando a interação do fator de necrose tumoral alfa (TNFa) com o p55 e p75 célula superfície receptores3, evitando os caminhos de sinal que finalmente levam a apoptose celular.
TNFa pode produzir inflamação em algumas doenças crônicas4. TNFa spuriously é secretada para o meio extracelular por macrófagos, que são sentinelas do sistema imunitário inato e os principais intervenientes neste tipo de doença5. Como um caminho comum, desregulamentação TNFa é associada com a patogênese destas doenças. Sem controle e sob constante indução e estresse celular, TNFa induz a degeneração do tecido e morte celular, finalmente levando à artrite reumatoide, doença de Crohn e outros perfis patológicos6.
Antagonistas TNF que bloquear a interação entre o TNF e seus receptores foram cada vez mais usadas como uma terapia eficaz para reduzir a sintomatologia e impedem a progressão dessas doenças. Hoje em dia, medicamentos anti-TNFa são amplamente usados para controlar a concentração sistêmica desta citocina, evitando ainda mais a degeneração dos tecidos envolvidos. Nesse sentido, fornecer um bioensaio robusto e reprodutível para descrever a capacidade específica de uma droga para alcançar seu efeito biológico é imperativo.
Neste protocolo, crítica passos-identificado durante o desenvolvimento de um ensaio de neutralização-para a medição do sucesso de potência biológica são destacadas, com uma ênfase particular sobre as habilidades necessárias para executar o método analítico-bio. Este método bio-analítico fornece informações úteis comparabilidade entre diferentes lotes ou anti-TNFa medicamentos quando comparado a uma substância de referência clinicamente testado.
Protocolo
1. preparação dos meios de comunicação e soluções
- preparar o meio de cultura: RPMI-1640 com 10% FBS, pH 7.4.
- Preparar meio de cultura de ensaio: RPMI-1640 sem vermelho de fenol, mas com 1% FBS, pH 7.4.
- Preparar a solução de lavagem de celular: solução de Mg e Ca-livre de DPBS com EDTA 0,02%, pH 7.4.
- Preparar a solução de desprendimento celular: 0,125% tripsina com 1 mM EDTA.
- Descongelar 100 mL de uma solução 0,25% de tripsina-EDTA e transferir para um balão de 500 mL estéril.
- Mix com 100 mL de célula lava solução e diluir alíquotas de 15 mL em tubos estéreis de 15ml. Loja -70-80 ° c até o uso.
- Filtrar estas soluções através de uma membrana de 0,22 µm e aquecer até 37 ° C durante pelo menos 30 min antes de usar.
- Preparar solução estoque de indução de apoptose solução TNFa em 3,3 µ g/mL.
- Dissolver 20 µ g de TNFa com 500 µ l de água filtro esterilizados em seu recipiente primário e misturar até dissolução completa.
- Transferir para um tubo estéril 15 mL e adicionar 5,5 mL de solução DPBS livre de Ca e Mg para este tubo. Misture delicadamente, usando um misturador do vortex. Alíquota da solução em 70 porções µ l de
- . Dispense a cada alíquota em microtubos 0,5 mL e loja a -80 ° C.
- Preparar a apoptose por indução solução: solução de TNFa em 40 ng/mL.
- Descongelar uma alíquota da solução estoque de apoptose indução, incubando-lo num banho de água a 25 ˚ c durante 10 min.
- Diluir a solução de estoque de indução de apoptose de 40 ng/mL adicionando 61 µ l da solução de TNFa 3,3 µ g/mL para 4,939 mL do meio de cultura de ensaio em um tubo estéril 15 mL.
- Mix por misturador do vortex para 10 s; esta solução deve ser preparada na hora, antes do uso.
- Aquecer a solução a 37 ° C durante pelo menos 30 min antes de utilizar no ensaio de eneutralization do th.
- Preparar a solução de substrato: caspase 3/7 Glo solução 7 , 8.
- Descongelar a caspase solução-tampão (tampão de Glo caspase 3/7) 12 h antes do uso.
- Deixe a solução-tampão caspase e o substrato (substrato de Glo caspase 3/7) sente-se separadamente a 25 ± 5 ° C por 30 min antes da mistura.
- Transferir 10 mL da solução-tampão de caspase para o frasco de substrato e misture por inversão.
- Manter a 25 ± 5 ° C, protegido de luz até o uso.
Nota: A solução é estável por 6 horas à temperatura ambiente.
2. Culturing e contagem de células
- célula descongelar e a primeira subcultura.
- Remover um frasco com 164 WEHI células 9 de um congelador a-80 ˚ c e transferi-los para um banho de gelo-.
- Pipetar para cima e para baixo com 1 mL de meio de cultura previamente aquecido até que as células congeladas descongelar completamente.
- Dispensar 9 mL do meio de cultura previamente aquecido em um tubo estéril 15 mL.
- Transferir a suspensão de células para o tubo estéril 15 mL e misture suavemente cinco vezes por inversão.
- Centrifugar a suspensão de eritrócitos a 125 x g durante 3 min. descartar o sobrenadante e desagregar o centrifugado. Adicionar 5 mL de meio de cultura para o tubo de
- . Misture até que as células estão completamente resuspended.
- Para a contagem de células, transferir 50 µ l de suspensão de célula para uma 500 µ l microtubo e misture com 50 µ l de 0,4% trypan azul. Contar as células e ajuste de 0,5 x 10 6 células/mL. Veja o passo 2.2, abaixo.
- Adicionar 13 mL de meio de cultura previamente aquecido para um balão de cultura de células de 75 mL.
- Distribuir suficiente volume de suspensão celular da etapa 2.1.6 para atingir 0,5 x 10 6 células/mL no frasco de cultura de células e incubar a 37 ° C e 5% de CO 2 da noite pro dia.
- Celular contando.
Nota: Ver referência 10.- Usando a solução da etapa 2.1.6, transferência de 0,05 mL para um hemocytometer e determinar a densidade de células sob um microscópio usando trypan azul exclusão.
- Quantificar o número total de células e de células viáveis.
- Ajustar as suspensões celulares de 0,5 x 10 6 células/mL.
Equação 1
No meio de cultura V (mL) =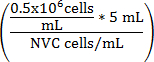
V meio de cultura (mL) = (5 mL - V suspensão de células)
V meio de cultura (mL) = volume ajustado de WEHI 164 suspensão de células
NVC = número de viável WEHI 164 células/mL
V meio de cultura (mL) = volume de meio de cultura de ensaio adicionado à suspensão de células para alcançar 0,5 x 10 6 células/mL
0,5 x 10 6 = densidade de célula de destino
- Celular destacamento e a segunda e terceira subcultura.
Nota: Um sistema de vácuo pode ser usado para retirar os frascos das soluções. Pipeta estéril descartável ou de vidro pode ser usada. Se a pipeta tem um entupimento de algodão na parte superior, ele deve ser removido antes do uso.- Remover o meio de cultura da cultura de pilha T-balão usando uma pipeta estéril de 1 mL e um vácuo. Solução de
- dispensar 5 mL de lavagem de célula na cultura T-balão, misture delicadamente e eliminar a solução. Repetir esta etapa duas vezes.
Nota: A remoção completa do meio de cultura é essencial para o destacamento de célula eficiente. - Adicionar 15 mL de solução de desprendimento de célula no T-balão e deixe descansar por 3 min em uma incubadora a 37 ° C e 5% de CO 2.
- Verificar a ausência de células anexadas na parede interna de balão sob o microscópio. Remover as células de cultura T-balão com uma pipeta estéril de 20ml e dispense-os em um tubo estéril de 50 mL.
- Centrifugar a suspensão de eritrócitos a 125 x g durante 3 min. descartar o sobrenadante e ressuspender o precipitado com outro 5 mL de meio de cultura.
- Contar as células e adicionar suficiente meio de cultura para atingir a concentração desejada de célula de acordo com a equação 1.
- Adicionar esta suspensão para um 72 cm 2 T-balão e incubar durante a noite a 37 ° C e 5% de CO 2.
- Subcultura das células pelo menos duas vezes antes de usá-los na neutralização do ensaio. Repita etapas 2.3.1-2.3.8 para os próximos dois dias.
- Do ensaio de suspensão celular.
- Selecione um 164 WEHI subcultura que tem pelo menos três passagens. Consulte a etapa 2.1.
- Desanexar e contar as células de acordo com as etapas 2.2 e 2.3 do presente protocolo.
- Diluir a suspensão de células de acordo com a equação 1 para 0.5 x 10 6 células/mL.
- Use esta suspensão celular para o ensaio de neutralização. Misture todas as suspensões celulares por antes do misturador vórtice uso.
3. Preparação de anticorpos e diluições
- quantificação dos mAbs.
- Determine a concentração da substância de referência, a amostra controle e amostra analítica através da absorção UV em 280 nm, utilizando a sua extinção em massa coeficiente (1.39) 11.
Nota: Concentrações originais poderiam ser tomadas de rótulos de produtos de droga. No entanto, isto deve ser verificado pela absorção de UV.
- Determine a concentração da substância de referência, a amostra controle e amostra analítica através da absorção UV em 280 nm, utilizando a sua extinção em massa coeficiente (1.39) 11.
- mAb diluições.
- Dilua todas amostras independentemente em triplicado, com solução de DPBS livre de Ca e Mg em 2 mL de microtubos, até 2 mg/mL. Confirmar esta concentração por absorção UV em triplicata, utilizando solução DPBS livre de Ca e Mg como o espaço em branco.
- Misturar as soluções de proteína de estoque por 5 s usando um misturador do vortex.
- Diluir 100 µ l de cada solução de mAb de 2 mg/mL com 0,9 mL de meio de cultura ensaio. Misturador do vortex e
- Mix por 5 s.
Nota: Estas soluções têm uma concentração de 200 µ g/mL. Diluições devem ser feitas para cada triplicado. - Diluir 10 & #181; L de cada solução de mAb 200 µ g/mL com 0,99 mL do meio de cultura de ensaio. Mix para 5 s usando um misturador do vortex. Estas soluções têm uma concentração de 2 µ g/mL. Executar diluições em série para cada triplicado antes de usá-los no ensaio de neutralização.
- Fazer anti-TNFa mAb diluições em três microplacas independentes. Fazer uma cópia de cada triplicado independente e dispensá-los em uma microplaca, como indicado na tabela 1. Substância de referência < tabela fo:keep-together.within-página = "1" fo:keep-com-next.within-página = "sempre" fo:text-alinhar = "centro" > prato 1 prato 2 placa 3 Poços poços de amostra amostra poços amostra substância de referência B2:B11 B2:B11 amostra de controlo B2:B11 de amostra para análise C2:C11 C2:C11 C2:C11 D2:D11 amostra analítica D2:D11 substância de referência D2:D11 amostra de controlo E2:E11 E2:E11 E2:E11 F2:F11 amostra de controlo F2:F11 amostra analítica F2:F11 substância de referência G2:G11 G2:G11 G2:G11 Tabela 1: matrizes de amostra de microplacas. Um ensaio de neutralização completa deve ser executado em três microplacas dentro coordenadas B2 para G11. Aleatória, distribuição de referência, analítica e amostras de controle permite aos investigadores verificar qualquer viés no ensaio de.
- Executar mAb de diluições de cada referência, amostra, ou controle, conforme mostrado na tabela 2.
Nota: As concentrações de mAb anti-TNFa descritas nesta tabela não são as concentrações finais no ensaio de neutralização. < td > 250
T 2 capaz: diluições de mAb Anti-TNFa. Diluições em série do anti-TNFa mAbs são demonstradas na tabela. Concentrações finais descritas nesta tabela não são as concentrações no ensaio, onde anti-TNFa mAbs foram diluídos por um fator de 3 (meio de cultura, mAb diluição + suspensão de células). Linhas em negrito representam as diluições provenientes de linhas 3, 5, 7, 9 e 10; linhas não-em negrito representam a diluição das linhas 3, 4 e 6. Estas diluições de série são feitas apenas antes de executar o ensaio de neutralização. Deve ter cuidado para misturar pipetando acima e para baixo três vezes antes de dispensar as diluições.Coluna placa de meio de cultura de Volume de ensaio (μL) Volume da substância de referência, a amostra analítica ou controle Amostra (uL) concentração na placa de ensaio (ng/mL) 2 0 230 2000 3 150 150 linha 2 de 1000 4 75 75 linha 3 de 500 5 100 50 da linha 3 333 6 75 75 de linha 4 7 75 75 linha 5 de 166 8 75 75 linha 6 de 125 9 75 75 fro linha m 7 83 10 75 75 linha 9 de 41 11 150 75 linha 10 de 13 - Manter as placas a 25 ± 5 ° C até o uso.
4. Ensaio de neutralização com células de 164 WEHI
- Mix vortexing todos celular suspensões (0,5 x 10 6 células/mL) antes da distribuição em qualquer etapa do presente protocolo.
Nota: Nesta seção, aquecer cada solução a 37 ° C por 30 min antes de usar. - Transferir 50 µ l de suspensão de célula para cada um dos 60 poços de microplacas, movendo-se de 2 a 11 de coluna e linha B a G.
- Transferir 50 µ l de referência mAb, amostra e controle diluições em microplacas. Seguem o padrão descrito na Figura 1.
- Adicionar 50 µ l da solução de indução de apoptose em cada poço.
- Usar celulares controles de 50 µ l de 164 WEHI células, dispensadas em três poços. Trazer a cada poço até um volume final de 150 µ l com meio de cultura ensaio.
- Usar um controle de citotoxicidade de uma mistura de 50 µ l de células WEHI 164 plus 50 µ l de solução de indução de apoptose. Trazer a cada poço até um volume final de 150 µ l com meio de cultura ensaio.
- Controle para o TNFa, usar 50 µ l da solução de indução de apoptose e trazê-lo a 150 µ l com meio de cultura ensaio.
- No ensaio em branco, use 150 µ l do meio de cultura ensaio sozinho.
- Preencher os restantes poços com 150 µ l de meio de cultura para evitar efeitos de evaporação placa. Repita os passos de
- 4.1.1-4.1.9 duas vezes em dois outras microplacas.
Nota: As concentrações finais de mAb na microplaca são: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0,028, 0,014 e 0,004 µ g/mL. - Carregar as amostras em microplacas, conforme indicado na Figura 1.
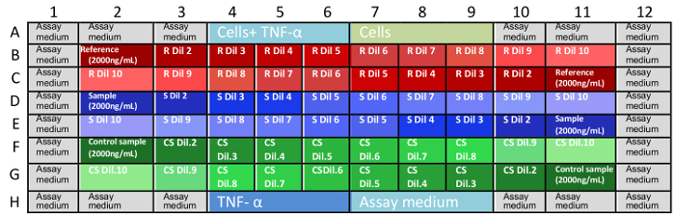
Figura 1: disposição das amostras nas placas de ensaio. B1 a G11 são bem coordenadas nas microplacas e descrever as posições onde as diluições da amostra são colocadas. Faltando as coordenadas são poços repleto de controles e ensaio de meio de cultura (A1-A12 e H1-H12). Esta distribuição aleatória de amostras (frente e verso de diluições nas microplacas) ajuda a eliminar o viés nos resultados devido a evaporação do meio ou outras variáveis. O melhor é que cada microplaca é feita por um analista de cada vez. R referência de, s amostra, CS: amostra de controlo, Dil: diluição. clique aqui para ver uma versão maior desta figura. - Incubar as três placas a 37 ° C e 5% CO 2 para 16 ± 2 h.
- Deixa o reagente de Glo caspase 3/7 fica a 25 ± 5 ° C por 30 min antes do uso.
- Adicione 100 µ l deste reagente a todos os poços, incluindo as amostras e controles.
- Apertar as placas usando um misturador do vortex de microplacas por 3 min 25 ± 5 ° C, imediatamente após o doseamento nos poços.
- Incubar as placas para 2,5 ± 0,5 h a 25 ± 5 ° C, protegido da luz.
- Inserir o microplates no luminómetro e completar a próxima seção.
5. Análise dos resultados
- usando um software para a deteção de luminescência, selecione a função de modo e ponto de extremidade de luminescência.
- Placa de selecionar um clear-fundo de 96 poços e seus 80 poços internos, excluindo colunas 1 e 12.
- Selecione um tempo de integração de 1.250 ms e 10 s para misturar o microplate antes da leitura.
- Selecione os poços onde amostra controle, substância analítica e substância de referência serão colocados e identificam-se com as respectivas concentrações correspondentes.
- Ler as amostras colocadas nas microplacas com o luminómetro.
- Usar uma quarta equação de parâmetro para a análise dos resultados. Gráfico de uma curva de dose-resposta, conforme representado na Figura 2.
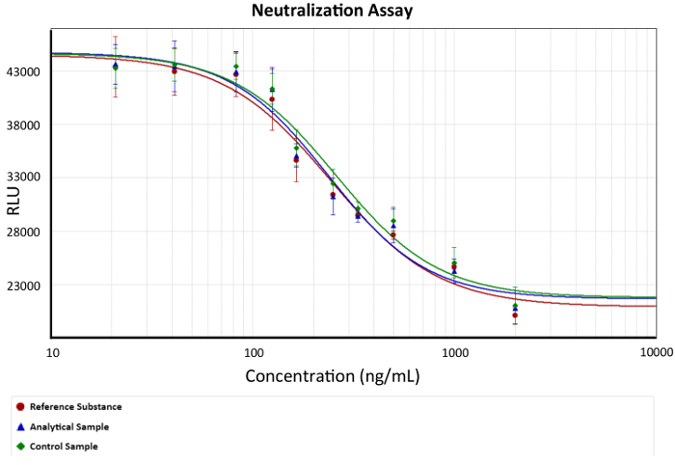
Figura 2: curva Dose-resposta. Concentração de mAb anti-TNFa e luminescência (viabilidade celular) é retratada. Uma quarta equação do parâmetro descrevendo a proteção anti-TNFa de mAbs foi usada como um modelo. EC50 é a concentração do mAb que pode neutralizar a quantidade de TNFa que provoca a morte celular de 50% em cada ensaio, exemplificado no gráfico, como a mudança na inclinação. Barras de descrevem o desvio padrão de luminescência para cada concentração do mAb. x representa a concentração de Ab anti-TNFa e é retratado como uma função logarítmica em ng/mL, enquanto y representa a resposta de luminescência em unidades arbitrárias de luminescência. clique aqui para ver uma versão maior desta figura.
Nota: A quarta equação do parâmetro, C é a concentração efetiva 50 (EC50). Esse valor será usado para comparar a substância de referência, amostra analítica e amostra de controle por meio da função efetora. - Para calcular as potências relativas, consertar a substância de referência a 100% e calcular as potências da amostra e controle conformemente.
Nota: Esses valores são representados na Figura 3.
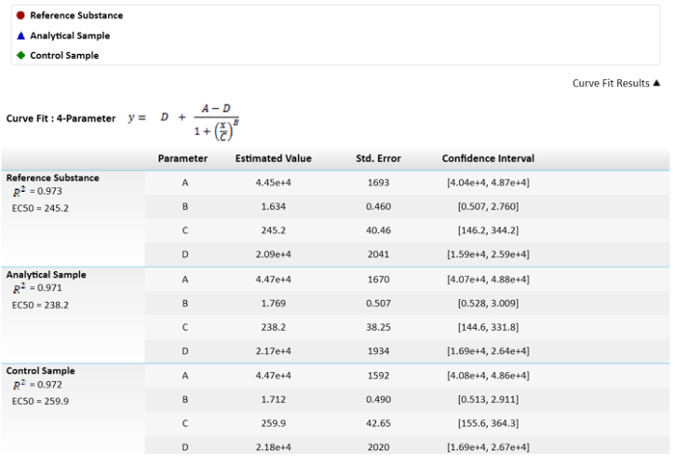
Figura 3: equação matemática utilizada para o cálculo de seus valores e o EC50s. EC50 valores ou parâmetros C, tem sua incerteza descrita como erro padrão. Uma comparação de EC50s entre os resultados de amostra e referência de potência relativa é também retratada. O intervalo de confiança é calculado com um α = 0,05. clique aqui para ver uma versão maior desta figura.
Resultados
Gráfico de dose-resposta (com controles)
A Figura 1 representa a resposta de luminescência versus concentração do mAb. Esta função sigmoidal exemplifica lançamento de caspase-3 e 7 em meio de cultura de ensaio devido a lise celular. Morte celular é reforçada pela inanição de soro mais TNFa indução de sinalização. Portanto, a molécula de anti-TNFa (mAb) interage com o cytokine, inibindo a sua interação com o receptor de c...
Discussão
Esta caracterização ajuda a determinar a priori o comportamento biológico de uma molécula em desenvolvimento antes caros e demorados testes clínicos são conduzidos. Também é útil para a liberação de lotes de um produto de droga aprovada. Vale ressaltar que estes ensaios são úteis para determinar se uma molécula possui um efeito biológico adequado sobre seu mecanismo de ação. O método bio-analítico apresentado neste tutorial é criticamente importante para a comparação de moléculas diferente...
Divulgações
Os autores não têm nada a divulgar
Agradecimentos
Este trabalho foi financiado pelo Conselho Nacional de ciência e tecnologia (CONACYT), México conceder PEI CONACYT 2015 220333, sem participação na concepção do estudo.
Materiais
| Name | Company | Catalog Number | Comments |
| WEHI 164 | ATCC | CRL-1751 | Fibrosarcoma cells from Mus musculus |
| RPMI-1640 Medium | ATCC | 30-2001 | Store medium at 2 °C to 8 °C |
| RPMI 1640 Medium, no phenol red | GIBCO | 11835-030 | Store medium at 2 °C to 8 °C |
| Trypsin-EDTA(0.25%),phenol red | GIBCO | 25200-056 | Store medium at -10 °C to -20 °C |
| DPBS, no calcium, no magnesium | GIBCO | 14190-136 | Store medium at 2 °C to 8 °C |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | Store at -20 °C to -70 °C |
| Fetal Bovine Serum (U.S), Super Low IgG | HyClone | SH3089803 | Store at -10 °C to -20 °C |
| Fetal Bovine Serum (U.S.), Characterized | HyClone | SH3007103 | Store at -10 °C to -20 °C |
| Caspase-Glo 3/7 Assay kit | Promega | G8093 | Store the Caspase-Glo. 3/7 Substrate and Caspase-Glo. 3/7 Buffer at –20 ºC protected fromLight |
| EDTA, Disodium Salt, Dihydrate, Crystal, A.C.S. Reagent | J.T.Baker | 8993-01 | -- |
| Sample mAb Adalimumab | Probiomed | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Reference and Control mAb Adalimumab | Abbvie | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Microplate Reader | Molecular Devices | 89429-536 | SpectraMax M3 Multi-Mode |
| Microplate reader Software | Molecular Devices | -- | SoftMax Pro 6.3 GxP |
| Incubator | Revco | 30482 | Revco RNW3000TABB Forced-Air CO2 |
| Laminar Flow Hood | The Baker Company | 200256 | Baker SG603A-HE | High Efficiency, Class II Type A2 |
Referências
- Elmore, S. Apoptosis: A Review of programmed cell death. Toxicol Patho. 35 (4), 495-516 (2007).
- Darwish, R. S. Regulatory mechanisms of apoptosis in regularly dividing cells. Cell Health Cytoskelet. 2 (1), 59-68 (2010).
- Tracey, D., et al. Tumor necrosis factor antagonist mechanism of action: A comprehensive review. Pharmacol Ther. 117 (2), 244-279 (2008).
- Körner, H., Sedgwick, J. Tumour necrosis factor and lymphotoxin: Molecular aspects and role in tissue-specific autoimmunity. Immunol Cell Biol. 74 (5), 465-472 (1996).
- Wong, M., et al. TNFa blockade in human diseases: Mechanisms and future directions. Clin Immunol. 126 (2), 121-136 (2008).
- Furst, D. E., Wallis, R., Broder, M., Beenhouwer, D. O. Tumor necrosis factor antagonists: different kinetics and/or mechanisms of action may explain differences in the risk for developing granulomatous infection. Semin Arthritis Rheum. 36 (3), 159-167 (2006).
- Karvinen, J., et al. Homogeneous time-resolved fluorescence quenching assay (LANCE) for caspase-3. J Biomol Screen. 7 (3), 223-231 (2002).
- Ren, Y. G., et al. Differential regulation of the TRAIL death receptors DR4 and DR5 by the signal recognition particle. Mol Biol Cell. 15 (11), 5064-5074 (2004).
- Sud, D., Bigbee, C., Flynn, J. L., Kirschner, D. E. Contribution of CD8+ T cells to control of Mycobacterium tuberculosis infection. J Immunol. 176 (7), 4296-4314 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Curr Protoc Immunol. Apendix 3, 3 (2001).
- Ramasubramanyan, N., et al. . Low acidic species compositions and methods for producing and using the same. 1, (2014).
- Masters, J. R., Stacey, G. N. Changing medium and passaging cell lines. Nat Protoc. 2 (9), 2276-2284 (2007).
- Eskandari, M. K., Nguyen, D. T., Kunkel, S. L., Remick, D. G. WEHI 164 subclone 13 assay for TNF: sensitivity, specificity, and reliability. Immunol Invest. 19 (1), 69-79 (1990).
- Hora, M. S., Rana, R. K., Smith, F. W. Lyophilized formulations of recombinant tumor necrosis factor. Pharm Res. 9 (1), 33-36 (1992).
- Ponnappan, S., Ponnappan, U. Aging and immune function: molecular mechanisms to interventions. Antiox Redox Signal. 14 (8), 1551-1585 (2011).
- Matsumaru, K., Ji, C., Kaplowitz, N. Mechanisms for sensitization to TNF-induced apoptosis by acute glutathione depletion in murine hepatocytes. Hepatology. 37 (6), 1425-1434 (2003).
- Camacho-Villegas, T., Mata-Gonzalez, T., Paniagua-Solis, J., Sanchez, E., Licea, A. Human TNF cytokine neutralization with a vNAR from Heterodontus francisci shark: a potential therapeutic use. mAbs. 5 (1), 80-85 (2013).
- Männel, D. N., Falk, W. Optimal induction of tumor necrosis factor production in human monocytes requires complete S-form lipopolysaccharide. Infect Immun. 57 (7), 1953-1958 (1989).
- Lis, K., Kuzawińska, O., Bałkowiec-Iskra, E. Tumor necrosis factor inhibitors-state of knowledge. Arch Med Sci. 10 (6), 1175-1185 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados