Method Article
Dos algoritmos para de alto rendimiento y multi-paramétrico Cuantificación de
* Estos autores han contribuido por igual
En este artículo
Resumen
Se crearon dos algoritmos de análisis de imagen, "Drosophila NMJ morfometría" y "Drosophila NMJ Bouton morfometría", para cuantificar automáticamente nueve características morfológicas de la unión neuromuscular Drosophila (NMJ).
Resumen
la morfología sináptica está estrechamente relacionada con la eficacia sináptica, y en muchos casos los defectos morfológicos sinapsis en última instancia conducir a un mal funcionamiento sináptico. La unión Drosophila larval neuromuscular (NMJ), un modelo bien establecido para las sinapsis glutamatérgicas, ha sido ampliamente estudiado por décadas. La identificación de las mutaciones que causan defectos morfológicos NMJ reveló un repertorio de genes que regulan el desarrollo de sinapsis y la función. Muchos de ellos fueron identificados en estudios a gran escala que se centraron en los enfoques cualitativos para detectar anomalías morfológicas de la Drosophila NMJ. Un inconveniente de los análisis cualitativos es que muchos jugadores sutiles que contribuyen a la morfología NMJ probable que pasan desapercibidos. Mientras que se requieren análisis cuantitativos para detectar las diferencias morfológicas más sutiles, tales análisis no son todavía comúnmente realizan porque son laboriosos. Este protocolo describe en detalle dos algoritmos de análisis de imagen "Drosophila 'Drosophila NMJ Bouton Morfometría', disponible como macros compatibles con Fiji, para el análisis morfométrico cuantitativo, precisa y objetiva de la Drosophila NMJ. Esta metodología se desarrolló para analizar terminales NMJ immunolabeled con los marcadores utilizados comúnmente Dlg-1 y . Brp Además, su aplicación más amplia a otros marcadores como Hrp, Csp y Syt se presenta en este protocolo Las macros son capaces de evaluar nueve características NMJ morfológicas:. zona NMJ, perimetrales NMJ, número de boutons, longitud NMJ, NMJ rama más larga longitud, el número de islas, número de ramas, el número de puntos de ramificación, el número de zonas activas en el terminal NMJ.
Introducción
Trastornos cognitivos tales como la discapacidad intelectual, trastorno del espectro autista y la esquizofrenia se caracterizan a menudo por una función anormal sináptica 1, 2, 3. morfología Synapse y función están estrechamente entrelazadas; defectos morfológicos pueden causar un mal funcionamiento sináptica y, a la inversa, la transmisión sináptica aberrante impactarán la maduración sináptica y la morfología 4, 5, 6.
Una serie de organismos modelo se han empleado con el fin de entender mejor la biología de la sinapsis y arrojar luz sobre cómo los cambios sinápticos afectan la función cerebral en salud y enfermedad 7, 8, 9. La Drosophila NMJ es una extensamente estudiada y bien establecido modelo in vivo para sy glutamatérgicanapse biología 10, 11. En las últimas décadas, este modelo se ha utilizado para los estudios fisiológicos y centrado genes, así como para las pantallas de genética a gran escala, con el objetivo de detectar diferencias morfológicas entre NMJs. En particular, las pantallas adelante genéticos han identificado muchos reguladores cruciales y mecanismos del desarrollo de sinapsis y la función 12, 13, 14, 15, 16. Sin embargo, la mayoría de estas pantallas se basó en la evaluación visual de la NMJ morfología terminal y en la detección cualitativa de las anormalidades sinápticas o de puntuación semicuantitativa de algunas características morfológicas. Como consecuencia, más sutiles alteraciones morfológicas sinápticas que no son obvias para el ojo humano se pierden fácilmente. Con el fin de poder detectar diferencias cuantitativas forma integral, lasNMJ tiene que ser evaluada con precisión mediante la cuantificación sistemática de los parámetros morfológicos de interés. La medición de características NMJ manual es laborioso, especialmente cuando hay varias características NMJ de interés y / o cuando se realizan pruebas de detección genéticos a gran escala. Para apoyar multiparamétrica, análisis morfológico de alto rendimiento y para lograr la cuantificación objetiva, dos macros "Drosophila NMJ morfometría" y "Drosophila NMJ Bouton morfometría" se desarrollaron 17. Ambas macros se ejecutan en el software de código abierto de análisis de imágenes Fiji 18, y pueden cuantificar ambas imágenes confocal y nonconfocal.
Medidas "Drosophila NMJ morfometría" terminales NMJ inmunoteñidas con el disco postsináptica marcador de gran-1 (Dlg-1) o la peroxidasa de rábano picante presináptica (HRP), co-etiquetados con el Bruchpilot marcador de zona activa (BRP). Cuantifica nueve paráme morfológicaTER (descrito más adelante): área NMJ, perimetrales NMJ, número de boutons, longitud NMJ, NMJ más larga longitud de rama, número de islas, número de ramas, número de puntos de ramificación, el número de zonas activas en la terminal sináptica (Figura 1) . Aunque un algoritmo para determinar el número de boutons está presente en esta macro, que no cumplía con los criterios de exactitud 17. Para evaluar adecuadamente el número de boutons, es necesario utilizar la macro "Drosophila NMJ Bouton Morfometría", que está diseñado específicamente para cuantificar boutons utilizando preparaciones NMJ inmunoteñidas por anti-sinaptotagmina (Syt) o proteína de cadena anti-Cisteína (Csp), y co-immunolabeled con Brp. La macro "Drosophila NMJ Bouton Morfometría" cuantifica los siguientes parámetros: número de boutons, área Bouton NMJ, longitud NMJ, NMJ más larga longitud de la rama, número de islas, número de ramas, el número de puntos de ramificación y el número de zo activones (Figura 2).
Las macros consisten en 3 sub-macros: (I) "Convertir a apilar" identifica todos los archivos de imagen disponibles y crea Z-hyperstacks y proyecciones de máxima intensidad de ambos canales. Como salida, esta macro generará dos nuevos archivos por sinapsis llamada "stack_image_name" y "flatstack_image_name". II) "Definir ROI" se abrirá todas las imágenes de proyección máximos "flatstack_image_name" consecutivamente y presentarlos con la solicitud para definir manualmente la región de interés (ROI) en el que está presente el terminal sináptica específica de interés. Esto se implementó para permitir la exclusión de las sinapsis que conectan a los músculos adyacentes y / u otros tipos de terminales sinápticas (tales como 1s) que pueden estar presentes en las imágenes 11. (III) "Analizar" se aplica totalmente automatizado análisis a todas las regiones de las imágenes dentro de las fronteras de la ROI. Comoresultado de este paso, el usuario obtendrá dos nuevos archivos: "results.txt", donde se anotarán toda la medición numérica y un "res_image_name.tif", donde se ilustrarán las segmentaciones imagen subyacente producidos por la macro. Durante el análisis de imagen tres estructuras se derivan de cada terminal sináptica: el contorno NMJ, el esqueleto NMJ, y el número de zonas activas Brp-positivos. El contorno NMJ se utiliza para determinar el área NMJ y su perímetro y una separación de cuencas posterior proporciona el número de boutons. Desde el esqueleto, cinco características NMJ se deducen: la longitud total NMJ, la suma de la longitud de la trayectoria continua más larga que conecta dos puntos finales (la más larga longitud de la rama), el número de compartimentos no conectados por NMJ (referido como "islas" ), el número de ramas, y el número de puntos de ramificación (un punto de ramificación conecta tres o más ramas). El número de zonas activas se determina en el Brp canales contandomanchas BRP-positivas. El esquema anotado NMJ (línea amarilla), el esqueleto NMJ (línea azul), y el número de zonas activas Brp-positivos (indicados por focos blanco) se visualizan en un cuadro los resultados y las medidas de los parámetros se procesan a una (. txt) archivo de salida (Figura 3).
Drosophila NMJ Morfometría" y 'Drosophila NMJ Bouton Morfometría' se describieron primero y extensamente validados por Nijhof et al. 17. Este manuscrito se centra en la metodología de análisis de la morfología NMJ usando las macros 'Drosophila NMJ morfometría' y 'Drosophila NMJ Bouton morfometría'. Sin embargo, antes de los análisis macro-asistida, disecciones NMJ y immunostainings deban llevarse a cabo. Estos son pasos cruciales, y la combinación de marcadores utilizados para inmunohistoquímica tiene que ser adecuado para los análisis de macro. Estos pasos se mencionan brevemente en sEcción 1 de este protocolo y dirigir al usuario a referencias que describen en detalle los protocolos para ejecutar estos procedimientos.
Protocolo
1. Requisitos Antes de Procesamiento de Imágenes
- Realizar Drosophila preparaciones libro abierto de tercer instar errante larvas (L3), como se ha descrito previamente 19.
- Co-inmunomarcador terminales Drosophila NMJ utilizando una combinación de dos marcadores: DLG-1 o Hrp junto con Brp para el análisis con "Drosophila NMJ Morfometría", y Syt o Csp junto con Brp para el análisis con "Drosophila NMJ Bouton Morfometría" 20.
NOTA: Los anticuerpos de la misma especie se pueden combinar por pre-etiquetado uno con un kit de anticuerpo-conjugación tales como el Zenon Alexa Etiquetado Kits 17. - NMJ imagen terminales utilizando un microscopio de elección, por ejemplo, la fluorescencia (con o sin ApoTome) o microscopía confocal.
- Adquirir una pila de imágenes de 2 canales del terminal NMJ.
- Ajustar los ajustes del microscopio de manera que el canal 1adquiere el terminal NMJ immunolabeled con Dlg-1 (o Hrp, Syt, Csp) y el canal 2 el terminal NMJ immunolabeled con Brp.
- Opcionalmente, analizar las imágenes de un canal (de sinapsis inmunomarcadas con un único anticuerpo) con las macros. NMJs Image immunolabeled única con Dlg-1 o Hrp para el análisis con "Drosophila NMJ Morfometría", o Syt o Csp para "Drosophila NMJ Bouton Morfometría".
NOTA: No es posible analizar las sinapsis immunostained con sólo el anti-Brp.
- Exportar las imágenes obtenidas como archivos individuales .tiff. Invertir el orden de los canales antes de ejecutar las macros si no se adquiere como se indica.
- Adquirir una pila de imágenes de 2 canales del terminal NMJ.
2. Requisitos e instalación de software
- Descargar las macros: "Drosophila NMJ Morfometría" y "Drosophila NMJ Bouton Morfometría" de la siguiente página web: https://figshare.com/s/ec634918c027f62f7f2a 21.
- Mover el cursor a la carpeta de "actualización de macros 1", y haga clic en la opción "vista" que aparece. Aparecerá una lista con el contenido de esta carpeta. La carpeta contiene las macros "Drosophila NMJ morfometría" y "Drosophila NMJ Bouton morfometría".
NOTA: Las dos macros son compatibles con las versiones 1.4 Fiji, que también se encuentra en la misma carpeta. Las macros pueden no funcionar en versiones recientes. Por favor utilice la versión 1.4 proporcionado. Es problemático para comenzar esta versión, incluso en equipos con una versión más reciente de Fiji disponibles. - Haga clic en "Descargar todos". El contenido de la carpeta será descargado en el ordenador como un archivo .zip. Descomprimir el archivo descargado.
- Copiar los archivos de Drosophila Drosophila y _NMJ_Morphometrics.ijm _NMJ_Bouton Morphometrics.ijm al directorio Fiji.app/plugins/. Al volver a arrancar el programa, las macros aparecerá en la parte inferior de los pluginsMenú desplegable.
3. Ejecutar Sub-macro "Convertir a la pila" para crear Z-proyecciones y Hyperstacks de las Imágenes NMJ
- Iniciar la interfaz gráfica mediante la selección de plugins en la barra de herramientas y seleccione "Drosophila NMJ Morfometría" en el menú desplegable.
- Definir la configuración de "cadena única de Archivo" en la interfaz gráfica de la macro.
NOTA: El software de microscopio utiliza una firma de identificación para organizar los aviones y los canales al almacenar pilas como archivos individuales .tiff. El ajuste de la cadena de archivo único entrado necesita especificar la firma asignado por el software para el primer plano del primer canal (importante: más baratos avión y número de canal debe indicarse). - Seleccionar sólo los sub-macro "Convertir a apilar" y haga clic en "OK" y seleccionar la carpeta donde se encuentran las imágenes. Si se selecciona un directorio principal con varias subcarpetas, todo individuo .tiff archivos dentro deel directorio principal y subcarpeta coincide con los criterios de cadena única de archivos serán procesados.
- Si el z-pila sólo contiene un canal, seleccione la casilla de "Canal a sólo 1".
- Observe que dos nuevos archivos de imagen por NMJ, por defecto denominado como stack_image_name y flatstack_image_name aparecerán. Almacenar sólo estos pila y flatstack para su posterior análisis. La serie de archivos .tiff se puede eliminar en este punto, lo que minimiza las capacidades de almacenamiento requeridos y evitar posibles fuentes de error.
4. Ejecutar Sub-macro "Definir ROI" para aislar el terminal NMJ de interés
- Iniciar la interfaz gráfica de "Drosophila NMJ Morfometría".
- Seleccione sólo la casilla de verificación "Definir retorno de la inversión" y pulse "OK" y seleccionar el directorio principal donde se almacenan las imágenes que tengan derecho flatstack_name y presiona "Seleccionar". El sub-macro "Definir retorno de la inversión" busca automáticamente a través de todas las subcarpetasdentro del directorio principal seleccionada.
- Como se abre la primera proyección, seleccione la función "selecciones a mano alzada" en la barra de herramientas. Con el ratón dibujar una selección que contiene exclusivamente la terminal de NMJ completa de interés y haga clic en "Aceptar" en la ventana "Definir terminal". La macro proceder con el siguiente proyección.
- Delinear el próximo retorno de la inversión y repetir hasta que se definan todas las regiones de interés. El archivo de imagen de retorno de la inversión, llamada "roi_image_name", se almacenará en el mismo directorio que las imágenes de la consola y de proyección generados anteriormente para cada una de las imágenes procesadas. La salida de este sub-macro es una imagen binaria de la ROI en blanco sobre un fondo negro.
5. Ejecutar Sub-macro "Analizar" para cuantificar Características NMJ Terminal
- Ir a la barra de herramientas, seleccione "plugins" y su uso:
"Drosophila _NMJ_Morphometrics" en el análisis de las sinapsis inmunomarcadas con anti-Dlg-1 o anti-HRP (canal 1) juntocon anti-Brp "_NMJ_Bouton_Morphometrics Drosophila" al analizar las sinapsis inmunomarcadas con anti-Syt o anti-CSP (canal 1) junto con Brp (2 canales), o (canal 2).- Cuando uno pilas de imágenes de canal son a analizar (el canal estructural Dlg-1 o HRP para "Drosophila_ NMJ_Morphometrics", o Syt o Csp para "Drosophila _NMJ__Bouton_Morphometrics"), seleccionar la casilla de "Channel solamente 1".
- Ajustar la escala correspondiente a las imágenes que se van a analizar. Si un píxel en la imagen corresponde a 2,5 m, indicar Scale-píxeles = 1, distancia escala en micras = 2,5. En caso de que ambos ajustes se deja en 0, el área NMJ, perímetro, longitud y la más larga longitud de la rama se expresan en número de píxeles.
- Si es necesario, ajustar la configuración por defecto de análisis de la macro. Realizar ajustes sólo si la sub-macro "Analizar" (esta sección con resultados insatisfactorios, y determined mejores ajustes en la sección 6) se ha ejecutado.
- Seleccione las casillas de verificación "Analizar" y "Wait" y pulse "OK".
- Seleccione la casilla de verificación "Wait" cuando se ejecuta el sub-macro "Analizar" en 2 imágenes del canal. De lo contrario, los errores en el conteo zona activa pueden ocurrir debido a las capacidades de computación limitados.
- Como una nueva ventana "Elija un directorio" se abre, seleccionar el directorio donde se encuentran las imágenes y pulse "Seleccionar". La macro analizará todas las imágenes almacenadas en el directorio principal y, si es aplicable, carpetas posteriores (usando los tres archivos de la ejecución de los anteriores sub-macros: stack_image_name, flatstack_image_name y roi_image_name). Los procesos macro cada imagen individual y consecutivamente. Esto puede tardar varios minutos por pilas de imágenes (dependiendo de la capacidad del ordenador).
- Después de ejecutar la macro, tenga en cuenta que un nuevo archivo de imagen res_image_name nombre para cada sinapsis analizó será almacenado creaTed en la carpeta de los padres. Las mediciones cuantitativas se almacenarán como archivo "results.txt".
- Inspeccionar todas las imágenes de resultado para detectar y excluir las imágenes con errores de segmentación. Posibles errores de segmentación se describen en la Tabla 3, junto con consejos sobre cómo ajustar la configuración de eludir estos. Imágenes resultado con tales errores de segmentación se proporcionan como ejemplos en la Figura 4.
NOTA: Cuando se ejecuta la macro con la configuración por defecto observado en la interfaz de usuario, hubo una precisión de aproximadamente el 95% cuando la evaluación macro se comparó con la evaluación manual 17.
6. Ajustar la configuración de macro para las Imágenes
- Cuando más de un 5% de las imágenes muestran errores de segmentación, explorar los diferentes algoritmos para definir / seleccionar los ajustes de macro más adecuados para las imágenes.
- Ajuste de rodadura valor radio de la bola
NOTA: El radio de la bola rodantefunción resta el fondo de la imagen. Esta función es de vital importancia cuando se trabaja con imágenes adquiridas en los microscopios de fluorescencia y / o cuando las imágenes tienen mucho ruido de fondo. La sustracción del fondo ayudará a pasos de auto-fijación de umbrales de la macro para producir adecuada segmentación de los terminales NMJ.- Seleccione tres Z-proyecciones NMJ (imágenes flatstack_image_name generados por sub-macro "Convertir a apilar") que son representativos del conjunto de datos de imagen.
- En la barra de herramientas, seleccione Imagen | color | canales de división. Se crearán dos imágenes, una que representa el canal 1 y el otro canal 2.
- Mantener sólo la imagen que pertenece al canal 1 abierto, correspondiente a Dlg-1, Hrp, Syt o immunolabeling Csp, y desechar la imagen del canal Brp mediante el cierre de la imagen.
- Ejecutar el filtro de "fondo Reste" seleccionando "Proceso" en la barra de herramientas, seguido de "Antecedentes Restar ..." en el menú desplegable.
- Haga clic en la casilla de vista previa en la ventana emergente y ajustar el radio de la bola rodante para el valor que aumentan el contraste entre la sinapsis y el fondo como en el panel (Figura 5A).
NOTA: Véase la Figura 5 para un ejemplo. En Figure5A, partes de la sinapsis están mostrando los mismos niveles de gris como el fondo, mientras que en la figura 5a' el 'radio de la bola rodante' ajustado a 500 genera un fuerte contraste entre la sinapsis y el fondo. - Cuando se define el valor apropiado para el radio de la bola rodante, ejecute el algoritmo de "fondo Reste" en los Z-proyecciones seleccionados con el mismo valor de radio de la bola rodante y guardarlos (en cualquier directorio).
NOTA: El valor del radio de bola rodante de 8 bits o imágenes RGB debe ser al menos tan grande como el radio del objeto más grande de la imagen que no es parte del fondo. Para las imágenes de 16 bits y 32 bits del radio debe inversely proporcional al rango de valor de píxel 22.
- Determinar los diferentes umbrales de automóviles que serán utilizados
- Abrir los Z-proyecciones guardadas en el paso anterior (6.2.6) y seleccione Imagen | Ajuste | AutoThreshold | Pruebe todos.
- Como una imagen binaria de umbral resultado aparecerá con todos los diferentes algoritmos de auto-umbral, determinar el algoritmo más adecuado para las imágenes.
- Cuando se ejecuta la macro más adelante, cambiar el umbral de los valores de la macro en consecuencia.
- Utilice umbrales más restrictivas tales como "RenyiEntrophy" o "momentos" como el umbral contorno NMJ y los umbrales más permisivas tales como "Li" para determinar el esqueleto NMJ, y "Huang" para determinar zonas activas. Cuando las imágenes son muy agudos con poco o ningún fondo, utilice "Huang" como" umbral de contorno NMJ. De lo contrario, las partes de la sinapsis podrían faltar después de la segmentación de imágenes.
- Véase la Figura 5B para un ejemplo. una adecuada segmentación de la sinapsis se obtiene con auto-umbrales señalados por cuadros de color verde. Algunos ejemplos de los umbrales no adecuados se destacan por cajas de color rojo (comprobar sinapsis en la alta ampliación). En este último, o bien partes de la sinapsis no están presentes o se incluyen partes del fondo. Véase la referencia 23 para obtener más información.
- Determinar el tamaño máximo de las partículas pequeñas
NOTA: Esta función excluirá todas las partículas detectadas por el umbral y el umbral esquema NMJ esqueleto que son más pequeños que el valor definido en el "ajuste de partículas pequeñas" del análisis. Este valor se define en píxeles. Esta función sirve como un filtro de ruido y es muy útil cuando las altas tasas de fondo no uniforme (como cristales / polvo) están presentes en las imágenes obtenidas.- Abra los Z-proyecciones guardado en el paso 6.2.6. y establecerla escala para detectar el número de píxeles a través Analizar | Escala de ajuste. Aplicar los siguientes ajustes: distancia en píxeles = 1, conocido distancia = 1, relación de aspecto de píxel = 1, Unidad de longitud = pixel y pulse "OK". Haga clic en la herramienta "Selección oval" en la barra de herramientas.
- Con el ratón dibujar una selección de cerca que rodea las partículas individuales que están presentes en la inmunotinción pero que no pertenecen a la unión neuromuscular. Presione Ctrl + m para un usuario de Windows o cmd + m para los usuarios de Mac. Una ventana de resultado se abrirá, que indica el área de las partículas seleccionadas en número de píxeles.
- Repita el paso anterior varias veces con varios artefactos presentes en las imágenes para determinar la mayor zona de partícula contaminante / artefacto. Este será el valor a establecer en la configuración cuando se ejecuta la macro más adelante. Cuando se ejecuta la macro establecer el "Tamaño de pequeñas partículas", como el más pequeño del tamaño de partícula pus observado un margen de 25%.
- Véase la Figura 5D para un ejemplo. El cristal más grande de detectared tiene una superficie de 112 píxeles. El ajuste "tamaño de partículas pequeñas", en el tratamiento de esta imagen con la macro, se debe establecer to125 - 150.
- Determinar el tamaño mínimo Bouton
NOTA: Esta función excluirá todos los boutons detectados por el umbral de contorno NMJ que son más pequeños que el valor definido en el análisis. Este valor se define en píxeles.- Siga los mismos pasos como se describe en la sección 6.4, pero en este caso dibujar una selección que rodea los boutons más pequeños presentes en el terminal NMJ. Elija el área más pequeña que corresponde al Bouton más pequeño de los medidos. Este es el valor de poner en el ajuste mínimo Bouton cuando se ejecuta la macro más adelante.
- Definir "Encuentra ruido máximos de tolerancia" valor
- Usa los Z-hyperstacks seleccionados en la sección 6.2.1.
- En la barra de herramientas, seleccione Imagen | color | canales de división para create 2 pilas (para el canal 1 y canal 2) y mantener la imagen correspondiente al canal Brp abierta. Descarta la imagen del otro canal mediante el cierre de la misma.
- Ir a la pestaña de plugins en el menú emergente, seleccione Proceso | Máximo (3D), y cuando aparece el maximum_image_name (que puede tardar hasta un par de minutos), cierre la pila imagen original.
- Seleccione el máximo ... nombre_imagen (la pila de imagen obtenida) y seleccione Plugins | proceso | Mínimo (3D), cierre la máxima ... nombre_imagen pila.
- En la barra de herramientas, seleccione Proceso | Encuentra máximos .... Una nueva ventana "Buscar máximos ..." se abrirá. Haga clic en la "selección de puntos de vista previa ..." casilla de verificación y llenar la caja "tolerancia de ruido" con el ajuste 50. Los puntos máximos se indica en la imagen como pequeñas cruces macro por defecto.
- Aumentar el valor de "tolerancia Noise" si la observación de un exceso de las zonas activas, es decir, anotados cruces que no están en la parte superior de las zonas activas que se encuentran encentrarse en el plano pila seleccionada, o zonas activas falsas que se detecta en el fondo.
- Por otro lado, si la observación de forma incompleta anotada zonas activas, es decir, las zonas activas en el foco no ser etiquetado reconocido, disminuir el valor de la "tolerancia de ruido". Mantenga probando diferentes valores siguientes este procedimiento hasta que las cruces están etiquetando adecuadamente las zonas activas en el enfoque. Rellene el campo "Buscar tolerancia de ruido máximos" con este valor.
- Véase la Figura 5C para un ejemplo. se detectan demasiadas zonas activas. En la Figura 5C' solamente se detectan las zonas activas en el foco.
- Aumentar el valor de "tolerancia Noise" si la observación de un exceso de las zonas activas, es decir, anotados cruces que no están en la parte superior de las zonas activas que se encuentran encentrarse en el plano pila seleccionada, o zonas activas falsas que se detecta en el fondo.
- Ejecutar la sub-macro "Analizar" para las imágenes representativas seleccionadas en el paso 5.1, con los parámetros definidos en los todos los pasos anteriores.
- Ajuste Brp-puntos lagrimales umbral inferior y superior
- Observe que un nuevo archivo se aparecen después de ejecutar el macro acuerdo con la etapa 6.6, llamado 2_active_zone_stack_image_name. En esta imagen apilar las zonas activas detectado por la función "Encuentra maxima" se indican mediante puntos blancos en cada plano.
- Abrir este archivo de arrastrar y soltar en la barra de herramientas y seleccione Imagen | apilar | Zproject | Tipo de proyección = rebanadas Sum. Se obtendrá una proyección de la 2_active_zone_stack_image_name.
- Seleccionar Imagen | Ajuste | Límite. Una nueva ventana de "umbral" se abrirá. Deslizar la barra superior para elegir un valor umbral, donde, todos los focos / spots deseada Brp-positivas se visualizan en rojo.
NOTA: Si el umbral se establece demasiado bajo, se contará un exceso de las zonas activas. Si se establece demasiado alto, se puede perder una fracción de las zonas activas.- Véase la Figura 5E para un ejemplo. Cuando umbral se fija en 400, la mayoría de las zonas activas (simbolizado como focos 1 pixel) no están incluidos en la segmentación, ya que no están resaltados en rojo (Figura 5E). Cuando umbral se establece a un valor de 50 todas las zonas activas están resaltados en rojo (Figura 5E).
- Definir este valor como umbral mínimo. Deja "umbral de puntos lagrimales superior" en el valor máximo.
- Vuelva a ejecutar la sub-macro "Analizar" para las imágenes representativas con la configuración definida en todos los pasos anteriores de esta sección. una evaluación crítica de los archivos de imágenes resultantes y asegúrese de que la segmentación se realiza correctamente. Si este no es el caso reajustar la configuración de acuerdo con la naturaleza de los errores de segmentación (Figura 4, Tabla 3).
Resultados
El archivo de resultados de texto aparecerá en el directorio principal. En él se resumen todos los parámetros medidos por imagen. Los resultados están relacionados con el nombre de archivo y, posteriormente, los parámetros se resumen en el orden indicado en las tablas 1 y 2.
Res_image_name es una pila de tres imágenes. La primera imagen pone de relieve el contorno y el esqueleto del terminal NMJ determinado por la macro basado en el canal 1 (inmunomarcaje Dlg-1, Hrp, Syt, o Csp). La segunda imagen es una copia de la primera imagen y, además, muestra los puntos BRP-positivos identificados que se detectan en el canal 2 como focos esquematizada. La tercera imagen proporciona la máxima proyección del segundo canal junto con focos Brp-positivos identificados.
El umbral de contorno NMJ está representado en amarillo la imagen resultado de salida macro en. NMJ área, PerimEter y el número de boutons se deduce de este umbral.
El umbral esqueleto NMJ se representa en azul la imagen resultado de salida macro en. NMJ longitud, el más largo longitud de la rama, número de sucursales, puntos de ramificación y las islas se deduce de este umbral.
El umbral de zonas activas NMJ no está representada la imagen resultado de salida macro en. Este umbral determina el área en la que los focos Brp-positivo podría potencialmente ser encontradas por el macro. Tiene el propósito de crear un área NMJ que es ligeramente más grande que el umbral definido por el esquema NMJ. Cuando se selecciona un umbral demasiado restrictivo, focos Brp-positiva situada en el margen de la sinapsis puede ser excluido. Cuando el umbral es demasiado permisiva, ruido de fondo puede ser contado como Brp-positivo manchas (Figuras 1 - 2).
para validate el rendimiento de la macro "Drosophila NMJ Morfometría", se ensayaron tres condiciones mutantes que ya fueron descritos por presentar defectos sinápticos en diferentes parámetros NMJ. Cada defecto fue detectado por un procedimiento de segmentación de imágenes diferente realizada por el macro (contorno NMJ, zonas esqueleto o activas, respectivamente 17). Después de la orientación de los tres genes de interés por inducible RNAi y disecciones escénicas y NMJ inmunotinción de larvas L3, se ejecuta la macro. Las mediciones morfológicas NMJ obtenidos fueron luego por parejas (RNAi frente a su control) en comparación utilizando una prueba t. En los tres casos, se encontraron diferencias estadísticas entre los mutantes y controles que afectan a parámetros que están de acuerdo con los defectos morfológicos previamente comunicados. Esto confirma que las macros son de hecho capaces de identificar adecuadamente los defectos descritos anteriormente en la Drosophila NMJ.
Ankyrin 2 (ANK2, CG42734) mutantes son conocidos para mostrar defectos morfología sinápticas, incluyendo boutons fusionados y NMJs más pequeñas. Se observaron Estos defectos para los mutantes ANK2 24, 25 y ANK2 knockdown moscas 26. Terminales NMJ de pan-neuronales Ank2- RNAi moscas desmontables (w; UAS-Dicer-2 / UAS-ANK2 RNAi KK107238; elav-Gal4 / +) mostraron significativamente menor área NMJ (media = 339,25 m 2; prueba t p = 2,18 x 10 -8) y el perímetro (media = 238,24 m; prueba t p = 1,82 x 10 -3), en comparación con el conjunto de datos genética control de fondo (w; UAS-Dicer-2 / UAS-KK60100; elav-Gal4 / + ) (media = 451,95 m 2 y media = 288,62 m, respectivamente) después de ejecutar "Drosophila NMJ Morfometría" (Figuras 6A y 4B).
La GTPasa Rab3 (CG7576) se requiere para la correcta distribución Bruchpilot y el mutante rup presenta con un número significativamente reducido de zonas activas 27. Se observó una disminución significativa en el número de zonas activas en la medición de focos Brp-positiva por la macro "Drosophila NMJ Morfometría" en terminales NMJ de moscas desmontables Rab3 pan-neuronales (w; UAS-Dicer-2 / UAS-RNAi KK100787; elav Gal4). El número medio de zonas activas por terminal NMJ en Rab3 -RNAi era 138 en contraste con 290 detectada en el conjunto de datos de control (/ +) de la prueba t p = 4,43 x 10 -29) (figuras 6A y 4C).
Highwire (hiw, CG32592) es un importante regulador del crecimiento NMJ; hiw mutaciones en gen conducen a un crecimiento excesivo y se extendieron ramificación de los terminales 28 NMJ. Medición de terminales NMJ de neuronal pan-line knockdown hiw -RNAi (w; UAS-Dicer-2 / UAS-RNAi-GD36085; elav-Gal4 / +) con "Drosophila NMJ Morfometría", se observaron diferencias significativas en los parámetros de esqueleto derivadas de: longitud (media = 147,36 m; control de media = 122,07 m; t -test p = 7,31 x 10 -7), la más larga longitud de la rama (media = 122,19 m; control de media = 105,65 m; prueba t p = 4,62 x 10 -4) número de ramas (media = 7,69; controlar media = 5,74; prueba t p = 2,52 x 10 -2) y el número de puntos de ramificación (media = 2,73; controlar media = 1,79; prueba t p = 3,31 x 10 -2). Todos estos parámetros se incrementaron significativamente (120 - 180%) en comparación con los controles de fondo genético (w; UAS-Dicer-2 / UAS-GD60000; elav-Gal4 / +) (Figuras 6A y 4D).
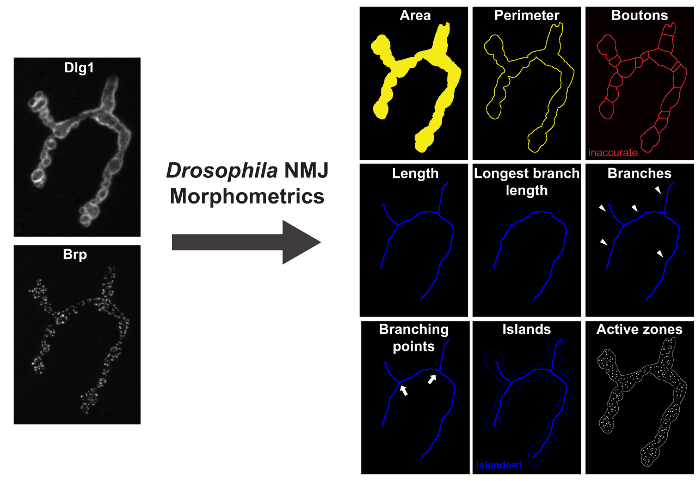
Figura 1: Drosophila _NMJ_Morphometrics Medidas 9 Parámetros de la DrosophiLa unión neuromuscular. A la izquierda están Dlg-1 y Brp immunolabeled terminales NMJ, imágenes en un microscopio de fluorescencia con ApoTome. A la derecha están las imágenes de resultado después de ejecutar "Drosophila NMJ Morfometría". Parámetros de área, perímetro y boutons están representados por el esquema de color amarillo macro-anotada indicado. longitud parámetros, la más larga longitud de la rama (LBL), sucursales, puntos de ramificación, y las islas son presentados por el contorno azul macro-anotada. focos inmunomarcadas-Brp (zonas activas) están representados por la macro como manchas blancas en las imágenes de resultado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Drosophila NMJ Bouton Morfometría Medidas 8 Parámetros de la Drosophila NMJ. A la izquierdason SYT-1 y Brp immunolabeled terminal de NMJ, captación de imagen sobre un microscopio de fluorescencia con ApoTome. A la derecha están las imágenes de resultado después de ejecutar "Drosophila NMJ Bouton Morfometría". Parámetros boutons y área de Bouton están representados por el contorno amarillo macro-anotada. longitud parámetros, la más larga longitud de la rama (LBL), sucursales, puntos de ramificación, y las islas son presentados por el contorno azul macro-anotada. focos inmunomarcadas-Brp (zonas activas) están representados por la macro como manchas blancas en las imágenes de resultado. Haga clic aquí para ver una versión más grande de esta figura.
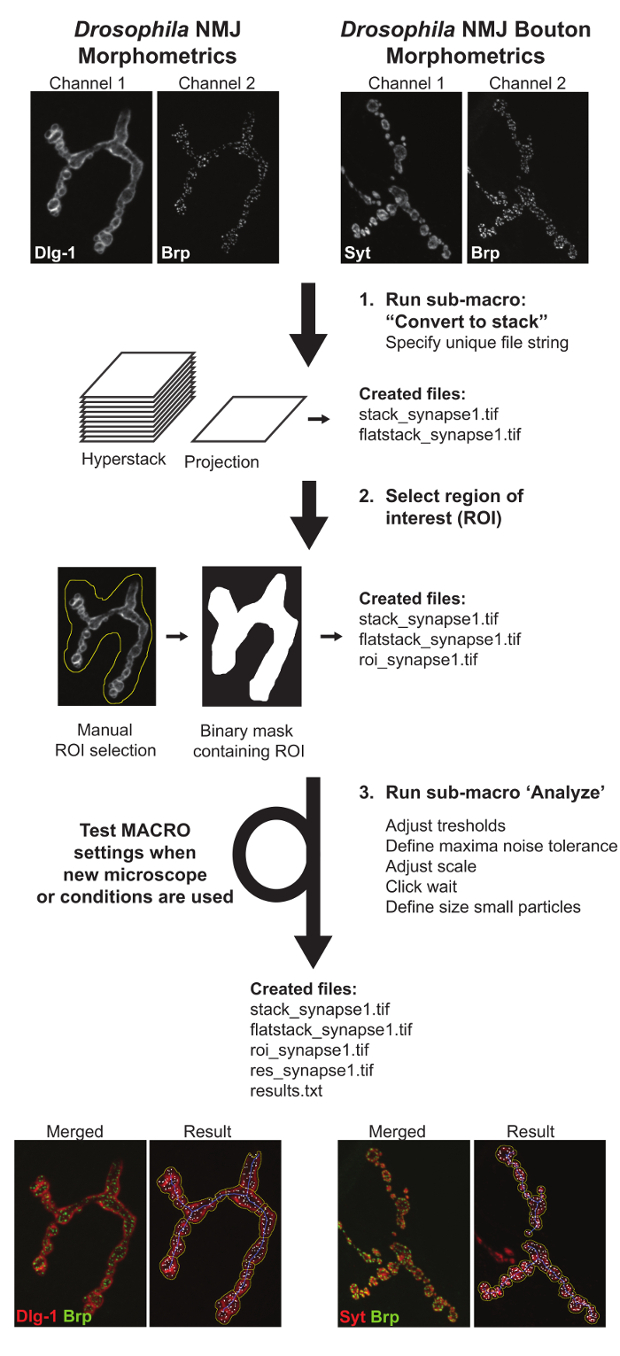
Figura 3: Gráfico de flujo que representa Drosophila NMJ Morfometría y Drosophila NMJ Bouton Morfometría Macros. La primera sub-macro "Convertir to pila" crea proyecciones y hyperstacks de los NMJs fotografiadas. El segundo sub-macro 'Definir ROI' requiere la introducción manual que define la ubicación del terminal NMJ de interés. Sub-macro tres, 'Analizar', las medidas de todos los parámetros NMJ. Un texto archivo que contiene los valores cuantitativos y un archivo de imagen resultante que representa la delimitación de los parámetros se creó para ayudar a la evaluación del usuario del desempeño macro. Cuando las imágenes se adquieren en diferentes condiciones, los valores de la macro tienen que ser probado y ajustado para garantizar un análisis preciso. Por favor, haga clic aquí para ver una versión más grande de esta figura.
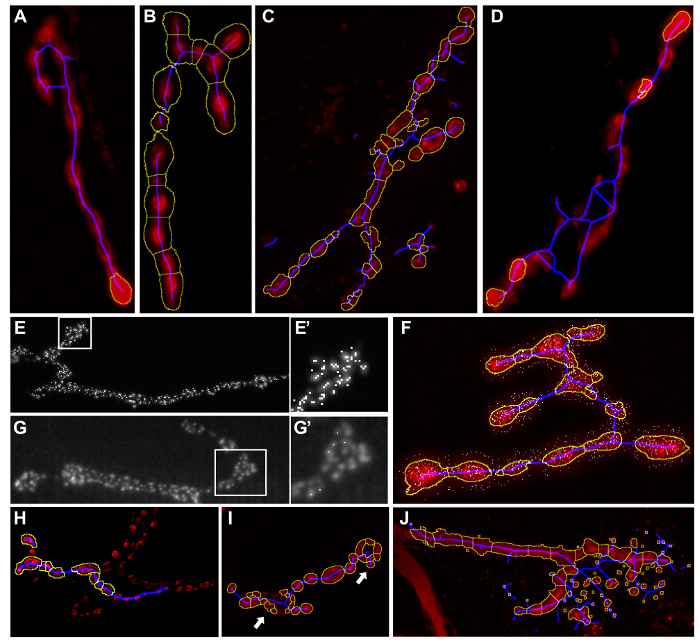
Figura 4: Ejemplos de inapropiados resultados de la segmentación de macros. Imágenes de Resultados después de ejecutar "Drosophila NMJ Morphometrics" o 'Drosophila NMJ Bouton Morfometría'. Las partes de la terminal sináptica no están incluidos en el esquema de color amarillo (A). Las partes de la de fondo se incluyen en la terminal sináptica por el contorno amarillo (B). línea esqueleto azul se extiende más allá de la terminal sináptica. (C - D) se detectan Demasiados zonas activas (E - E '). Algunas zonas activas permanecen sin ser detectados por el análisis (G - G'). las zonas activas se detectan fuera de la sinapsis (F) Bouton incorrecta segmentación. (Sólo aplicable cuando se ejecuta Drosophila NMJ Bouton Morfometría), boutons se pierden (H) o demasiadas boutons son detectados por la segmentación (I). las partículas a tales cristales o polvo que son parte del fondo están incluidos en la segmentación (J) . Información de cómo cambiar la configuración para evitar estos errores se proporcionan en la Tabla 3 . Haga clic aquí para ver una versión más grande de esta figura.
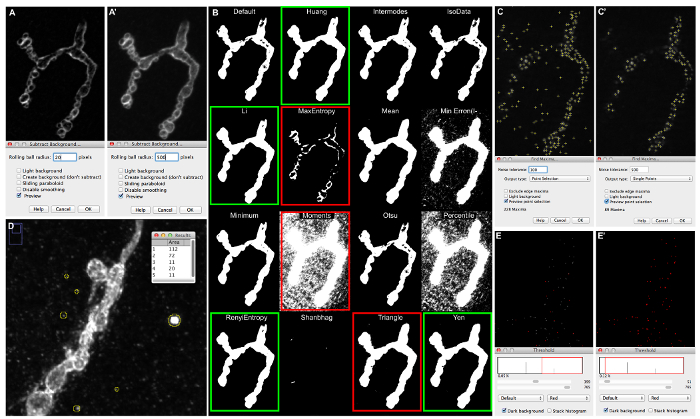
Figura 5: Ejemplos de ajustes-ajuste macro y sus consecuencias para la segmentación de imágenes. (A) Reste fondo vista previa de una sinapsis immunolabeled Dlg-1, captación de imagen sobre un microscopio de fluorescencia con ApoTome, cuando "Rolling radio de la bola" se establece en 20 (A) o 500 (A'). (B) Las imágenes de salida obtenidos después de correr Imagen | Ajuste | Auto-Umbral | Trate toda la imagen ilustra segmentaciones de imagen obtenidos por los 16 diferentes algoritmos de umbral automático. (C) "Encuentra Maxima" vista previa cuando la creación de "tolerancia de ruido" en 50 (C) y 500 (C'); C.Azonas tivos que son detectados por la segmentación son etiquetados por una pequeña cruz. (D) Medición de las "partículas pequeñas" que aparecen en el fondo de la imagen de una sinapsis immunolabeled con anti-HRP, captación de imagen sobre un microscopio confocal. (E) de proyección "rebanadas Sum" obtiene de la 2_active_zone_stack_ima-ge_name. Umbral se fija en 400 (E) y en 50 (E'). Haga clic aquí para ver una versión más grande de esta figura.
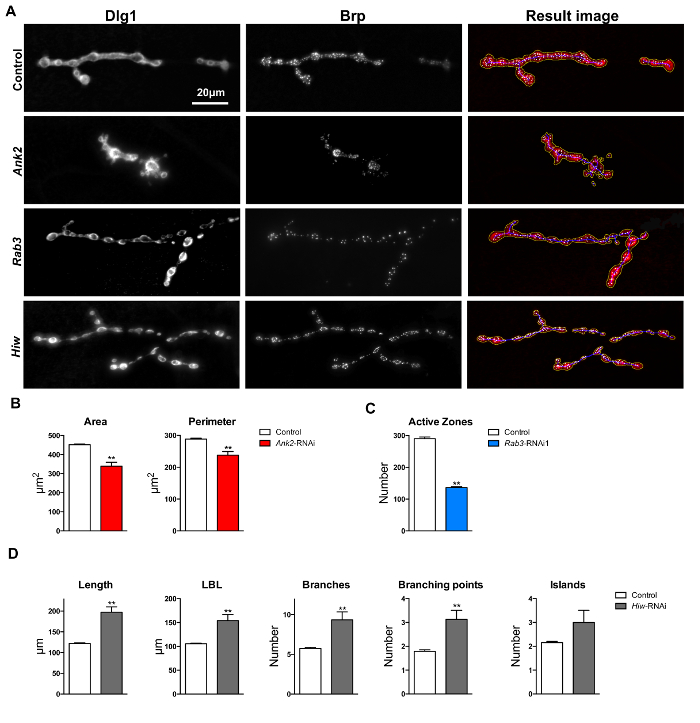
Figura 6: Evaluación Macro y cuantificación de NMJs en las imágenes Muscle 4. (A) Resultados después de ejecutar macro "Drosophila NMJ Morfometría" en Dlg-1 y Brp immunolabeled terminales NMJ. área de parámetros, perímetro y Boutons están representados por el esquema de color amarillo-macro anotada. longitud parámetros, la más larga longitud de la rama (LBL), sucursales, puntos de ramificación, y las islas son presentados por el contorno azul macro-anotada. focos inmunomarcadas-Brp (zonas activas) están representados por la macro como manchas blancas en las imágenes de resultado. La barra de escala indica 20 m. (B) Ankyrin2 RNAi desmontables presentan un área NMJ más pequeño y el perímetro comparación con los controles antecedentes genéticos. (C) Rab3 knockdown resultó en NMJs con un menor número de zonas activas Brp-positivas en comparación con los controles de antecedentes genéticos. (D) knockdown Highwire resultó en más largo, mayor longitud más larga rama, más ramificada y con puntos de ramificación más por terminales NMJ en comparación con NMJs control de fondo genéticos. Las barras de error indican SEM, ** p <0,01, dos T-test de cola. Por favor, haga clic en élvolver a ver una versión más grande de esta figura.
| Parámetro | estructura NMJ | Explicación |
| Área (μm2) | contorno NMJ | El área de la NMJ marcado completa |
| Perímetro (m) | contorno NMJ | El perímetro que pertenece a la zona |
| #Boutons | contorno NMJ | El número de botones sinápticos ( 'perlas en una cuerda') de la UNM |
| Longitud (m) | Esqueleto | La longitud total de la completa terminal de NMJ |
| Más larga longitud de la rama (m) | Esqueleto | La suma de la longitud de la trayectoria continua más larga que la conexión de cualquiera de los dos puntos finales de la NMJ |
| #RamaES | Esqueleto | El número total de ramificaciones |
| puntos #Branching | Esqueleto | El número de puntos de ramificación (varias ramas puede derivar de un punto de ramificación) |
| #Islands | Esqueleto | El número de compartimentos sinápticas DLG1-positivos no conectados (o cualquier otro tinción) |
| zonas #Active | manchas BRP-positivo | El número de zonas activas, basado en tinción Brp |
Tabla 1: Parámetros medidos por NMJ "Drosophila NMJ Morfometría". Los parámetros NMJ medidos por el macro "Drosophila NMJ Morfometría" aparecerán como una lista en el archivo de texto obtenida, siguiendo el orden descrito en esta tabla. Esta tabla se reproduce desde Nijhof et al. 17
| Parámetro | estructura NMJ | Explicación |
| boutons | contorno NMJ | El número de botones sinápticos ( 'perlas en una cuerda') de la UNM |
| área de Bouton | contorno NMJ | El área total de todos los boutons |
| Longitud (m) | Esqueleto | La longitud total de la completa terminal de NMJ |
| Más larga longitud de la rama (m) | Esqueleto | La suma de la longitud de la trayectoria continua más larga que la conexión de cualquiera de los dos puntos extremos de la NMJ |
| #Branches | Esqueleto | El número total de ramificaciones |
| puntos #Branching | Esqueleto | The número de puntos de ramificación (varias ramas puede derivar de un punto de ramificación) |
| #Islands | Esqueleto | El número de compartimentos sinápticas DLG1-positivos no conectados (o cualquier otro tinción) |
| zonas #Active | manchas BRP-positivo | El número de zonas activas, basado en tinción Brp |
Tabla 2: Parámetros medidos por NMJ "Drosophila NMJ Bouton Morfometría". Los parámetros NMJ medidos por el macro "Drosophila _Bouton_NMJ_Morphometrics" aparecerán como una lista en el archivo de texto obtenida, siguiendo el orden descrito en esta tabla. Esta tabla se reproduce desde Nijhof et al. 17
| Segmentación | Errores observados | Ejemplo | ajustes requeridos | |
| Área NMJ y el perímetro (Representado por contorno amarillo imagen resultante) | Las partes de la terminal sináptica, o bien no están incluidas en el esquema de color amarillo o partes del fondo están incluidos en la terminal sináptica se indica en amarillo. | Figura 5A-B | Ajustar el valor 'Rolling Ball Radio'. Véase la sección 6.1. | Ajuste 'umbral esquema NMJ'. Véase la sección 6.2. |
| los parámetros relacionados con la longitud NMJ (representada por la línea esqueleto azul imagen el resultado en) | línea esqueleto azul o bien se extiende más allá o no está presente a lo largo de toda la terminal sináptica. | Figura 5C-D | Ajustar el valor 'Rolling Ball Radio'. Véase la sección 6.1. | Ajuste 'umbral esquema NMJ'. Véase la sección 6.2. |
| puntos lagrimales BRP-positivos (representados por puntos de imagen en los resultados) | se detectan demasiadas zonas activas. | Figura 5E-E' | Disminuir el valor 'Encuentra tolerancia de ruido máximos'. Véase la sección 6.5. | |
| puntos lagrimales BRP-positivos (representados por puntos de imagen en los resultados) | Las zonas activas se pierden por el análisis. | Figura 5G-G' | Aumentar el valor 'Encuentra tolerancia de ruido máximos'. Véase la sección 6.5. | Disminuir 'umbral más bajo BRP-puntos lagrimales'. Ver sección 6.6. |
| puntos lagrimales BRP-positivos (representados por puntos de imagen en los resultados) | artefactos zona activa se detectan exterior de la terminal sináptica. | Figura 5F | Ajustar la sección 'Activo umbral de Zona' 6.2. | Aumentar 'umbral más bajo BRP-puntos lagrimales'. Ver sección 6.6. |
| Las partículas pequeñas | Partículas tales unos cristales o polvo que forman parte de los antecedentes parecen estar incluido en la segmentación. | Figura 5J | Seleccione la casilla 'Eliminar las partículas pequeñas'. Ver sección 6.3. | Determinar las partículas pequeñas de tamaño máximo. Ver sección 6.3. |
| segmentación Bouton | segmentación incorrecta Bouton (Sólo aplicable a Drosophila NMJ Bouton Morfometría y no utilice Drosophila NMJ Morfometría para la segmentación Bouton). | Figura 5H-I | Ajuste 'umbral esquema NMJ'. Véase la sección 6.1. | Determinar 'Bouton tamaño mínimo'. Véase la sección 6.4. |
Tabla 3: Solución de problemas Guía para los diferentes tipos de errores en la segmentación de imágenes que se pueden producir por las macros. Esta tabla describe los diferentes tipos deerrores de segmentación de imágenes producidas por las macros. Estas pueden ser fácilmente detectados en las imágenes de los resultados. Ejemplos de cada tipo de error se muestran en la Figura 4. En la sección "ajustes" de la tabla, los parámetros que necesitan ser ajustados están resaltados, y el usuario se somete a la sub-etapa crítica de la sección 6, que describen cómo ajustar estos valores.
Discusión
"Drosophila NMJ Morfometría" y "Drosophila NMJ Bouton Morfometría" son herramientas poderosas para los investigadores interesados en la evaluación de la morfología de la sinapsis. evaluación manual de los parámetros NMJ es laborioso; se estima que las macros se ahorrarían un investigador experimentado hasta 15 min / NMJ pasó en la segmentación manual de imagen. Con una o dos docenas de sinapsis evaluados por condición o genotipo, esto resume rápidamente hasta una cantidad considerable de tiempo ahorrado, incluso en estudios a pequeña escala. Al realizar grandes pantallas, la ganancia de la utilización de análisis de alto rendimiento, en comparación con la evaluación manual y la cuantificación, puede ser inmensa. Además de un mayor rendimiento, los macros proporcionan fácilmente análisis objetivo; excluyen a los prejuicios personales que de otra forma requieren experimentos ciegos, así como las diferencias interpersonales que se producen cuando varios investigadores participan en el análisis. Por último, las macros proporcionan una una sensible y precisoÁLISIS de características NMJ, lo que permite la identificación de reguladores sinápticas que causan más sutil que defectos NMJ dramáticos y hasta ahora han permanecido poco apreciado por el ojo del investigador. La información detallada sobre los procedimientos de validación y los algoritmos utilizados en las macros se encuentran en la publicación Nijhof et al. 17.
La funcionalidad de los macros se ha validado para medir apropiadamente características morfológicas de Drosophila melanogaster NMJs en músculo 4. Posteriormente, se demostró que las macros también eran adecuados para analizar las sinapsis en otros músculos en este organismo. Es probable que las macros también se pueden usar para medir los parámetros morfológicos de NMJ con estructura similar en otras especies, incluyendo otras especies de Drosophila y otros insectos. Incluso NMJs muy distantes en la evolución, por ejemplo, NMJs de ratones, muestran una conformación estructural bastante similar 29. Las macros no se han probado en los preparativos NMJ de otras especies, pero los usuarios potenciales se les anima a probar las macros para tales fines.
Es muy importante que el usuario explora los diferentes umbrales de automóviles y algoritmos para definir / seleccionar los ajustes de macro más adecuados para las imágenes. Con estos ajustes, se logra una precisión de aproximadamente el 95% cuando la evaluación macro se comparó con la evaluación manual. Ajuste de los valores de la macro a adecuadamente segmento 100% de las imágenes puede ser un procedimiento muy laborioso o incluso imposible. Por lo tanto, la exclusión de las imágenes no segmentados correctamente se recomienda si su número es inferior al 5%. Evidentemente, si la calidad de las imágenes es baja, las macros se generan mayores proporciones de segmentaciones imagen insatisfactorios. Las imágenes de baja calidad influirán de manera similar la evaluación manual y por lo tanto no pueden ser ligada a la evolución de las macros. No obstante las macros son bastante robusta ya que fueron diseñados para una imagenS generada en un microscopio de alta contenido (un microscopio de fluorescencia automatizado que permite obtener imágenes de gran número de muestras) 17.
Un punto crítico es que el usuario inspecciona visualmente todas las imágenes resultado generado por las macros. Esto permitirá detectar y excluir las imágenes con la segmentación insatisfactorio. En la sección 6 de este protocolo, el usuario es guiado cómo ajustar la configuración de la segmentación de imagen correcta cuando se ejecuta el sub-macro "Analizar". Para familiarizarse rápidamente con los requisitos de las macros y cómo ajustar los valores de la macro una carpeta llamada "Examples_adjusting valores de la macro" está incluido en el repositorio de https://figshare.com/s/ec634918c027f62f7f2a macro. Trece subcarpetas, cada uno con ejemplos de imágenes obtenidas en diferentes plataformas de microscopio (microscopios alto contenido / confocal / fluorescencia) y diferentes immunostainings, se proporcionan. Un PDF titulado “guía Ejemplos” se incluye en el mismocarpeta en la que se proporcionan los ajustes requeridos para cada ejemplo, junto con un documento de texto que proporciona los resultados esperados y los resultados de las imágenes.
Las macros se han diseñado para procesar las imágenes guardadas como archivos separados .tiff, sin embargo, algunos usuarios podrían haber salvado sus imágenes en un formato diferente. La siguiente página web https://figshare.com/s/ec634918c027f62f7f2a 21 contiene una carpeta con el nombre "Drosophila NMJ" donde tres archivos de ejemplo (Ejemplo 1 - 3) y la "Guía de ejemplos" de documentos con instrucciones detalladas de cómo importar imágenes en la macro si no se almacenan como archivos separados .tiff también se pueden encontrar en la misma carpeta.
En conjunto, las macros "Drosophila NMJ Morfometría" y "Drosophila NMJ Bouton morfometría" cuantificar diez diferentes características NMJ: área NMJ, perímetro NMJ, número de boutons, área Bouton NMJ, longitud NMJ, NMJ más larga que la longitud de la rama, número de IslaNDS, número de ramas, el número de puntos de ramificación y el número de zonas activas. Esto proporciona una gran ventaja sobre las herramientas disponibles hasta ahora que pueden evaluar sólo una o algunas de sus funciones sinápticas 30, 31. Análisis cuantitativo Multiparámetrico lleva un gran potencial para nuevos descubrimientos, por ejemplo, para identificar nuevos reguladores que controlan uno hasta numerosos aspectos de la biología sinapsis. También proporciona la resolución necesaria para determinar los genes que correguladores de exactamente las mismas o superposición de las características NMJ y por lo tanto es probable que operar en vías moleculares comunes. Por último, se abre la posibilidad de investigar cómo los diferentes parámetros sinápticos se correlacionan entre sí en condiciones inalteradas 17 y aseguran que los genes tales correlaciones morfométricos coordinados.
En su conjunto, este protocolo se ilustra cómo utilizar las dos macros "Drosophila NMJ Morfometría" y"Drosophila NMJ Bouton Morfometría", que realizan la cuantificación objetiva y sensible de diez características morfológicas NMJ en una forma de alto rendimiento.
Divulgaciones
Los autores no tienen conflictos de intereses a revelar.
Agradecimientos
Reconocemos el centro de Centro de Recursos de Drosophila Viena y Bloomington Drosophila (NIH P40OD018537) para proporcionar cepas de Drosophila. Agradecemos a Jack Fransen desde el Centro de Imagen microscópica de apoyo de expertos en imágenes. Este estudio fue apoyado por becas VIDI y superior (917-96-346, 912-12-109) de la Organización Holandesa para la Investigación Científica (NWO), por dos becas de doctorado / Universidad de Radboud DCN Medical Center, por el Retraso Mental Red Alemana financiado por el programa NGFN + del Ministerio Federal alemán de Educación e Investigación (BMBF) y por Gencodys de la Unión Europea 7PM gran escala integrados de red (SALUD-241995) a AS. Los donantes no tenía papel en el diseño del estudio, la recogida y análisis de datos, decisión a publicar, o la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Immunostaining | Dilution | ||
| Mouse anti-discs large 1 | Developmental Studies Hybridoma Bank | AFFN-DLG1-4D6 | 1/25 (conjungated using the Zenon Alexa Fluor 528 Labeling Kit) |
| Rabbit anti-horseradish peroxidase | Jackson IR | 323-005-021 | 1/500 |
| Rabbit anti-Synaptotagmin | Gift from Hugo Bellen | Jan-00 | |
| Mouse anti-Cysteine string protein | Developmental Studies Hybridoma Bank | DCSP-1(ab49) | 1/10 (conjungated using the Zenon Alexa Fluor 528 Labeling Kit) |
| Mouse anti-Bruchpilot | Developmental Studies Hybridoma Bank | nc82 | Jan-50 |
| Goat anti-mouse Alexa Fluor 488 | Life technologies | A11029 | 1/200 |
| Goat anti-rabbit Alexa Fluor 568 | Life technologies | A11011 | 1/500 |
| Zenon Alexa Fluor 568 Mouse IgG1 Labeling Kit | ThermoFisher | Z25006 | |
| ProLong Gold Antifade Mountant | ThermoFisher | P36930 | |
| Material | Company | Catalog number | Comments |
| Equipment | |||
| Confocal microscope or fluorescence microscope | Leica SP5 | ||
| Zeiss Axio imager | |||
| Computer | Mac or Pc | ||
| Material | Company | Catalog number | Comments |
| Software | |||
| FIJI |
Referencias
- Lin, Y. C., Koleske, A. J. Mechanisms of synapse and dendrite maintenance and their disruption in psychiatric and neurodegenerative disorders. Annu Rev Neurosci. 33, 349-378 (2010).
- van Bokhoven, H. Genetic and epigenetic networks in intellectual disabilities. Annu Rev Genet. 45, 81-104 (2011).
- Penzes, P., Buonanno, A., Passafaro, M., Sala, C., Sweet, R. A. Developmental vulnerability of synapses and circuits associated with neuropsychiatric disorders. J Neurochem. 126, 165-182 (2013).
- Mainen, Z. F., Sejnowski, T. J. Influence of dendritic structure on firing pattern in model neocortical neurons. Nature. 382, 363-366 (1996).
- Yuste, R., Majewska, A., Holthoff, K. From form to function: calcium compartmentalization in dendritic spines. Nat Neurosci. 3, 653-659 (2000).
- Vetter, P., Roth, A., Hausser, M. Propagation of action potentials in dendrites depends on dendritic morphology. J Neurophysiol. 85, 926-937 (2001).
- Bosch, M., Hayashi, Y. Structural plasticity of dendritic spines. Curr Opin Neurobiol. 22, 383-388 (2012).
- Mehnert, K. I., Cantera, R. Circadian rhythms in the morphology of neurons in Drosophila. Cell Tissue Res. 344, 381-389 (2011).
- Sigrist, S. J., Reiff, D. F., Thiel, P. R., Steinert, J. R., Schuster, C. M. Experience-dependent strengthening of Drosophila neuromuscular junctions. J Neurosci. 23, 6546-6556 (2003).
- Ruiz-Canada, C., Budnik, V. Introduction on the use of the Drosophila embryonic/larval neuromuscular junction as a model system to study synapse development and function, and a brief summary of pathfinding and target recognition. Int Rev Neurobiol. 75, 1-31 (2006).
- Menon, K. P., Carrillo, R. A., Zinn, K. Development and plasticity of the Drosophila larval neuromuscular junction. Wiley Interdiscip Rev Dev Biol. 2, 647-670 (2013).
- Kraut, R., Menon, K., Zinn, K. A gain-of-function screen for genes controlling motor axon guidance and synaptogenesis in Drosophila. Curr Biol. 11, 417-430 (2001).
- Parnas, D., Haghighi, A. P., Fetter, R. D., Kim, S. W., Goodman, C. S. Regulation of postsynaptic structure and protein localization by the Rho-type guanine nucleotide exchange factor dPix. Neuron. 32, 415-424 (2001).
- Eaton, B. A., Fetter, R. D., Davis, G. W. Dynactin is necessary for synapse stabilization. Neuron. 34, 729-741 (2002).
- Laviolette, M. J., Nunes, P., Peyre, J. B., Aigaki, T., Stewart, B. A. A genetic screen for suppressors of Drosophila NSF2 neuromuscular junction overgrowth. Genetics. 170, 779-792 (2005).
- Collins, C. A., Wairkar, Y. P., Johnson, S. L., DiAntonio, A. Highwire restrains synaptic growth by attenuating a MAP kinase signal. Neuron. 51, 57-69 (2006).
- Nijhof, B., et al. A New Fiji-Based Algorithm That Systematically Quantifies Nine Synaptic Parameters Provides Insights into Drosophila NMJ Morphometry. PLoS Comput Biol. 12, e1004823(2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9, 676-682 (2012).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Dubos, A., et al. Conditional depletion of intellectual disability and Parkinsonism candidate gene ATP6AP2 in fly and mouse induces cognitive impairment and neurodegeneration. Hum Mol Genet. 24, 6736-6755 (2015).
- Nijhof, B., et al. Drosophila NMJ Morphometrics. , figshare https://doi.org/10.6084/m9.figshare.2077399. (2017).
- Ferreira, T., Rasband, W. ImageJ User Guide IJ 1.46. , http://rsbweb.nih.gov/ij/docs/guide/146-29.html (2014).
- Ferreira, T., Rasband, W. ImageJ User Guide IJ 1.46. , Available from: http://fiji.sc/Auto_Threshold (2014).
- Pielage, J., et al. A presynaptic giant ankyrin stabilizes the NMJ through regulation of presynaptic microtubules and transsynaptic cell adhesion. Neuron. 58, 195-209 (2008).
- Koch, I., et al. Drosophila ankyrin 2 is required for synaptic stability. Neuron. 58, 210-222 (2008).
- Iqbal, Z., et al. Homozygous and heterozygous disruptions of ANK3: at the crossroads of neurodevelopmental and psychiatric disorders. Hum Mol Genet. 22, 1960-1970 (2013).
- Prokop, A. Organization of the efferent system and structure of neuromuscular junctions in Drosophila. Int Rev Neurobiol. 75, 71-90 (2006).
- Wan, H. I., et al. Highwire regulates synaptic growth in Drosophila. Neuron. 26, 313-329 (2000).
- Shi, L., Fu, A. K., Ip, N. Y. Molecular mechanisms underlying maturation and maintenance of the vertebrate neuromuscular junction. Trends Neurosci. 35, 441-453 (2012).
- Sutcliffe, B., Forero, M. G., Zhu, B., Robinson, I. M., Hidalgo, A. Neuron-type specific functions of DNT1, DNT2 and Spz at the Drosophila neuromuscular junction. PLoS One. 8, e75902(2013).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100(2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados