Method Article
高スループットとのマルチパラメトリック定量化のための2個のアルゴリズム
* これらの著者は同等に貢献しました
要約
二つの画像解析アルゴリズム、「 ショウジョウバエ NMJ形態計測」および「 ショウジョウバエ NMJブートン形態計測を」自動的ショウジョウバエ神経筋接合部(NMJ)の9つの形態学的特徴を定量化するために、 作成されました 。
要約
シナプスの形態は、シナプス伝達効率に緊密に関連しており、多くの場合、形態学的シナプスの欠陥は、最終的にシナプス機能不全につながります。 ショウジョウバエ幼虫神経筋接合部(NMJ)、グルタミン酸作動性シナプスのための十分に確立されたモデルは、広範囲に数十年にわたって研究されてきました。 NMJの形態学的欠陥を引き起こす変異の同定は、シナプスの発達および機能を調節する遺伝子のレパートリーを明らかにしました。これらの多くは、 ショウジョウバエ NMJの形態異常を検出するための定性的なアプローチに焦点を当てた大規模な研究で同定されました。定性分析の欠点は、NMJの形態に貢献し、多くの微妙な選手がそう見過ごされたままということです。定量分析は、微妙な形態学的差異を検出するために必要とされるのに対し、彼らが面倒であるため、このような分析はまだ一般的に行われていません。このプロトコルは、「詳細にショウジョウバエ 2つの画像分析アルゴリズムを説明しますショウジョウバエ NMJブートン形態計測』、 ショウジョウバエ NMJの、定量的な正確かつ客観的形態計測分析のために。この方法は、一般的に使用されるマーカーはDlg-1で免疫NMJ端子を分析するために開発されBRPさらに、例えばHRP、CSPとSYTなどの他のマーカーへの広い適用は、このプロトコルで提示されているマクロは、9つの形態学的NMJの機能を評価することができる:NMJ面積、NMJ境界、終末の数、NMJ長、NMJ最長分岐長さ、島の数、分岐の数、分岐点及びNMJ端子にアクティブなゾーンの数の数。
概要
このような知的障害、自閉症スペクトラム障害と統合失調症の認知障害は、しばしば異常なシナプス機能1、2、3によって特徴付けられます。シナプスの形態および機能がしっかり絡み合っています。形態学的欠陥は、シナプス機能不全を引き起こす可能性があり、逆に、異常なシナプス伝達は、シナプスの成熟および形態4、5、6に影響を与えます。
モデル生物の数は、よりよいシナプス生物学を理解し、シナプスの変化が健康と病気7、8、9での脳機能にどのように影響するかに光を当てるために使用されてきました。 ショウジョウバエ NMJはグルタミン酸SYのために広く研究およびin vivoモデルで十分に確立されていますnapse生物学10、11。過去数十年間では、このモデルはのNMJ間の形態学的な差を検出する目的で、だけでなく、大規模な遺伝子スクリーニングのために、生理学的および遺伝子に焦点を当てた研究のために使用されてきました。具体的には、フォワード遺伝子スクリーニングは、シナプスの開発の根底にある多くの重要な調節因子および機構を特定し12、13、14、15、16として機能しています。しかしながら、これらの画面のほとんどはNMJ端子形態の視覚的評価に及び定性的なシナプスの異常の検出または少数形態学的特徴の半定量的スコアに依存していました。その結果、人間の目には非自明ではなく、微妙なシナプスの形態異常を見逃しやすいです。総合的に定量的な差を検出できるようにするために、NMJは正確に関心の形態学的パラメータを系統的に定量化して評価する必要があります。手動NMJの機能を測定することは、いくつかのNMJ関心の特徴および/または大規模な遺伝的スクリーニングを実行するときがある場合は特に、面倒です。マルチパラメトリック、ハイスループット形態素解析をサポートするため、客観定量化を達成するために、2つのマクロ「 ショウジョウバエ NMJ形態計測」と「 ショウジョウバエ NMJブトン形態計測は、」17を開発しました。両方のマクロは、オープンソースの画像解析ソフトウェアフィジー18で実行され、共焦点および非共画像の両方を定量化することができます。
「ショウジョウバエ NMJ形態計測」対策後シナプスマーカーディスク大-1(はDlg-1)又はシナプス前西洋ワサビペルオキシダーゼ(HRP)で免疫染色NMJ端子、アクティブゾーンマーカーbruchpilot(BRP)で同時標識しました。これは、9形態学的parameを定量化TERS(さらに後述する):NMJ面積、NMJ境界、終末の数、NMJ長、NMJ最長枝長、島の数、分岐の数、分岐点とシナプス末端における活性なゾーンの数の数( 図1) 。終末の数を決定するためのアルゴリズムは、このマクロに存在しているが、精度17の基準を満たしませんでした。適切終末の数を評価するために、具体的には、抗シナプトタグミン(SYT)または抗システインストリングタンパク質(CSP)によって免疫染色NMJ製剤を用いて終末を定量化するために設計された「 ショウジョウバエ NMJブートン形態計測」マクロを使用する必要があり、そしてBRPとの共免疫標識。終末の数、NMJのブートン領域、NMJ長、NMJ最長枝長、島の数、分岐の数、分岐点の数および活性ZOの数:「ショウジョウバエ NMJブートン形態計測」マクロは、以下のパラメータを定量化NE( 図2)。
マクロは、3つのサブマクロから成る:(I)「スタックに変換」は、すべての利用可能な画像ファイルを識別し、Z-hyperstacksと両チャンネルの最大強度投影を作成します。出力として、このマクロは、「stack_image_name」と「flatstack_image_name」と呼ばれるシナプスごとに2つの新しいファイルが生成されます。 II)連続して、すべての最大投影像「flatstack_image_name」を開き、手動で関心のある特定のシナプスの端末が存在する関心領域(ROI)を定義するための要求でそれらを提示する「ROIの定義」。これは、隣接する筋肉及び/又は画像11に存在することができる(例えば1秒など)シナプス末端の他のタイプに接続するシナプスの排除を可能にするために実施されました。 (III)ROIの境界内の画像のすべての領域に完全に自動化された分析を適用し、「分析」。として全ての数値測定が注釈されます「RESULTS.TXT」とマクロによって生成される基礎となる画像セグメンテーションを説明する「res_image_name.tif」:このステップの結果、ユーザは、2つの新しいファイルを取得します。 NMJアウトライン、NMJ骨格、およびBRP-正極活ゾーンの数:画像解析中に3つの構造は、各シナプス末端から誘導されます。 NMJ輪郭はNMJ面積およびその周囲を決定するために使用され、その後の流域の分離は、終末の数を提供します。スケルトンから、5つのNMJの機能が推定される総NMJ長さ、任意の2つのエンドポイントを結ぶ連続最長パスの長さの和(最長分岐長)、NMJ当たりの未接続区画の数(「島」と呼ばれます)、分岐の数、分岐点(一方の分岐点が3つ以上のブランチを接続)の数。アクティブなゾーンの数をカウントすることによってBRPチャネルに決定されますBRP-陽性スポット。 (注釈付きNMJ輪郭(黄線)、NMJ骨格(青線)、及び(白病巣で示す)BRP-正極活ゾーンの数は、結果画面に表示され、パラメータの測定をするために処理されます。 TXT)出力ファイル( 図3)。
ショウジョウバエ NMJ形態計測」および『 ショウジョウバエ NMJブートン形態計測はショウジョウバエ NMJ形態計測『および『 ショウジョウバエ NMJブートン形態計測』』最初に説明し、広範囲Nijhof ら 17によって検証した。この論文は、マクロを使用して、NMJの形態を分析する方法に焦点を当てて』。それにもかかわらず、マクロ支援分析、NMJ解剖および免疫染色の前に実行する必要がある。これらは重要なステップであり、そして免疫組織化学のために使用されるマーカーの組み合わせは、マクロ分析に適していることが必要である。これらの手順は簡単にSEに記載されていますこのプロトコルのction 1及びこれらの手順を実行するために詳細にプロトコルを記述参照にユーザーを導きます。
プロトコル
画像処理に先立っ1.要件
- 以前に19を説明したように、第三齢放浪幼虫(L3)のショウジョウバエオープンブックの準備を行います。
- 「 ショウジョウバエ NMJブートン形態計測」20と分析のために一緒に「 ショウジョウバエ NMJ形態計測」と分析のためのBRP、一緒BRPとSYTまたはCSPにおけるはDlg-1またはHRP:二つのマーカーの組み合わせを使用して共免疫標識ショウジョウバエ NMJ端末。
注:同一の種からの抗体は、ゼノンのAlexaラベリングキット17として抗体共役キットで予め標識一つにより合成することができます。 - 選択肢、 例えば、蛍光(とやApoTomeなし)または共焦点顕微鏡の顕微鏡を用いた画像NMJ端末。
- NMJ端末の2チャンネルの画像スタックを取得します。
- チャネル1なるように顕微鏡の設定を調整しますBRPで免疫NMJ端末2はDlg-1(またはHRP、SYT、CSP)及びチャネルで免疫NMJ端子を取得します。
- 必要に応じて、マクロで(単一抗体で免疫シナプスの)1チャンネルの画像を分析します。画像のNMJは「 ショウジョウバエ NMJ形態計測」、または「 ショウジョウバエ NMJブトン形態計測」のSYTまたはCSPにおける分析のためにはDlg-1またはHRPで一意に免疫標識。
注:これは唯一の抗BRPで免疫シナプスを分析することはできません。
- 個人の.TIFFファイルとして得られた画像をエクスポートします。示されているように取得されていない場合は、マクロを実行する前に、チャンネル順序を反転します。
- NMJ端末の2チャンネルの画像スタックを取得します。
2.ソフトウェア要件とインストール
- 次のWebサイトから「 ショウジョウバエ NMJ形態計測」と「 ショウジョウバエ NMJブトン形態計測」:マクロをダウンロードhttps://figshare.com/s/ec634918c027f62f7f2a 21。
- フォルダ「マクロのアップデート1」にカーソルを移動し、表示されるオプションの「表示」をクリックしてください。このフォルダの内容の一覧が表示されます。フォルダには、マクロの「 ショウジョウバエ NMJ形態計測」と「 ショウジョウバエ NMJブトン形態計測」が含まれています。
注:どちらのマクロも同じフォルダ内に用意されたフィジーのバージョン1.4、と互換性があります。マクロは、最近のバージョンでは動作しない場合があります。提供されるバージョン1.4を利用してください。それも利用でき、より最近のフィジーのバージョンを搭載したコンピュータ上で、このバージョンを起動する問題がありません。 - 「すべてをダウンロード」をクリックします。フォルダの内容は、.zipファイルとしてコンピュータにダウンロードされます。ダウンロードしたファイルを解凍します。
- Fiji.app/plugins/ディレクトリにショウジョウバエ _NMJ_Morphometrics.ijmとショウジョウバエ _NMJ_Bouton Morphometrics.ijmファイルをコピーします。プログラムを再起動すると、マクロはプラグインの下部に表示されますドロップダウンメニュー。
3.ファイル名を指定して実行サブマクロNMJ画像のZ-予測とHyperstacksを作成するために「スタックへの変換」
- ツールバーのプラグインを選択することにより、グラフィカルインタフェースを起動し、ドロップダウンメニューで「 ショウジョウバエ NMJ形態計測」を選択します。
- マクロのグラフィカルインタフェースの「ユニークなファイルの文字列」の設定を定義します。
注:顕微鏡ソフトウェアは、個々の「.TIFFファイルとしてスタックを格納する際プレーンとチャネルを整理するための識別署名を使用します。第1の流路(:最低面とチャンネル番号が指示される必要がある重要)の第一面にソフトウェアによって割り当てられた署名を指定する必要が設定入力された一意のファイル文字列。 - 唯一のサブマクロおよび「OK」をクリックして、画像が配置されているフォルダを選択し、「スタックに変換」を選択します。いくつかのサブフォルダを持つメインのディレクトリを選択した場合は、すべての個人は」.TIFFは内のファイルユニークなファイルの文字列の条件に一致するメインディレクトリとサブフォルダが処理されます。
- zスタックは、一つのチャンネルのみが含まれている場合は、「唯一のチャンネル1」ボックスを選択します。
- NMJ画像ごとに2つの新しいファイルは、デフォルトでstack_image_nameと呼ば及びflatstack_image_nameが表示されることに注意してください。さらなる分析のためにのみこれらのスタックとflatstackを保管してください。 .TIFFファイルシリーズは、必要なストレージ容量を最小限にし、潜在的な誤差源を避け、この時点で削除することができます。
4.ファイル名を指定して実行サブマクロ関心のNMJターミナルを描写するために、「ROIの定義」
- 「 ショウジョウバエ NMJ形態計測」のグラフィカルインタフェースを起動します。
- 唯一のチェックボックス「OK」を押して「ROIの定義」と題しflatstack_name画像が保存されている主なディレクトリを選択し、押して「選択」を選択します。サブマクロ「ROIの定義は、」自動的にすべてのサブフォルダを検索します選択されたメインディレクトリ内。
- 第一突起が開くように、ツールバーの「フリーハンドの選択」ツールを選択します。マウスを使用すると、もっぱらの関心の完全なNMJ端子が含まれており、「端末の定義」「OK」ウィンドウ内をクリックして選択範囲を描画します。マクロは、次の投影を進めます。
- 次のROIを描くと、すべてのROIが定義されるまで繰り返します。 「roi_image_name」という名前のROI画像ファイルは、処理された画像の各々について以前に生成スタックと投影画像と同じディレクトリに保存されます。このサブマクロの出力は、黒の背景に白でROIの二値画像です。
5.ファイル名を指定して実行サブマクロNMJターミナルの機能を定量化するために、「分析」
- ツールバーに移動し、「プラグイン」を選択して使用します。
「 ショウジョウバエ _NMJ_Morphometrics」一緒にアンチはDlg-1または抗HRP(チャンネル1)で免疫シナプスを解析一緒にBRP(チャネル2)と抗SYTまたは抗CSP(チャンネル1)で免疫シナプスを分析する場合、抗BRP(チャネル2)、または「 ショウジョウバエ _NMJ_Bouton_Morphometrics」を有します。- 一つのチャンネルの画像スタックを分析する場合(「Drosophila_ NMJ_Morphometrics」、またはSYTまたは「 ショウジョウバエ _NMJ__Bouton_Morphometrics」のCSP用構造チャネルはDlg-1またはHRP)は、ボックス「チャンネル1のみ」を選択します。
- 分析すべき画像に対応するスケールを調整します。画像中の1つの画素が2.5μmとに対応する場合、ミクロン= 2.5中のスケール画素= 1、スケールの距離を示しています。ケースでは、両方の設定はNMJ面積、周囲長、長さ及び最長の分岐の長さは画素数で表現され、0のままにされています。
- 必要な場合は、マクロのデフォルトの解析設定を調整します。のみサブマクロ「解析」(この不満足な結果のセクション、およびDETE場合の調整を行いますセクション6でrminedより良い設定)が実行されています。
- チェックボックスを選択し、「分析」と「待って」と「OK」を押します。
- 2枚のチャンネルの画像にサブマクロ「分析」を実行しているときに「待って」チェックボックスを選択します。それ以外の場合は、アクティブゾーンカウントのエラーが原因限られたコンピュータの能力に発生する可能性があります。
- 新しいウィンドウとして、「ディレクトリの選択」が開き、画像が配置されているディレクトリを押して「選択」を選択します。マクロは、メインディレクトリに格納されているすべての画像を解析し、適用、その後のフォルダ(前のサブマクロの実行から3つのファイルを使用して:stack_image_name、flatstack_image_nameとroi_image_name)の場合であろう。マクロプロセス個々に連続各画像。これは、(コンピュータの能力に依存)画像スタックごとに数分かかることがあります。
- マクロを実行した後、それぞれの新しいイメージファイルの名前res_image_nameが分析されていることに注意してくださいシナプスクレアになります保存親フォルダ内のテッド。定量的測定は、「RESULTS.TXT」ファイルとして保存されます。
- セグメンテーションエラーで画像を検出して排除するために、すべての結果の画像を点検します。可能なセグメントのエラーがこれらを回避するために、設定を調整するための方法をアドバイスとともに、 表3に記載されています。そのようなセグメンテーション・エラーの結果画像を図4に例として提供されます。
注:ユーザーインターフェイスで観察されたデフォルト設定でマクロを実行する場合、マクロ評価を手動評価17と比較し約95%の精度でした。
6.画像にマクロの設定を調整します
- 画像の5%以上は、セグメンテーションエラーを表示すると、画像に適したマクロ設定を選択/定義するために、異なるアルゴリズムを探ります。
- 転がりボール半径値を調整します
注:ローリングボール半径この関数は、画像の背景を減算します。蛍光顕微鏡で取得した画像を扱う場合、この機能は極めて重要であるおよび/またはイメージが高いバックグラウンドノイズを持っている場合。背景の減算はNMJ端末の十分なセグメンテーションを生成するために、マクロの自動閾値処理ステップを助けます。- 画像データセットの代表である3つのNMJ Z-突起(サブマクロによって生成flatstack_image_name画像は「スタックに変換」)を選択します。
- ツールバーで、[イメージ|色|スプリットチャンネル。 2枚の画像は、チャネル1および他のチャネル2を表す1つを作成します。
- Dlg-1、HRP、SYTまたはCspと免疫標識に対応する、1つのオープンチャネルに属する画像のみを保持し、画像を閉じることによってBRPチャネル画像を捨てます。
- ドロップダウンメニューに続くツールバーの「プロセス」「減算背景を...」を選択することにより、フィルタ「減算背景」を実行します。
- ポップアップウィンドウにプレビューチェックボックスをクリックして、パネル( 図5A」)のようにシナプスと背景とのコントラストを高める値にローリングボールの半径を調整します。
注:例えば、図5を参照してください。 図5Aに」500に設定された『ローリングボール半径が』シナプスと背景との間の強いコントラストを生成する一方Figure5Aにおいて、シナプスの部分は、背景と同じグレーレベルを示しています。 - 転動ボール半径の適切な値が定義されている場合、同じローリングボールの半径の値と選択されたZ-突起の「減算背景」アルゴリズムを実行し、(任意のディレクトリに)保存します。
注:8ビットまたはRGB画像のローリングボールの半径の値は、背景の一部ではない画像内の最大物体の半径と少なくとも同じ大きさであるべきです。 16ビットおよび32ビットの画像に対して半径INVされるべきです画素値の範囲22にersely比例します。
- 使用される別の自動しきい値を決定します
- 前のステップ(6.2.6)に保存されたZ-投影を開き、画像を選択|調整|自動閾値|すべてを試してみてください。
- バイナリ閾値処理結果の画像は、すべての異なる自動閾値アルゴリズムを用いて表示されるように、画像に最も適したアルゴリズムを決定します。
- 後でマクロを実行している場合は、それに応じてマクロ設定でしきい値を変更。
- 活性領域を決定するために、そのような「RenyiEntrophy」またはNMJ骨格を決定するためのNMJ輪郭閾値およびそのような「李」としてより許容閾値として「瞬間」、および「黄」のような、より制限しきい値を使用します。画像は背景なしに少しと非常にシャープである場合、それ以外のシナプスの部分は画像分割後に欠落している可能性があります。NMJアウトラインしきい値「と「黄」を使用。
- 例えば、 図5Bを参照してください。シナプスの適切なセグメンテーションは、緑色のボックスで強調表示された自動閾値とが得られます。非適切な閾値の幾つかの例は、(高倍率でシナプスをチェック)赤枠で強調されています。後者では、シナプスのいずれかの部分が欠落しているまたは背景の部分が含まれます。詳細については、23を参照してください。
- 小粒子の最大サイズを決定します
注:この機能は、分析から「小さな粒子の設定」で定義された値よりも小さいNMJのアウトラインしきい値とスケルトンのしきい値によって検出された全ての粒子を除外します。この値は、ピクセル単位で定義されています。この関数は、ノイズフィルタとして機能し、(例えば結晶/粉塵のような)不均一なバックグラウンドの高い速度が得られた画像中に存在する場合に非常に有用です。- ステップ6.2.6で保存したZ-突起を開きます。そして、設定分析を経て、画素数を検出するためのスケール|セットのスケール。以下の設定を適用する:距離をピクセル単位= 1、既知の距離= 1、画素アスペクト比= 1、長さ=画素を押して「OK」のユニット。ツールバーの「楕円選択」ツールをクリックします。
- マウスを使用すると密接に免疫染色に存在するが、NMJに属していない単一の粒子を囲む選択範囲を描画します。 MacユーザーのためのWindowsユーザーまたはCMD + mに対してCtrlキーを押し+ mを。結果ウィンドウは、画素の数で選択された粒子の領域を示す、開きます。
- 最大の汚染粒子/アーチファクト領域を決定する画像内に存在するいくつかのアーティファクトで、前のステップを数回繰り返します。これは、後にマクロを実行すると、設定に設定する値になります。最小粒子径観察膿のような「小粒子サイズ」は25%のマージンを設定するマクロを実行する場合。
- 例えば、図5Dを参照してください。最大の結晶検出edは112個のピクセルの面積を有しています。 「小粒子サイズ」設定、マクロでこの画像を処理する場合、to125設定されるべきである - 150。
- 最小ブトンサイズを決定
注:この機能は、分析から定義された値よりも小さいNMJアウトラインしきい値によって検出されたすべての終末を除外します。この値は、ピクセル単位で定義されています。- セクション6.4に記載したのと同じ手順に従うが、この場合にNMJ端末内に存在する最小終末を囲む選択を描きます。測定されたものの中で最小ブトンに対応する最小のエリアを選択してください。これは、後にマクロを実行する場合の最小ブートンサイズ設定に設定する値です。
- 定義値「の最大値のノイズ耐性を探します」
- セクション6.2.1で選択されたZ-hyperstacksを使用してください。
- ツールバーで、[イメージ|色|クレアへのスプリットチャンネルTE(チャネル1とチャネル2のための)2つのスタックとBRPチャネルオープンに対応する画像を保ちます。それを閉じることで、他のチャンネルの画像を破棄します。
- プロセスを選択し、ポップアップメニューでプラグイン]タブに移動します|最大(3D)、およびmaximum_image_nameは(数分を取ることができます)表示されたときに、元の画像のスタックを閉じます。
- |最大...イメージ名(取得した画像スタック)を選択し、プラグインを選択プロセス|最小(3D)、最大...イメージ名のスタックを閉じます。
- ツールバーで、[プロセス|最大値を検索...。新しいウィンドウが「最大値検索...」が開きます。 「...プレビューポイント選択」チェックボックスをクリックして、少し交配として画像に示される50の極大点を設定し、デフォルトのマクロで「ノイズ耐性」ボックスを埋めます。
- であり、アクティブなゾーンの上にはない注釈付きのアクティブなゾーン、 すなわち十字架の過剰を観察する場合は、「ノイズ耐性」値を増やしバックグラウンドで検出され選択されたスタック・プレーン、または偽の活性領域に焦点を当てます。
- 一方、不完全注釈付きのアクティブゾーンを観察する場合、「ノイズ耐性」の値を下げ、認識ラベル付けされていない焦点にアクティブなゾーン、すなわち 。十字架が適切にフォーカスでのアクティブゾーンをラベル付けされてまで、この手順を以下に異なる値を試してください。この値を持つ「検索最大値のノイズ耐性」を記入してください。
- 例えば、 図5Cを参照してください。あまりにも多くのアクティブゾーンが検出されています。 図5Cに」焦点でのみアクティブゾーンが検出されます。
- であり、アクティブなゾーンの上にはない注釈付きのアクティブなゾーン、 すなわち十字架の過剰を観察する場合は、「ノイズ耐性」値を増やしバックグラウンドで検出され選択されたスタック・プレーン、または偽の活性領域に焦点を当てます。
- すべての前のステップで定義された設定を用いて、ステップ5.1で選択された代表的な画像は、「分析」サブマクロを実行します。
- 下側及び上側しきい値BRP-涙点を調整します
- 新しいファイルはメートルを実行した後に表示されることになることに注意してください2_active_zone_stack_image_nameと呼ばれる6.6のステップに従っアクロ。この画像では、各平面において白丸で示されている「最大値を探す」機能により検出された活性領域をスタック。
- ツールバーと選択画像にそれをドラッグアンドドロップすることで、このファイルを開きます|スタック| Zproject |投射型=合計スライス。 2_active_zone_stack_image_nameの投影が得られるであろう。
- 選択画像|調整|しきい値。新しいウィンドウ「しきい値」を開きます。全ての所望の病巣/ BRP陽性スポットが赤色で可視化され、閾値を選択する上部バーをスライド。
注:しきい値の設定が低すぎると、アクティブなゾーンの過剰がカウントされます。設定が高すぎる場合は、アクティブなゾーンの割合を逃したことになります。- 例えば、図5Eを参照してください。閾値が400に設定されている場合、それらは赤色( 図5で強調表示されないので、(1つの画素病巣として象徴)活性領域の大部分は、セグメントに含まれていませんE)。閾値は50の値に設定されている場合、すべてのアクティブなゾーンが赤色( 図5E」)で強調されています。
- 最小しきい値として、この値を定義します。最大値の「上限涙点のしきい値を」のままにしておきます。
- サブマクロこのセクションのすべての前のステップで定義された設定を持つ代表的な画像は、「分析」を再実行します。批判的に結果の画像ファイルを評価し、セグメント化が適切に行われていることを確認します。そうでない場合、セグメンテーションエラー( 図4、 表3)の性質に応じて設定を再調整します。
結果
テキスト結果ファイルは、メインディレクトリに表示されます。これは、画像ごとに、すべての測定されたパラメータをまとめたもの。結果は、ファイル名にリンクされ、パラメータが続いて表1および表2に示された順序にまとめます。
Res_image_nameは、三画像スタックです。最初の画像は、チャンネル1(はDlg-1、HRP、SYT、又はCspとの免疫標識)に基づいて、マクロによって決定NMJ端末の概要および骨格を強調する。第二の画像は、第1の画像のコピーであり、さらに図式病巣としてチャネル2で検出された識別されたBRP陽性スポットを示しています。第三の画像は、識別されたBRP陽性病巣と共に第2チャンネルの最大投影を提供します。
NMJ輪郭閾値は、マクロ出力結果画像において黄色で表されています。 NMJ面積、ペリム島ETERと終末の数がこのしきい値から推定されています。
NMJ骨格閾値は、マクロ出力結果画像に青色で示されています。 NMJ長、最長枝の長さ、枝の数は、分岐点と島々がこのしきい値から推定されています。
NMJアクティブゾーン閾値は、マクロ出力結果の画像で表現されていません。このしきい値はBRP陽性病巣は、潜在的にマクロが遭遇することができるエリアを決定します。 NMJアウトラインしきい値によって定義されたものよりも少し大きいNMJ領域を作成するためのものです。あまりにも制限スレッショルドを選択した場合、シナプスの余白に位置BRP-陽性病巣を除外することができます。閾値があまりにも寛容である場合、バックグラウンドノイズは、BRP-陽性スポット( - 2図1)としてカウントすることができます。
VALIDAへTE「 ショウジョウバエ NMJ形態計測」マクロの性能は、既に異なるパラメータNMJにおけるシナプスの欠陥を提示するために記載された3つの変異条件を試験しました。各欠陥は、マクロ(NMJの概要、それぞれ17骨格又はアクティブゾーン)によって実行される異なる画像分割手順によって検出しました。誘導性RNAiにより関心の三つの遺伝子を標的とし、解剖し、L3幼虫のNMJ免疫染色を行った後、マクロを実行しました。得られたNMJの形態学的測定値は、次に、(その制御対のRNAi)ペアワイズたt-検定を用いて比較しました。すべての3つのケースでは、統計的な差は以前に報告された形態学的欠陥と一致しているパラメータに影響を与える変異体とコントロールの間に見られました。これは、マクロが実際に適切にショウジョウバエ NMJで、前述の欠陥を識別することができることを確認しています。
アンキリン 2(Ank2、CG42734)変異体を融合終末小さいのNMJを含むシナプスの形態の欠陥を示すことが知られています。これらの欠陥はAnk2突然変異体24、25のために認められたとAnk2ノックダウンは26を飛びます。汎神経Ank2-のRNAiノックダウンハエ(; UAS-ダイサー-2 / UAS-Ank2のRNAi KK107238; W ELAV-GAL4 / +)のNMJ端子は、t検定P = 2.18有意に小さいNMJ面積(339.25 平方 μm=平均値を示しました×10 -8)と周囲(平均= 238.24ミクロン; t検定P = 1.82×10 -3)、W遺伝的背景の制御データ(と比較し; UAS-ダイサー-2 / UAS-KK60100; ELAV-GAL4 / + ()= 451.95μmの2を意味し、 " ショウジョウバエ NMJ形態計測"( 図6Aおよび図4B)を実行した後)は、それぞれ、= 288.62ミクロンを意味します。
GTPアーゼRAB3(CG7576)は、適切なbruchpilot分布のために必要とされるとRUP変異体は、活性領域27の有意に減少した数を呈します。 UAS-ダイサー-2 / UAS-RNAiをKK100787;パン-神経RAB3ノックダウンハエ(WのNMJ端子における「 ショウジョウバエ NMJ形態計測」マクロによってBRP陽性病巣を測定する際にアクティブなゾーンの数の有意な減少が観察されたELAV -Gal4)。 RAB3 -RNAiにおけるNMJ端末当たりの活性領域の平均数は、制御データ(/ +)t検定Pで検出290 = 4.43×10 -29)( 図6Aおよび4C)とは対照的に、138でした。
Highwire(HIW、CG32592)はNMJ増殖の重要な調節因子です。 NMJ端末28の分岐を過剰に増殖し、拡張するHIW遺伝子の変異リード。 U;パン-神経HIW -RNAiノックダウン線(WのNMJ端子を測定; AS-ダイサー-2 / UAS-のRNAi GD36085 " ショウジョウバエ NMJ形態計測"とELAV-GAL4 / +)、有意差は骨格由来のパラメータにおいて観察された:長さ(= 147.36μmの平均、平均値= 122.07μmの制御; Tコントロール平均= 105.65ミクロン;検定P = 7.31は、10 -7)、最長の分岐の長さは(= 122.19μmの平均X t検定P = 4.62×10 -4)枝(= 7.69平均数、平均対照= 5.74。 t検定P = 2.52×10 -2)と分岐点(= 2.73平均数、平均対照= 1.79; t検定P = 3.31×10 -2)。これら全てのパラメータは有意に増加した(120から180パーセント)の遺伝的バックグラウンド対照と比較して(W; UAS-ダイサー-2 / UAS-GD60000; ELAV-GAL4 / +)( 図6A及び図4D)。
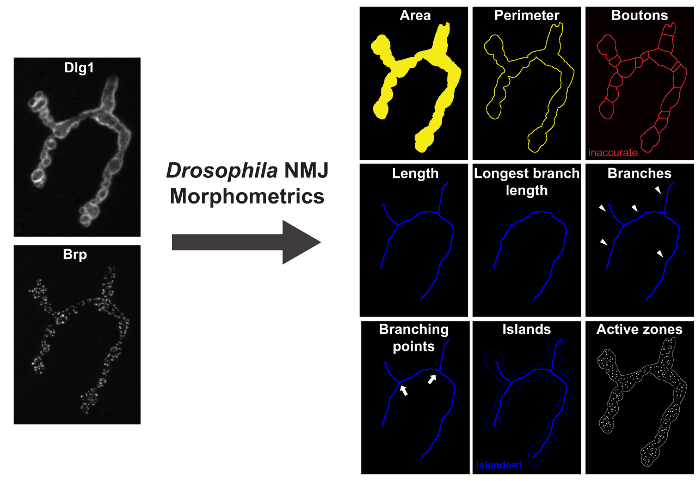
図1: ショウジョウバエ _NMJ_MorphometricsはDrosophiの9のパラメータを測定しますラNMJ。左側にはDlg-1およびBRPはApoTomeと蛍光顕微鏡で撮像されたNMJの端子を、免疫標識されています。右側には「 ショウジョウバエ NMJ形態計測」を実行した後に結果画像です。パラメータ領域、境界及び終末を示すマクロ注釈付き黄色のアウトラインによって表されます。パラメータの長さは、最長の枝の長さ(LBL)、枝、分岐点、そして島々は、マクロ注釈付き青のアウトラインが提示されています。 BRP-免疫標識病巣(活性領域)は、結果画像における白いスポットとしてマクロによって表されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2: ショウジョウバエ NMJブトン形態計測は、 ショウジョウバエ NMJの8つのパラメータを測定します。左にSYT-1およびBRPはApoTomeと蛍光顕微鏡で撮像され、NMJ端子を免疫標識されています。右側には「 ショウジョウバエ NMJブトン形態計測」を実行した後に結果画像です。パラメータの終末とブトン領域は、マクロ注釈付きの黄色の輪郭で表されます。パラメータの長さは、最長の枝の長さ(LBL)、枝、分岐点、そして島々は、マクロ注釈付き青のアウトラインが提示されています。 BRP-免疫標識病巣(活性領域)は、結果画像における白いスポットとしてマクロによって表されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
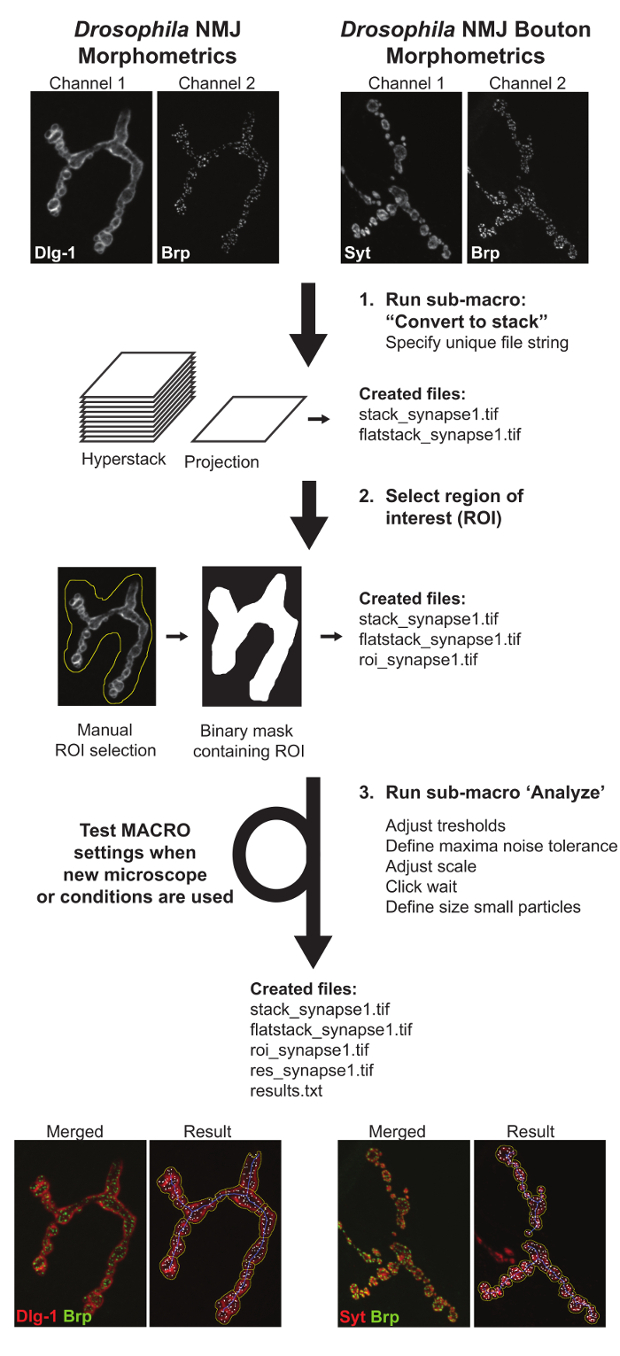
図3: ショウジョウバエ NMJ形態計測およびショウジョウバエ NMJブトン形態計測マクロを示すフローチャート。最初のサブマクロ「変換Tスタックoは」撮像さのNMJの突起とhyperstacksを作成する。第2のサブマクロ 『ROIの定義』関心のNMJ端末の位置を規定する手動入力を必要とする。三つのサブマクロ 『』分析、すべてのNMJのパラメータを測定する。テキスト定量値とパラメータ描写を描いた結果画像ファイルを含むファイルは、マクロパフォーマンスのユーザの評価を支援するために作成されている。画像は異なる条件で取得された場合は、マクロ設定をテストし、正確な分析を確保するために調整する必要があります。 こちらをクリックしてください。この図の拡大版を表示します。
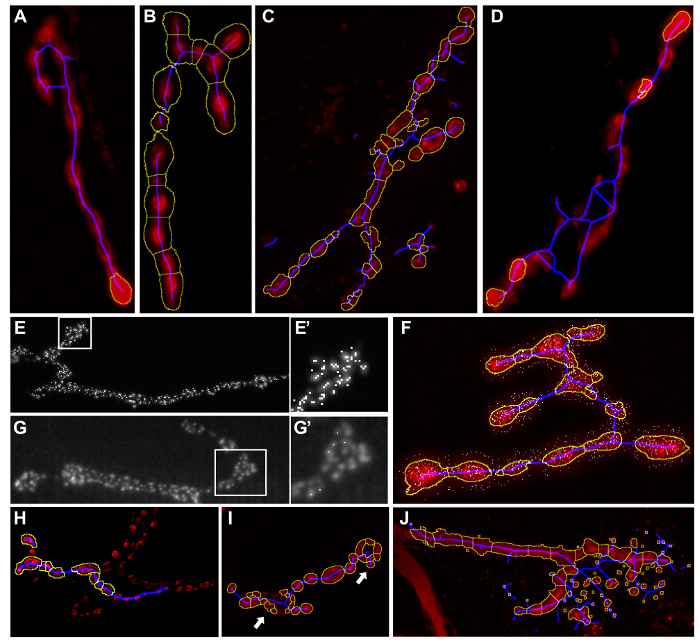
図4:不適切なマクロセグメンテーション結果の例。 「 ショウジョウバエ NMJ Morphometrを実行した後の結果画像ICS」または『 ショウジョウバエ NMJブートン形態計測は、』。シナプス末端の部分は黄色のアウトライン(A)には含まれない。背景の一部が黄色のアウトライン(B)によってシナプス端末に含まれている。ブルースケルトン線を越えて延びていますシナプス末端(C - D)。あまりにも多くの活性領域が検出された(E - E「)。(いくつかの活性ゾーンは分析G - G)によって検出されないまま」アクティブゾーンがシナプス(F)の外側で検出された不正ブートンセグメンテーション( ショウジョウバエ NMJブトン形態計測を実行している場合にのみ適用可能)は、終末が(H)で失われるか、あまりにも多くの終末は、セグメンテーション(I)によって検出される。セグメントに含まれている背景の一部である粒子ような結晶やダスト(J) 。これらのエラーを回避するための設定を変更する方法については、表3に提供されています栄。 この図の拡大版をご覧になるにはこちらをクリックしてください。
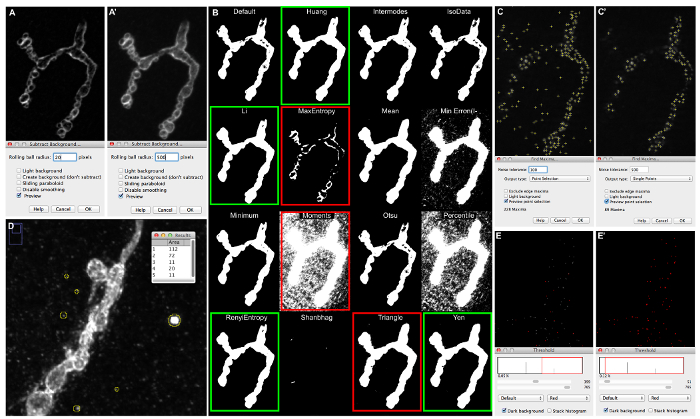
図5:マクロ設定の調整と画像セグメンテーションのための彼らの結果の例。 "ローリングボールの半径が" 20(A)又は500(A」)に設定されている場合(A)、ApoTomeと蛍光顕微鏡で撮像さはDlg-1免疫標識シナプスの背景プレビューを引きます。 (B)出力イメージを実行した後に得られた画像|調整|自動しきい値| 16種類の自動閾値アルゴリズムによって得られた画像のセグメンテーションを示し、すべての画像を試みます。 (C)50(C)及び500(C」)の「ノイズ耐性」を設定するとき、プレビュー「最大値を探します」。交流セグメンテーションによって検出されるTIVEゾーンは、小さな十字で標識されます。 (D)共焦点顕微鏡で画像化された抗HRPで免疫シナプスの画像の背景に現れる「小粒子」の測定。 2_active_zone_stack_ima-ge_nameから得られた(E) "合計スライス"投影。閾値は、400(E)に、50(E」)に設定されています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
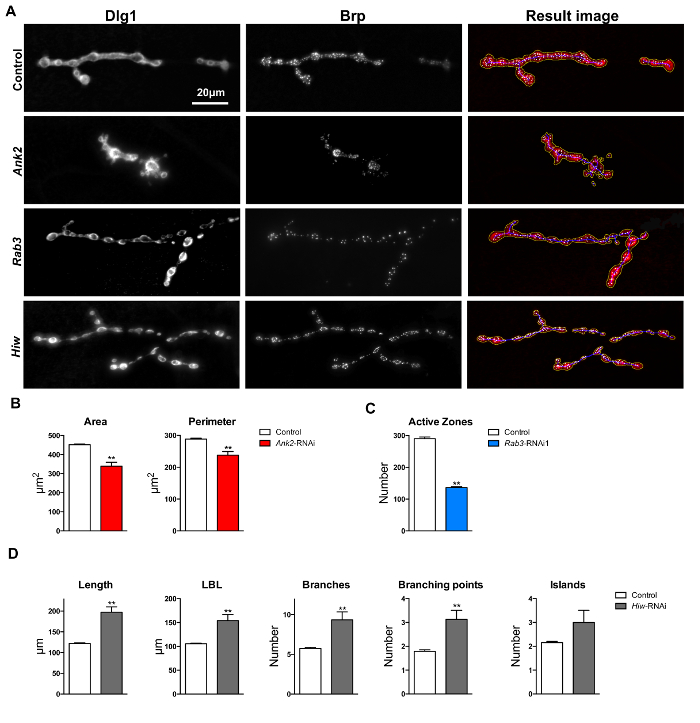
図6:マッスル4(A)上のNMJのマクロ評価および定量化はDlg-1およびBRPの「 ショウジョウバエ NMJ形態計測」マクロを実行した後の画像を結果はNMJ端子を免疫標識。パラメータ領域、境界線とブトンSは、マクロ注釈付きの黄色の輪郭で表されます。パラメータの長さは、最長の枝の長さ(LBL)、枝、分岐点、そして島々は、マクロ注釈付き青のアウトラインが提示されています。 BRP-免疫標識病巣(活性領域)は、結果画像における白いスポットとしてマクロによって表されます。スケールバーは20μmで示しています。 (B)の遺伝的バックグラウンド対照と比較Ankyrin2のRNAiノックダウン展示小さいNMJ面積と周囲長。 (C)RAB3ノックダウンは、遺伝的バックグラウンド対照と比較してBRP-正極活ゾーンの低い数とのNMJをもたらしました。 (D)Highwireノックダウンは、より多くの分枝および遺伝的バックグラウンドコントロールのNMJと比較して、NMJ端末当たりより多くの分岐点でより高い最長枝の長さは、長いをもたらしました。エラーバーは、SEMを示す** P <0.01、2両側t検定。 彼をクリックしてくださいこの図の拡大版を表示するために再。
| パラメーター | NMJ構造 | 説明 |
| エリア(μm2で) | NMJ概要 | 完全なラベルされたNMJのエリア |
| 境界(ミクロン) | NMJ概要 | エリアに属する境界線 |
| #Boutons | NMJ概要 | NMJのシナプス終末の数(「文字列の真珠」) |
| 長さ(μm)と | スケルトン | 完全なNMJ端子の全長 |
| 最長の枝の長さ(μm)と | スケルトン | NMJの任意の2つのエンドポイントを結ぶ連続最長パスの長さの和 |
| #ブランチES | スケルトン | 枝の総数 |
| #Branchingポイント | スケルトン | 分岐点の数は、(複数のブランチは、一つの分岐点から導出することができます) |
| #Islands | スケルトン | 非接続DLG1陽性シナプス区画の数(または任意の他の染色) |
| #Activeゾーン | BRP-陽性スポット | BRP染色に基づいて、アクティブなゾーンの数、 |
表1:「 ショウジョウバエ NMJ形態計測」により測定NMJパラメータ。 「 ショウジョウバエ NMJ形態計測」マクロで測定しNMJのパラメータは、この表で説明する順序を以下、取得したテキストファイル内のリストとして表示されます。このテーブルはNijhof らから転載されています。 17
キープtogether.withinページ
| パラメーター | NMJ構造 | 説明 |
| 終末 | NMJ概要 | NMJのシナプス終末の数(「文字列の真珠」) |
| ブトンエリア | NMJ概要 | すべての終末の総面積 |
| 長さ(μm)と | スケルトン | 完全なNMJ端子の全長 |
| 最長の枝の長さ(μm)と | スケルトン | NMJの任意の2つのエンドポイントを結ぶ連続最長パスの長さの和 |
| #Branches | スケルトン | 枝の総数 |
| #Branchingポイント | スケルトン | 目分岐点の電子の数が(いくつかの枝は、一つの分岐点から導出することができます) |
| #Islands | スケルトン | 非接続DLG1陽性シナプス区画の数(または任意の他の染色) |
| #Activeゾーン | BRP-陽性スポット | BRP染色に基づいて、アクティブなゾーンの数、 |
表2:「 ショウジョウバエ NMJブトン形態計測」により測定NMJパラメータ。 「 ショウジョウバエ _Bouton_NMJ_Morphometrics」マクロで測定しNMJのパラメータは、この表で説明する順序を以下、取得したテキストファイル内のリストとして表示されます。このテーブルはNijhof らから転載されています。 17
| セグメンテーション | 観測エラー | 例 | 必要な調整 | |
| (結果画像において黄色のアウトラインによって表される)NMJ面積と周囲長 | シナプス末端の部分は、いずれかの黄色のアウトラインに含まれていない、または背景の部分は黄色で概説シナプス端末に含まれています。 | 図5A-B | 「ローリングボール半径」の値を調整します。 6.1節を参照してください。 | 「NMJアウトラインしきい値」を調整します。セクション6.2を参照してください。 |
| NMJの長さに関連するパラメータ(結果画像における青骨格線によって表されます) | ブルー骨格線は越えて伸びるか、全体のシナプスの端末に沿って存在していないのいずれか。 | 図5C-D | 「ローリングボール半径」の値を調整します。 6.1節を参照してください。 | 「NMJアウトラインしきい値」を調整します。セクション6.2を参照してください。 |
| (結果画像のドットにより表される)BRP陽性涙点 | あまりにも多くのアクティブゾーンが検出されています。 | 図5E-E」 | 「最大値のノイズ耐性を探す」の値を減らします。セクション6.5を参照してください。 | |
| (結果画像のドットにより表される)BRP陽性涙点 | アクティブゾーンは分析によって失われます。 | 図5G、G」 | 「最大値のノイズ耐性を探す」の値を増やします。セクション6.5を参照してください。 | 「BRP-涙点より低いしきい値」を下げます。 6.6節を参照してください。 |
| (結果画像のドットにより表される)BRP陽性涙点 | アクティブゾーンの成果物は、シナプスターミナルの外で検出されています。 | 図5F | 「アクティブゾーンしきい値」のセクション6.2を調整します。 | 「BRP-涙点より低いしきい値」を増やします。 6.6節を参照してください。 |
| 小さな粒子 | 背景の一部である結晶または埃このような粒子は、セグメントに含まれるように見えます。 | 図5J | 「小さな粒子を削除]ボックスを選択します。 6.3節を参照してください。 | 小さな粒子に最大サイズを決定します。 6.3節を参照してください。 |
| ブトンセグメンテーション | 誤ったブトンセグメンテーション(ショウジョウバエNMJブトン形態計測にのみ適用され、ブトンセグメンテーションのためのショウジョウバエNMJ形態計測を使用しないでください)。 | 図5H-I | 「NMJアウトラインしきい値」を調整します。 6.1節を参照してください。 | 「最小のブトンサイズ」を決定します。 6.4節を参照してください。 |
表3:マクロによって製造することができる画像セグメンテーションにおけるエラーの種類ごとにガイドのトラブルシューティング。この表は、異なる種類の説明しますマクロによって生成された画像セグメンテーションエラー。これらは、簡単に結果画像で検出することができます。各エラータイプの例は、 図4に示されています。表の「調整部」に、調整する必要がある設定が強調表示され、ユーザはこれらの設定を調整する方法について説明セクション6の臨界サブステップ、と呼ばれます。
ディスカッション
「 ショウジョウバエ NMJ形態計測」と「 ショウジョウバエ NMJブトン形態計測は、」シナプスの形態を評価することに興味を持って研究者のための強力なツールです。 NMJのパラメータの手動評価は面倒です。それはマクロが15分に経験豊富な研究者を救うであろうと推定されている/ NMJは、手動画像セグメンテーションに費やしました。条件または遺伝子型ごとに評価したシナプスの1〜2ダースで、これはすぐにでも小規模の研究では、保存された時間のかなりの量を合計します。大画面を行う場合、手動評価および定量化に比べ、ハイスループット分析を使用しての利得は、巨大であり得ます。スループットの向上に加えて、マクロが容易に客観的な分析を提供すること。彼らは、そうでない場合は盲目の実験と同様に、複数の研究者が分析に関与しているときに発生する対人の違いを必要とする個人的な偏見を除外します。最後に、マクロは敏感かつ正確なANを提供します劇的なNMJ欠陥よりもむしろ微妙な原因と、これまで研究者の目によって正しく評価されていない残っているシナプス制御因子の同定を可能にするNMJの機能のalysis、。検証手順およびマクロに利用するアルゴリズムについての詳細な情報は、パブリケーションNijhof らに見出されます。 17。
マクロの機能が適切に引き続き筋肉4.でキイロショウジョウバエのNMJの形態学的特徴を測定することが確認されている、それはマクロもこの生物において他の筋肉でシナプスを分析するのに適したことが示されました。マクロは、他のショウジョウバエの種、さらに昆虫を含む他の種で同様の構造を持つNMJの形態学的パラメータを測定するために使用することができる可能性が高いです。進化では非常に遠くでものNMJ、 例えば、マウスののNMJは、非常に似た構造の立体構造29を示し、。マクロは、他の種からのNMJの準備でテストされていないが、潜在的なユーザーは、このような目的のためにマクロをテストすることをお勧めします。
ユーザーが画像に適したマクロ設定を選択/定義するためにさまざまな自動しきい値とアルゴリズムを探ることが非常に重要です。マクロ評価は手動評価と比較した場合、これらの設定で、約95%の精度が達成されます。適切に画像のセグメント100%が非常に面倒又は不可能でさえ処置することができるマクロ設定を調整します。その数は5%以下である場合はそのため、適切にセグメント化されていない画像の排除が推奨されます。画像の品質が低い場合には明らかに、マクロが不十分な画像セグメンテーションのより高い比率を生成します。低品質の画像は、同様に手動評価に影響を与えることになるので、マクロのパフォーマンスにリンクすることはできません。彼らは画像のために設計されたとしてもかかわらずマクロはかなり頑丈です高含量顕微鏡17(多数のサンプルのイメージングを可能にする自動化蛍光顕微鏡)で生成されたS。
重要な点は、ユーザーが視覚的にマクロによって生成されたすべての結果の画像を検査ということです。これは不満足なセグメンテーションと一緒に写真を検出して排除することができます。このプロトコルのセクション6において、ユーザは、「分析」サブマクロを実行するときに正しい画像セグメンテーションのための設定を調整する方法を案内されます。すぐにマクロの要件とどのようにマクロの設定「マクロの設定をExamples_adjusting」というフォルダを調整することで理解するには、マクロリポジトリhttps://figshare.com/s/ec634918c027f62f7f2aに含まれています。サーティーンサブフォルダ、異なる顕微鏡プラットフォーム(高含有量/共焦点/蛍光顕微鏡)と異なる免疫染色で得られた実施例の画像とのそれぞれが、設けられています。 「例のガイド」と題されたPDFを同じに含まれています各実施例に必要な設定が期待結果と結果の画像を提供するテキストドキュメントとともに提供されるフォルダー。
マクロが.TIFFファイルを分けて保存された画像を処理するように設計された、それにもかかわらず、一部のユーザーは、さまざまな形式で自分の画像を保存している場合があります。ドキュメントのマクロに画像をインポートする方法の詳細な手順で「例ガイド」 -以下のウェブサイトhttps://figshare.com/s/ec634918c027f62f7f2a 21は、3つのサンプルファイル(3例1)「 ショウジョウバエ NMJ」という名前のフォルダが含まれています.TIFF分離したファイルとして保存されていない場合も、同じフォルダに格納されています。
NMJ面積、NMJ周囲長、終末の数、NMJのブトンエリア、NMJ長、NMJ最長支店長、イスラの数:一緒に、「 ショウジョウバエ NMJ形態計測」と「 ショウジョウバエ NMJブトン形態計測」マクロは10種類のNMJの機能を定量化NDS、分岐の数、分岐点の数とアクティブなゾーンの数。これは、1つまたは少数のシナプス機能30、31を評価することができ、これまでに利用可能なツール上で大きな利点を提供します。マルチパラメトリック定量分析は、シナプスの生物学の多くの側面までの1を制御する新たな規制当局を特定するために、例えば 、新たな発見のための大きな可能性を負いません。それはまた、全く同じ又は重複NMJ機能をcoregulate、したがって共通の分子経路で動作する可能性がある遺伝子を決定するために必要な解像度を提供します。最後に、シナプスのパラメータは、遺伝子は、このような協調形態学的相関を確保邪魔されずに条件17とで相互に関連付ける方法を異なる調査する可能性を開きます。
まとめると、このプロトコルは、「 ショウジョウバエ NMJ形態計測」二つのマクロを使用する方法を説明し、ハイスループット様式で10の形態素NMJ機能の客観的かつ高感度定量を行う「 ショウジョウバエ NMJブートン形態計測」、。
開示事項
著者は、開示する利害の衝突を持っていません。
謝辞
我々はショウジョウバエ株を提供するためのウィーンショウジョウバエリソースセンターとブルーミントンショウジョウバエストック・センター(NIH P40OD018537)を認めます。私たちは、イメージングの専門家支援のための顕微鏡的イメージングセンターからジャック・フランセン感謝します。この研究は、ドイツの精神遅滞のネットワークにより、2 DCN /ラートボウト大学医療センターの博士フェローシップによって、VIDIおよび科学研究費オランダ機構(NWO)からTOP助成金(917-96-346、912-12-109)によってサポートされていました教育研究(BMBF)のドイツ連邦環境省のNGFN +プログラムによっておよびASへの欧州連合(EU)のFP7の大規模な統合ネットワークGencodys(HEALTH-241995)によって資金を供給。資金提供者は、研究デザイン、データの収集と分析、公表することを決定、または原稿の準備で何の役割を持っていました。
資料
| Name | Company | Catalog Number | Comments |
| Immunostaining | Dilution | ||
| Mouse anti-discs large 1 | Developmental Studies Hybridoma Bank | AFFN-DLG1-4D6 | 1/25 (conjungated using the Zenon Alexa Fluor 528 Labeling Kit) |
| Rabbit anti-horseradish peroxidase | Jackson IR | 323-005-021 | 1/500 |
| Rabbit anti-Synaptotagmin | Gift from Hugo Bellen | Jan-00 | |
| Mouse anti-Cysteine string protein | Developmental Studies Hybridoma Bank | DCSP-1(ab49) | 1/10 (conjungated using the Zenon Alexa Fluor 528 Labeling Kit) |
| Mouse anti-Bruchpilot | Developmental Studies Hybridoma Bank | nc82 | Jan-50 |
| Goat anti-mouse Alexa Fluor 488 | Life technologies | A11029 | 1/200 |
| Goat anti-rabbit Alexa Fluor 568 | Life technologies | A11011 | 1/500 |
| Zenon Alexa Fluor 568 Mouse IgG1 Labeling Kit | ThermoFisher | Z25006 | |
| ProLong Gold Antifade Mountant | ThermoFisher | P36930 | |
| Material | Company | Catalog number | Comments |
| Equipment | |||
| Confocal microscope or fluorescence microscope | Leica SP5 | ||
| Zeiss Axio imager | |||
| Computer | Mac or Pc | ||
| Material | Company | Catalog number | Comments |
| Software | |||
| FIJI |
参考文献
- Lin, Y. C., Koleske, A. J. Mechanisms of synapse and dendrite maintenance and their disruption in psychiatric and neurodegenerative disorders. Annu Rev Neurosci. 33, 349-378 (2010).
- van Bokhoven, H. Genetic and epigenetic networks in intellectual disabilities. Annu Rev Genet. 45, 81-104 (2011).
- Penzes, P., Buonanno, A., Passafaro, M., Sala, C., Sweet, R. A. Developmental vulnerability of synapses and circuits associated with neuropsychiatric disorders. J Neurochem. 126, 165-182 (2013).
- Mainen, Z. F., Sejnowski, T. J. Influence of dendritic structure on firing pattern in model neocortical neurons. Nature. 382, 363-366 (1996).
- Yuste, R., Majewska, A., Holthoff, K. From form to function: calcium compartmentalization in dendritic spines. Nat Neurosci. 3, 653-659 (2000).
- Vetter, P., Roth, A., Hausser, M. Propagation of action potentials in dendrites depends on dendritic morphology. J Neurophysiol. 85, 926-937 (2001).
- Bosch, M., Hayashi, Y. Structural plasticity of dendritic spines. Curr Opin Neurobiol. 22, 383-388 (2012).
- Mehnert, K. I., Cantera, R. Circadian rhythms in the morphology of neurons in Drosophila. Cell Tissue Res. 344, 381-389 (2011).
- Sigrist, S. J., Reiff, D. F., Thiel, P. R., Steinert, J. R., Schuster, C. M. Experience-dependent strengthening of Drosophila neuromuscular junctions. J Neurosci. 23, 6546-6556 (2003).
- Ruiz-Canada, C., Budnik, V. Introduction on the use of the Drosophila embryonic/larval neuromuscular junction as a model system to study synapse development and function, and a brief summary of pathfinding and target recognition. Int Rev Neurobiol. 75, 1-31 (2006).
- Menon, K. P., Carrillo, R. A., Zinn, K. Development and plasticity of the Drosophila larval neuromuscular junction. Wiley Interdiscip Rev Dev Biol. 2, 647-670 (2013).
- Kraut, R., Menon, K., Zinn, K. A gain-of-function screen for genes controlling motor axon guidance and synaptogenesis in Drosophila. Curr Biol. 11, 417-430 (2001).
- Parnas, D., Haghighi, A. P., Fetter, R. D., Kim, S. W., Goodman, C. S. Regulation of postsynaptic structure and protein localization by the Rho-type guanine nucleotide exchange factor dPix. Neuron. 32, 415-424 (2001).
- Eaton, B. A., Fetter, R. D., Davis, G. W. Dynactin is necessary for synapse stabilization. Neuron. 34, 729-741 (2002).
- Laviolette, M. J., Nunes, P., Peyre, J. B., Aigaki, T., Stewart, B. A. A genetic screen for suppressors of Drosophila NSF2 neuromuscular junction overgrowth. Genetics. 170, 779-792 (2005).
- Collins, C. A., Wairkar, Y. P., Johnson, S. L., DiAntonio, A. Highwire restrains synaptic growth by attenuating a MAP kinase signal. Neuron. 51, 57-69 (2006).
- Nijhof, B., et al. A New Fiji-Based Algorithm That Systematically Quantifies Nine Synaptic Parameters Provides Insights into Drosophila NMJ Morphometry. PLoS Comput Biol. 12, e1004823(2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9, 676-682 (2012).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Dubos, A., et al. Conditional depletion of intellectual disability and Parkinsonism candidate gene ATP6AP2 in fly and mouse induces cognitive impairment and neurodegeneration. Hum Mol Genet. 24, 6736-6755 (2015).
- Nijhof, B., et al. Drosophila NMJ Morphometrics. , figshare https://doi.org/10.6084/m9.figshare.2077399. (2017).
- Ferreira, T., Rasband, W. ImageJ User Guide IJ 1.46. , http://rsbweb.nih.gov/ij/docs/guide/146-29.html (2014).
- Ferreira, T., Rasband, W. ImageJ User Guide IJ 1.46. , Available from: http://fiji.sc/Auto_Threshold (2014).
- Pielage, J., et al. A presynaptic giant ankyrin stabilizes the NMJ through regulation of presynaptic microtubules and transsynaptic cell adhesion. Neuron. 58, 195-209 (2008).
- Koch, I., et al. Drosophila ankyrin 2 is required for synaptic stability. Neuron. 58, 210-222 (2008).
- Iqbal, Z., et al. Homozygous and heterozygous disruptions of ANK3: at the crossroads of neurodevelopmental and psychiatric disorders. Hum Mol Genet. 22, 1960-1970 (2013).
- Prokop, A. Organization of the efferent system and structure of neuromuscular junctions in Drosophila. Int Rev Neurobiol. 75, 71-90 (2006).
- Wan, H. I., et al. Highwire regulates synaptic growth in Drosophila. Neuron. 26, 313-329 (2000).
- Shi, L., Fu, A. K., Ip, N. Y. Molecular mechanisms underlying maturation and maintenance of the vertebrate neuromuscular junction. Trends Neurosci. 35, 441-453 (2012).
- Sutcliffe, B., Forero, M. G., Zhu, B., Robinson, I. M., Hidalgo, A. Neuron-type specific functions of DNT1, DNT2 and Spz at the Drosophila neuromuscular junction. PLoS One. 8, e75902(2013).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100(2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved