Method Article
Due Algoritmi per high-throughput e multi-parametrica Quantificazione degli
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Sono stati creati due algoritmi di analisi dell'immagine, "Drosophila NMJ morfometria" e "Drosophila NMJ Bouton morfometria", quantificare automaticamente nove caratteristiche morfologiche della giunzione neuromuscolare Drosophila (NMJ).
Abstract
morfologia sinaptica è strettamente correlata all'efficacia sinaptica, e in molti casi difetti morfologici sinapsi in definitiva portare a malfunzionamenti sinaptica. Larvale Drosophila giunzione neuromuscolare (NMJ), un modello ben consolidato per sinapsi glutammatergica, è stato ampiamente studiato per decenni. Identificazione di mutazioni causano difetti morfologici NMJ rivelato un repertorio di geni che regolano lo sviluppo delle sinapsi e funzione. Molti di questi sono stati identificati in studi su larga scala che si è concentrato su approcci qualitativi per rilevare anomalie morfologiche della Drosophila NMJ. Un inconveniente di analisi qualitative è che molti giocatori sottili che contribuiscono alla morfologia NMJ probabile rimangono inosservati. Considerando analisi quantitative sono necessarie per rilevare le differenze morfologiche sottili, tali analisi non sono ancora comunemente eseguite perché sono laboriose. Questo protocollo descrive in dettaglio due algoritmi di analisi dell'immagine "Drosophila 'Drosophila NMJ Bouton Morfometria', disponibile come macro compatibili Fiji, per l'analisi quantitativa, precisa e oggettiva morfometrica della Drosophila NMJ. Questa metodologia è sviluppato per analizzare terminali NMJ immunolabeled con i marcatori comunemente utilizzati Dlg-1 e . BRP Inoltre, la sua più ampia applicazione ad altri marcatori, come Hrp, Csp e Syt è presentato in questo protocollo Le macro sono in grado di valutare nove caratteristiche NMJ morfologiche:. Area NMJ, perimetro NMJ, numero di boutons, lunghezza NMJ, NMJ più lungo ramo lunghezza, numero di isole, il numero di rami, il numero di punti di ramificazione e il numero di zone attive nel terminale NMJ.
Introduzione
Disturbi cognitivi come la disabilità intellettiva, disturbo dello spettro autistico e la schizofrenia sono spesso caratterizzati da anormale funzione sinaptica 1, 2, 3. Sinapsi morfologia e funzione sono strettamente intrecciati; difetti morfologici possono causare malfunzionamenti sinaptica e, inversamente, trasmissione sinaptica aberrante influenzeranno maturazione sinaptica e morfologia 4, 5, 6.
Un certo numero di organismi modello sono state impiegate al fine di comprendere meglio la biologia delle sinapsi e far luce su come i cambiamenti sinaptici influenzano la funzione del cervello in salute e malattia 7, 8, 9. Drosophila NMJ è un ampiamente studiato e ben stabilito modello in vivo per glutamatergici synapse biologia 10, 11. Negli ultimi decenni, questo modello è stato utilizzato per studi fisiologici e gene-concentrata, così come per gli schermi genetici su larga scala, con lo scopo di rilevare le differenze morfologiche tra NMJs. In particolare, gli schermi genetici in avanti hanno identificato molti regolatori cruciali e meccanismi alla base dello sviluppo sinapsi e funzionamento 12, 13, 14, 15, 16. Tuttavia, la maggior parte di questi schermi invocati valutazione visiva del NMJ morfologia del terminale e sulla determinazione qualitativa delle anomalie sinaptiche o tracciatura semi-quantitativa di alcune caratteristiche morfologiche. Di conseguenza, piuttosto sottili anomalie morfologiche sinaptiche che non sono evidenti per l'occhio umano potrebbero passare facilmente inosservate. Per essere in grado di rilevare completo differenze quantitative, leNMJ deve essere accuratamente valutata quantificando sistematica dei parametri morfologici di interesse. Misurare caratteristiche NMJ manualmente è laboriosa, soprattutto quando ci sono diverse caratteristiche NMJ di interesse e / o durante l'esecuzione di screening genetici su larga scala. Per supportare multiparametrica, high-throughput analisi morfologica e per conseguire quantificazione oggettiva, due macro "Drosophila NMJ morfometria" e "Drosophila NMJ Bouton morfometria" sono stati sviluppati 17. Entrambe le macro vengono eseguite in open source software di analisi di immagine Fiji 18, e possono quantificare entrambe le immagini confocale e nonconfocal.
Misure "Drosophila NMJ morfometria" terminali NMJ immunostained con il disco postsinaptica marcatore larga 1 (Dlg-1) o il presinaptica perossidasi di rafano (HRP), co-etichettati con il marcatore Bruchpilot zona attiva (BPA). Si quantifica nove Parame morfologicaters (descritto di seguito): area NMJ, perimetrali NMJ, numero di boutons, lunghezza giunzioni neuromuscolari, giunzioni neuromuscolari più lunga lunghezza ramo, numero di isole, numero di rami, il numero di punti di ramificazione e il numero di zone attive nel terminale sinaptico (Figura 1) . Anche se è presente un algoritmo per determinare il numero di boutons in questa macro, esso non soddisfa i criteri per la precisione 17. Per valutare correttamente il numero di boutons, è necessario utilizzare la macro "Drosophila NMJ Bouton Morfometria", che è specificamente progettato per quantificare boutons su preparazioni NMJ immunostained da anti-sinaptotagmina (Syt) o della proteina stringa anti-cisteina (CSP), e co-immunolabeled con Brp. La macro "Drosophila NMJ Bouton Morfometria" quantifica i seguenti parametri: numero di boutons, NMJ zona bouton, lunghezza giunzioni neuromuscolari, giunzioni neuromuscolari maggiore lunghezza ramo, il numero di isole, il numero di rami, il numero di punti di ramificazione e il numero di zo attivonna (Figura 2).
Le macro sono costituite da 3 sub-macro: (I) "Convertire a impilare" identifica tutti i file di immagine disponibili e crea Z-hyperstacks e proiezioni di massima intensità di entrambi i canali. Come uscita, questa macro genera due nuovi file ogni sinapsi chiamato "stack_image_name" e "flatstack_image_name". II) "Definire ROI" si aprirà tutte le immagini di proiezione massime "flatstack_image_name" consecutivamente e presentarli con la richiesta di definire manualmente la regione di interesse (ROI) in cui è presente il terminale sinaptico specifico di interesse. Questo è stato realizzato per consentire esclusione delle sinapsi collegano ai muscoli adiacenti e / o altri tipi di terminali sinaptici (come 1s) che possono essere presenti nelle immagini 11. (III) "Analyse" applicato completamente automatizzato analisi per tutte le regioni delle immagini entro i confini della ROI. ComeA seguito di tale fase, l'utente otterrà due nuovi file: "results.txt" dove verrà annotata tutta la misura numerica e un "res_image_name.tif" dove verranno illustrati i segmentazione di immagini sottostanti prodotte dalla macro. Durante l'analisi dell'immagine tre strutture sono derivati da ogni terminale sinaptico: il contorno NMJ, lo scheletro giunzione neuromuscolare, e il numero di zone attive Brp-positivi. Lo schema NMJ viene utilizzato per determinare l'area NMJ e il suo perimetro e una successiva separazione svolta fornisce il numero di boutons. Dallo scheletro, cinque funzioni NMJ si deducono: lunghezza totale NMJ, la somma della lunghezza del percorso continuo lungo collegare i due punti finali (maggiore lunghezza ramo), il numero di scomparti estranee al NMJ (denominate "isole" ), il numero di rami, e il numero di punti di ramificazione (un punto di diramazione collega tre o più rami). Il numero di zone attive è determinato nel Brp canale contandomacchie BRP-positivi. Lo schema annotato NMJ (linea gialla), lo scheletro NMJ (linea blu), e il numero di zone attive Brp-positivi (indicati da foci bianco) vengono visualizzati in un quadro risultati e le misurazioni dei parametri sono trattati per un (. txt) file di output (Figura 3).
Drosophila NMJ Morfometria" e 'Drosophila NMJ Bouton Morfometria' sono stati descritti e ampiamente convalidati da Nijhof et al. 17. Questo manoscritto si concentra sulla metodologia per analizzare NMJ morfologia utilizzando le macro 'Drosophila NMJ morfometria' e 'Drosophila NMJ Bouton morfometria'. Tuttavia, prima di analisi macro-assistita, dissezioni NMJ e immunostainings devono essere eseguiti. Questi sono passi fondamentali, e la combinazione di marcatori utilizzati per immunoistochimica deve essere adatto per analisi macro. Questi passaggi sono brevemente menzionati in séction 1 di questo protocollo e dirigere l'utente a riferimenti che descrivono in dettaglio i protocolli per eseguire queste procedure.
Protocollo
1. Requisiti Prima di Image Processing
- Eseguire Drosophila preparazioni aperta telefonico di terzo stadio vagare larve (L3), come descritto in precedenza 19.
- Co-immunolabel terminali Drosophila NMJ utilizzando una combinazione di due marcatori: Dlg-1 o HRP insieme Brp per l'analisi con "Drosophila NMJ Morfometria", e Syt o Csp insieme Brp per l'analisi con "Drosophila NMJ Bouton Morfometria" 20.
NOTA: Anticorpi delle stesse specie possono essere combinati pre-etichettatura uno con un kit anticorpo-coniugazione come lo Zenon Alexa Labeling Kit 17. - Immagine terminali NMJ usando un microscopio di scelta, per esempio, fluorescenza (con o senza apotome) o microscopia confocale.
- Acquisire un'immagine 2 canali pila del terminale NMJ.
- Regolare le impostazioni del microscopio in modo che il canale 1acquisisce il terminale NMJ immunolabeled con Dlg-1 (o Hrp, Syt, CSP) e il canale 2 il terminale NMJ immunolabeled con Brp.
- Opzionalmente, analizzare le immagini di un canale (di sinapsi immunolabeled con un unico anticorpo) con le macro. NMJs Immagine immunolabeled unico con Dlg-1 o Hrp per l'analisi con "Drosophila NMJ Morfometria", o Syt o Csp per "Drosophila NMJ Bouton Morfometria".
NOTA: Non è possibile analizzare sinapsi immunostained con solo anti-Brp.
- Esportare le immagini ottenute come singoli file TIFF. Invertire l'ordine dei canali prima di eseguire le macro, se non acquisito come indicato.
- Acquisire un'immagine 2 canali pila del terminale NMJ.
2. Requisiti software e installazione
- Scarica le macro: "Drosophila NMJ Morfometria" e "Drosophila NMJ Bouton Morfometria" dal seguente sito web: https://figshare.com/s/ec634918c027f62f7f2a 21.
- Spostare il cursore sulla cartella "update Macro 1", e fare clic sull'opzione che appare "vista". Apparirà un elenco con il contenuto di questa cartella. La cartella contiene le macro "Drosophila NMJ morfometria" e "Drosophila NMJ Bouton morfometria".
NOTA: Entrambe le macro sono compatibili con le versioni 1.4 Fiji, che è prevista anche nella stessa cartella. Le macro potrebbero non funzionare su versioni più recenti. Si prega di utilizzare la versione 1.4 fornito. E 'priva di problemi per iniziare questa versione, anche su computer con una più recente versione disponibile Fiji. - Clicca su "Scarica tutto". Il contenuto della cartella verrà scaricato sul computer come un file .zip. Decomprimere il file scaricato.
- Copiare i file Drosophila _NMJ_Morphometrics.ijm e Drosophila _NMJ_Bouton Morphometrics.ijm alla directory Fiji.app/plugins/. Quando si riavvia il programma, le macro appariranno nella parte inferiore dei pluginmenu a discesa.
3. Esegui Sub-macro "Converti in Stack" Per creare Z-proiezioni e Hyperstacks delle immagini NMJ
- Avviare l'interfaccia grafica selezionando Plugin nella barra degli strumenti e scegli "Drosophila NMJ Morfometria" nel menu a discesa.
- Definire l'impostazione "Unique String File" nella interfaccia grafica della macro.
NOTA: Il software microscopio utilizza una firma di identificazione per organizzare aerei e canali per memorizzare le pile come singoli file TIFF. L'unica impostazione file stringa immesso deve specificare la firma assegnato dal software al primo piano del primo canale (importante: più basso aereo e numero di canale deve essere indicato). - Selezionare solo la sub-macro "Convertire da impilare" e fare clic su "OK" e selezionare la cartella in cui si trovano le immagini. Se si seleziona una directory principale con diverse sottocartelle, tutti i singoli' .tiff file all'internola directory principale e sottocartella corrispondenti ai criteri di stringa di file unico saranno trattati.
- Se z-stack contiene un solo canale, selezionare la casella "Canale solo 1".
- Si noti che due nuovi file immagine NMJ per, per impostazione predefinita definiti come stack_image_name e appariranno flatstack_image_name. Conservare solo questi stack e flatstack per ulteriori analisi. La serie di file TIFF può essere eliminato a questo punto, minimizzando le capacità di conservazione richieste e di evitare possibili fonti di errore.
4. Esegui Sub-macro "Definire ROI" per delineare il Terminal NMJ di interesse
- Avviare l'interfaccia grafica di "Drosophila NMJ Morfometria".
- Selezionare solo la casella di controllo "Definisci ROI" e premere "OK" e selezionare la directory principale in cui le immagini intitolate flatstack_name vengono memorizzate e premere il tasto "Select". Il sub-macro "Definire ROI" cerca automaticamente attraverso tutte le sottocartelleall'interno della directory principale selezionata.
- Come si apre la prima proiezione, selezionare lo strumento "selezione a mano libera" nella barra degli strumenti. Utilizzando il mouse disegnare una selezione che contiene esclusivamente il terminale completo NMJ di interesse e cliccare su "OK" nella finestra "Definisci terminale". La macro procedere con la successiva proiezione.
- Delineare la prossima ROI e ripetere fino a quando tutte le ROI sono definiti. Il file di immagine ROI, denominata "roi_image_name", viene memorizzato nella stessa directory delle immagini dello stack e proiezione generati in precedenza per ciascuna delle immagini elaborate. L'uscita di questo sub-macro è un'immagine binaria del ROI in bianco su sfondo nero.
5. Esegui Sub-macro "Analizza" per quantificare Caratteristiche NMJ Terminal
- Vai alla barra degli strumenti, selezionare "plugins" e l'uso:
"Drosophila _NMJ_Morphometrics" quando si analizzano sinapsi immunolabeled con anti-Dlg-1 o anti-Hrp (canale 1) insiemecon anti-Brp (canale 2), oppure "Drosophila _NMJ_Bouton_Morphometrics" quando si analizzano sinapsi immunolabeled con anti-Syt o anti-CSP (canale 1) insieme Brp (canale 2).- Quando uno stack di immagini canale devono essere analizzate (il canale strutturale Dlg-1 o HRP per "Drosophila_ NMJ_Morphometrics", o Syt o Csp per "Drosophila _NMJ__Bouton_Morphometrics"), selezionare la casella "Canale solo 1".
- Regolare la scala corrispondente alle immagini da analizzare. Se un pixel nell'immagine corrisponde a 2,5 um, indicare Scale pixel = 1, Scale-Distanza in um = 2.5. Nel caso entrambe le impostazioni vengono lasciati a 0, l'area NMJ, perimetro, lunghezza e maggiore lunghezza ramo saranno espressi in numero di pixel.
- Se necessario, regolare le impostazioni di analisi predefinite della macro. Effettuare le regolazioni solo se il sub-macro "analizzare" (questa sezione con risultati insoddisfacenti, e determined impostazioni migliori nel paragrafo 6) è stato eseguito.
- Selezionare le caselle di controllo "Analyse" e "Wait" e premere "OK".
- Selezionare la casella di controllo "Wait" quando si esegue il sub-macro "Analyse" su 2 immagini del canale. Altrimenti errori nel conteggio zona attiva può verificarsi a causa di capacità informatiche limitate.
- Come una nuova finestra "Seleziona una directory" si apre, selezionare la directory in cui si trovano le immagini e premere il tasto "select". La macro analizzerà tutte le immagini memorizzate nella directory principale e, se del caso, le cartelle successive (utilizzando i tre file di eseguire le precedenti sub-macro: stack_image_name, flatstack_image_name e roi_image_name). I processi macro ciascuna immagine individualmente e consecutivamente. Questo può richiedere diversi minuti per ogni serie di immagini (a seconda della capacità del computer).
- Dopo l'esecuzione della macro, si noti che un nuovo file di immagine denominato res_image_name per ogni sinapsi analizzato memorizzati saranno created nella cartella dei genitori. Le misurazioni quantitative saranno memorizzati come file "results.txt".
- Ispezionare tutte le immagini di risultato per rilevare ed escludere le immagini con gli errori di segmentazione. Eventuali errori di segmentazione sono descritti nella tabella 3, insieme a consigli su come regolare le impostazioni di aggirare questi. Immagini risultanti con tali errori segmentazione vengono forniti come esempi della Figura 4.
NOTA: Quando si esegue la macro con le impostazioni di default osservati nell'interfaccia utente, c'era una precisione di circa il 95% quando la valutazione macro è stato confrontato con valutazione manuale 17.
6. Regolare le Impostazioni macro alle immagini
- Quando più di 5% di immagini mostrano errori di segmentazione, esplorare i diversi algoritmi per definire / scegliere le impostazioni macro più adatte per le immagini.
- Regolare rotolamento valore del raggio sfera
NOTA: Il raggio della sfera rotolantela funzione sottrae lo sfondo dell'immagine. Questa funzione è di fondamentale importanza quando si lavora con le immagini acquisite su microscopi a fluorescenza e / o quando le immagini hanno rumore di fondo elevato. La sottrazione del fondo contribuirà a passaggi di auto-thresholding della macro di produrre adeguata la segmentazione dei terminali NMJ.- Selezionare tre Z-proiezioni NMJ (immagini flatstack_image_name generati da sub-macro "Convert to stack") che sono rappresentativi dell'insieme di dati dell'immagine.
- Nella barra degli strumenti, selezionare Immagine | Colore | canali Spalato. saranno creati due immagini, un canale 1 e l'altro canale 2 rappresenta.
- Mantenere solo l'immagine appartenente al canale 1 aperto, corrispondente al Dlg-1, Hrp, Syt o Csp immunomarcatura, ed eliminare l'immagine del canale Brp chiudendo l'immagine.
- Eseguire il filtro "background Sottrarre" selezionando "Processo" nella barra degli strumenti seguito da "sfondo Sottrarre ..." nel menu a discesa.
- Spunta la casella di anteprima nella finestra a comparsa e regolare il raggio della sfera rotolante al valore che aumenta il contrasto tra la sinapsi e lo sfondo come nel pannello (Figura 5A').
NOTA: Vedere Figura 5 per un esempio. In Figure5A, parti della sinapsi mostrano gli stessi livelli di grigio come sfondo, mentre in Figura 5A' 'rolling raggio della sfera' impostato a 500 genera un forte contrasto tra la sinapsi e lo sfondo. - Quando viene definito il valore appropriato per il raggio della sfera di rotolamento, eseguire l'algoritmo "background sottrazione" Z-proiezioni selezionati con lo stesso valore di raggio della sfera rotolante e (in qualsiasi directory) salvare.
NOTA: Il valore del raggio Rolling Ball per 8 bit o immagini RGB dovrebbe essere almeno grande come il raggio del grande oggetto nell'immagine che non fa parte dello sfondo. Per le immagini a 16 bit e 32 bit il raggio deve essere inversely proporzionale al campo di valori di pixel 22.
- Determinare le diverse auto-soglie che verranno utilizzati
- Aprire le Z-proiezioni salvati nel passaggio precedente (6.2.6) e selezionare Immagine | regolare | AutoThreshold | Prova tutto.
- Come apparirà un'immagine risultato thresholded binaria con tutti i diversi algoritmi di auto-soglia, determinare l'algoritmo più adatto per le immagini.
- Quando si esegue la macro in seguito, modificare la soglia nelle impostazioni macro di conseguenza.
- Utilizzare soglie più restrittive come "RenyiEntrophy" o "Moments" come soglia contorno NMJ e soglie più permissive come "Li" per determinare lo scheletro NMJ, e "Huang" per determinare zone attive. Quando le immagini sono molto nitide con poco o nessun fondo, usare "Huang" come" soglia di contorno NMJ. In caso contrario, le parti della sinapsi potrebbero mancare dopo segmentazione delle immagini.
- Vedere Figura 5B per un esempio. la segmentazione appropriata della sinapsi si ottiene con auto-soglie evidenziate da scatole verdi. Alcuni esempi di soglie non adatti sono evidenziate dalle caselle rosse (verificare sinapsi ad alto ingrandimento). In quest'ultimo, sia parti della sinapsi sono mancanti o parti dello sfondo sono inclusi. Vedi riferimento 23 per ulteriori informazioni.
- Determinare la dimensione massima delle particelle
NOTA: Questa funzione escluderà tutte le particelle rilevati dalla soglia contorno NMJ e la soglia di scheletro che sono più piccoli del valore definito nel "piccole particelle impostazione" dall'analisi. Questo valore è definito in pixel. Questa funzione funge da filtro rumore ed è molto utile quando elevati tassi di sfondo non uniforme (come cristalli / polvere) sono presenti nelle immagini ottenute.- Aprire le Z-proiezioni salvati nella fase 6.2.6. e impostarela scala per rilevare il numero di pixel tramite analizzare | Set Scala. Applicare le seguenti impostazioni: distanza in pixel = 1, nota la distanza = 1, proporzioni pixel = 1, Unità di lunghezza = pixel e premere "OK". Fare clic sullo strumento "selezione ovale" nella barra degli strumenti.
- Utilizzando il mouse disegnare una selezione strettamente circostante singole particelle che sono presenti nel immunocolorazione ma non appartengono alla NMJ. Premere Ctrl + m per un utente Windows o cmd + m per gli utenti Mac. Si aprirà una finestra dei risultati, indicando l'area delle particelle selezionate in numero di pixel.
- Ripetere le precedenti passaggio più volte con diversi manufatti presenti nelle immagini di determinare la più grande area contaminante particelle / artefatto. Questo sarà il valore da impostare nella cornice durante l'esecuzione della macro in seguito. Quando si esegue la macro impostare il "Piccole particelle di dimensioni" come la più piccola dimensione delle particelle pus osservato un margine del 25%.
- Vedere Figura 5D per un esempio. Il cristallo più grande rilevaed ha una superficie di 112 pixel. L'impostazione "Piccole particelle dimensioni", durante l'elaborazione immagine con la macro, dovrebbe essere impostato a 125 - 150.
- Determinare dimensione minima bouton
NOTA: Questa funzione esclude tutti boutons rilevati dalla soglia contorno NMJ che sono inferiori al valore definito dall'analisi. Questo valore è definito in pixel.- Seguire la stessa procedura come descritto nella sezione 6.4, ma in questo caso al prelievo di una selezione che circonda le più piccole boutons presenti nel terminale NMJ. Scegliere l'area più piccola corrispondente al più piccolo bouton di quelli misurati. Questo è il valore per impostare nell'impostazione dimensione minima bouton durante l'esecuzione della macro seguito.
- Definire "Trova maxima rumore tolleranza" valore
- Utilizzare i Z-hyperstacks selezionati nella sezione 6.2.1.
- Nella barra degli strumenti, selezionare Immagine | Colore | canali Split a CreaTE 2 pile (per il canale 1 e del canale 2) e mantenere l'immagine corrispondente al canale Brp aperta. Scartare l'immagine altro canale chiudendolo.
- Vai alla scheda plug-in nel menu a comparsa, selezionare Processo | Massimo (3D), e quando appare il maximum_image_name (che può richiedere fino a pochi minuti), chiudere lo stack immagine originale.
- Selezionare la massima ... image_name (l'immagine di stack ottenuto) e selezionare Plugin | processo | Minimo (3D), chiudere il massimo ... nome_immagine stack.
- Nella barra degli strumenti, selezionare Processo | Trova maxima .... Una nuova finestra "Trova maxima ..." si aprirà. Fare clic su "selezione point anteprima ..." casella di controllo e riempire la casella "tolleranza Noise" con la macro di default impostazione 50. I punti Maxima sarà indicato nel l'immagine come piccole croci.
- Aumentare il valore "tolleranza Noise" se osservando un eccesso di zone attive annotati, cioè croci che non sono in cima a zone attive che sonoconcentrarsi sul piano pila selezionata, o zone attive falsi che vengono rilevati in background.
- D'altra parte, se non completamente osservando annotato zone attive, cioè zone attive a fuoco non essere etichettato riconosciuto, diminuire il valore "tolleranza Noise". Continuare a provare diversi valori che seguono questo procedimento fino a quando le croci sono opportunamente etichettano zone attive a fuoco. Riempire il "Trova tolleranza al rumore maxima" con questo valore.
- Vedere Figura 5C per un esempio. vengono rilevati troppi zone attive. Nella figura 5C' solo vengono rilevate le zone attive a fuoco.
- Aumentare il valore "tolleranza Noise" se osservando un eccesso di zone attive annotati, cioè croci che non sono in cima a zone attive che sonoconcentrarsi sul piano pila selezionata, o zone attive falsi che vengono rilevati in background.
- Eseguire il sub-macro "analizzare" per le immagini rappresentative selezionate nella fase 5.1, con le impostazioni definite nelle tutti i passaggi precedenti.
- Regolare Brp-puncta inferiore e soglia superiore
- Si noti che un nuovo file apparirà dopo l'esecuzione del macro secondo lo stadio 6.6, chiamato 2_active_zone_stack_image_name. In questa immagine impilare le zone attive rilevate dalla funzione "Trova maxima" sono indicate da punti bianchi in ciascun piano.
- Aprire questo file trascinandolo e rilasciandolo nella barra degli strumenti e selezionare Immagine | Stack | Zproject | tipo di proiezione = fette Somma. Una proiezione del 2_active_zone_stack_image_name sarà ottenuta.
- Seleziona Immagine | regolare | Soglia. Un nuovo "Threshold" finestra si aprirà. Far scorrere la barra superiore per scegliere un valore di soglia in cui, tutti / spot Brp-positivi foci desiderato vengono visualizzati in rosso.
NOTA: Se la soglia è troppo basso, un eccesso di zone attive verrà contato. Se impostato troppo alto, una frazione delle zone attive ci mancherà.- Vedere Figura 5E per un esempio. Quando la soglia è impostata a 400, la maggior parte delle zone attive (simboleggiati come foci 1 pixel) non sono inclusi nella segmentazione, in quanto non sono evidenziate in rosso (Figura 5E). Quando la soglia è impostata ad un valore di 50 tutte le zone attive sono evidenziate in rosso (Figura 5E').
- Definire questo valore come soglia minima. Lasciare "soglia puncta superiore" sul valore massimo.
- Eseguire nuovamente il sub-macro "Analyse" per le immagini rappresentative con le impostazioni definite in tutte le fasi precedenti di questa sezione. Valutare criticamente i file immagine risultanti e assicurarsi che la segmentazione è fatto correttamente. Se questo non è il caso regolare nuovamente le impostazioni secondo la natura degli errori di segmentazione (Figura 4, Tabella 3).
Risultati
Il file dei risultati di testo apparirà nella directory principale. Riassume tutti i parametri misurati per immagine. I risultati sono legati al nome del file ei parametri vengono successivamente riassunti nell'ordine indicato nelle tabelle 1 e 2.
Res_image_name è uno stack a tre immagini. La prima immagine evidenzia il contorno e scheletro del terminale NMJ determinata dalla macro basata sul canale 1 (immunomarcatura Dlg-1, Hrp, Syt, o CSP). La seconda immagine è una copia della prima immagine e inoltre mostra BRP-positive punti individuati rilevati nel canale 2 come foci schematizzato. La terza immagine fornisce la sporgenza massima del secondo canale insieme identificati foci Brp-positivi.
La soglia di contorno NMJ è rappresentato in giallo l'immagine macro risultato in uscita a. zona NMJ, perimeter e il numero di boutons sono dedurre da questa soglia.
La soglia scheletro NMJ è rappresentato in blu nell'immagine macro risultato di uscita in. lunghezza NMJ, più lunga durata ramo, numero di sportelli, ramificazione punti e isole sono dedurre da questa soglia.
La soglia zone attive NMJ non è rappresentata l'immagine macro risultato di uscita in. Questa soglia determina l'area in cui i fuochi Brp-positivi potenzialmente potrebbe essere rilevato dalla macro. Esso è destinato a creare un'area NMJ che è leggermente più grande di quello definito dalla soglia contorno NMJ. Quando viene selezionata una soglia troppo restrittivo, può essere escluso foci Brp-positive situato al margine della sinapsi. Quando la soglia è troppo permissivo, il rumore di fondo può essere considerato come Brp-positivi macchie (figure 1 - 2).
per validate le prestazioni della macro "Drosophila NMJ Morfometria", sono stati testati tre condizioni mutanti che sono stati già descritti per presentare difetti sinaptiche diversi parametri NMJ. Ogni difetto è stato rilevato da un diverso procedimento segmentazione di immagini eseguita dalla macro (NMJ contorno, zone scheletro o attivi, rispettivamente 17). Dopo mira le tre geni di interesse da inducibile RNAi e dissezioni performanti e NMJ immunocolorazione di L3 larve, la macro è stato eseguito. Le misurazioni morfologiche NMJ ottenuti sono stati poi a coppie (RNAi contro il suo controllo) rispetto utilizzando un t-test. In tutti e tre i casi, differenze statistiche sono state trovate tra mutanti e controlli interessano parametri che sono in accordo con i difetti morfologici precedentemente riportati. Ciò conferma che le macro sono infatti in grado di identificare in modo adeguato i difetti descritti in precedenza al Drosophila NMJ.
Ankyrin 2 (Ank2, CG42734) mutanti sono noti per presentare difetti morfologia sinaptiche, tra boutons fuse e NMJs piccoli. Questi difetti sono stati osservati per Ank2 mutanti 24, 25 e Ank2 knockdown vola 26. Terminali NMJ di pan-neuronali Ank2- RNAi linea atterramento (w; UAS-Dicer-2 / UAS-RNAi Ank2 KK107238; elavata-GAL4 / +) hanno mostrato significativamente più piccola zona NMJ (media = 339,25 um 2; t-test p = 2.18 x 10 -8) e il perimetro (media = 238,24 um; t-test p = 1,82 x 10 -3), rispetto al gruppo di dati genetica controllo di sfondo (w; UAS-Dicer-2 / UAS-KK60100; elavata-GAL4 / + ) (media = 451,95 um 2 e media = 288,62 um, rispettivamente) dopo aver eseguito "Drosophila NMJ Morfometria" (figure 6A e 4B).
Il GTPase Rab3 (CG7576) è necessario per un'adeguata distribuzione Bruchpilot e il mutante RUP presenta con un numero notevolmente ridotto di zone attive 27. È stata osservata una diminuzione significativa del numero di zone attive nella misurazione foci Brp-positivi dalla macro "Drosophila NMJ Morfometria" nei terminali NMJ di mosche smontabili Rab3 pan-neuronali (w; UAS-Dicer-2 / UAS-RNAi KK100787; elavata -Gal4). Il numero medio di zone attive per terminale NMJ in Rab3 -RNAi era 138 in contrasto 290 rilevato nell'insieme di dati di controllo (/ +) t-test p = 4,43 x 10 -29) (figure 6A e 4C).
Highwire (HIW, CG32592) è un importante regolatore di crescita NMJ; mutazioni nel gene hiw portare ad invadere ed estesa ramificazione dei terminali NMJ 28. Misurazione terminali NMJ di pan-neuronale linea knockdown Hiw -RNAi (w; UAS-Dicer-2 / UAS-RNAi-GD36085; elavata-GAL4 / +) con "Drosophila NMJ Morfometria", state osservate differenze significative nei parametri scheletro-derived: lunghezza (media = 147.36 um; media di controllo = 122.07 um; t -test p = 7.31 x 10 -7), più lunga lunghezza ramo (media = 122.19 um; media di controllo = 105.65 um; t-test p = 4,62 x 10 -4) numero di rami (media = 7.69; controllare medio = 5,74; t-test p = 2.52 x 10 -2) e il numero di punti di ramificazione (media = 2.73; controllare medio = 1,79; t-test p = 3,31 x 10 -2). Tutti questi parametri sono stati significativamente aumentati (120 - 180%) rispetto ai controlli genetici sfondo (w; UAS-Dicer-2 / UAS-GD60000; elavata-GAL4 / +) (figure 6A e 4D).
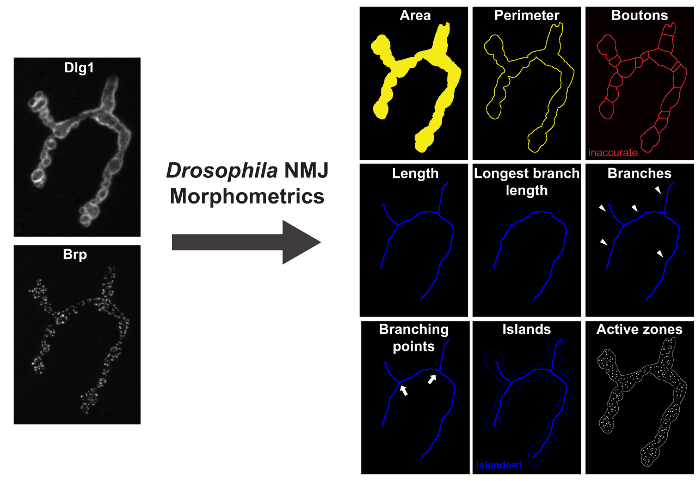
Figura 1: Drosophila _NMJ_Morphometrics Misure 9 Parametri del Drosophila NMJ. A sinistra sono Dlg-1 e Brp immunolabeled terminali NMJ, impressi su un microscopio a fluorescenza con apotome. Sulla destra sono le immagini di risultato dopo l'esecuzione "di Drosophila NMJ Morfometria". Parametri area, perimetro e boutons sono rappresentati dal contorno giallo macro-annotato indicato. lunghezza parametri, più lunga durata ramo (LBL), filiali, punti di ramificazione, e le isole sono presentati dal contorno blu macro-annotato. foci BRP-immunolabeled (zone attive) sono rappresentati dalla macro come macchie bianche nelle immagini di risultato. Si prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 2: Drosophila NMJ Bouton Morfometria Misure 8 Parametri della Drosophila NMJ. Sulla sinistrasono Syt-1 e Brp immunolabeled terminale NMJ, ripreso su un microscopio a fluorescenza con apotome. Sulla destra sono le immagini risultato dopo l'esecuzione di "Drosophila NMJ Bouton Morfometria". Parametri boutons e l'area Bouton sono rappresentati dal contorno giallo macro-annotato. lunghezza parametri, più lunga durata ramo (LBL), filiali, punti di ramificazione, e le isole sono presentati dal contorno blu macro-annotato. foci BRP-immunolabeled (zone attive) sono rappresentati dalla macro come macchie bianche nelle immagini di risultato. Si prega di cliccare qui per vedere una versione più grande di questa figura.
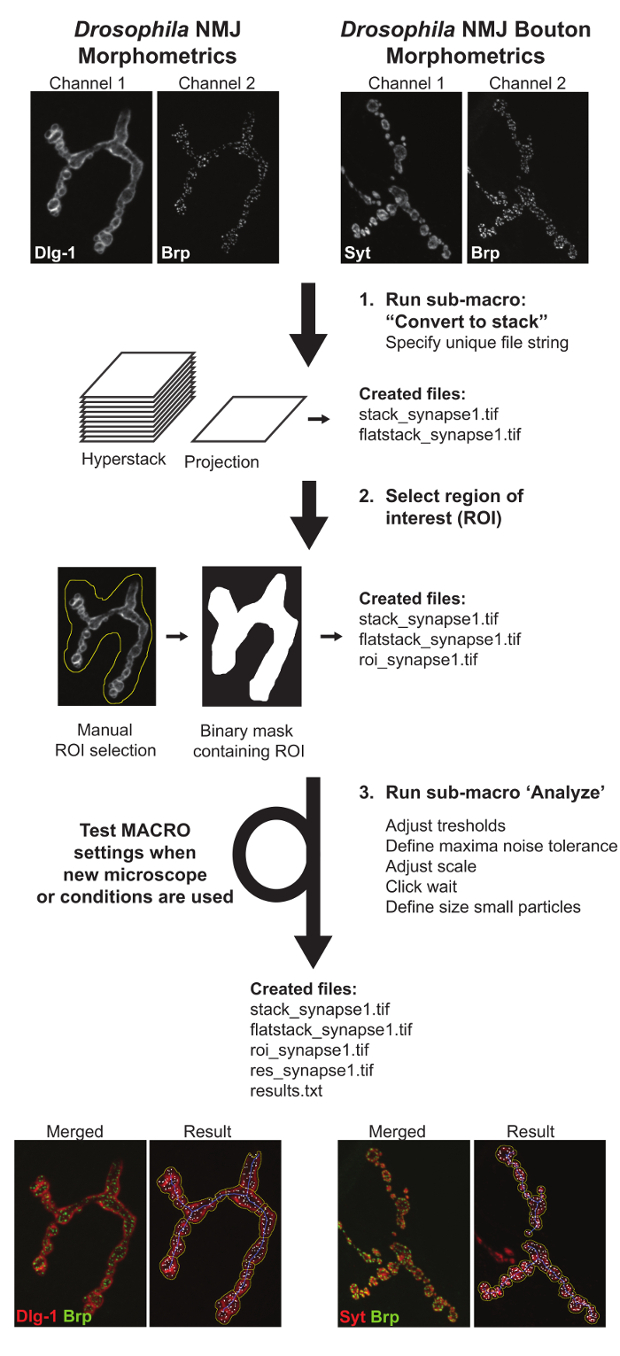
Figura 3: Diagramma di flusso rappresentante Drosophila NMJ Morfometria e Drosophila NMJ Bouton Morfometria macro. Il primo sotto-macro "Convertire to stack" crea proiezioni e hyperstacks delle NMJs impressi. La seconda sotto-macro 'Definire ROI' richiede l'inserimento manuale che definisce la posizione del terminale NMJ di interesse. Sub-macro tre, 'Analyse', misure tutti i parametri NMJ. Un testo file contenente i valori quantitativi e un file di immagine risultato che descrive il parametro di delineazione sono creati per aiutare la valutazione degli utenti, di prestazioni macro. Quando le immagini sono acquisite in condizioni differenti, le impostazioni macro devono essere testati e regolato per garantire un'analisi accurata. clicca qui per visualizzare una versione più grande di questa figura.
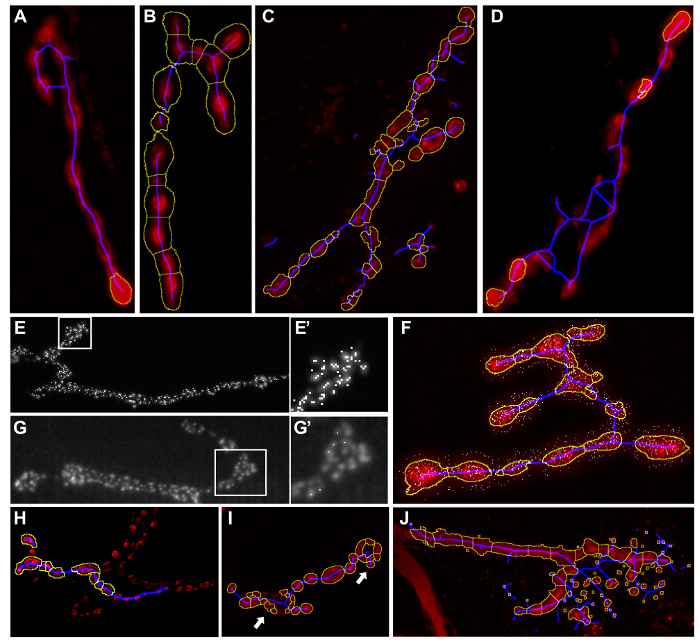
Figura 4: Esempi di macro inappropriate segmentazione Risultati. Le immagini dei risultati dopo l'esecuzione "Drosophila NMJ Morphometrics" o 'Drosophila NMJ Bouton Morfometria'. Componenti del terminale sinaptico non sono inclusi nel contorno giallo (A). Parti del fondo sono compresi nel terminale sinaptico dalla sagoma gialla (B). Blu linea scheletro si estende al di là del terminale sinaptica. (C - D) Troppi zone attive vengono rilevati (E - E '). Alcune zone attive non vengono individuati dall'analisi (G - G'). le zone attive vengono rilevati all'esterno sinapsi (F) non corretta bouton segmentazione. (applicabile durante l'esecuzione di Drosophila NMJ Bouton Morfometria Solo), boutons sono mancati (H) o troppi boutons vengono rilevati dalla segmentazione (I). le particelle una tale cristalli o polvere che fanno parte dello sfondo sono inclusi nella segmentazione (J) . Informazioni come modificare le impostazioni per evitare questi errori sono riportati nella Tabella 3 . Si prega di cliccare qui per vedere una versione più grande di questa figura.
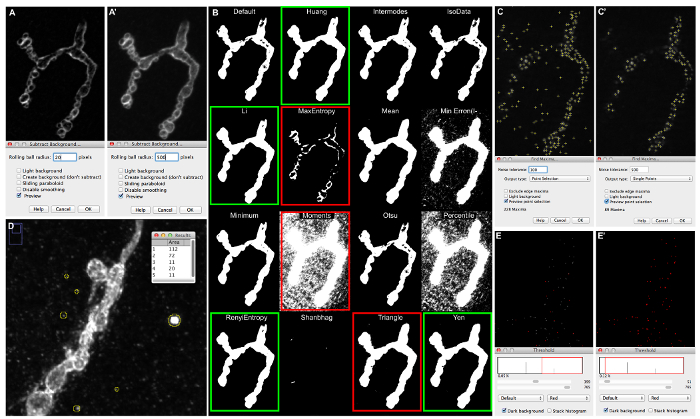
Figura 5: Esempi di regolazioni macro-regolazione e loro conseguenze per la segmentazione di immagini. (A) Sottrarre sfondo anteprima di un immunolabeled sinapsi Dlg-1, ripreso su un microscopio a fluorescenza con apotome, quando "raggio di rotolamento ball" è impostato a 20 (A) o 500 (A'). (B) le immagini di output ottenuti dopo l'esecuzione Immagine | regolare | Auto-Soglia | Prova tutta l'immagine illustra segmentazione di immagini ottenuti dai 16 differenti algoritmi di auto-soglia. (C) "Trova Maxima" anteprima durante l'impostazione di "tolleranza Noise" a 50 (C) e 500 (C'); ACzone tive che vengono rilevati dal segmentazione sono etichettati da una piccola croce. (D) Misura delle "piccole particelle" che figurano in background immagine di una sinapsi immunolabeled con l'anti-HRP, ripreso su un microscopio confocale. (E) proiezione "fette sum" ottenuto dalla 2_active_zone_stack_ima-ge_name. Soglia è fissata a 400 (E) e 50 (E'). Si prega di cliccare qui per vedere una versione più grande di questa figura.
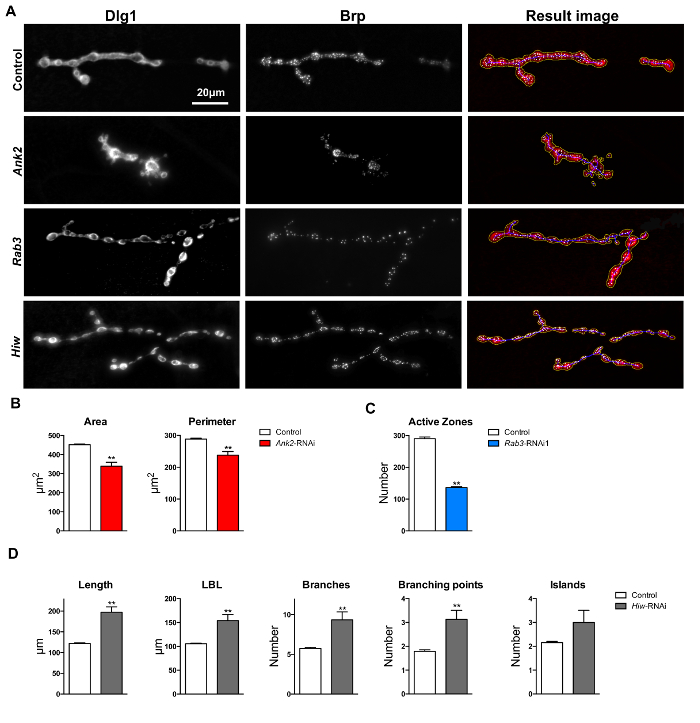
Figura 6: Valutazione Macro e quantificazione di NMJs sulle immagini muscolare 4. (A) dei risultati dopo aver eseguito macro "Drosophila NMJ Morfometria" a Dlg-1 e Brp immunolabeled terminali NMJ. Parametri zona, perimetro e boutons sono rappresentati dal contorno giallo macro-annotato. lunghezza parametri, più lunga durata ramo (LBL), filiali, punti di ramificazione, e le isole sono presentati dal contorno blu macro-annotato. foci BRP-immunolabeled (zone attive) sono rappresentati dalla macro come macchie bianche nelle immagini di risultato. La barra di scala indica 20 um. (B) Ankyrin2 RNAi knockdown mostra un'area più piccola NMJ e perimetro rispetto ai controlli genetici sfondo. (C) Rab3 atterramento determinato NMJs con un minor numero di zone attive Brp-positivi rispetto ai controlli genetici sfondo. (D) atterramento Highwire comportato più, superiore maggiore lunghezza ramo, più ramificato e con punti più ramificate per terminali NMJ rispetto al genetici NMJs controllo sfondo. Le barre di errore indicano SEM, ** p <0.01, a due code T-test. Si prega di cliccare luiri per visualizzare una versione più grande di questa figura.
| Parametro | struttura NMJ | Spiegazione |
| Area (μm2) | NMJ contorno | L'area della completa NMJ etichettato |
| Perimetrale (um) | NMJ contorno | Il perimetro appartenente all'area |
| #Boutons | NMJ contorno | Il numero di bottoni sinaptici ( 'perle di una collana') del NMJ |
| Lunghezza (micron) | Scheletro | La lunghezza totale del terminale completo NMJ |
| Maggiore lunghezza ramo (um) | Scheletro | La somma della lunghezza del percorso continuo lungo collegare i due punti della NMJ |
| #Ramoes | Scheletro | Il numero totale di sportelli |
| punti #Branching | Scheletro | Il numero di punti di ramificazione (diversi rami può derivare da un punto di diramazione) |
| #Islands | Scheletro | Il numero di non-collegati compartimenti sinaptici DLG1-positivi (o qualsiasi altra colorazione) |
| zone #Active | macchie BRP-positivi | Il numero di zone attive, basato su Brp colorazione |
Tabella 1: NMJ parametri misurati da "Drosophila NMJ Morfometria". I parametri misurati NMJ dalla macro "Drosophila NMJ Morfometria" verranno visualizzati come un elenco nel file di testo ottenuto, seguendo l'ordine descritto in questa tabella. Questa tabella è ristampato da Nijhof et al. 17
| Parametro | struttura NMJ | Spiegazione |
| Boutons | NMJ contorno | Il numero di bottoni sinaptici ( 'perle di una collana') del NMJ |
| zona Bouton | NMJ contorno | La superficie totale di tutti i boutons |
| Lunghezza (micron) | Scheletro | La lunghezza totale del terminale completo NMJ |
| Maggiore lunghezza ramo (um) | Scheletro | La somma della lunghezza del percorso continuo lungo collegare i due punti finali della NMJ |
| #Branches | Scheletro | Il numero totale di sportelli |
| punti #Branching | Scheletro | the numero di ramificazione punti (diversi rami può derivare da un punto di diramazione) |
| #Islands | Scheletro | Il numero di non-collegati compartimenti sinaptici DLG1-positivi (o qualsiasi altra colorazione) |
| zone #Active | macchie BRP-positivi | Il numero di zone attive, basato su Brp colorazione |
Tabella 2: NMJ parametri misurati da "Drosophila NMJ Bouton Morfometria". I parametri misurati NMJ dalla macro "Drosophila _Bouton_NMJ_Morphometrics" verranno visualizzati come un elenco nel file di testo ottenuto, seguendo l'ordine descritto in questa tabella. Questa tabella è ristampato da Nijhof et al. 17
| Segmentazione | Errori osservati | Esempio | adeguamenti richiesti | |
| NMJ area e il perimetro (Rappresentato da contorno giallo nell'immagine finale) | Componenti del terminale sinaptico non sono né compresi nel contorno giallo o parti dello sfondo sono incluse nel terminale sinaptico delineato in giallo. | Figura 5A-B | Regolare il valore 'sfera rotolante Radius'. Vedere la sezione 6.1. | Regolare 'soglia di contorno NMJ'. Vedere la sezione 6.2. |
| NMJ parametri relativi lunghezza (rappresentata dalla linea scheletro blu all'immagine risultati in) | Blu linea scheletro sia estende oltre o non è presente lungo tutta terminale sinaptico. | Figura 5C-D | Regolare il valore 'sfera rotolante Radius'. Vedere la sezione 6.1. | Regolare 'soglia di contorno NMJ'. Vedere la sezione 6.2. |
| puncta BRP-positivi (rappresentato da punti immagine risultati in) | vengono rilevati troppi zone attive. | Figura 5E-E' | Diminuire il valore 'Trova tolleranza al rumore maxima'. Vedere la sezione 6.5. | |
| puncta BRP-positivi (rappresentato da punti immagine risultati in) | zone attive sono mancati dall'analisi. | Figura 5G-G' | Aumentare il valore 'Trova tolleranza al rumore maxima'. Vedere la sezione 6.5. | Diminuire 'BRP-puncta soglia inferiore'. Vedere la sezione 6.6. |
| puncta BRP-positivi (rappresentato da punti immagine risultati in) | artefatti zona attiva vengono rilevati all'esterno del terminale sinaptico. | Figura 5F | la sezione 'soglia di zona attiva' 6.2 Regolare. | Aumentare 'BRP-puncta soglia inferiore'. Vedere la sezione 6.6. |
| piccole particelle | Particelle un tale cristalli o polveri che fanno parte dello sfondo sembrano essere incluso nella segmentazione. | Figura 5J | Selezionare la casella di 'rimuovere le piccole particelle'. Vedere la sezione 6.3. | Determinare piccole particelle di dimensione massima. Vedere la sezione 6.3. |
| Bouton segmentazione | la segmentazione errato bouton (solo per Drosophila NMJ Bouton Morfometria; non utilizzare Drosophila NMJ Morfometria per Bouton la segmentazione). | Figura 5H-I | Regolare 'soglia di contorno NMJ'. Vedere la sezione 6.1. | Determinare 'dimensione minima bouton'. Vedere la sezione 6.4. |
Tabella 3: Risoluzione dei problemi guida per i diversi tipi di errori in segmentazione delle immagini che possono essere prodotti dalle macro. Questa tabella descrive i diversi tipi dierrori di segmentazione delle immagini prodotte dalle macro. Questi possono essere facilmente individuati nelle immagini risultati. Esempi di ogni tipo di errore sono mostrati nella Figura 4. Nella sezione "regolazione" della tabella, le impostazioni che devono essere regolate sono evidenziate, e l'utente si riferisce alla sottofase critica della sezione 6, che descrivono come regolare queste impostazioni.
Discussione
"Drosophila NMJ Morfometria" e "Drosophila NMJ bouton Morfometria" sono strumenti potenti per i ricercatori interessati a valutare sinapsi morfologia. la valutazione manuale dei parametri NMJ è laboriosa; si stima che le macro risparmierebbero un ricercatore esperto fino a 15 min / NMJ speso per la segmentazione manuale dell'immagine. Con uno o due decine di sinapsi valutati per ogni condizione o genotipo, questo riassume rapidamente fino a una considerevole quantità di tempo risparmiato, anche in studi su piccola scala. Quando si esegue grandi schermi, il guadagno di utilizzare alta analisi del throughput, rispetto alla valutazione manuale e la quantificazione, può essere immensa. Oltre a una maggiore produttività, le macro prontamente fornire un'analisi obiettiva; escludono pregiudizi personali che altrimenti richiederebbero sperimentazioni in cieco nonché le differenze tra persone che si verificano quando più i ricercatori sono coinvolti nell'analisi. Infine, le macro offrono un un sensibile e precisoANALISI DELLA caratteristiche NMJ, permettendo l'identificazione di regolatori sinaptici che causano piuttosto sottile di drammatici difetti NMJ e rimaste sinora apprezzati dall'occhio del ricercatore. Informazioni dettagliate sulle procedure di convalida e gli algoritmi utilizzati nelle macro si trovano nella pubblicazione Nijhof et al. 17.
La funzionalità delle macro è stato validato per misurare in modo appropriato le caratteristiche morfologiche della Drosophila melanogaster NMJs al muscolo 4. Successivamente, è stato dimostrato che le macro sono stati anche adatto per analizzare le sinapsi in altri muscoli in questo organismo. È probabile che le macro possono essere utilizzati anche per misurare parametri morfologici di giunzioni neuromuscolari con struttura simile in altre specie, tra le altre specie Drosophila e altri insetti. Anche NMJs molto lontane nell'evoluzione, per esempio, NMJs di topi, mostrano una conformazione strutturale abbastanza simile 29. Le macro non sono stati testati sui preparativi NMJ da altre specie, ma i potenziali utenti sono incoraggiati a testare le macro per tali scopi.
E 'molto importante che l'utente esplora le diverse auto-soglie e gli algoritmi per definire / scegliere le impostazioni macro più adatte per le immagini. Con queste impostazioni, una precisione di circa il 95% si ottiene quando la valutazione macro è stato confrontato con la valutazione manuale. Regolazione delle impostazioni macro correttamente segmento 100% delle immagini può essere una procedura molto laboriosa o addirittura impossibile. Pertanto, l'esclusione di immagini non correttamente segmentati è raccomandato se il loro numero è inferiore al 5%. Evidentemente, se la qualità delle immagini è bassa, le macro si generano elevati rapporti di segmentazione di immagini insoddisfacenti. immagini di bassa qualità saranno allo stesso modo influenzare la valutazione manuale e possono quindi non essere legato alla performance delle macro. Tuttavia le macro sono piuttosto robusti come sono stati progettati per un'immagines generata su un alto contenuto microscopio (un microscopio a fluorescenza automatico che permette l'imaging di un gran numero di campioni) 17.
Un punto critico è che l'utente controlla visivamente tutte le immagini di risultati generati dalle macro. Questo permetterà di individuare ed escludere le immagini con la segmentazione insoddisfacente. Nella sezione 6 di questo protocollo, l'utente viene guidato come regolare le impostazioni corrette segmentazione di immagini quando si esegue il sub-macro "Analyse". Per conoscere rapidamente con i requisiti delle macro e come regolare le impostazioni macro una cartella chiamata "Examples_adjusting impostazioni macro" è incluso nel repository https://figshare.com/s/ec634918c027f62f7f2a macro. Tredici sottocartelle, ciascuna con immagini esempi ottenuti a piattaforme diverse microscopio (microscopi alto contenuto / confocale / fluorescenza) e diversi immunostainings, sono forniti. Un PDF intitolato “Esempi guida” è incluso nella stessacartella in cui vengono fornite le impostazioni necessarie per ogni esempio, insieme ad un documento di testo che fornisce i risultati attesi e risultati immagini.
Le macro sono stati progettati per processare le immagini salvate come TIFF separati file, tuttavia alcuni utenti potrebbero aver salvato le loro immagini in un formato diverso. Il seguente sito web https://figshare.com/s/ec634918c027f62f7f2a 21 contiene una cartella denominata "Drosophila NMJ" dove tre file di esempio (esempio 1 - 3) e la "Guida Esempi" documento con le istruzioni dettagliate su come importare le immagini nella macro se non memorizzati come file separati .tiff si possono trovare anche nella stessa cartella.
Insieme, "Drosophila NMJ Morfometria" e "Drosophila NMJ Bouton morfometria" macro quantificare dieci diverse caratteristiche NMJ: area NMJ, perimetro NMJ, numero di boutons, area bouton NMJ, lunghezza NMJ, giunzioni neuromuscolari più lunga di lunghezza ramo, numero di islands, numero di rami, il numero di punti di ramificazione e il numero di zone attive. Ciò fornisce un grande vantaggio rispetto gli strumenti finora disponibili che possono valutare solo uno o alcune caratteristiche sinaptiche 30, 31. Analisi quantitativa multiparametrica porta grande potenziale per nuove scoperte, ad esempio, per identificare nuovi regolatori che controllano uno fino a numerosi aspetti della biologia sinapsi. Esso fornisce anche la risoluzione necessaria per identificare i geni che coregulate esattamente uguali o sovrapposti caratteristiche NMJ e quindi suscettibili di operare in percorsi molecolari comuni. Infine, si apre la possibilità di studiare come diversi parametri sinaptiche correlazione tra loro in condizioni inalterate 17 e quali geni garantiscono tali correlazioni morfometrici coordinati.
Nel loro insieme, questo protocollo illustra come utilizzare i due macro "Drosophila NMJ Morfometria" e"Drosophila NMJ Bouton Morfometria", che svolgono quantificazione oggettiva e sensibile di dieci caratteristiche morfologiche NMJ in modo ad alta produttività.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Riconosciamo il magazzino centrale di Vienna Drosophila Resource Center e Bloomington Drosophila (NIH P40OD018537) per la fornitura di ceppi di Drosophila. Ringraziamo Jack Fransen dalla Microscopical Imaging Center per il supporto di esperti nel campo dell'imaging. Questo studio è stato sostenuto da VIDI e le sovvenzioni TOP (917-96-346, 912-12-109) dalla Organizzazione olandese per la ricerca scientifica (NWO), da due borse di studio di dottorato di ricerca DCN / Radboud University Medical Center, dal ritardo mentale rete tedesca finanziato dal programma NGFN + del ministero federale tedesco dell'Istruzione e della ricerca (BMBF) e dal Gencodys dell'Unione europea del 7 ° PQ su larga scala integrati di rete (Health-241995) per AS. I finanziatori avevano alcun ruolo nel disegno dello studio, la raccolta e l'analisi dei dati, la decisione di pubblicare, o preparazione del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| Immunostaining | Dilution | ||
| Mouse anti-discs large 1 | Developmental Studies Hybridoma Bank | AFFN-DLG1-4D6 | 1/25 (conjungated using the Zenon Alexa Fluor 528 Labeling Kit) |
| Rabbit anti-horseradish peroxidase | Jackson IR | 323-005-021 | 1/500 |
| Rabbit anti-Synaptotagmin | Gift from Hugo Bellen | Jan-00 | |
| Mouse anti-Cysteine string protein | Developmental Studies Hybridoma Bank | DCSP-1(ab49) | 1/10 (conjungated using the Zenon Alexa Fluor 528 Labeling Kit) |
| Mouse anti-Bruchpilot | Developmental Studies Hybridoma Bank | nc82 | Jan-50 |
| Goat anti-mouse Alexa Fluor 488 | Life technologies | A11029 | 1/200 |
| Goat anti-rabbit Alexa Fluor 568 | Life technologies | A11011 | 1/500 |
| Zenon Alexa Fluor 568 Mouse IgG1 Labeling Kit | ThermoFisher | Z25006 | |
| ProLong Gold Antifade Mountant | ThermoFisher | P36930 | |
| Material | Company | Catalog number | Comments |
| Equipment | |||
| Confocal microscope or fluorescence microscope | Leica SP5 | ||
| Zeiss Axio imager | |||
| Computer | Mac or Pc | ||
| Material | Company | Catalog number | Comments |
| Software | |||
| FIJI |
Riferimenti
- Lin, Y. C., Koleske, A. J. Mechanisms of synapse and dendrite maintenance and their disruption in psychiatric and neurodegenerative disorders. Annu Rev Neurosci. 33, 349-378 (2010).
- van Bokhoven, H. Genetic and epigenetic networks in intellectual disabilities. Annu Rev Genet. 45, 81-104 (2011).
- Penzes, P., Buonanno, A., Passafaro, M., Sala, C., Sweet, R. A. Developmental vulnerability of synapses and circuits associated with neuropsychiatric disorders. J Neurochem. 126, 165-182 (2013).
- Mainen, Z. F., Sejnowski, T. J. Influence of dendritic structure on firing pattern in model neocortical neurons. Nature. 382, 363-366 (1996).
- Yuste, R., Majewska, A., Holthoff, K. From form to function: calcium compartmentalization in dendritic spines. Nat Neurosci. 3, 653-659 (2000).
- Vetter, P., Roth, A., Hausser, M. Propagation of action potentials in dendrites depends on dendritic morphology. J Neurophysiol. 85, 926-937 (2001).
- Bosch, M., Hayashi, Y. Structural plasticity of dendritic spines. Curr Opin Neurobiol. 22, 383-388 (2012).
- Mehnert, K. I., Cantera, R. Circadian rhythms in the morphology of neurons in Drosophila. Cell Tissue Res. 344, 381-389 (2011).
- Sigrist, S. J., Reiff, D. F., Thiel, P. R., Steinert, J. R., Schuster, C. M. Experience-dependent strengthening of Drosophila neuromuscular junctions. J Neurosci. 23, 6546-6556 (2003).
- Ruiz-Canada, C., Budnik, V. Introduction on the use of the Drosophila embryonic/larval neuromuscular junction as a model system to study synapse development and function, and a brief summary of pathfinding and target recognition. Int Rev Neurobiol. 75, 1-31 (2006).
- Menon, K. P., Carrillo, R. A., Zinn, K. Development and plasticity of the Drosophila larval neuromuscular junction. Wiley Interdiscip Rev Dev Biol. 2, 647-670 (2013).
- Kraut, R., Menon, K., Zinn, K. A gain-of-function screen for genes controlling motor axon guidance and synaptogenesis in Drosophila. Curr Biol. 11, 417-430 (2001).
- Parnas, D., Haghighi, A. P., Fetter, R. D., Kim, S. W., Goodman, C. S. Regulation of postsynaptic structure and protein localization by the Rho-type guanine nucleotide exchange factor dPix. Neuron. 32, 415-424 (2001).
- Eaton, B. A., Fetter, R. D., Davis, G. W. Dynactin is necessary for synapse stabilization. Neuron. 34, 729-741 (2002).
- Laviolette, M. J., Nunes, P., Peyre, J. B., Aigaki, T., Stewart, B. A. A genetic screen for suppressors of Drosophila NSF2 neuromuscular junction overgrowth. Genetics. 170, 779-792 (2005).
- Collins, C. A., Wairkar, Y. P., Johnson, S. L., DiAntonio, A. Highwire restrains synaptic growth by attenuating a MAP kinase signal. Neuron. 51, 57-69 (2006).
- Nijhof, B., et al. A New Fiji-Based Algorithm That Systematically Quantifies Nine Synaptic Parameters Provides Insights into Drosophila NMJ Morphometry. PLoS Comput Biol. 12, e1004823(2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9, 676-682 (2012).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Dubos, A., et al. Conditional depletion of intellectual disability and Parkinsonism candidate gene ATP6AP2 in fly and mouse induces cognitive impairment and neurodegeneration. Hum Mol Genet. 24, 6736-6755 (2015).
- Nijhof, B., et al. Drosophila NMJ Morphometrics. , figshare https://doi.org/10.6084/m9.figshare.2077399. (2017).
- Ferreira, T., Rasband, W. ImageJ User Guide IJ 1.46. , http://rsbweb.nih.gov/ij/docs/guide/146-29.html (2014).
- Ferreira, T., Rasband, W. ImageJ User Guide IJ 1.46. , Available from: http://fiji.sc/Auto_Threshold (2014).
- Pielage, J., et al. A presynaptic giant ankyrin stabilizes the NMJ through regulation of presynaptic microtubules and transsynaptic cell adhesion. Neuron. 58, 195-209 (2008).
- Koch, I., et al. Drosophila ankyrin 2 is required for synaptic stability. Neuron. 58, 210-222 (2008).
- Iqbal, Z., et al. Homozygous and heterozygous disruptions of ANK3: at the crossroads of neurodevelopmental and psychiatric disorders. Hum Mol Genet. 22, 1960-1970 (2013).
- Prokop, A. Organization of the efferent system and structure of neuromuscular junctions in Drosophila. Int Rev Neurobiol. 75, 71-90 (2006).
- Wan, H. I., et al. Highwire regulates synaptic growth in Drosophila. Neuron. 26, 313-329 (2000).
- Shi, L., Fu, A. K., Ip, N. Y. Molecular mechanisms underlying maturation and maintenance of the vertebrate neuromuscular junction. Trends Neurosci. 35, 441-453 (2012).
- Sutcliffe, B., Forero, M. G., Zhu, B., Robinson, I. M., Hidalgo, A. Neuron-type specific functions of DNT1, DNT2 and Spz at the Drosophila neuromuscular junction. PLoS One. 8, e75902(2013).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100(2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon