Method Article
Dois Algoritmos para métodos de alta capacidade e Multi-paramétrico Quantificação de
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Dois algoritmos de análise de imagem, "Drosophila MNJ morfometria" e "Drosophila MNJ Bouton morfometria" foram criados, para quantificar automaticamente nove características morfológicas da junção neuromuscular Drosophila (MNJ).
Resumo
morfologia sináptico é fortemente relacionada com a eficácia sináptica, e em muitos casos defeitos sinapse morfológicas em última análise, conduzir a mau funcionamento sináptica. A junção neuromuscular Drosophila larval (JNM), um modelo bem estabelecido para as sinapses glutamatérgicas, tem sido extensivamente estudado ao longo de décadas. Identificação de mutações que causam defeitos morfológicas JNM revelou um repertório de genes que regulam o desenvolvimento e função sinapse. Muitos deles foram identificados em estudos de grande escala que se concentravam em abordagens qualitativas para detectar anormalidades morfológicas da Drosophila MNJ. A desvantagem de análises qualitativas é que muitos jogadores sutis que contribuem para a morfologia MNJ provável passar desapercebido. Considerando análises quantitativas são necessários para detectar as diferenças morfológicas mais sutis, tais análises ainda não são comumente realizados porque são trabalhoso. Este protocolo descreve em detalhe dois algoritmos de análise de imagem "Drosophila 'Drosophila MNJ Bouton Morfometria', disponível como macros Fiji compatíveis, para análise morfométrica quantitativa, precisa e objetiva da Drosophila MNJ. Esta metodologia é desenvolvida para analisar terminais MNJ imunomarcadas com os marcadores mais usados Dlg-1 e . brp Além disso, a sua aplicação mais alargada a outros marcadores tal como HRP, CSP e SYT é apresentada neste protocolo As macros são capazes de avaliar nove características JNM morfológicas:. área JNM, perímetro JNM, Número de boutons, comprimento JNM, JNM ramo mais longo comprimento, o número de ilhas, número de ramos, número de pontos de ramificação e número de zonas activas no terminal JNM.
Introdução
Distúrbios cognitivos tais como deficiência mental, perturbação do espectro do autismo e esquizofrenia são frequentemente caracterizadas por função anormal sináptica 1, 2, 3. morfologia e função sinapse são firmemente interligados; defeitos morfológicas pode causar mau funcionamento sináptica e, inversamente, a transmissão sináptica aberrante terá impacto maturação sináptica e morfologia 4, 5, 6.
Uma série de organismos modelo têm sido empregadas, a fim de melhor compreender a biologia sinapse e lançar luz sobre como as mudanças sinápticas afetar a função cerebral na saúde e na doença 7, 8, 9. A Drosophila JNM é um extensivamente estudada e bem estabelecido modelo in vivo para sy glutamatérgicanapse biologia 10, 11. Nas últimas décadas, este modelo tem sido utilizado para estudos fisiológicos e focada para o gene, assim como para rastreios genéticos grande escala, com o objectivo de detectar diferenças morfológicas entre NMJs. Em particular, telas para a frente genéticas identificaram muitos reguladores cruciais e mecanismos subjacentes ao desenvolvimento sinapse e funcionar 12, 13, 14, 15, 16. No entanto, a maior parte destes ecrãs baseado na avaliação visual da JNM morfologia terminal e na detecção qualitativa das alterações sinápticas ou de pontuação semi-quantitativo de algumas características morfológicas. Como consequência, anormalidades morfológicas sinápticas em vez sutis que não são óbvias para o olho humano são facilmente perdidas. A fim de ser capaz de detectar de forma abrangente diferenças quantitativas, asJNM tem de ser avaliado de forma precisa por quantificação sistemática dos parâmetros morfológicos de interesse. Medindo características JNM manualmente é trabalhoso, especialmente quando há vários recursos JNM de interesse e / ou ao realizar rastreios genéticos de grande escala. A fim de apoiar multiparamétrica, análise morfológica de alto rendimento e para conseguir a quantificação objectivo, dois macros "Drosophila JNM Morfometria" e "Drosophila JNM Bouton Morfometria" foram desenvolvidos 17. Ambas as macros executar no open source software de análise de imagem Fiji 18, e pode quantificar ambas as imagens confocal e nonconfocal.
Medidas "Drosophila JNM Morfometria" terminais JNM imunocoradas com o disco pós-sináptica marcador grande-1 (Dlg-1) ou a peroxidase de rábano pré-sináptico (HRP), co-marcadas com o marcador bruchpilot zona activa (Brp). Ele quantifica nove Parame morfológicaters (descrito abaixo): área JNM, perímetro JNM, Número de boutons, comprimento JNM, JNM maior comprimento dos ramos, número de ilhas, número de ramos, número de pontos de ramificação e número de zonas activas no terminal sináptico (Figura 1) . Embora um algoritmo para determinar o número de boutons está presente nesta macro, não satisfazer os critérios de precisão 17. Para avaliar correctamente o número de boutons, é necessário usar a macro "Drosophila JNM Bouton Morfometria", o qual é especificamente concebido para quantificar boutons usando preparações JNM imunocoradas pelo anti-sinaptotagmina (SYT) ou proteína de cadeia anti-cisteína (CSP), e co-immunolabeled com Brp. A macro "Drosophila MNJ Bouton Morfometria" quantifica os seguintes parâmetros: número de boutons, área bouton MNJ, comprimento MNJ, MNJ maior comprimento ramo, número de ilhas, número de agências, número de pontos de ramificação e número de zo ativanes (Figura 2).
As macros consistem em 3 sub-macros: (I) "Converter para empilhar" identifica todos os arquivos de imagem disponíveis e cria Z-hyperstacks e projeções de intensidade máxima de ambos os canais. Como saída, esta macro irá gerar dois novos arquivos por sinapse chamado "stack_image_name" e "flatstack_image_name". II) "define ROI" vai abrir todas as imagens de projecção máximos "flatstack_image_name" consecutivamente e apresentá-los com o pedido para definir manualmente a região de interesse (ROI) no qual o terminal sináptico específico de interesse está presente. Isto foi implementado para permitir a exclusão de sinapses de ligação para músculos adjacentes e / ou outros tipos de terminais sinápticos (tais como 1s) que podem estar presentes nas imagens 11. (III) "Analisar" Aplica-se totalmente automatizado de análise para todas as regiões das imagens dentro das fronteiras do ROI. Comoresultado desta etapa, o usuário obterá dois novos arquivos: "Results.txt" onde toda a medida numérica será anotada e um "res_image_name.tif" onde as segmentações imagem subjacente produzidos pela macro será ilustrado. Durante a análise de imagem três estruturas são derivados a partir de cada terminal sináptico: o contorno JNM, o esqueleto JNM, e o número de zonas activas Brp-positivos. O contorno JNM é usada para determinar a área JNM e do seu perímetro e uma bacia de separação subsequente fornece o número de boutons. A partir do esqueleto, cinco características MNJ são deduzidos: o comprimento total MNJ, a soma do comprimento do mais longo caminho contínuo de conectar os dois pontos finais (maior comprimento de ramo), o número de compartimentos desconexos por MNJ (referido como "ilhas" ), o número de ramos, e o número de pontos de ramificação (um ponto de ramificação liga três ou mais ramificações). O número de zonas activas é determinado no Brp-canal por contagemmanchas BRP-positivos. O contorno anotada JNM (linha amarela), o esqueleto JNM (linha azul), e o número de zonas activas Brp-positivas (indicados por focos branco) são mostrados numa imagem de resultados e as medições dos parâmetros são processados para uma (. txt) ficheiro de saída (Figura 3).
Drosophila JNM Morfometria" e 'Drosophila JNM Bouton Morfometria' foram descritos pela primeira e extensivamente validado por Nijhof et ai. 17. Este manuscrito centra-se na metodologia para análise da morfologia JNM usando as macros 'Drosophila JNM Morfometria' e 'Drosophila JNM Bouton Morfometria'. no entanto, antes de análises macro-assistida, dissecações JNM e imunomarcações precisam ser executadas. Estes são passos cruciais, e a combinação de marcadores utilizados para imuno-histoquímica têm de ser adequados para análises macro. Estes passos são brevemente mencionado em sEç ã o 1 do presente protocolo e direccionar o utilizador para referências que descrevem em detalhe os protocolos para executar estes procedimentos.
Protocolo
1. Requisitos Antes de Processamento de Imagem
- Executar Drosophila preparações livro aberto de larvas de terceira instar de errante (L3), como previamente descrito 19.
- Co-immunolabel terminais Drosophila JNM usando uma combinação de dois marcadores: Dlg-1 ou em conjunto com HRP Brp para análise com "Drosophila JNM Morfometria", e SYT ou CSp em conjunto com Brp para análise com "Drosophila JNM Bouton Morfometria" 20.
NOTA: Os anticorpos da mesma espécie, podem ser combinados por pré-marcação um com um kit de anticorpo-conjugação tal como o Zenon Alexa Rotulagem Kits 17. - Imagem terminais MNJ usando um microscópio de escolha, por exemplo, fluorescência (com ou sem ApoTome) ou microscopia confocal.
- Adquirir uma pilha de 2-canal do terminal JNM.
- Ajustar as configurações de microscópio de um modo que o canal 1adquire do terminal JNM immunolabeled com Dlg-1 (ou de hrp, SYT, CSP) e o canal 2 do terminal JNM immunolabeled com Brp.
- Opcionalmente, analisar imagens de um canal (de sinapses imunomarcadas com um único anticorpo) com as macros. NMJs imagem immunolabeled exclusivamente com Dlg-1 ou de hrp para análise com "Drosophila MNJ Morfometria", ou SYT ou Csp para "Drosophila MNJ Bouton Morfometria".
NOTA: Não é possível analisar sinapses imunomarcadas com apenas anti-Brp.
- Exportar as imagens obtidas como .tiff individuais'. Inverter a ordem dos canais, antes de executar as macros se não for adquirida como indicado.
- Adquirir uma pilha de 2-canal do terminal JNM.
2. Requisitos e instalação de software
- Baixar as macros: "Drosophila MNJ Morfometria" e "Drosophila MNJ Bouton Morfometria" no seguinte site: https://figshare.com/s/ec634918c027f62f7f2a 21.
- Mova o cursor para a pasta "update Macros 1" e clique na opção "view" que aparece. Uma lista com o conteúdo desta pasta irá aparecer. A pasta contém as macros "Drosophila MNJ morfometria" e "Drosophila MNJ Bouton morfometria".
NOTA: Ambas as macros são compatíveis com versões Fiji 1.4, que também é fornecido na mesma pasta. As macros podem não funcionar em versões recentes. Por favor utilize o fornecido versão 1.4. É problemático para começar esta versão, mesmo em computadores com um mais recente versão Fiji disponível. - Clique em "Baixar todos". O conteúdo da pasta será baixado para o computador como um arquivo .zip. Descompacte o arquivo baixado.
- Copie os arquivos de Drosophila _NMJ_Morphometrics.ijm e Drosophila _NMJ_Bouton Morphometrics.ijm para o diretório Fiji.app/plugins/. Quando reiniciar o programa, as macros aparecerá na parte inferior da Pluginsmenu suspenso.
3. Run Sub-macro "Converter para Stack" para criar Z-projeções e Hyperstacks das imagens MNJ
- Inicie a interface gráfica, selecionando Plugins na barra de ferramentas e escolha "Drosophila MNJ Morfometria" no menu suspenso.
- Definir a configuração "String Arquivo Único" na interface gráfica do macro.
NOTA: O software microscópio usa uma assinatura de identificação para organizar planos e canais ao armazenar pilhas como .tiff individuais'. A configuração de string de arquivo exclusivo entrou precisa especificar a assinatura atribuído pelo software para o primeiro plano do primeiro canal (importante: menor avião e número do canal precisa ser indicado). - Selecione apenas a sub-macro "Converter para empilhar" e clique em "ok" e selecione a pasta onde as imagens estão localizadas. Se um diretório principal com várias subpastas é selecionada, todos individuais' .tiff arquivos dentroo diretório principal e subpasta correspondem aos critérios de cordas de arquivo exclusivo será processado.
- Se o z-pilha contém apenas um canal, seleccionar a opção "canal só um".
- Observe que dois novos arquivos por imagem MNJ, por padrão denominado como stack_image_name e flatstack_image_name aparecerá. Armazenar apenas estes pilha e flatstack para análise posterior. A série .tiff pode ser excluído neste momento, minimizando as capacidades de armazenamento necessários e evitando fontes de erro potenciais.
4. Executar Sub-macro "Definir ROI" para delinear o Terminal MNJ de Interesse
- Inicie a interface gráfica de "Drosophila MNJ Morfometria".
- Seleccione apenas a opção "Definir ROI" e pressione "OK" e selecione o diretório principal onde as imagens direito flatstack_name são armazenados e pressione "Selecionar". O sub-macro "Definir ROI" procura automaticamente através de todas as subpastasdentro do diretório principal selecionado.
- Como a primeira projeção se abre, selecione a opção "seleções Freehand" ferramenta na barra de ferramentas. Usando o mouse desenhe uma seleção que contém exclusivamente o terminal completa MNJ de interesse e clique em "OK" na janela "Definir terminal". A macro irá prosseguir com o próximo projecção.
- Delinear a próxima ROI e repetir até que todas as ROIs são definidos. O arquivo de imagem ROI, chamado "roi_image_name", serão armazenados no mesmo diretório que as imagens de pilha e de projeção anteriormente geradas para cada uma das imagens processadas. A saída deste sub-macro é uma imagem binária do ROI em branco sobre um fundo preto.
5. Run Sub-macro "Analisar" para Quantificar Características MNJ Terminal
- Vá para a barra de ferramentas, selecione "Plugins" e uso:
"Drosophila _NMJ_Morphometrics" quando analisando sinapses imunomarcadas com anti-Dlg-1 ou anti-HRP (canal 1), juntamentecom anti-Brp (dois canais), ou "Drosophila _NMJ_Bouton_Morphometrics" quando analisam sinapses imunomarcadas com anti-SYT ou anti-CSP (canal 1), juntamente com o Brp (canal 2).- Quando um canal de pilhas de imagens são para ser analisada (o canal estrutural Dlg-1 ou HRP para "Drosophila_ NMJ_Morphometrics", ou SYT ou CSp para "Drosophila _NMJ__Bouton_Morphometrics"), seleccionar o quadro "Canal apenas 1".
- Ajustar a escala correspondente para as imagens a serem analisadas. Se um pixel da imagem corresponde a 2,5 mm, indicam Escala Pixels-= 1, escala-Distância em? M = 2,5. No caso de ambas as configurações são deixados em 0, a área MNJ, perímetro, comprimento e maior comprimento ramo será expressa em número de pixels.
- Se necessário, ajuste as configurações de análise padrão da macro. Realizar ajustes apenas se a sub-macro "Analisar" (esta seção com resultados insatisfatórios, e determined melhores configurações na secção 6) foi executado.
- Marque as caixas "Analisar" e "Wait" e pressione "OK".
- Selecione a caixa de seleção "Wait" ao executar a sub-macro "Analisar" em 2 imagens dos canais. Caso contrário, erros na contagem zona ativa pode ocorrer devido a capacidades de computador limitados.
- Como uma nova janela "Escolha uma Directory" se abre, selecione o diretório onde as imagens estão localizadas e pressione "select". A macro irá analisar todas as imagens armazenadas no diretório principal e, se aplicável, as pastas subsequentes (usando os três arquivos de executar os sub-macros anteriores: stack_image_name, flatstack_image_name e roi_image_name). Os macroprocessos cada imagem individual e consecutivamente. Isso pode levar vários minutos por pilha de imagens (dependendo da capacidade do computador).
- Depois de executar a macro, note que um novo arquivo de imagem chamado res_image_name para cada analisados sinapse armazenado será created na pasta dos pais. As medições quantitativas serão armazenados como arquivo "results.txt".
- Inspecione todas as imagens de resultado para detectar e excluir fotos com erros de segmentação. Erros de segmentação possíveis são descritos na Tabela 3, juntamente com conselhos como ajustar as definições para contornar estes. Imagens resultado com tais erros de segmentação são fornecidos como exemplos na Figura 4.
NOTA: Ao executar o macro com as configurações padrão observados na interface do usuário, houve uma precisão de cerca de 95% quando a avaliação macro foi comparado com avaliação manual 17.
6. Ajuste as configurações de macro para as Imagens
- Quando mais de 5% das imagens mostram erros de segmentação, explorar os diferentes algoritmos para definir / escolher as configurações de macro mais adequados para as imagens.
- Ajuste rolando valor de raio bola
NOTA: O raio de bola rolandofunção subtrai o fundo da imagem. Esta função é de importância crucial quando se trabalha com imagens adquiridas em microscópios de fluorescência e / ou quando as imagens têm de ruído elevado ruído de fundo. A subtração do fundo vai ajudar etapas auto-thresholding do macro para produzir segmentação adequada dos terminais MNJ.- Selecione três Z-projeções MNJ (imagens flatstack_image_name gerados pelo sub-macro "Converter para empilhar") que são representativos do conjunto de dados de imagem.
- Na barra de ferramentas, selecione Imagem | Cor | canais de Split. Duas imagens será criado, um representando um canal e o outro canal 2.
- Manter somente a imagem que pertence a um canal aberto, que corresponde a Dlg-1, de hrp, SYT ou CSp imunomarcação, e descartar a imagem do canal Brp fechando a imagem.
- Execute o filtro "background Subtrair" selecionando "Processo" na barra de ferramentas, seguido de "Background Subtrair ..." no menu suspenso.
- Clique na caixa de pré-visualização em que a janela e ajustar o raio da esfera de rolamento para o valor que aumentar o contraste entre o fundo e sinapse como no painel (Figura 5A').
NOTA: Veja a Figura 5 para um exemplo. Em Figure5A, partes da sinapse são mostrando os mesmos níveis de cinzento como o fundo, ao passo que na Figura 5A' o 'rolamento raio da esfera' definida como 500 gera um forte contraste entre a sinapse e o fundo. - Quando o valor apropriado para o raio bola rolar é definido, execute o algoritmo de "background Subtrair" nos Z-projeções selecionados com o mesmo valor de raio bola rolando e salvá-los (em qualquer diretório).
NOTA: O valor do raio bola rolando para 8 bits ou imagens RGB deve ser pelo menos tão grande como o raio do maior objeto na imagem que não faz parte do plano de fundo. Para imagens de 16 bits e 32 bits do raio deve ser inversely proporcional à faixa de valor de pixel 22.
- Determinar as diferentes auto-limiares que serão usados
- Abra os Z-projeções salvos na etapa anterior (6.2.6) e Selecionar imagem | Ajuste | AutoThreshold | Tente todos.
- Como uma imagem resultado thresholded binário aparecerá com todos os diferentes algoritmos de auto-limiar, determinar o algoritmo mais adequado para as imagens.
- Ao executar o macro mais tarde, alterar o limite nas configurações de macro em conformidade.
- Use limites mais restritivos como "RenyiEntrophy" ou "Momentos", como o limite de contorno MNJ e limiares mais permissivas, como "Li" para determinar o esqueleto MNJ, e "Huang" para determinar zonas ativas. Quando as imagens são muito nítidas com pouco ou nenhum fundo, use "Huang" como" limiar esboço MNJ. Caso contrário partes da sinapse pode estar faltando depois de segmentação de imagens.
- Ver Figura 5B para um exemplo. adequada segmentação da sinapse é obtido com auto-limiares destacadas por caixas verdes. Alguns exemplos de limiares não-adequados são realçadas por caixas vermelhos (vá sinapses em alta ampliação). Neste último, tanto as partes da sinapse estão faltando ou partes do fundo estão incluídos. Ver referência 23 para mais informações.
- Determinar o tamanho máximo das partículas pequenas
NOTA: Esta função irá excluir todas as partículas detectadas pelo limiar esboço MNJ e limite de esqueleto que são menores do que o valor definido na "definição pequenas partículas" da análise. Este valor é definido em pixels. Esta função serve como um filtro de ruído e é muito útil quando as altas taxas de fundo não uniforme (como cristais / pó) estão presentes nas imagens obtidas.- Abra os Z-projecções guardados no passo 6.2.6. e definira escala para detectar número de pixels através Analisar | Set Scale. Aplicar as seguintes configurações: distância em pixels = 1, conhecida distância = 1, proporção de pixel = 1, unidade de comprimento = pixels e pressione "Ok". Clique na ferramenta "seleção Oval" na barra de ferramentas.
- Utilizando o rato desenhar uma selecção circundante estreitamente partículas individuais que estão presentes no imunocoloração mas não pertencem ao MNJ. Pressione Ctrl + m para um usuário do Windows ou CMD + m para usuários de Mac. Uma janela de resultado será aberta, indicando a área das partículas seleccionadas em número de pixels.
- Repetir os passos anteriores várias vezes com vários artefactos presentes nas imagens para determinar a maior área de contaminação da partícula / artefato. Este será o valor a ser definido na configuração durante a execução do macro mais tarde. Ao executar a macro definir a "partículas de tamanho pequeno" como o menor tamanho de partícula pus observada uma margem de 25%.
- Ver Figura 5D para um exemplo. A maior cristal detectared tem uma área de 112 pixels. A configuração "tamanho Pequenas partículas", ao processar esta imagem com o macro, deve ser definida a 125 - 150.
- Determine o tamanho mínimo bouton
NOTA: Esta função irá excluir todos os boutons detectados pelo limiar esboço MNJ que são menores do que o valor definido a partir da análise. Este valor é definido em pixels.- Seguir os mesmos passos como descrito na secção 6.4, mas neste caso estabelecer uma selecção circundante as menores boutons presentes no terminal JNM. Escolha a menor área correspondente ao menor bouton dos mais medidas. Este é o valor a ser definido na definição de tamanho mínimo bouton ao executar a macro mais tarde.
- Definir "Encontrar máximos de ruído tolerância" valor
- Utilizar os Z-hyperstacks seleccionados na secção 6.2.1.
- Na barra de ferramentas, selecione Imagem | Cor | canais de divisão para create 2 pilhas (para os canais 1 e 2) e manter a imagem que corresponde ao canal Brp aberta. Descartar a imagem outro canal fechando-o.
- Vá até a aba plugins no menu pop-up, selecione Processo | Máxima (3D), e quando o maximum_image_name aparece (que pode levar até alguns minutos), feche a pilha imagem original.
- Selecione a Máxima ... image_name (a pilha imagem obtida) e selecione Plugins | processo | Mínimo (3D), feche o máximo ... pilha image_name.
- Na barra de ferramentas, selecione Processo | Encontrar maxima .... Uma nova janela "Encontrar maxima ..." será aberta. Clique no botão "seleção de ponto de visualização ..." caixa de seleção e preencher a caixa de "tolerância Noise" com a configuração 50. Os pontos máximos será indicado na imagem como pequenas cruzes macro padrão.
- Aumentar o valor "tolerância Noise" se observar um excesso de zonas ativas anotados, ou seja cruzes que não estão no topo de zonas ativas que estão emse concentrar no plano pilha selecionada, ou zonas ativas falsos que são detectados no fundo.
- Por outro lado, se observando incompleta anotada zonas ativas, ou seja, zonas ativas em foco não ser rotulado reconhecido, diminua o valor "tolerância Noise". Continue tentando valores diferentes seguintes este procedimento até que as cruzes são rotular adequadamente zonas ativas em foco. Encha o "Find a tolerância de ruído máximos" com este valor.
- Ver Figura 5C para um exemplo. Muitas zonas ativas são detectados. Na Figura 5C' apenas as zonas ativas em foco são detectados.
- Aumentar o valor "tolerância Noise" se observar um excesso de zonas ativas anotados, ou seja cruzes que não estão no topo de zonas ativas que estão emse concentrar no plano pilha selecionada, ou zonas ativas falsos que são detectados no fundo.
- Execute o sub-macro "Analisar" para as imagens representativas selecionados na etapa 5.1, com as configurações definidas em todas as etapas anteriores.
- Ajuste-Brp pontos lacrimais limiar superior e inferior
- Observe que um novo arquivo será exibido após a execução do macro de acordo com a etapa 6.6, chamado 2_active_zone_stack_image_name. Nesta imagem empilhar as zonas activas detectados pela função "Encontrar máximos" são indicadas por pontos brancos em cada avião.
- Abrir este arquivo, arrastando e soltando-o na barra de ferramentas e selecione Imagem | Stack | Zproject | Tipo de projecção = fatias Sum. será obtida uma projecção do 2_active_zone_stack_image_name.
- Selecionar Imagem | Ajuste | Limite. Uma nova janela "Threshold" será aberta. Deslizar a barra superior para escolher um valor limiar, onde, todos os pontos / focos desejado Brp-positivos são visualizados no vermelho.
NOTA: Se o limite é muito baixo, um excesso de zonas ativas serão contadas. Se for definido muito alto, uma fração das zonas ativas serão perdidas.- Ver Figura 5E para um exemplo. Quando limiar é ajustado para 400, a maior parte das zonas activas (simbolizados como um pixel de focos 1) não estão incluídos na segmentação, uma vez que eles não são destacadas em vermelho (Figura 5E). Quando limiar é ajustado a um valor de 50 todas as zonas activas são destacadas em vermelho (Figura 5E).
- Definir esse valor como limite mínimo. Deixar "limiar puncta superior" no valor máximo.
- Execute novamente o sub-macro "Analisar" para as imagens representativas com as configurações definidas em todas as etapas anteriores desta seção. Avaliar criticamente os arquivos de imagem resultantes e certificar-se de que a segmentação é feito corretamente. Se este não é o caso reajustar as definições de acordo com a natureza dos erros de segmentação (Figura 4, Tabela 3).
Resultados
O arquivo de resultados de texto aparecerá no diretório principal. É resume todos os parâmetros medidos por imagem. Os resultados estão ligados ao nome do ficheiro e os parâmetros são subsequentemente resumidos na ordem indicada nas Tabelas 1 e 2.
Res_image_name é uma pilha de três imagens. A primeira imagem destaca o contorno e esqueleto do terminal JNM determinada pela macro baseado no canal 1 (imunomarcação Dlg-1, de hrp, SYT, ou CSP). A segunda imagem é uma cópia da primeira imagem e adicionalmente mostra as manchas BRP-positivos identificados que são detectadas no canal 2 como focos esquematizado. A terceira imagem fornece a máxima projecção do segundo canal em conjunto com focos Brp-positivos identificados.
O limiar esboço MNJ é representado em amarelo na imagem resultado de saída macro. área MNJ, Perimeter e número de boutons são deduzidas a partir deste limiar.
O limiar esqueleto MNJ é representado em azul na imagem resultado de saída macro. comprimento MNJ, maior comprimento ramo, número de agências, pontos de ramificação e ilhas são deduzidas a partir deste limiar.
O limiar zonas ativos MNJ não está representada na imagem resultado de saída macro. Este limiar determina a área onde os focos Brp positivo potencialmente poderia ser encontrado pela macro. Destina-se a criar uma área MNJ que é ligeiramente maior do que o definido pelo limite esboço MNJ. Quando um limiar demasiado restritiva é seleccionado, focos Brp-positiva localizada na margem da sinapse pode ser excluída. Quando o limiar é também permissiva, o ruído de fundo pode ser considerado como positivo Brp-manchas (Figuras 1 - 2).
para validate o desempenho da macro "Drosophila JNM Morfometria", três condições mutantes que já foram descritos para apresentar defeitos sinápticas em diferentes parâmetros JNM foram testados. Cada defeito foi detectada por um processo de segmentação de imagens diferente realizada pela macro (JNM esboço, as zonas activas esqueleto ou, respectivamente 17). Após a segmentação dos três genes de interesse por RNAi indutível e dissecção de palco e JNM imunocoloração de larvas L3, o macro foi executada. As medições morfológicas JNM obtidos foram, em seguida, aos pares (ARNi contra a sua testemunha) comparados usando um teste t. Em todos os três casos, foram encontradas diferenças estatísticas entre mutantes e controlos que afectam os parâmetros que estão de acordo com os defeitos morfológico anteriormente relatados. Isto confirma que as macros são, de facto capaz de identificar de forma adequada defeitos anteriormente descritos na Drosophila JNM.
Anquirina 2 (Ank2, CG42734) mutantes são conhecidos por exibir defeitos morfologia sinápticas, incluindo boutons fundidos e NMJs menores. Estes defeitos foram observados para Ank2 mutantes 24, 25 e Ank2 knockdown moscas 26. JNM terminais de pan-neuronais Ank2- ARNi moscas knockdown (w; UAS-Dicer-2 / UAS-Ank2 ARNi KK107238; elav-Gal4 / +) mostrou significativamente menor área JNM (média = 339,25? M 2; teste t de p = 2,18 x 10 -8) e de perímetro (média = 238,24 m; teste t de p = 1,82 x 10 ~ 3), em comparação com o conjunto de dados de controlo genético fundo (w; UAS-Dicer-2 / UAS-KK60100; elav-Gal4 / + ) (média = 451,95? m 2 e média = 288,62 mm, respectivamente) após a execução de "Drosophila JNM Morfometria" (Figuras 6A & 4B).
O GTPase Rab3a (CG7576) é necessário para distribuição bruchpilot adequada e o mutante rup apresenta-se com um número significativamente reduzido de zonas activas 27. Observou-se uma diminuição significativa no número de zonas activas quando se mede focos Brp-positiva pela macro "Drosophila JNM Morfometria" nos terminais JNM de moscas knockdown Rab3a pan-neuronais (w; UAS-Dicer-2 / UAS-RNAi KK100787; elav -Gal4). O número médio de zonas activas por terminal JNM em Rab3a -RNAi era de 138, em contraste com 290 detectada no conjunto de dados de controle (/ +) t de Student p = 4,43 x 10 -29) (Figuras 6A e 4C).
Highwire (HIW, CG32592) é um regulador importante do crescimento JNM; mutações no gene levam hiw para cobrir e estendido ramificação dos terminais JNM 28. Medindo terminais de JNM neuronal pan-linha knockdown Hiw -RNAi (w; LAS-Dicer-2 / UAS-RNAi-GD36085; elav-Gal4 / +) com "Drosophila JNM Morfometria", não foram observadas diferenças significativas nos parâmetros derivados do esqueleto: comprimento (média = 147,36 m; controlo média = 122,07 m; t -test p = 7,31 x 10 -7), maior comprimento do ramo (média = 122,19 m; controlo média = 105,65 m; teste t de p = 4,62 x 10 -4) número de ramos (média = 7,69; controlar média = 5,74; teste t de p = 2,52 x 10 ~ 2) e o número de pontos de ramificação (média = 2,73; controlar média = 1,79; teste t de p = 3,31 x 10 ~ 2). Todos estes parâmetros foram significativamente aumentados (120-180%) comparado com os controlos de fundo genético (w; UAS-Dicer-2 / UAS-GD60000; elav-Gal4 / +) (Figuras 6A e 4D).
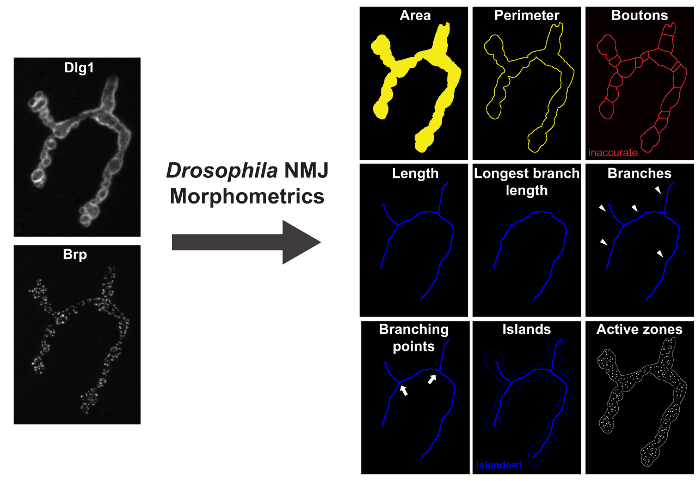
Figura 1: Drosophila _NMJ_Morphometrics medidas 9 Parâmetros do Drosophila MNJ. À esquerda são Dlg-1 e da BRP immunolabeled terminais MNJ, fotografada em um microscópio de fluorescência com ApoTome. À direita são imagens resultado depois de executar "Drosophila MNJ Morfometria". Parâmetros área, perímetro e boutons são representados pelo contorno amarelo anotada-macro indicada. comprimento parâmetros, maior comprimento ramo (LBL), ramos, pontos de ramificação, e ilhas são apresentados pelo contorno azul anotada-macro. focos BRP-imunomarcadas (zonas ativas) são representados pela macro como manchas brancas nas imagens de resultados. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: Drosophila JNM Bouton Morfometria mede 8 Parâmetros da Drosophila JNM. À esquerdasão SYT-1 e Brp immunolabeled terminal de JNM, fotografadas num microscópio de fluorescência com ApoTome. À direita são imagens resultado depois de executar "Drosophila MNJ Bouton Morfometria". Parâmetros boutons e área de bouton são representados pelo contorno amarelo anotada-macro. comprimento parâmetros, maior comprimento ramo (LBL), ramos, pontos de ramificação, e ilhas são apresentados pelo contorno azul anotada-macro. focos BRP-imunomarcadas (zonas ativas) são representados pela macro como manchas brancas nas imagens de resultados. Por favor clique aqui para ver uma versão maior desta figura.
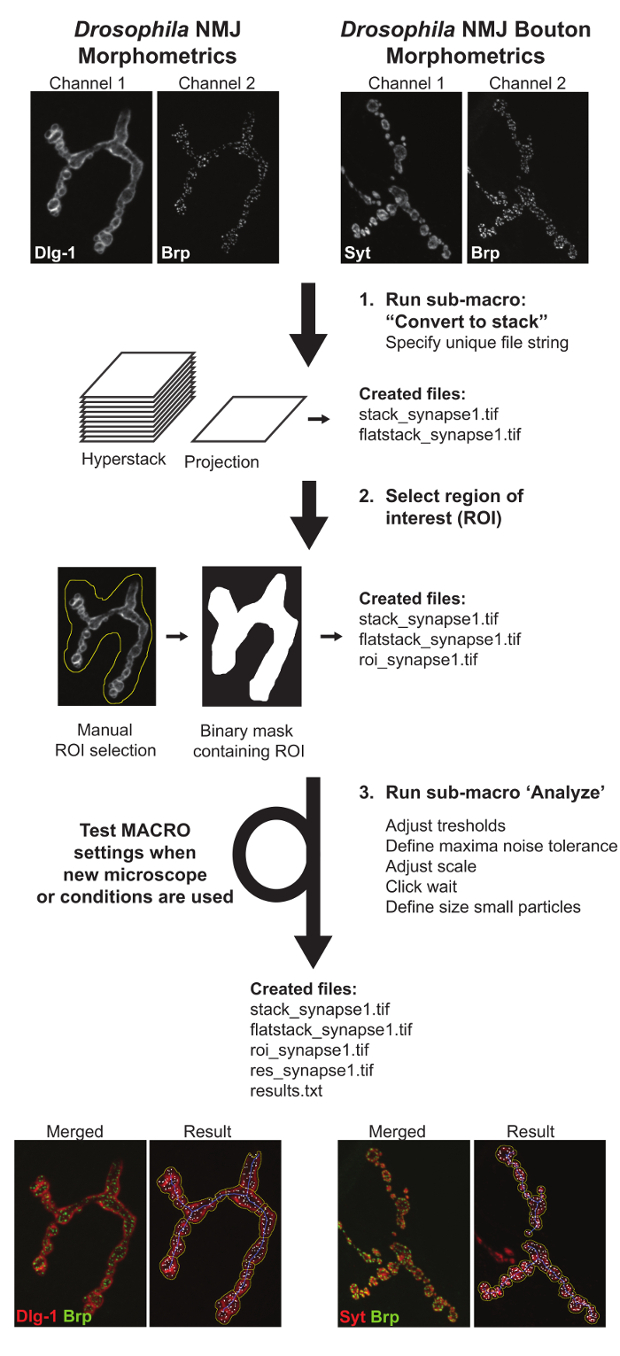
Figura 3: Fluxograma Representando Drosophila MNJ Morfometria e Drosophila MNJ Bouton Morfometria Macros. O primeiro sub-macro "Converter tO pilha" cria projecções e hyperstacks dos NMJs fotografadas. O segundo sub-macro 'definem ROI' requer entrada manual que define o local do terminal JNM de interesse. Sub-macro três, 'Análise', medidas de todos os parâmetros NMJ. Um texto arquivo contendo os valores quantitativos e um arquivo de imagem resultado retratando o delineamento parâmetro são criados para auxiliar a avaliação do usuário do desempenho macro. Quando as imagens são adquiridas em condições diferentes, as configurações de macro tem de ser testado e ajustado para garantir a análise precisa. por favor clique aqui para ver uma versão maior desta figura.
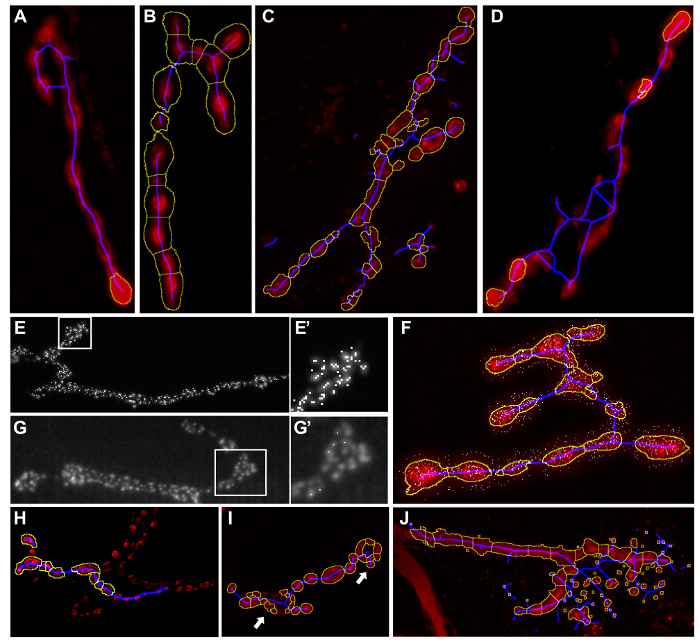
Figura 4: Exemplos de resultados inadequados Segmentação Macro. Imagens resultado depois de executar "Drosophila MNJ Morphometrics" ou 'Drosophila JNM Bouton Morfometria'. As peças do terminal sináptico não estão incluídos no esboço amarelo (A). As partes do fundo são incluídos no terminal sináptico pelo contorno amarelo (B). A linha esqueleto azul se estende para além do terminal sináptico. (C - D) Demasiados zonas activas são detectadas (E - E '). Algumas zonas activas permanecer sem ser detectada pela análise (L - L'). zonas activas são detectadas fora da sinapse (F) incorrecto segmentação Bouton. (Apenas durante a execução de Drosophila JNM Bouton Morfometria), boutons são perdidas (H) ou demasiadas boutons são detectados pela segmentação (I). as partículas tais cristais ou pó que são parte do fundo são incluídos na segmentação (J) . Informações como alterar as configurações para evitar esses erros são fornecidos na Tabela 3 . Por favor clique aqui para ver uma versão maior desta figura.
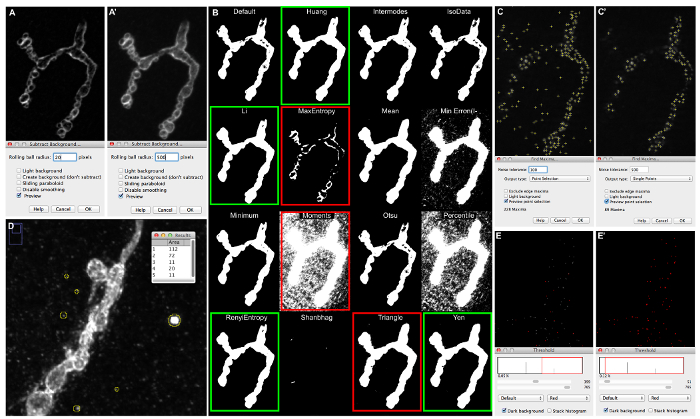
Figura 5: Exemplos de Ajustes de definição de macro e suas conseqüências para Segmentação de imagem. (A) Subtrair visualização de uma sinapse immunolabeled Dlg-1, fotografadas num microscópio de fluorescência com ApoTome fundo, quando "Rolling raio da esfera" é definido como 20 (A) ou 500 (A'). (B) imagens de saída obtidos após a execução de Imagem | Ajuste | Auto-Threshold | Experimente toda a imagem ilustra segmentações de imagem obtidos pelos 16 diferentes algoritmos de auto-limite. (C) "Encontrar Maxima" preview quando a criação de "tolerância Noise" a 50 (C) e 500 (C'); CAzonas tivos que são detectados pela segmentação são rotulados por uma pequena cruz. (D) A medição das partículas "pequenas" que aparecem na imagem do fundo de uma sinapse immunolabeled com anti-HRP, fotografadas num microscópio confocal. (E) "fatias Sum" de projecção obtida a partir da 2_active_zone_stack_ima-ge_name. Limiar é fixada em 400 (E) e a 50 (E'). Por favor clique aqui para ver uma versão maior desta figura.
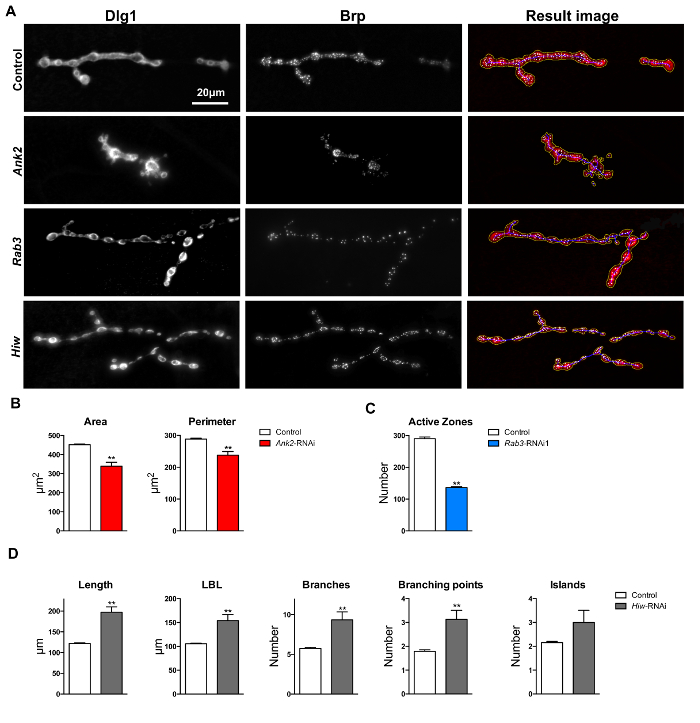
Figura 6: Avaliação Macro e quantificação de NMJs em imagens Muscle 4. (A) Resultado após a execução de macro "Drosophila MNJ Morfometria" na DLG-1 e da BRP immunolabeled terminais MNJ. área de parâmetros, perímetro e boutons são representadas pelo contorno amarelo macro-anotada. comprimento parâmetros, maior comprimento ramo (LBL), ramos, pontos de ramificação, e ilhas são apresentados pelo contorno azul anotada-macro. focos BRP-imunomarcadas (zonas ativas) são representados pela macro como manchas brancas nas imagens de resultados. A barra de escala indica 20 um. (B) Ankyrin2 RNAi knockdown exibem uma área JNM menor perímetro e em comparação com controlos de fundo genéticos. (C) Rab3a knockdown resultou em NMJs com um menor número de zonas activas Brp-positivos em comparação com controlos de fundo genéticos. (D) knockdown Highwire resultou em mais longa, maior maior comprimento de ramo, mais ramificada e com pontos de ramificação mais por terminais JNM comparação com genéticos NMJs de controlo de fundo. As barras de erro indicam SEM, ** p <0,01, dois teste t unilateral. Por favor, clique elere para ver uma versão maior desta figura.
| Parâmetro | estrutura MNJ | Explicação |
| Área (um2) | esboço MNJ | A área da completa MNJ rotulada |
| Perímetro (m) | esboço MNJ | O perímetro pertencente à área |
| #Boutons | esboço MNJ | O número de boutons sinápticas ( 'pérolas em uma string') do MNJ |
| Comprimento (mm) | Esqueleto | O comprimento total do terminal completa JNM |
| Maior comprimento de ramificação (m) | Esqueleto | A soma do comprimento do maior caminho contínuo de conectar os dois pontos finais do MNJ |
| #Ramoes | Esqueleto | O número total de ramos |
| pontos #Branching | Esqueleto | O número de pontos de ramificação (vários ramos pode derivar a partir de um ponto de ramificao) |
| #Islands | Esqueleto | O número de não-ligados compartimentos sinápticas dlg1-positivos (ou qualquer outro coloração) |
| zonas #Active | manchas BRP-positivo | O número de zonas activas, com base na coloração Brp |
Tabela 1: MNJ parâmetros medidos pela "Drosophila MNJ Morfometria". Os parâmetros MNJ medidos pela macro "Drosophila MNJ Morfometria" aparecerá como uma lista no arquivo de texto obtido, seguindo a ordem descrita nesta tabela. Esta tabela é reproduzida de Nijhof et al. 17
| Parâmetro | estrutura MNJ | Explicação |
| boutons | esboço MNJ | O número de boutons sinápticas ( 'pérolas em uma string') do MNJ |
| área Bouton | esboço MNJ | A área total de todos os boutons |
| Comprimento (mm) | Esqueleto | O comprimento total do terminal completa JNM |
| Maior comprimento de ramificação (m) | Esqueleto | A soma do comprimento do maior caminho contínuo de conectar os dois pontos finais do MNJ |
| #Branches | Esqueleto | O número total de ramos |
| pontos #Branching | Esqueleto | ºe número de pontos de ramificação (vários ramos podem derivar de um ponto de ramificação) |
| #Islands | Esqueleto | O número de não-ligados compartimentos sinápticas dlg1-positivos (ou qualquer outro coloração) |
| zonas #Active | manchas BRP-positivo | O número de zonas activas, com base na coloração Brp |
Tabela 2: MNJ parâmetros medidos pela "Drosophila MNJ Bouton Morfometria". Os parâmetros MNJ medidos pela macro "Drosophila _Bouton_NMJ_Morphometrics" aparecerá como uma lista no arquivo de texto obtido, seguindo a ordem descrita nesta tabela. Esta tabela é reproduzida de Nijhof et al. 17
| segmentação | Erros observados | Exemplo | ajustes necessários | |
| Área MNJ e perímetro (Representado pelo contorno amarelo image resultado in) | Partes do terminal sináptico ou não estão incluídos no esboço amarelo ou partes do fundo são incluídos no terminal sináptico contorno amarelo. | A Figura 5A-B | Ajustar o valor 'Rolling bola Radius'. Ver secção 6.1. | Ajuste 'limiar esboço MNJ'. Consulte a seção 6.2. |
| parâmetros do comprimento em relação JNM (representado pela linha esqueleto azul na imagem resultados) | A linha azul esqueleto, quer se estende para além de, ou não está presente ao longo de todo o terminal sináptico. | A Figura 5C-D | Ajustar o valor 'Rolling bola Radius'. Ver secção 6.1. | Ajuste 'limiar esboço MNJ'. Consulte a seção 6.2. |
| puncta BRP-positivo (representados por pontos resultados imagem in) | Muitas zonas ativas são detectados. | A Figura 5E-E' | Diminuir o valor 'Encontrar tolerância de ruído maxima'. Consulte a seção 6.5. | |
| puncta BRP-positivo (representados por pontos resultados imagem in) | zonas ativas são perdidas pela análise. | Figura 5G-L' | Aumentar o valor 'Encontrar tolerância de ruído maxima'. Consulte a seção 6.5. | Diminuir 'limiar inferior Brp-puncta'. Ver secção 6.6. |
| puncta BRP-positivo (representados por pontos resultados imagem in) | artefactos zona activa são detectados fora do terminal sináptico. | Figura 5F | Ajuste secção 6.2 'limiar zona ativa'. | Aumentar 'limiar inferior Brp-puncta'. Ver secção 6.6. |
| pequenas partículas | Partículas tais cristais ou pó que fazem parte do plano de fundo parecem estar incluídos na segmentação. | A figura 5J | Marque a caixa 'Remover pequenas partículas'. Ver secção 6.3. | Determinar pequenas partículas de tamanho máximo. Ver secção 6.3. |
| segmentação Bouton | segmentação incorreta bouton (Apenas aplicável a Drosophila MNJ Bouton Morfometria, não use Drosophila MNJ Morfometria para a segmentação bouton). | A Figura 5H-I | Ajuste 'limiar esboço MNJ'. Ver secção 6.1. | Determine 'tamanho mínimo bouton'. Consulte a seção 6.4. |
Tabela 3: Resolução de problemas Guia para os diferentes tipos de erros em Segmentação de imagem que pode ser produzido pelo Macros. Esta tabela descreve os diferentes tipos deerros de segmentação de imagem produzidos pelas macros. Estes podem ser facilmente detectadas nas imagens resultados. Os exemplos de cada tipo de erro são mostrados em Figura 4. Na seção "ajustes" da tabela, as configurações que precisam ser ajustados são destacados, eo usuário é referido sub-passo crítico da secção 6, que descrevem como ajustar essas configurações.
Discussão
"Drosophila MNJ Morfometria" e "Drosophila MNJ bouton Morfometria" são ferramentas poderosas para pesquisadores interessados em avaliar a morfologia sinapse. avaliação manual dos parâmetros MNJ é trabalhoso; estima-se que as macros iria salvar um investigador experiente até 15 min / MNJ gasto em segmentação de imagem manual. Com uma a duas dezenas de sinapses avaliadas por condição ou genótipo, este rapidamente resume a uma quantidade considerável de tempo economizado, mesmo em estudos de pequena escala. Ao realizar telas grandes, o ganho do uso de análise de alto rendimento, em comparação com a avaliação manual e quantificação, pode ser imenso. Além do aumento de taxa de transferência, as macros prontamente fornecer análise objectiva; excluem preconceitos pessoais que de outra forma exigem experimentos cegos, bem como diferenças interpessoais que ocorrem quando vários pesquisadores estão envolvidos na análise. Finalmente, as macros fornecem uma uma sensível e precisoANÁLISE das características JNM, permitindo a identificação de reguladores sinápticos que provocam, em vez subtil do que defeitos JNM dramáticas e até agora não apreciado permaneceram pelo olho do investigador. Informações detalhadas sobre procedimentos de validação e os algoritmos utilizados nas macros são encontrados na publicação Nijhof et al. 17.
A funcionalidade das macros foi validado para medir apropriadamente características morfológicas de Drosophila melanogaster NMJs no músculo 4. Subsequentemente, foi demonstrado que as macros foram também adequado para analisar as sinapses em outros músculos neste organismo. É provável que as macros também pode ser utilizado para medir os parâmetros morfológicos de JNM com estrutura semelhante, em outras espécies, incluindo outras espécies de Drosophila e outros insectos. Mesmo NMJs muito distantes em evolução, por exemplo, NMJs de ratinhos, apresentam uma conformação estrutural muito semelhante 29. As macros não foram testados sobre os preparativos MNJ de outras espécies, mas potenciais utilizadores são encorajados a testar as macros para tais fins.
É muito importante que o usuário explora as diferentes auto-limiares e algoritmos para definir / escolher as configurações de macro mais adequados para as imagens. Com estas definições, uma precisão de cerca de 95% é alcançado quando a avaliação macro foi comparada à avaliação manual. Ajustar as configurações de macro para adequadamente segmento 100% das imagens pode ser um procedimento muito trabalhoso ou mesmo impossível. Portanto, a exclusão de imagens não devidamente segmentadas é recomendado se seus números são inferiores a 5%. Evidentemente, se a qualidade das imagens é baixo, as macros irá gerar índices mais elevados de segmentações imagem insatisfatórios. imagens de baixa qualidade irá influenciar semelhante avaliação manual e não pode, portanto, ser associado ao desempenho das macros. No entanto as macros são bastante robustos como eles foram projetados para a imagems gerados em um alto conteúdo microscópio (um microscópio de fluorescência automatizada que permite imagens de um grande número de amostras) 17.
Um ponto crítico é que o utilizador inspecciona visualmente todas as imagens resultados gerados por as macros. Isso permitirá detectar e excluir fotos com segmentação insatisfatória. Na secção 6 deste protocolo, o usuário é guiado como ajustar as configurações de segmentação de imagem correta ao executar a sub-macro "Analisar". Para familiarizar rapidamente com as exigências das macros e como ajustar as configurações de macro uma pasta chamada "Examples_adjusting configurações de macro" está incluído no macro repositório https://figshare.com/s/ec634918c027f62f7f2a. Treze subpastas, cada um com exemplos de imagens obtidas em diferentes plataformas de microscópio (microscópios elevado teor / confocal / fluorescência) e diferentes colorações imunológicas, são fornecidos. A PDF intitulado “Exemplos guia” está incluído na mesmapasta onde as configurações necessárias para cada exemplo são fornecidos, juntamente com um documento de texto fornecendo os resultados esperados e imagens resultados.
As macros foram projetadas para processar imagens guardadas como .tiff arquivos separados, no entanto alguns usuários podem ter salvo suas imagens em um formato diferente. A seguir https://figshare.com/s/ec634918c027f62f7f2a website 21 contém uma pasta chamada "Drosophila MNJ", onde três arquivos de exemplo (Exemplo 1-3) eo "Guia de exemplos" do documento com instruções detalhadas sobre como importar imagens para o macro se não for armazenado como .tiff arquivos separados também podem ser encontradas na mesma pasta.
Juntos, "Drosophila MNJ Morfometria" e "Drosophila MNJ bouton morfometria" macros quantificar dez diferentes características MNJ: área MNJ, perímetro MNJ, Número de boutons, área bouton MNJ, comprimento MNJ, MNJ mais longo comprimento ramo, Número de islaNDS, número de agências, número de pontos de ramificação e número de zonas ativas. Isto proporciona uma grande vantagem sobre as ferramentas até agora disponíveis, que pode avaliar apenas uma ou algumas características sinápticas 30, 31. Análise quantitativa multiparamétricas tem grande potencial para novas descobertas, por exemplo, para identificar novos reguladores que controlam um até vários aspectos da biologia sinapse. Ele também proporciona a resolução necessária para determinar genes que coregulate exactamente as mesmas características ou sobrepostos JNM e assim são susceptíveis de operar em vias moleculares comuns. Finalmente, ele abre a possibilidade de investigar como diferentes parâmetros sinápticas se correlacionam com o outro em condições não perturbadas 17 e que genes garantir tais correlações morfométricas coordenadas.
Tomados em conjunto, este protocolo ilustra como usar as duas macros "Drosophila MNJ Morfometria" e"Drosophila JNM Bouton Morfometria", que executam a quantificação objectivo e sensível de dez características morfológicas JNM de um modo de elevado rendimento.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Reconhecemos centro de estoque de Viena Drosophila Resource Center e Bloomington Drosophila (NIH P40OD018537) para fornecer linhagens de Drosophila. Agradecemos Jack Fransen do Microscopical Imaging Center de apoio especializado em imagem. Este estudo foi apoiado por VIDI e concede superior (917-96-346, 912-12-109) da Organização Holandesa para Pesquisa Científica (NWO), por duas bolsas de doutoramento DCN / Universidade Radboud Medical Center, pela Deficiência Mental rede alemã financiado pelo programa NGFN + do Ministério Federal Alemão de Educação e Pesquisa (BMBF) e pela Gencodys da União Europeia FP7 larga escala integrada de rede (Saúde-241995) para aS. Os financiadores não tiveram nenhum papel no desenho do estudo, coleta de dados e análise, decisão de publicar ou preparação do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Immunostaining | Dilution | ||
| Mouse anti-discs large 1 | Developmental Studies Hybridoma Bank | AFFN-DLG1-4D6 | 1/25 (conjungated using the Zenon Alexa Fluor 528 Labeling Kit) |
| Rabbit anti-horseradish peroxidase | Jackson IR | 323-005-021 | 1/500 |
| Rabbit anti-Synaptotagmin | Gift from Hugo Bellen | Jan-00 | |
| Mouse anti-Cysteine string protein | Developmental Studies Hybridoma Bank | DCSP-1(ab49) | 1/10 (conjungated using the Zenon Alexa Fluor 528 Labeling Kit) |
| Mouse anti-Bruchpilot | Developmental Studies Hybridoma Bank | nc82 | Jan-50 |
| Goat anti-mouse Alexa Fluor 488 | Life technologies | A11029 | 1/200 |
| Goat anti-rabbit Alexa Fluor 568 | Life technologies | A11011 | 1/500 |
| Zenon Alexa Fluor 568 Mouse IgG1 Labeling Kit | ThermoFisher | Z25006 | |
| ProLong Gold Antifade Mountant | ThermoFisher | P36930 | |
| Material | Company | Catalog number | Comments |
| Equipment | |||
| Confocal microscope or fluorescence microscope | Leica SP5 | ||
| Zeiss Axio imager | |||
| Computer | Mac or Pc | ||
| Material | Company | Catalog number | Comments |
| Software | |||
| FIJI |
Referências
- Lin, Y. C., Koleske, A. J. Mechanisms of synapse and dendrite maintenance and their disruption in psychiatric and neurodegenerative disorders. Annu Rev Neurosci. 33, 349-378 (2010).
- van Bokhoven, H. Genetic and epigenetic networks in intellectual disabilities. Annu Rev Genet. 45, 81-104 (2011).
- Penzes, P., Buonanno, A., Passafaro, M., Sala, C., Sweet, R. A. Developmental vulnerability of synapses and circuits associated with neuropsychiatric disorders. J Neurochem. 126, 165-182 (2013).
- Mainen, Z. F., Sejnowski, T. J. Influence of dendritic structure on firing pattern in model neocortical neurons. Nature. 382, 363-366 (1996).
- Yuste, R., Majewska, A., Holthoff, K. From form to function: calcium compartmentalization in dendritic spines. Nat Neurosci. 3, 653-659 (2000).
- Vetter, P., Roth, A., Hausser, M. Propagation of action potentials in dendrites depends on dendritic morphology. J Neurophysiol. 85, 926-937 (2001).
- Bosch, M., Hayashi, Y. Structural plasticity of dendritic spines. Curr Opin Neurobiol. 22, 383-388 (2012).
- Mehnert, K. I., Cantera, R. Circadian rhythms in the morphology of neurons in Drosophila. Cell Tissue Res. 344, 381-389 (2011).
- Sigrist, S. J., Reiff, D. F., Thiel, P. R., Steinert, J. R., Schuster, C. M. Experience-dependent strengthening of Drosophila neuromuscular junctions. J Neurosci. 23, 6546-6556 (2003).
- Ruiz-Canada, C., Budnik, V. Introduction on the use of the Drosophila embryonic/larval neuromuscular junction as a model system to study synapse development and function, and a brief summary of pathfinding and target recognition. Int Rev Neurobiol. 75, 1-31 (2006).
- Menon, K. P., Carrillo, R. A., Zinn, K. Development and plasticity of the Drosophila larval neuromuscular junction. Wiley Interdiscip Rev Dev Biol. 2, 647-670 (2013).
- Kraut, R., Menon, K., Zinn, K. A gain-of-function screen for genes controlling motor axon guidance and synaptogenesis in Drosophila. Curr Biol. 11, 417-430 (2001).
- Parnas, D., Haghighi, A. P., Fetter, R. D., Kim, S. W., Goodman, C. S. Regulation of postsynaptic structure and protein localization by the Rho-type guanine nucleotide exchange factor dPix. Neuron. 32, 415-424 (2001).
- Eaton, B. A., Fetter, R. D., Davis, G. W. Dynactin is necessary for synapse stabilization. Neuron. 34, 729-741 (2002).
- Laviolette, M. J., Nunes, P., Peyre, J. B., Aigaki, T., Stewart, B. A. A genetic screen for suppressors of Drosophila NSF2 neuromuscular junction overgrowth. Genetics. 170, 779-792 (2005).
- Collins, C. A., Wairkar, Y. P., Johnson, S. L., DiAntonio, A. Highwire restrains synaptic growth by attenuating a MAP kinase signal. Neuron. 51, 57-69 (2006).
- Nijhof, B., et al. A New Fiji-Based Algorithm That Systematically Quantifies Nine Synaptic Parameters Provides Insights into Drosophila NMJ Morphometry. PLoS Comput Biol. 12, e1004823(2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9, 676-682 (2012).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Dubos, A., et al. Conditional depletion of intellectual disability and Parkinsonism candidate gene ATP6AP2 in fly and mouse induces cognitive impairment and neurodegeneration. Hum Mol Genet. 24, 6736-6755 (2015).
- Nijhof, B., et al. Drosophila NMJ Morphometrics. , figshare https://doi.org/10.6084/m9.figshare.2077399. (2017).
- Ferreira, T., Rasband, W. ImageJ User Guide IJ 1.46. , http://rsbweb.nih.gov/ij/docs/guide/146-29.html (2014).
- Ferreira, T., Rasband, W. ImageJ User Guide IJ 1.46. , Available from: http://fiji.sc/Auto_Threshold (2014).
- Pielage, J., et al. A presynaptic giant ankyrin stabilizes the NMJ through regulation of presynaptic microtubules and transsynaptic cell adhesion. Neuron. 58, 195-209 (2008).
- Koch, I., et al. Drosophila ankyrin 2 is required for synaptic stability. Neuron. 58, 210-222 (2008).
- Iqbal, Z., et al. Homozygous and heterozygous disruptions of ANK3: at the crossroads of neurodevelopmental and psychiatric disorders. Hum Mol Genet. 22, 1960-1970 (2013).
- Prokop, A. Organization of the efferent system and structure of neuromuscular junctions in Drosophila. Int Rev Neurobiol. 75, 71-90 (2006).
- Wan, H. I., et al. Highwire regulates synaptic growth in Drosophila. Neuron. 26, 313-329 (2000).
- Shi, L., Fu, A. K., Ip, N. Y. Molecular mechanisms underlying maturation and maintenance of the vertebrate neuromuscular junction. Trends Neurosci. 35, 441-453 (2012).
- Sutcliffe, B., Forero, M. G., Zhu, B., Robinson, I. M., Hidalgo, A. Neuron-type specific functions of DNT1, DNT2 and Spz at the Drosophila neuromuscular junction. PLoS One. 8, e75902(2013).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100(2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados