Method Article
Mínimamente invasiva músculo incrustación (MIME) - una nueva técnica Experimental para facilitar la miogénesis mediada por células de donantes
En este artículo
Resumen
Describimos una nueva técnica experimental que llamamos mínimamente invasiva del músculo incrustación (MIME), que se basa en la evidencia que el tejido muscular esquelético contiene células viables miógenas que pueden facilitar la miogénesis mediada por células de donantes cuando están implantados en un músculo de host.
Resumen
Músculo esquelético posee capacidad regenerativa debido a residente de tejido, generadoras de fibra muscular (miógenas) satélite células (SCs), que pueden formar nuevas fibras musculares bajo las condiciones adecuadas. Aunque SCs pueden cosecharse de tejido muscular y cultivan en vitro, las células mioblastos resultante no son muy eficaces en la promoción de miogénesis cuando trasplantó en músculo de host. Quirúrgico exponiendo el músculo host e injerto de segmentos de tejido donante, o las fibras musculares aisladas con sus SCs en músculo de host, promueve mejor miogénesis en comparación con el trasplante de mioblastos. Hemos desarrollado una técnica novedosa que llamamos mínimamente invasiva del músculo incrustación (MIME). MIME consiste en pasar una aguja quirúrgica a través del músculo de host, dibujo un pedazo de tejido del músculo donante a través de la pista de la aguja y entonces dejando el tejido donante incrustado en el músculo de host que puede actuar como una fuente de SCs para el músculo del host. Aquí describimos detalladamente los pasos involucrados en la realización de MIME en un modelo de ratón inmunodeficiente que expresa una proteína fluorescente verde (GFP) en todas sus células. Inmunodeficiencia en el ratón de host reduce el riesgo de rechazo inmunológico del tejido donante y expresión de GFP permite la identificación fácil de las fibras de músculo de host (GFP +) y fibras musculares derivadas de células donantes (GFP-). Nuestros datos experimentales sugieren que MIME puede utilizarse para implantar un músculo extensor digitorum longus (EDL) de un ratón de donantes en el tibial anterior (TA) músculo un ratón anfitrión. Nuestros datos también sugieren que cuando un myotoxin (cloruro de bario, volver2) se inyecta en el músculo de host después de MIME, hay evidencia de miogénesis derivados de la célula donante en el músculo de host, con aproximadamente 5%, 26%, 26% y 43% de las fibras en un solo host TA músculo que muestra la no contribución de host, host mínimo contribución, contribución moderada de host y host máxima contribución, respectivamente.
Introducción
Músculo esquelético sano, aunque poste-mitotic, posee excelente capacidad de regeneración debido a la presencia de tejido-residente miógenas células conocidas como células satélite (SCs)1,2; y ha comentado en3,4. Sin embargo, bajo condiciones patológicas causadas por distrofias musculares, traumas o envejecimiento acelerado, la regeneración del músculo podría no continuar con la degradación muscular, y por lo tanto, ocurre una pérdida de fibra muscular progresiva5. Aunque se han desarrollado métodos efectivos para aislar SCs del músculo y ampliar en la cultura para generar gran número de mioblastos (y posteriormente miotubos), intenta generar fisiológicamente relevantes números de fibras musculares en el músculo de host tienen rindió solamente éxito mínimo6. Como con muchos otros tipos de células, cuando mioblastos se inyectan solo en tejido anfitrión, la mayoría de las células no engraft7,8. Hemos demostrado que la estimulación eléctrica neuromuscular (NMES) facilita la miogénesis derivados de la célula donante en músculo de ratón deficiente regeneración anfitrión que fue inyectado con mioblastos humanos8. Otros han demostrado que quirúrgico injerto músculo hecho una biopsia o solo las fibras musculares con SCs adjuntos, facilitar la miogénesis moderada sin NMES, sugiriendo que podría ser más ventajoso que implantar implantar toda las fibras musculares con SCs miogénica de las células solo9,10. Como donante o ingeniería tejido injertado en músculo de host produce mejores resultados que el trasplante las células solas, es posible que tejidos o estructuras del tejido pueden proporcionar señales cruciales para el engraftment de la célula donante; un concepto que se está convirtiendo en cada vez más evidente en estudios de terapia celular con varias células tipos10,11,12.
Los datos recientes sugieren que SCs obtenidas de seres humanos más de 2 semanas post mortem generan miotubos en cultura13. Por lo tanto, nos proponemos evaluar si la implantación del músculo tejido cosechado post mortem en un anfitrión vivo invertirá pérdida de fibra muscular. Hemos desarrollado una técnica novedosa llamada MIME para implante del tejido muscular donante en tejido de músculo esquelético de un anfitrión vivo para promover la miogénesis derivados de la célula donante. MIME consiste en pasar una aguja quirúrgica a través del músculo de host para crear una pista de la aguja; dibujo de un pequeño segmento de tejido del músculo donante a través de la pista de la aguja; dejando el tejido donante incrustados en el músculo del anfitrión; y cerrar los orificios de aguja con adhesivo tisular. Después de practicar la técnica en ratones eutanasia estudió en otros experimentos, han realizado ahora MIME en vivo ratones que son inmunodeficientes y ubicuo expresan una proteína fluorescente verde (GFP), y seguimiento a los 3 y 14 días post-MIME. En el mimo después de 3 días, confirmamos que músculo EDL de ratón (GFP-) donante implantado en ratón anfitrión músculo (GFP +) TA, restos incrustados en el músculo de host. En el mimo después de 14 días, después de volver2 myotoxin lesión para inducir daño y miogénesis, confirmamos que aproximadamente 5%, 26%, 26% y 43% de las fibras en un solo host músculo TA no mostrar contribución acogida, contribución mínima host, host moderada contribución y la máxima sede de contribución, respectivamente. Nucleación central (un marcador de degeneración y regeneración posterior) se ve en aproximadamente el 95% de las fibras musculares de TA después de la inyección de MIME y myotoxin.
Estudiamos los músculos TA 14 días después de MIME + volver2 porque este momento capta la etapa intermedia de la regeneración, cuando una mayoría de las fibras regeneradas son nucleated centralmente. Estudiamos GFP + ratones como anfitriones para MIME, para que cuando nos finalmente trasplante de músculo humano cadavérico en ratones host, seamos capaces de distinguir fácilmente las fibras musculares de origen del host y de los donantes. Utilizamos el ratón músculo EDL como el tejido donante experimental, puesto que solo fibras de este músculo han mostrado mayor potencial miógeno que TA músculos9. El músculo EDL también es sinérgico con el músculo de la TA y tiene similar composición del tipo de fibra. Nuestros datos preliminares sugieren que MIME es capaz de facilitar la miogénesis derivados de la célula donante en el músculo de host.
Protocolo
todos los estudios que involucran animales vivos están aprobados por la institución cuidado Animal y el Comité uso (IACUC) en la Universidad Estatal de Wayne, Detroit, Michigan, Estados Unidos y están de acuerdo con la guía para el cuidado y uso de animales de laboratorio () 8ª edición, 2011, había publicado por la prensa nacional de Academias, 500 quinto Street, NW, 285 de caja de seguridad, Washington, DC 20055, USA). Según los protocolos aprobados de IACUC, procedimientos que implican dolor o señal de socorro se realizaron bajo anestesia general, que es inducida y mantenida por inhalación isoflurano (1.5-5% al efecto). La anestesia fue verificada por la falta de retirada a los pies de pizca y de palpebral o vibrissae respuestas (el porcentaje de isoflurano fue aumentado según sea necesario para mantener el efecto). Debido a la naturaleza mínimamente invasiva de los protocolos, un " puntas estériles " técnica fue seguida. Mientras que los animales estaban bajo anestesia, jalea de petróleo se aplicó a los ojos para evitar la sequedad. No hay tratamientos especiales fueron requeridos; sin embargo, dieta gel fue proporcionado a los animales durante 24 h, siguiendo los procedimientos que la anestesia general. el investigador es aprobado por el IACUC retener analgesia después de MIME, ya que el procedimiento no implica exponer quirúrgicamente el host muscular, ya que se limita a un miembro posterior y no afecta la función normal, y porque muchos fármacos analgésicos comunes son conocidos por afectar la regeneración normal del músculo.
1. Modelos animales
- ratones Host para MIME
- ratones uso NSG-GFP (8-10 semanas, masculino) como anfitriones para el músculo injertos estudios.
Nota: Estos ratones son anfitriones ideal para los injertos allogeneic músculo porque carecen de linfocitos T y B madurados y células de asesino naturales funcionales, deficiencias en la señalización de citocinas y han sido utilizados por otros para que las células no musculares allografting o xenografting < sup clase = "xref" > 14. Ubicua expresión de GFP permite la fácil identificación de host (GFP +) y derivados de la célula donante (GFP-) las fibras musculares.
- ratones uso NSG-GFP (8-10 semanas, masculino) como anfitriones para el músculo injertos estudios.
- Ratones donantes para MIME
- ratones C57BL/6J de uso (semana 12-16) como ratones donantes.
Nota: Estos ratones son donante conveniente ratones porque tienen un genoma totalmente asignado, no son conocidos por tener alguna patología del músculo esquelético, son fácilmente disponibles y económicos y no expresan GFP.
- ratones C57BL/6J de uso (semana 12-16) como ratones donantes.
2. Preparación del tejido muscular donante
- cosecha donantes EDL músculos y atar las suturas guía
- eutanasia los ratones donantes por dislocación cervical y toracotomía realizada bajo anestesia general, administrada por una mesa vaporizador de isoflurano impulsado por oxígeno médico (isoflurano inhalado; 2-5% al efecto).
- a los músculos de la EDL, utilice un par de tijeras quirúrgicas para abrir la piel sobre la superficie anterior de la pierna. Localizar el músculo de la TA en la pata anterior y extráigala para visualizar el músculo EDL que se encuentra detrás del músculo de TA. Deslice la punta de un par de pinzas detrás del músculo EDL y aplique tracción suave para ver si se extienden los dedos del pie (Esto confirma que el músculo es el EDL).
Nota: zona de tejido donante debe ser quirúrgico, asépticamente preparado antes de la cosecha. - Uso ~ segmentos de 10 cm de seda 4-0, sutura trenzada, no absorbible, estéril y hacer dos nudos dobles para las suturas guías se aplican a los tendones proximales y distales del músculo EDL. ( figura 1A).
- Cortar el tendón distal del EDL, reflejar el músculo EDL y cortar el tendón proximal.
- Lugar el donante EDL los músculos en una placa Petri lleno con solución de Ringer ratón.
3. Preparación de Host ratones para MIME
- anestesia
- Coloque el ratón anfitrión bajo anestesia general (isoflurano inhalado; 1.5-5% a efecto) administrado por un vaporizador de isoflurano mesa impulsado por oxígeno médico.
- Inducir la anestesia en una sala de inducción y luego transferir el ratón a un cono de nariz para mantener la anestesia mientras realiza otros procedimientos en el animal. Brindar apoyo térmico con una isotérmica gel almohadilla térmica mientras el animal está bajo anestesia.
- Preparación de la piel
- para quitar el animal ' s de la piel, aplicar una crema depilatoria sobre el aspecto anterior de la pierna trasera izquierda. La pierna derecha sirve como un tramo de control para procedimientos subsecuentes.
- Deje la crema depilatoria en 2 minutos limpiar apagado la crema depilatoria junto con la independiente piel con trapos empapados en fosfato tampón salino (PBS). Después del retiro de la piel, frote la piel con tres paños alternados de povidona-yodo fregar solución y 70% etanol.
- Crear una pista de la aguja en el músculo de TA de host
- pasar una aguja quirúrgica de calibre 18 (1 en largo) a través del centro de la hostia músculo TA a lo largo del músculo ' eje s ( figura 1B). Pase la aguja en dirección caudal a lo, a lo largo de la longitud de los músculos TA y a través del centro del vientre muscular ( figura 1B).
Nota: El propósito de este paso es crear una pista de la aguja, que un trozo de músculo donante puede ser embebido. Incrustar el tejido del donante en el centro del músculo TA potencialmente permitiría el SCs del tejido donante para migrar y facilitar la miogénesis en el host todo músculo TA.
- pasar una aguja quirúrgica de calibre 18 (1 en largo) a través del centro de la hostia músculo TA a lo largo del músculo ' eje s ( figura 1B). Pase la aguja en dirección caudal a lo, a lo largo de la longitud de los músculos TA y a través del centro del vientre muscular ( figura 1B).
- Tejido del donante incrustando en la pista de la aguja de host músculo TA
- una vez la aguja quirúrgica en el host músculo TA, pase las suturas guías en un extremo del tejido donante a través del lumen de la aguja quirúrgica en un Dirección caudo-cefálica ( figura 1).
- Dibujar el tejido donante a través de la pista de la aguja, se retira la aguja del músculo en dirección caudo-cefálica host TA.
- Utilizar las suturas guías en los extremos cefálicos y caudales del tejido donante para ajustar la colocación del tejido donante. Asegurar que el tejido del donante es instalado en el host músculo TA ( figura 1).
- Una vez que se optimiza la colocación de tejido donante, cortar las suturas guías, hacer cualquier ajuste final a la colocación de tejido donante con pinzas de punta fina.
- Cierre cutáneo de heridas la aguja ( Figura 1E -F) por aproximar el borde de la herida con pinzas y aplicar adhesivo tejido veterinaria con la punta de una aguja de calibre 27 quirúrgica.
4. Myotoxin la inyección intramuscular para inducir la degeneración muscular concertada y regeneración
- después de MIME, inyectar 50-60 μL de 1.2% volver 2 (myotoxin) en el host músculo TA para inducir daño extenso fibra muscular en el músculo del host y el tejido donante encajado dentro de ella 15.
- Volver inyectar 2 a 3 sitios a lo largo de la longitud de la hostia TA músculo (proximal, media y distal tercio del vientre muscular).
Nota: Inyección de miotoxinas como volver 2, cardiotoxins y notexin en músculo esquelético induce daño de la fibra de músculo concertada seguida de regeneración 16.
- Volver inyectar 2 a 3 sitios a lo largo de la longitud de la hostia TA músculo (proximal, media y distal tercio del vientre muscular).
5. Cuidado posterior al procedimiento de Animal
- después de MIME y volver 2 inyección, limpiar el ratón de host ' trasero izquierdo s pierna con etanol y aplique una capa delgada de vaselina para proteger la piel.
- Después de cuidado de la piel posterior al procedimiento, retire el ratón anfitrión el cono de nariz.
- Colocar el ratón en una jaula de recuperación solitario sin ropa de cama. Proporcionar apoyo térmico al animal de la recuperación a través de una almohadilla de calefacción isotérmica gel colocado en la mitad de la jaula de recuperación.
Nota: Una mitad no se calienta por lo que ese animal puede alejarse de la almohada si es necesario. - Después de que el ratón anfitrión ha recuperado totalmente de la anestesia, devolver el animal a su jaula original. Coloque la espalda animal en las instalaciones de animales hasta que se realizan experimentos de seguimiento. Controlar el ratón anfitrión diariamente hasta que esté listo para el seguimiento de – ejemplo: en 3 a 14 días post-MIME. Después de MIME, animales son monitoreados por personal del laboratorio así como por personal veterinario – principalmente se trata de evaluar si los animales son brillante, alerta y sensible; y también determinar si los animales muestran signos manifiestos de dolor o tienen dificultad en movimiento, alimentación, beber y aseo personal.
6. Colección de tejido
- músculo de host de la cosecha
- eutanasia los ratones host por dislocación cervical y toracotomía realizada bajo anestesia general, administrada por un vaporizador de isoflurano mesa impulsado por () oxígeno médico isoflurano inhalado; 2-5% al efecto). el investigador tiene también la aprobación del IACUC para cosecha TA los músculos debajo anestesia general antes de la eutanasia.
- para acceder a los músculos de host TA, utilice un par de tijeras quirúrgicas para abrir la piel sobre la superficie anterior de la pierna. Localizar el músculo de la TA en la pierna anterior, cortar el tendón distal, reflejar el músculo y cortar los accesorios del músculo proximal (ver sección 2.1).
- Recoger (experimental) de izquierda y derecha (control) TA músculos.
- Snap congelación músculos cosechados
- pesan los músculos cosechados colocando peso papel y balanza.
- Sumergir brevemente los músculos en aceite mineral para crioprotección. Seque el exceso aceite. Músculos de
- lugar en papel de aluminio y snap congelan los músculos sumergiendo rápidamente les en lleno en un Dewar de nitrógeno líquido. Transferir las muestras a crioviales etiquetados y almacenar las muestras en un congelador de-80 ° C para estudios posteriores.
7. Los estudios histológicos
- Cryosectioning tejido muscular para recoger las secciones seriales de la Cruz
- transferir las muestras desde el congelador de-80 ° C a un criostato colocándolos en un Dewar con nitrógeno líquido.
- En el criostato, manejar una muestra en un momento. Con una fría hoja de afeitar (lámina almacenada en criostato), cortar la muestra dos veces en el vientre medio del músculo TA para producir un segmento de músculo que tiene 1-2 mm de espesor. Este segmento para la fabricación de las secciones de criostato y volver las porciones restantes del músculo a su cryovial.
- Con la temperatura de corte óptimo (OCT), compuesto de congelación, asegurar el segmento grueso del tejido en un disco de muestra de criostato. Coloque el disco de muestra en las mordazas.
- Áspero-cara la muestra por corte de la secciones de 20 μm. Recoger unos 20 μm secciones sobre portaobjetos de vidrio para las secciones de criostato.
- Si la calidad de las 20 secciones μm es satisfactoria, cambie el grosor de corte a 5 μm y recoger algunas secciones para evaluar la calidad. Si las secciones de 5 μm son satisfactorias en la calidad, recoger las secciones seriales. Recoge secciones de 2-3 por diapositiva y recoger bastantes secciones de 3 diapositivas.
- Recoger las secciones de la experimental (izquierda) y de los músculos TA de control (derecha) de cada animal.
- Estudio de GFP expresión
Nota: designar un conjunto de las diapositivas preparadas (sección 7.1) para el estudio de expresión de GFP en las fibras musculares.- ~ 50 μl de medio de tratamiento anti se aplica en las secciones y aplica un cubreobjetos de vidrio. Sellar los bordes del cubreobjetos con el pulimento de clavo claro.
- Con el microscopio de luz y fluorescente (véase Tabla de materiales), estudiar las secciones con un 10 X objetivo y un filtro adecuado para la visualización de GFP.
- Recoger imágenes digitales (~ 15) de superposición de campos visuales para cubrir la sección representativa entera del músculo TA. Recoger las imágenes de contraste de fase para cada uno de los campos de visión cambiando a modo de contraste de fase en el microscopio de fluorescencia.
- Abrir imágenes con un software de proyección de imagen adecuado que puede azulejo imágenes individuales para producir una sola imagen compuesta; por ejemplo, uso el " photomerge " opción bajo el menú archivo en el software de imágenes listados en la Tabla de materiales.
- Abrir las imágenes de fluorescencia de GFP con un software de análisis de imagen adecuado (p. ej., ImageJ). Círculo individuales fibras musculares mediante la " herramienta ROI " y registrar la intensidad de fluorescencia media para cada fibra.
- Calcular la intensidad máxima GFP (fluorescencia) tomando el promedio de la intensidad de fluorescencia media de 10 fibras que muestran alta expresión de GFP y tienen morfología normal. Calcular el % máximo de GFP de intensidad para cada fibra dividiendo la intensidad de floración significa para cada fibra de la intensidad máxima de la GFP y multiplicando por 100. Tabular los resultados de los análisis GFP para cada músculo TA como se muestra en la figura 3E.
- Estudio de ubicación de integridad y myonuclear de fibra del músculo por etiquetado inmunofluorescente de desmin y 4 ', 6-diamidino-2-phenylindole (DAPI), respectivamente.
Nota: Designar un conjunto de diapositivas preparadas, como el anterior, para estudiar el etiquetado de desmina en las fibras musculares. Secciones- fix con paraformaldehído al 2% en PBS durante 10 minutos Lávese las secciones tres veces con PBS.
PRECAUCIÓN: Use equipo de protección personal (PPE) al manipular al manipular paraformaldehido. - Secciones de bloque con 3% de seroalbúmina bovina diluido en PBS con 0,01% Triton-X100 durante 30 minutos. Esta solución de bloqueo es referida en adelante como el diluyente principal.
- Diluir el conejo anti-desmin la inmunoglobulina G (IgG) en el diluyente principal (1: 200).
- Después de que el bloqueo sea completo, los anticuerpos primarios diluidos se aplican en secciones e incubar durante una noche en un refrigerador a ~ 4 º C. lavar las secciones (5 min) con PBS que contenga 0,1% Tritón X-100. Esta solución es referida en adelante como el primer tampón de lavado.
- Las secciones de lavado 3 veces (a 5 min por lavado) con PBS.
- Preparar el anticuerpo secundario diluyendo cabra anti conejo IgG (conjugado colorante fluorescente rojo) en PBS con 0,01% Tritón X-100.
- Aplicar el anticuerpo secundario diluido en las secciones e incubar a temperatura ambiente (~ 23 ° C) durante 60 min
- Lavar las secciones (5 min) con el primer tampón de lavado. Las secciones de lavado 3 veces (a 5 min por lavado) con PBS.
- Aplicar DAPI para 3 minutos Lávese las secciones 3 veces (1 minuto por lavado) con PBS. Aplicar ~ 50 μl del medio anti-fade en las secciones y aplique el vidrio cubreobjetos. Sellar los bordes del cubreobjetos con el pulimento de clavo claro.
- Con el microscopio de luz y fluorescente (véase Tabla de materiales), estudio el colorante fluorescente de secciones seriadas con un 10 X objetivo y un filtro apropiado para visualizar rojo.
- Recoger las imágenes digitales (~ 15) de los campos visuales superpuestas para cubrir la sección representativa entera del músculo TA. Recoger las imágenes de fluorescencia de DAPI etiquetado para cada uno de los campos visuales al cambiar a la configuración de filtro adecuada.
- Abierta y analizar las imágenes usando un software de tratamiento de imágenes adecuado como se describe en pasos 7.2.3 - 7.2.4.
Nota: Estudio de imágenes para identificar, que las fibras musculares son dañada (desmin negativos), que las fibras musculares tienen nucleación central (desmina positiva fibras que tienen núcleos marcados con DAPI ubicados internamente en lugar de periférico) y, las áreas de la sección tiene inflamación o fibrosis (áreas que tienen muchos núcleos marcados con DAPI agrupados, pero están desprovistas de fibras musculares).
- fix con paraformaldehído al 2% en PBS durante 10 minutos Lávese las secciones tres veces con PBS.
Resultados
En 3 días posterior al MIME, el donante EDL que se implanta por MIME está contenido dentro del compartimiento del músculo de host TA (figura 2A–C). Como era de esperar, las secciones transversales del músculo TA de ratones donantes, estudiados bajo la óptica de la fluorescencia, no muestran fluorescencia verde porque no expresan GFP (Figura 2D). Por el contrario, las secciones transversales del músculo de ratones de host que se implantan con el tejido donante, TA muestran fluorescencia verde uniforme en las fibras musculares de TA, como las fibras expresan GFP (Figura 2E). En los cortes transversales de músculos implantados por MIME con tejido donante, hay una línea de demarcación entre las fibras musculares de host (GFP +) y fibras del músculo donante (GFP-). Las imágenes de contraste de fase de los campos de visión se muestra en la Figura 2D–F se presentan en la Figura 2E'–F' y sugieren que de hecho son las fibras musculares presentes en las regiones donde no hay GFP señal.
En 14 días post-MIME y volver2 inyección, mediante el estudio de Cruz serial TA del músculo de los que quedan sin etiqueta o están marcados con anticuerpos para desmina (figura 3), nos enteramos de que la señal GFP se expresa por todas las fibras musculares en el tratamiento muscular de ratones de host, pero no en el músculo Tratado de MIME (desmin rojo etiquetado detecta fibras musculares viables). En el músculo de host TA tratado con mimo y volver2 inyección, la miogénesis derivados de la célula donante es evidente de la presencia de muchas desmin(+) las fibras musculares que no mostrar ninguna señal detectable de GFP (figura 3–D, C 3' –D'). Quiméricas fibras musculares derivados de la probable fusión de las células miógenas host y de los donantes puede detectarse por la baja a niveles moderados de la fluorescencia de GFP expuesto por estas fibras. Numerosas fibras quiméricas aparecen en todo el diámetro entero de la TA muscular lo que sugiere que el donante SCs son capaces de migrar varios cientos de micras en epimysium del músculo del host. Cuantificación de GFP + fibras se muestra en la figura 3E. La figura 4 muestra imágenes de gran aumento de secciones seriadas de Cruz de un músculo de TA entero de MIME + volver2 tratados.
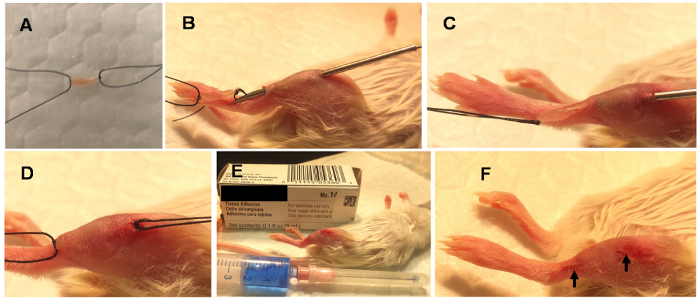
Figura 1 . Pasos en mínimamente invasivo del músculo incrustación (MIME).
MIME se realiza bajo anestesia general. Se trata de colocar aproximadamente 10 mg de músculo donante (ratón donante EDL) en solución de Ringer y atar las suturas guías a sus extremos (A). Una aguja de calibre 18 se pasa por el eje largo del músculo del host (B) y el tejido donante se dibuja a través de la pista (C)de la aguja. El tejido donante es izquierdo incrustado en el músculo de host (D), se cortan las suturas guías y los orificios de aguja están sellados con adhesivo tisular (E). Las heridas de aguja sellados se indican con las flechas (F). Haga clic aquí para ver una versión más grande de esta figura.
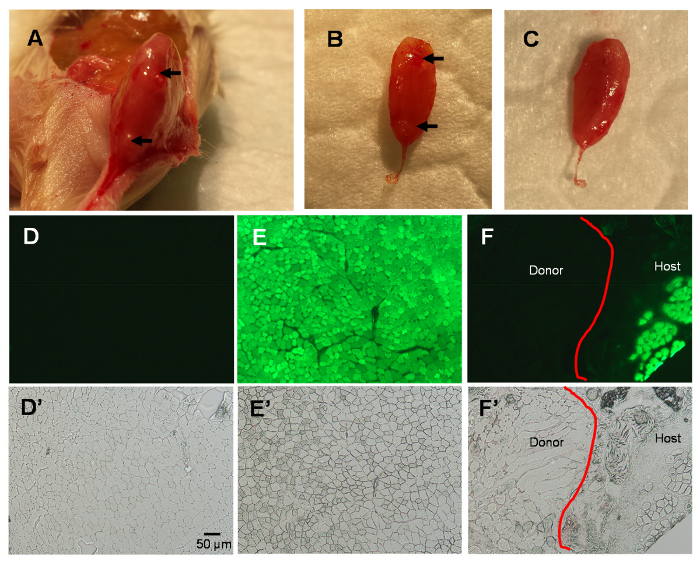
Figura 2 . Estudios del músculo TA 3 días después de MIME.
Músculo de anfitrión recoge 3 días después de MIME; Nota marcas de aguja en host TA (flechas; A-B). Además los datos confirman que el ratón integrado donantes EDL es instalado dentro del compartimiento del músculo TA (B-C). Imágenes de fluorescencia del músculo TA secciones mostrar ninguna fluorescencia verde en músculo de TA de tipo salvaje (D), fluorescencia verde brillante en el músculo de TA NSG-GFP (E)y una distinción entre host y donante de músculo en músculo NSG-GFP TA en 3 días -MIME (F). Se muestran las imágenes de contraste de fase de los campos de visión en el D F en D'-F', respectivamente. La línea roja en paneles F y F' muestra la línea de demarcación entre el tejido del anfitrión y de los donantes. Barra de escala = 50 μm. haga clic aquí para ver una versión más grande de esta figura.
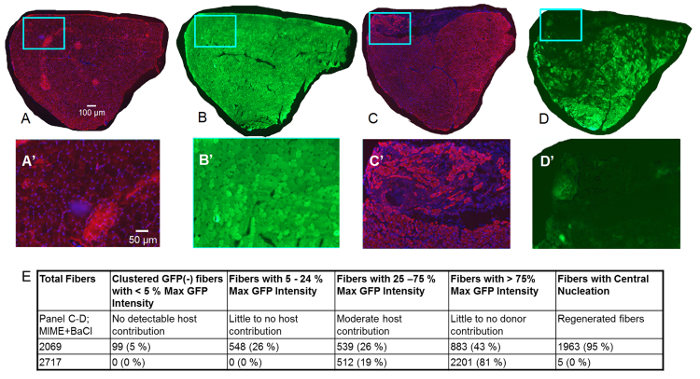
Figura 3 . Estudios del músculo TA 14 días después de MIME.
Los datos recogidos 14 días post-MIME se presentan. La señal roja es de etiquetado inmunofluorescente de desmina (un signo positivo para el desmin denota que myofibers son viables), la señal azul es de DAPI (núcleos de manchas), y es la señal verde de la GFP. En músculo de Control TA (trasera derecha) extraído del ratón de host, como era de esperar, casi todos myofibers son positivos para el desmin, sugiriendo que estos myofibers son viables (A; señal roja). Además, basado en la coloración de DAPI, es evidente que petequiales de myofibers casi todos encuentran periféricamente, como se esperaría en el músculo sano (A; señal azul). Las secciones seriales del músculo Control TA muestran que, casi todas las fibras musculares son verde brillante, lo que implica que son positivos para GFP. En MIME + volver2 -tratamiento muscular de TA (trasera izquierda), miogénesis mediada por células de donante es evidente de la presencia de muchas desmin(+) las fibras musculares que no presentan detectable fluorescencia de GFP (C, D, C'-D'). Desmin(+) fibras musculares con baja a moderada fluorescencia de GFP (quiméricas fibras musculares) están presentes en todo el diámetro del músculo entero TA, sugiriendo que MIME proporciona a donantes SCs que pueden migrar dentro epimysium del músculo TA y promover derivados de la célula donante miogénesis. A'-D' alta magnificación de imágenes de las regiones dentro de los cuadros azules en Un D. Cuantificación de fibras GFP(+) y fibras nucleadas centralmente se muestra en E. Barras de escala = 100 μm (A-d) y 50 (A'-D'). Haga clic aquí para ver una versión más grande de esta figura.
RC="/files/ftp_upload/55731/55731fig4.jpg" / >
Figura 4 . Evidencia de daños generalizados y la regeneración 14 días después de la inyección de2 MIME y volver.
Alta magnificación, se presentan secciones seriales de la Cruz de un músculo de TA entero de MIME + volver2 tratados. Los datos muestran que muchas fibras musculares, que son moderadamente o fuertemente GFP + han situado los núcleos (A-B; rojo señal en la A es de desmin, la señal azul en el A es de DAPI y verde señal en B es de GFP). Estos datos sugieren que la degeneración y la regeneración después de volver2 inyección no afecta la expresión de GFP. En este contexto, la presencia de fibras de músculo central nucleadas en MIME + volver2 tratados TA músculo, con expresión de GFP poco no, sugiere que estas fibras son el resultado probable de la miogénesis (o regeneración) con contribución significativa de GFP - células miógenas. Estas observaciones se pueden verificar más en imágenes de gran aumento de campos seleccionados (C-F; C y D y E y F, respectivamente, solapan las regiones desde las secciones seriales de la Cruz; código de colores de las fronteras de la imagen indican la ubicación de las regiones en el A y B). Barras de escala = 100 μm (A-B) y 50 (C-F). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí, presentamos un protocolo detallado para la nueva técnica experimental conocido como mimo, desarrollado en nuestro laboratorio, implante del tejido muscular donante en el tejido muscular de host. Se trata de una adaptación de un músculo abierto injerto técnica que ya ha demostrado ser eficaz en la promoción de miogénesis mediada por células de donantes en un host músculo9,10,17.
El objetivo de MIME es no permitir el injerto del donante tejido muscular sí mismo en el músculo de host (en la actualidad no sabemos si esto ocurre), sino proporcionar una fuente de donantes SCs que pueden contribuir a la miogénesis en el músculo de host en condiciones que estimulan la m uscle regeneración. Nuestra esperanza es que después de MIME ha sido optimizado y probado en estudios básicos y preclínicos, podría proporcionar información valiosa para dirigir terapias clínicas destinadas a aumentar la regeneración muscular en los músculos esqueléticos que han sufrido pérdida de masa muscular miogénicos.
Hay numerosas preguntas que todavía no han contestado con respecto a cómo MIME podría traducirse en una terapia clínica, por ejemplo: ¿Cómo controlamos la calidad de tejido del donante? ¿Cómo controlamos rechazo inmune de células y tejido del donante? ¿Se borra el tejido donante después de prever las células miogénesis o sale detrás de una cicatriz fibrótica? ¿Afecta el tipo de fibra del músculo donante o host de la miogénesis mediada por células de donante? ¿Que los músculos pueden beneficiarse prácticamente de MIME? Estamos ampliando nuestros estudios para evaluar si MIME es segura y eficaz, identificar los tratamientos adyuvantes que pueden aumentar miogénesis derivados del donante y responder a muchas de las preguntas mencionadas anteriormente.
Después de completar nuestras pruebas del trasplante allogeneic de ratón a ratón con MIME, nuestro siguiente paso es hacer humanos a ratón MIME con tejido humano cadavérico para evaluar el potencial miógeno de tejido cadavérico. Esperamos que estos experimentos conducirá a una nueva línea de investigación básica y traslacional, que consiste en tejido fino del músculo de los donantes, que se registre en iniciativas como el programa de legado de cuerpo para la educación y el programa regalo de vida para la donación de órganos .
Los datos representativos presentados en este manuscrito sugieren que a los 14 días después de MIME, hay varios myofibers viables que carecen de GFP o tienen niveles bajos de GFP. Nuestra interpretación de estos datos es que las células satélite de GFP-donantes contribuyeron a la miogénesis en el músculo de host. Realizamos este experimento en preparación para la implantación de tejido cadavérico humano en un músculo de ratón de host. Para demostrar inequívocamente que las células satélite de donantes contribuyen a la miogénesis en el músculo de host después de MIME, sería útil implantar tejido donante que expresa de un reportero fluorescente, que puede ser fácilmente distinguido de GFP (p. ej., rojo fluorescente proteína expresando tejido donante implantado en GFP + músculo host).
Esta técnica está limitada principalmente por la naturaleza de la SCs en el tejido del donante. Si el SCs en el tejido del donante son viable, que la técnica es probable facilitar miogénesis mediada por células de donantes, mientras que si no son viables, no pueden ocurrir la miogénesis. Sin embargo, ya que SCs son muy resistentes y viables para aproximadamente 2 semanas post-mortem, es muy probable que para los propósitos experimentales, el tejido donante que se implanta dentro de unos minutos después de la cosecha facilitará la miogénesis mediada por células de donantes13 . Además, como se refirió anteriormente, es posible que desde el tejido de músculo entero (que contiene SCs, madurez de las fibras musculares, así como fibroblastos reside en el músculo) se encaja en el músculo de host, la fibrosis puede ocurrir. Sin embargo, esta hipótesis debe examinarse empíricamente. La literatura sobre daño de músculo por contracciones perjudiciales, criocauterización y miotoxinas experimentales, sugiere que las células inmunes (principalmente macrófagos) son capaces de efectivamente claro detritos celulares de las fibras dañadas y remodelación de la matriz extracelular18. Por lo tanto, es posible que después de la inyección de2 MIME y volver, siempre y cuando las células inmunes del anfitrión tienen a degeneración fibras del músculo donante, podrían despejar escombros, dejando sólo el donante SCs. Finalmente, la magnitud de la miogénesis derivados del donante es dependiente en la cantidad de tejido donante que se incrusta en el músculo de host. En orden para el compartimiento del músculo host a ser completamente repoblada por myofibers derivados de la célula donante, se necesitaría un método como X o gamma-irradiación a ablar músculo host SCs y también requiere procedimientos repetidos de MIME.
Se ha demostrado que exponer quirúrgicamente un músculo host y suturar de un pedazo de tejido del donante en el músculo de host pueden facilitar la miogénesis mediada por célula donante9,10,17. Este abordaje quirúrgico abierto se ha utilizado en el pasado para seguir la progresión de la miogénesis y generar modelos murinos de enfermedades del músculo humano. El aspecto innovador de la técnica de mimo es que es mínimamente invasiva y no implica exponer quirúrgicamente el músculo de host. Esto reduce el riesgo de infección iatrogénica y el grado de malestar en el animal del anfitrión, por lo tanto lo que es más factible realizar MIME repetidamente en el mismo músculo de host si es necesario.
Anticipamos que la técnica del mimo podría ser un adecuado refinamiento para el abordaje quirúrgico abierto que actualmente se sigue para implantar tejido donante en un ratón de host. Esto podría acelerar la generación de modelos de ratón humanizado, incrustando una biopsia muscular humano en músculo de ratón del host. Además, basado en nuestros datos preliminares de injerto de ratón a ratón, Anticipamos que MIME será efectiva en lograr la miogénesis mediada por células de donantes de tejido de donante cadavérico humano como donante SCs son viables. Por último, con las pruebas adicionales y validación, esperamos que la técnica de mimo le ayudará a desarrollar nuevas terapias para facilitar la miogénesis mediada por células de donantes en los seres humanos con enfermedades musculares.
El éxito de la técnica de mimo depende críticamente precisamente incrustar el tejido donante dentro del compartimiento fascial (epimysium) del músculo del host. Sólo si el tejido donante se coloca dentro del compartimiento del músculo de anfitrión, será capaz de proporcionar SCs al músculo del host de manera precisa. Si el tejido donante se coloca fuera del músculo de host, no está claro en cuanto a lo que sería su destino. En nuestro modelo experimental de mimo, utilizamos el músculo TA como el músculo de host, ya que es destacado y colocado superficialmente en el aspecto anterolateral de la pierna. El tamaño, la orientación y la posición anatómica de los músculos TA, hace fácil confirmar que el tejido del donante es colocado correctamente dentro del músculo de host TA después de MIME. En este trabajo, hemos proporcionado evidencia experimental de que el tejido del donante rered incorporada en el host músculo TA en MIME después de 3 días y allí es miogénesis mediada por células de donantes en el músculo de host en el mimo después de 14 días.
Divulgaciones
Los autores tienen intereses financieros que compiten.
Agradecimientos
Este trabajo fue posible por una beca de piloto de la Alianza para Investigación Regenerativa de rehabilitación y formación (AR3T) y un paquete de inicio de la Facultad de la Wayne State University al bote. AR3T es apoyado por Eunice Kennedy Shriver Instituto Nacional de salud infantil y desarrollo humano (NICHD), Instituto Nacional de desórdenes neurológicos y movimiento (NINDS) y National Institute of Biomedical Imaging y bioingeniería (NIBIB ) de los institutos nacionales de salud bajo la concesión número P2CHD086843. El contenido es responsabilidad exclusiva de los autores y no representan necesariamente las opiniones oficiales de los institutos nacionales de salud.
Materiales
| Name | Company | Catalog Number | Comments |
| NSG-GFP mice | The Jackson Laboratory (Bar Harbor, ME) | Stock #021937 | Immunodeficient host mice that ubiquitously express green fluorescent protein |
| C57BL/6J mice | The Jackson Laboratory (Bar Harbor, ME) | Stock #000664 | Control donor mice |
| Tabletop isoflurane vaporizer | VetEquip (Livermore, CA) | Item #901801 | Inhaled anesthesia system |
| Magic depilatory crea | Softsheen Carson (New York, NY) | N/A | Razorless hair removal cream |
| 4-0 Silk, black, braided, non-absorbable sutures | Roboz Surgical Instrument Co, Inc. (Gaithersburg, MD) | SUT106631 | Guiding sutures for donor tissue |
| VetBond veterinary tissue adhesive | 3M (Maplewood, MN) | Catalog #1469Sb | Veterinary tissue adhesive for sutureless skin closure |
| Barium chloride | Ricca Chemical Company (Arlington, TX) | Product #R0854000-500A 854-16 | Myotoxin to induce muscle damage and stimulate regeneration |
| Deltaphase isothermal gel heating pad | Braintree Scientific (Braintree, MA) | Item #39DP | Heating pad to provide thermal support to animals while under anesthesia |
| HM525NX cryostat | ThermoFisher (Waltham, MA) | Catalog #HM525NX | Cryostat to make frozen sections of muscle |
| Vectashield Antifade Medium | Vector Laboratories, Inc. (Burlingame, CA) | Catalog Number: H-1000 | Antifade medium to preserve fluorescence in immunofluorescently labeled samples |
| Rabbit anti Desmin Antibody | Labvision Thermo Scientific (Fremont, CA) | RB9014P | Rabbit anti desmin antibody for desmin immunofluorescent labeling |
| Goat anti Rabbit Alexa 568 Antibody | ThermoFisher (Waltham, MA) | Catalog#: A-21069 | Goat anti rabbit secondary antibody for desmin immunofluorescent labeling |
| 4',6-diamidino-2-phenylindole (DAPI) | Seracare (Milford, MA) | Catalog #5930-0006 or 71-03-01 | Reagent for fluorescent labeling of nuclei |
| Axio Scope.A1 microscope | Carl Zeiss (Peabody, MA) | Product #Axio Scope.A1 | Light and fluorescence microscope |
| Photoshop CS4 | Adobe Systems (San Jose, CA) | Photoshop CS4 | Imaging Software for perform image tiling |
| Image J | National Institutes of Health (Bethesda, MD) | Image J for Windows 64-bit Operating System | Imaging Software for quantitative fluorescence analysis |
Referencias
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Robertson, T. A., Grounds, M. D., Papadimitriou, J. M. Elucidation of aspects of murine skeletal muscle regeneration using local and whole body irradiation. J Anat. 181 (Pt 2), 265-276 (1992).
- Charge, S. B., Rudnicki, M. A. Cellular and molecular regulation of muscle regeneration. Physiol Rev. 84 (1), 209-238 (2004).
- Brack, A. S., Rando, T. A. Tissue-specific stem cells: lessons from the skeletal muscle satellite cell. Cell Stem Cell. 10 (5), 504-514 (2012).
- Krag, T. O., Hauerslev, S., Sveen, M. L., Schwartz, M., Vissing, J. Level of muscle regeneration in limb-girdle muscular dystrophy type 2I relates to genotype and clinical severity. Skelet Muscle. 1 (1), 31 (2011).
- Skuk, D., et al. Dystrophin expression in myofibers of Duchenne muscular dystrophy patients following intramuscular injections of normal myogenic cells. Mol Ther. 9 (3), 475-482 (2004).
- Beauchamp, J. R., Morgan, J. E., Pagel, C. N., Partridge, T. A. Dynamics of myoblast transplantation reveal a discrete minority of precursors with stem cell-like properties as the myogenic source. J Cell Biol. 144 (6), 1113-1122 (1999).
- Sakellariou, P., et al. Neuromuscular electrical stimulation promotes development in mice of mature human muscle from immortalized human myoblasts. Skelet Muscle. 6 (1), 4 (2015).
- Collins, C. A., et al. Stem cell function, self-renewal, and behavioral heterogeneity of cells from the adult muscle satellite cell niche. Cell. 122 (2), 289-301 (2005).
- Zhang, Y., et al. Human skeletal muscle xenograft as a new preclinical model for muscle disorders. Hum Mol Genet. 23 (12), 3180-3188 (2014).
- Juhas, M., Engelmayr, G. C., Fontanella, A. N., Palmer, G. M., Bursac, N. Biomimetic engineered muscle with capacity for vascular integration and functional maturation in vivo. Proc Natl Acad Sci U S A. 111 (15), 5508-5513 (2014).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Eng Part A. 20 (17-18), 2402-2411 (2014).
- Latil, M., et al. Skeletal muscle stem cells adopt a dormant cell state post mortem and retain regenerative capacity. Nat Commun. 3, 903 (2012).
- Maykel, J., et al. NOD-scidIl2rg (tm1Wjl) and NOD-Rag1 (null) Il2rg (tm1Wjl) : a model for stromal cell-tumor cell interaction for human colon cancer. Dig Dis Sci. 59 (6), 1169-1179 (2014).
- Casar, J. C., et al. Heparan sulfate proteoglycans are increased during skeletal muscle regeneration: requirement of syndecan-3 for successful fiber formation. J Cell Sci. 117 (Pt 1), 73-84 (2004).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PLoS One. 11 (1), e0147198 (2016).
- Roberts, P., McGeachie, J. K., Grounds, M. D., Smith, E. R. Initiation and duration of myogenic precursor cell replication in transplants of intact skeletal muscles: an autoradiographic study in mice. Anat Rec. 224 (1), 1-6 (1989).
- Tidball, J. G. Mechanisms of muscle injury, repair, and regeneration. Compr Physiol. 1 (4), 2029-2062 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados