Method Article
Minimamente invasivo músculo incorporação (MIME) - uma nova técnica Experimental para facilitar Myogenesis doador-mediada por células
Neste Artigo
Resumo
Nós descrevemos uma nova técnica experimental que chamamos minimamente invasiva músculo incorporação (MIME), que se baseia a evidência de que o tecido muscular esquelético contém células miogênico viáveis que podem facilitar o doador-mediada por células myogenesis quando implantado em um músculo do hospedeiro.
Resumo
Músculo esquelético possui capacidade regenerativa devido ao tecido-residente, geradores músculo de fibra (miogênico) células satélites (SCs), que podem formar novas fibras musculares sob certas condições. Embora SCs podem ser colhidas de tecido muscular e cultivadas em vitro, as células myoblast resultante não são muito eficazes na promoção myogenesis quando transplantada em músculo do hospedeiro. Cirurgicamente, expondo o músculo de anfitrião e enxertia de segmentos de tecido muscular de doadores, ou as fibras musculares isoladas com seus SCs no músculo do hospedeiro, promove melhor myogenesis em relação ao transplante de myoblast. Temos desenvolvido uma nova técnica que chamamos minimamente invasiva músculo incorporação (MIME). MIME envolve passando uma agulha cirúrgica através do músculo de anfitrião, desenhando um pedaço de tecido de músculo doador através da pista de agulha e em seguida, deixando o tecido doador incorporado no músculo do hospedeiro, para que ele pode atuar como uma fonte de SCs para o músculo do hospedeiro. Aqui descrevemos detalhadamente as etapas envolvidas na realização de MIME em um modelo de rato imunodeficientes que expressa uma proteína verde fluorescente (GFP) em todas as suas células. Imunodeficiência no mouse anfitrião reduz o risco de rejeição imune do tecido doador, e expressão de GFP permite fácil identificação das fibras musculares de anfitrião (GFP +) e fibras de músculo doador-derivado de células (GFP-). Nossos piloto dados sugerem que MIME pode ser usado para implantar um músculo extensor dos dedos longo (EDI), de um rato do doador para o músculo tibial anterior (TA) de um rato de anfitrião. Nossos dados sugerem também que quando um myotoxin (cloreto de bário, BaCl2) é injetado no músculo hospedeiro após MIME, existem provas de myogenesis doador-derivado de células no músculo do hospedeiro, com cerca de 5%, 26%, 26% e 43% das fibras em um único host TA músculo não mostrando nenhuma contribuição de anfitrião, contribuição mínima anfitrião, contribuição moderada de anfitrião e contribuição máxima do anfitrião, respectivamente.
Introdução
Músculo esquelético saudável, mesmo que pós-mitótico, possui excelente capacidade regenerativa devido à presença de tecido-residente miogênico células conhecidas como células satélites (SCs)1,2; e revisto em3,4. No entanto, sob condições patológicas causadas por distrofias musculares, trauma ou envelhecimento acelerado, a regeneração do músculo pode não acompanhar a ruptura muscular, e assim, a perda progressiva da fibra muscular ocorre5. Embora métodos eficazes foram desenvolvidos para isolar SCs do músculo e expandi-las em cultura para gerar grandes números de mioblastos (e, posteriormente, myotubes), as tentativas de gerar números fisiologicamente relevantes das fibras musculares no músculo do hospedeiro ter rendeu apenas sucesso mínimo6. Como com muitos outros tipos de células, quando mioblastos são injetados em paz tecido do hospedeiro, a maioria das células não engraft7,8. Mostramos que a estimulação elétrica neuromuscular (EENM) facilita myogenesis doador-derivado de células no músculo de rato hospedeiro de regeneração deficiente que foi injetado com mioblastos humano8. Outros têm demonstrado que cirurgicamente enxertia uma biópsia muscular ou única fibras musculares com SCs anexados, facilitar myogenesis moderada, mesmo sem a EENM, sugerindo que implantar toda fibras musculares com SCs pode ser mais vantajoso do que a implantação células miogênico sozinho9,10. Desde que o doador ou tecido muscular engenharia enxertados em músculo hospedeiro produz melhores resultados do que o transplante de células sozinhos, é possível que tecido ou tecido-como estruturas podem fornecer pistas cruciais para enxertia de doador-célula; um conceito que está se tornando cada vez mais evidente em estudos de terapia com células envolvendo várias células tipos10,11,12.
Dados recentes sugerem que SCs obtidos de seres humanos mais de 2 semanas post-mortem geram myotubes na cultura13. Pretendemos, portanto, avaliar se a implantação do músculo tecido colhido post-mortem em um hospedeiro vivo irá reverter a perda de fibras musculares. Temos desenvolvido uma nova técnica chamada MIME para o tecido muscular de doador do implante no tecido do músculo esquelético de um hospedeiro vivo para promover myogenesis doador-derivado de células. MIME envolve a passagem de uma agulha cirúrgica através do músculo de anfitrião para criar uma faixa de agulha; desenho de um pequeno segmento do tecido muscular de doador através da faixa de agulha; deixar o tecido doador incorporado no músculo do hospedeiro; e fechando os buracos de agulha com adesivo de tecido. Depois de praticar a técnica em camundongos sacrificados estudou em outras experiências, têm agora realizamos MIME em ratos vivos que são imunodeficientes e ubiquitously expressar uma proteína verde fluorescente (GFP) e acompanhamento aos 3 e 14 dias pós-MIME. Em 3 dias pós-MIME, podemos confirmar que o músculo de EDI de rato (GFP-) doador implantou no rato hospedeiro muscular (GFP +) TA, permanece incorporado no músculo do hospedeiro. Na mímica após 14 dias, após a lesão de myotoxin BaCl2 para induzir e myogenesis, confirmamos que aproximadamente 5%, 26%, 26% e 43% das fibras em um único host músculo TA não mostram nenhuma contribuição de anfitrião, contribuição mínima anfitrião, anfitrião moderada contribuição e máximo servem de contribuição, respectivamente. Nucleação central (um marcador de degeneração e regeneração subsequente) é vista em aproximadamente 95% de fibras de músculo TA após injeção de MIME e myotoxin.
Estudamos os músculos TA 14 dias depois de MIME + BaCl2 porque neste ponto do tempo captura o estágio intermediário de regeneração, quando a maioria das fibras regeneradas são nucleated centralmente. Nós estudamos GFP + ratos como anfitriões para MIME, para que quando nós eventualmente transplante muscular cadavérico humano em ratos de acolhimento, será capaz de facilmente distinguir fibras musculares de origem host e doador. Usamos o mouse músculo EDI como o tecido do doador experimental, desde simples fibras deste músculo demonstraram maior potencial miogênico que TA músculos9. O músculo de EDI é também sinérgico para o músculo TA e tem composição semelhante tipo de fibra. Nossos dados preliminares sugerem que o MIME é capaz de facilitar myogenesis doador-derivado de células no músculo do hospedeiro.
Protocolo
todos os estudos que envolvam animais vivos são aprovados pelo cuidado do Animal de instituição e Comissão de utilização (IACUC) na Universidade Estadual de Wayne, Detroit, Michigan, EUA e estão em conformidade com o guia para o cuidado e uso de animais de laboratório ( 8ª edição, 2011, publicado pela imprensa nacional de academias, 500 quinta rua, 285 Lockbox, NW, Washington, DC 20055, EUA). Conforme os protocolos aprovados IACUC, procedimentos que envolvem dor e/ou angústia foram realizados sob anestesia geral, que é induzida e mantida por inalação de isoflurano (1,5-5% para o efeito). Anestesia foi verificada pela falta de retirada aos pés pitada e de palpebral ou respostas vibrissae (a porcentagem de isoflurano foi aumentada conforme necessário para manter o efeito). Devido à natureza minimamente invasiva dos protocolos, um " estéril dicas " técnica foi seguida. Enquanto os animais estavam sob anestesia, vaselina foi aplicada aos olhos para evitar ressecamento. Sem tratamentos especiais foram necessários; no entanto, gel de dieta foi fornecida aos animais durante 24 h seguintes procedimentos envolvendo anestesia geral. O investigador é aprovado pelo IACUC reter analgesia após MIME, desde que o procedimento não envolve expor cirurgicamente o host muscular, pois limita-se a um membro posterior e não afeta a função normal, e porque muitos medicamentos analgésicos comuns são conhecidos por afetar a regeneração muscular normal.
1. Modelos animais
- ratos de Host para MIME
- ratos uso NSG-GFP (8-10 semana, masculino) como hospedeiros para o músculo enxertos estudos.
Nota: Estes ratos são anfitriões ideais para músculo alogênico enxertos porque falta de linfócitos T e B maduros e funcionais natural killer células, são deficientes em citocinas sinalização e têm sido usados por outros para células não-musculares de allografting ou Xeno < sup classe = "xref" > 14. Expressão de GFP onipresente permite a fácil identificação de host (GFP +) e doador-derivado de células (GFP-) fibras musculares.
- ratos uso NSG-GFP (8-10 semana, masculino) como hospedeiros para o músculo enxertos estudos.
- Ratos de doador para MIME
- uso C57BL/6J ratos (semana de 12-16) como ratos doador.
Nota: Estes ratos são ratos doador porque eles têm um genoma totalmente mapeado, não são conhecidos por terem qualquer patologia músculo esquelético, são facilmente disponíveis e econômicos e não expressam GFP.
- uso C57BL/6J ratos (semana de 12-16) como ratos doador.
2. Preparar o tecido do músculo doador
- amarrando orientadores suturas e músculos de EDI doador colheita
- eutanásia os ratos doador por deslocamento cervical e toracotomia realizada sob anestesia geral administrada por um tabletop vaporizador de isoflurano, conduzido pelo oxigênio médico (isoflurano inalado; 2-5% para o efeito).
- Para acessar os músculos de EDI, use um par de tesouras cirúrgicas para abrir a pele sobre a superfície anterior da perna. Localize o músculo TA na perna anterior e removê-lo para visualizar o músculo de EDI que está situado atrás do músculo TA. Deslize a ponta de um par de pinças atrás do músculo de EDI e aplicar uma tração suave para ver se os dedos estendem (confirma-se que o músculo é o EDI).
Nota: área de tecido do doador deve ser cirurgicamente, assepticamente preparado antes da colheita. - Uso ~ segmentos de 10 cm de seda 4-0, sutura trançada, não absorvível, estéril e faça dois nós dobro para aplicar as suturas orientadores para os tendões proximais e distais do músculo do EDI. ( figura 1A).
- Cortar o tendão distal do EDI, refletem o músculo de EDI e cortar o tendão proximal.
- Lugar o doador EDL músculos em uma placa de Petri preenchida com solução de Ringer rato.
3. Preparando o Host ratos para MIME
- anestesia
- Posicione o mouse de acolhimento sob anestesia geral (isoflurano inalado; 1.5-5% para o efeito), administrado por um vaporizador de isoflurano do tabletop conduzido pelo oxigênio médico.
- Induzir anestesia em uma câmara de indução e depois transferir o mouse para um cone de nariz para manter a anestesia durante a execução de outros procedimentos do animal. Fornecer apoio térmico com um gel isotérmico, almofada de aquecimento, enquanto o animal está sob anestesia.
- Preparação de pele
- para remover o animal ' s da pele, aplique um creme depilatório sobre a face anterior da pata traseira esquerda. A perna direita serve como uma perna de controle para os procedimentos subsequentes.
- Deixar o creme depilatório em 2 min. Limpe fora junto com a moradia, o creme depilatório peles com toalhetes embebidos em fosfato tampão salino (PBS). Após a remoção da pele, esfregue a pele com três lenços alternadas de etanol esfrega de solução e 70% de iodo-povidona.
- Criando uma faixa de agulha no músculo hospedeiro TA
- passar uma agulha cirúrgica (1 em long) de calibre 18 através do centro de acolhimento músculo TA ao longo do músculo ' eixo longo s ( figura 1B). Passe a agulha no sentido cephalo-caudal, ao longo do comprimento do músculo TA e através do centro do ventre muscular ( figura 1B).
Nota: O objetivo desta etapa é criar uma faixa de agulha, na qual pode ser incorporado a um pedaço de músculo do doador. Incorporação do tecido do doador no centro do músculo TA potencialmente permitiria as SCs do tecido do doador para migrar e facilitar myogenesis em todo o anfitrião todo músculo TA.
- passar uma agulha cirúrgica (1 em long) de calibre 18 através do centro de acolhimento músculo TA ao longo do músculo ' eixo longo s ( figura 1B). Passe a agulha no sentido cephalo-caudal, ao longo do comprimento do músculo TA e através do centro do ventre muscular ( figura 1B).
- Tecido de doador incorporação na faixa de agulha de host músculo TA
- uma vez que a agulha cirúrgica dentro do host músculo TA, passe as suturas orientadores em uma extremidade do tecido doador através do lúmen da agulha cirúrgica em um direção anteriores-cefálica ( Figura 1).
- Desenhar o tecido doador através da pista de agulha, como a agulha é retirada do músculo em uma direção cefálica anteriores anfitrião TA.
- Use as suturas orientadores nas extremidades cefálicas e caudais do tecido doador para ajustar a colocação do tecido doador. Certifique-se de que o tecido do doador é acomodado dentro do host músculo TA ( Figura 1).
- Uma vez que a colocação do tecido doador é otimizada, cortar as suturas orientadores, fazer quaisquer ajustes finais para a colocação de tecido doador com pinça de ponta fina.
- Selo cutâneo agulha feridas ( Figura 1E -F) aproximando da borda da ferida com pinça e aplicando o adesivo de tecido veterinária com a ponta de uma agulha cirúrgica 27.
4. Injeção intramuscular de Myotoxin para induzir a degeneração muscular concertada e regeneração
- depois de MIME, injetar 50-60 µ l de 1,2% BaCl 2 (myotoxin) no host músculo TA para induzir dano extenso fibra muscular no músculo do hospedeiro e o tecido do doador incorporado dentro dele 15.
- Injetar BaCl 2 em 3 locais ao longo do comprimento do host TA muscular (proximal, média e distal um terço do ventre muscular).
Nota: Injetando myotoxins como BaCl 2, cardiotoxins e notexin no músculo esquelético induz danos concertada da fibra muscular, seguido pela regeneração 16.
- Injetar BaCl 2 em 3 locais ao longo do comprimento do host TA muscular (proximal, média e distal um terço do ventre muscular).
5. Cuidado pós-processual de Animal
- depois de MIME e BaCl 2 injeção, limpe o mouse do host ' traseiro esquerdo s perna com etanol e aplique uma camada fina de vaselina para proteger a pele.
- Depois de cuidados com a pele pós-processual, remova o mouse do host do cone de nariz.
- Coloque o mouse em uma gaiola de recuperação solitária sem fundamento. Fornecer suporte térmico para o animal se recuperando através de uma almofada de aquecimento do gel isotérmico colocado abaixo dos metade da gaiola recuperação.
Nota: Uma metade não é aquecida para que esse animal pode afastar a almofada de aquecimento se necessário. - Depois o mouse do host se recuperou completamente de anestesia, devolver o animal para sua gaiola original. Coloque a animal de volta na instalação de animal até são realizados experimentos de acompanhamento. Monitorar o mouse do host diariamente até que esteja pronto para acompanhamento – exemplo: em 3 ou 14 dias pós-MIME. Na sequência MIME, animais são monitorados pelo pessoal de laboratório bem como pelo pessoal veterinário – trata-se principalmente avaliar se os animais são luminosos, alerta e responsivo; e também avaliar se os animais estão mostrando sinais evidentes de dor ou estão tendo dificuldade em mover-se, alimentando, bebendo e aliciamento.
6. Coleção de tecido
- músculo do anfitrião de colheita
- eutanásia os ratos de acolhimento por deslocamento cervical e toracotomia realizada sob anestesia geral administrada por um vaporizador de isoflurano do tabletop conduzido pelo oxigênio médico ( isoflurano inalado; 2-5% para o efeito). O investigador também tem aprovação de IACUC para colheita TA músculos sob anestesia geral antes da eutanásia.
- para acessar os músculos anfitrião TA, use um par de tesouras cirúrgicas para abrir a pele sobre a superfície anterior da perna. Localizar o músculo TA na etapa anterior, cortar o tendão distal, refletem o músculo e corte os anexos muscular proximal (ver secção 2.1).
- Coletar esquerda (experimental) e direito (controle) TA músculos.
- Snap congelamento músculos colhidos
- pesar os músculos colhidos, colocando em pesar o papel e escala de pesagem.
- Brevemente mergulhe os músculos em óleo mineral para cryoprotection. Borre fora o excesso de óleo. Músculos
- lugar na folha de alumínio e snap congelam os músculos imergindo-os rapidamente em nitrogênio líquido preenchido um Dewar. Transferir as amostras para cryovials etiquetados e armazenar as amostras em um freezer-80 ° C para estudos posteriores.
7. Estudos histológicos
- Cryosectioning tecido muscular para coletar seriais seções transversais
- transferir as amostras do freezer-80 ° C para um criostato, colocando-os em um Dewar contendo nitrogênio líquido.
- Em criostato, lidar com uma amostra de cada vez. Com uma lâmina de barbear fria (lâmina armazenada no criostato), corte a amostra duas vezes no meio da barriga do músculo TA para produzir um segmento do músculo que é cerca de 1-2 mm de espessura. Manter este segmento para fazer as seções do criostato e retornar as porções restantes do músculo ao seu cryovial.
- Com o ideal da temperatura de corte (OCT) congelamento composto, assegurar o segmento espesso de tecido para um disco de amostra do criostato. Coloque o disco de amostra no porta-amostra.
- Áspero-rosto a amostra por corte 20 µm seções. Recolher alguns 20 µm seções sobre lâminas de vidro para as seções do criostato.
- Se a qualidade das 20 seções µm é satisfatória, alterar a espessura de corte de 5 µm e recolher algumas seções para avaliar a qualidade. Se as 5 seções µm são satisfatórias em qualidade, recolha seções seriais. Recolher seções de 2-3 por slide e coletar suficiente seções para 3 slides.
- Recolher seções do experimental (esquerda) e músculos de TA (à direita) de controle de cada animal.
- Expressão de GFP estudando
Nota: designar um conjunto de slides preparados (seção 7.1) para estudar a expressão de GFP nas fibras musculares.- Aplicar ~ 50 µ l de meio anti-desvaneça-se nas seções e uma lamela de vidro. Selar as bordas da lamínula com esmalte claro.
- Usando o microscópio de luz e fluorescente (ver Tabela de materiais), estudar as seções com um 10 X objetivo e um filtro adequado para a visualização de GFP.
- Coletar imagens digitais (~ 15) de sobreposição de campos visuais para cobrir toda a secção do músculo TA Cruz. Recolher as imagens de contraste de fase para cada um dos campos visual passando para modo de contraste de fase sobre o microscópio de fluorescência.
- Abrir imagens com um software de imagem adequado que pode empilhar imagens individuais para produzir uma única imagem composta; por exemplo, uso o " photomerge " opção no Menu arquivo no software de imagens constantes da Tabela de materiais.
- Abrir as imagens de fluorescência de GFP com um software de análise de imagem apropriado (por exemplo, ImageJ). Fibras de músculo círculo individuais usando o " ferramenta ROI " e gravar a intensidade de fluorescência dizer para cada fibra.
- Calcular a intensidade máxima GFP (fluorescência), tendo a média da intensidade da fluorescência de 10 fibras que mostram alta expressão de GFP e têm morfologia normal, quer dizer. Calcule a intensidade máxima de GFP % para cada fibra dividindo a intensidade de florescimento quer dizer para cada fibra pela intensidade máxima GFP e multiplicando por 100. Tabular os resultados da análise para cada músculo TA GFP como mostrado na Figura 3E.
- Estudar a localização de integridade e myonuclear de fibra muscular por imunofluorescência rotulagem de desmin e 4 ', 6-diamidino-2-phenylindole (DAPI), respectivamente.
Nota: Designe um conjunto de slides preparados, como acima, para estudar a rotulagem desmin nas fibras musculares.- Fix seções com 2% paraformaldeído em PBS durante 10 min. lavagem as seções três vezes com PBS.
Atenção: Usar equipamento de protecção adequado (EPI) quando manipulação ao manusear paraformaldeído. - Seções de bloco com 3% albumina de soro bovino diluído em PBS contendo 0,01% Triton-X100 por 30 min. Esta solução de bloqueio é referida como daqui por diante o diluente primário.
- Diluir a coelho anti-desmin da imunoglobulina G (IgG) no diluente primária (1: 200).
- Após o bloqueio completo, aplicam-se os anticorpos primários diluídos em seções e incubar durante uma noite no frigorífico, a ~ o 4 ° C. Lave as seções de uma vez (5 min) com PBS contendo 0,1% Triton X-100. Esta solução é referida daqui por diante como o tampão de lavagem primeiro.
- Lavar as seções 3 vezes (5 min por lavagem) com PBS.
- Preparar o anticorpo secundário diluindo cabra anti-rabbit IgG (conjugada com corante fluorescente vermelho) em PBS contendo 0,01% Triton X-100.
- Aplicar o anticorpo secundário diluído nas secções e incubar a temperatura ambiente (~ 23 ° C) por 60 min.
- Lavar as seções de uma vez (5 min) com o primeiro tampão de lavagem. Lave as seções 3 vezes (5 min por lavagem) com PBS.
- Aplicar DAPI 3 min. Lave as seções 3 vezes (1 min por lavagem) com PBS. Aplicar ~ 50 µ l do meio de antidesvanece-se em seções e lamela de vidro. Selar as bordas da lamínula com esmalte claro.
- Usando o microscópio de luz e fluorescente (ver Tabela de materiais), estudo a tintura fluorescente seções serial com um 10 X objetivo e um filtro apropriado para visualizar vermelho.
- Recolher as imagens digitais (~ 15) dos campos visual sobrepostos para cobrir toda a secção do músculo TA Cruz. Recolher as imagens de fluorescência de DAPI rotulagem para cada um dos campos visual alternando para a configuração de filtro apropriado.
- Aberto e analisar as imagens usando um software de imagem apropriado conforme descrito nas etapas 7.2.3 - 7.2.4.
Nota: Estudar imagens para identificar, quais fibras musculares são danificado (desmin negativo), que fibras musculares têm nucleação central (desmin fibras positivas que têm núcleos DAPI-rotulado localizados internamente ao invés de perifericamente) e, quais áreas da seção tem inflamação e/ou fibrose (áreas que têm muitos núcleos DAPI-rotulado agrupados, mas são desprovidos de fibras musculares).
- Fix seções com 2% paraformaldeído em PBS durante 10 min. lavagem as seções três vezes com PBS.
Resultados
Em 3 dias pós-MIME, o doador EDI que é implantado por MIME está contido no interior do compartimento de músculo TA anfitrião (Figura 2A–C). Como esperado, as seções transversais do músculo TA de ratos do doador, estudou sob a óptica de fluorescência, não mostrar fluorescência verde, porque eles não expressam GFP (Figura 2D). Em contraste, as seções transversais do músculo de ratos de host que não são implantados com tecido doador, TA mostrar fluorescência verde uniforme nas fibras musculares TA, como as fibras expressam GFP (Figura 2E). Em cortes transversais dos músculos implantados por MIME com tecido de músculo doador, há uma linha de demarcação entre as fibras musculares de anfitrião (GFP +) e fibras musculares de doador (GFP-). As imagens de contraste de fase dos campos visual mostrados na Figura 2D–F são apresentadas na Figura 2E'–F' e sugerem que efectivamente existem fibras musculares presentes em regiões onde não há nenhum GFP sinal.
Em 14 dias pós-MIME e BaCl2 injeção, estudando serial Cruz seções do músculo TA que restam unlabeled ou são rotuladas com anticorpos para desmin (Figura 3), aprendemos que o sinal GFP é expressa por todas as fibras musculares na Não tratado músculo de ratos do anfitrião, mas não no músculo MIME-tratada (vermelho desmin rotulagem detecta viáveis fibras musculares). No músculo hospedeiro TA tratado com injeção de MIME e BaCl2 , o doador-derivado de células myogenesis é evidente da presença de muitas fibras musculares desmin(+) que não mostram nenhum sinal detectável de GFP (Figura 3–D, C 3' –D'). Quiméricoes fibras musculares decorrentes da provável fusão das células miogênico host e doador pode ser detectadas pelo baixo a níveis moderados de fluorescência de GFP exibido por estas fibras. Numerosas fibras quiméricoes aparecem em todo o diâmetro inteiro do músculo TA sugerindo que o doador SCs são capazes de migrar centenas de micra dentro o epimísio do músculo do hospedeiro. Quantificação de GFP + fibras é mostrada na Figura 3E. A Figura 4 mostra imagens de alta ampliação da série seções transversais de um inteiro MIME + BaCl2 tratados TA muscular.
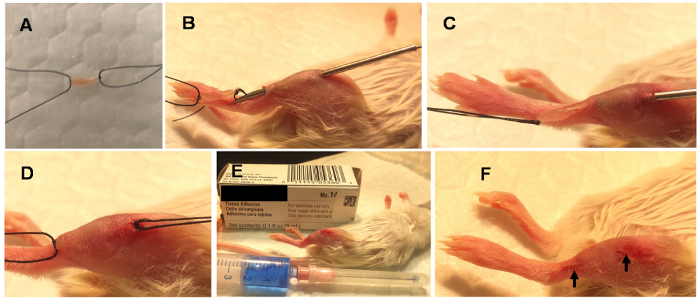
Figura 1 . Etapas envolvidas na minimamente invasiva músculo incorporação (MIME).
MIME é realizada sob anestesia geral. Envolve colocar ~ 10 mg de músculo doador (doador do mouse EDI) em solução de Ringer e atar as suturas orientadores de suas extremidades (A). Uma agulha de calibre 18 é transmitida através do eixo do músculo do anfitrião (B) e o tecido do doador é desenhado através da pista de agulha (C). O tecido do doador é esquerda incorporada no músculo do hospedeiro (D), as suturas orientadores são cortadas e os furos de agulha são selados com cola de tecido (E). As feridas de agulha selados são indicadas com setas (F). Clique aqui para ver uma versão maior desta figura.
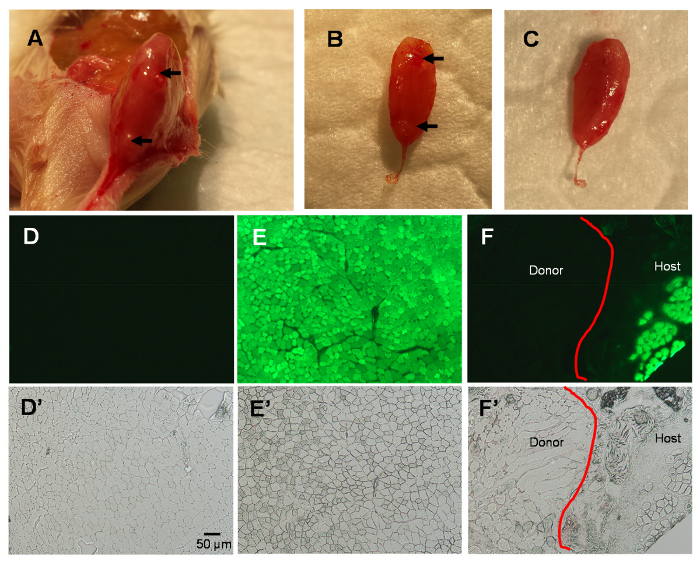
Figura 2 . Estudos do músculo TA 3 dias após o MIME.
Músculo de anfitrião coletados 3 dias após o MIME; Nota de marcas de agulha no host TA (setas; A-B). Dados mais confirmam que o rato incorporado doador EDL é acomodado no interior do compartimento de músculo TA (B-C). Imagens de fluorescência do músculo TA seções transversais mostrar nenhuma fluorescência verde no músculo de TA do selvagem-tipo (D), fluorescência verde brilhante no músculo TA NSG-GFP (E)e uma distinção entre host e doador muscular no músculo TA NSG-GFP em 3 dias pós-mimo (F). As imagens de contraste de fase dos campos visual em D-F são mostradas em D'-F', respectivamente. A linha vermelha em painéis F e F' mostra a linha de demarcação entre o tecido do hospedeiro e doador. Barra de escala = 50 µm. clique aqui para ver uma versão maior desta figura.
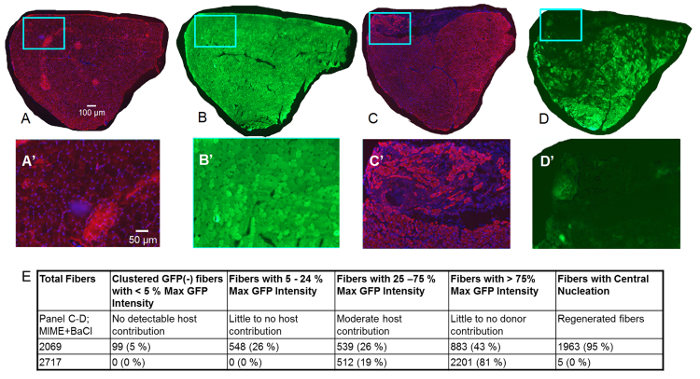
Figura 3 . Estudos do músculo TA 14 dias depois de MIME.
Dados coletados 14 dias pós-MIME são apresentados. O sinal vermelho é de rotulagem imunofluorescência de desmin (um sinal positivo para desmin denota que myofibers são viáveis), o sinal azul é de DAPI (núcleos de manchas), e o sinal verde é de GFP. No músculo TA de controle (membro posterior direito) colhido o mouse do host, como esperado, quase todos os myofibers são positivos para desmin, sugerindo que estes myofibers são viáveis (A; sinal vermelho). Além disso, com base na coloração de DAPI, é evidente que myonuclei de quase todos os myofibers se encontram perifericamente, como seria de esperar num músculo saudável (A; sinal azul). Serial do músculo TA controle mostram que, quase todas as fibras musculares são verde brilhante, sugerindo que eles são positivos para as boas práticas agrícolas. Em MIME + BaCl2 -tratados músculo TA (membro posterior esquerdo), myogenesis doador-mediada por células é evidente a partir da presença de muitas fibras musculares desmin(+) que não mostram nenhuma fluorescência detectável de GFP (C-D, C'-D'). Desmin(+) fibras musculares com baixo a moderado fluorescência de GFP (quiméricoes fibras musculares) estão presentes em todo o diâmetro do músculo TA inteiro, sugerindo que, MIME fornece dador SCs que podem migrar dentro do epimísio do músculo TA e promover doador-derivado de células myogenesis. A'-D' são imagens de alta ampliação das regiões dentro as caixas azuis na -i. Quantificação de GFP(+) fibras e fibras centralmente nucleadas são mostrados em mi. Barras de escala = 100 µm (A-D) e 50 µm (A'-D'). Clique aqui para ver uma versão maior desta figura.
RC="/files/ftp_upload/55731/55731fig4.jpg" / >
Figura 4 . Evidências de danos generalizados e regeneração 14 dias após a injeção de MIME e BaCl2 .
Alta ampliação, seriais seções transversais de um inteiro MIME + BaCl2 tratados TA músculo são apresentadas. Os dados mostram que fibras musculares, que são moderadamente muitos ou fortemente GFP + centralmente localizado núcleos (A-B; vermelho sinal na é de desmin, sinal azul, em lá é de DAPI e sinal verde em B é de GFP). Estes dados sugerem que a degeneração e regeneração após a injeção de BaCl2 não afeta a expressão de GFP. Neste contexto, a presença de fibras de músculo central nucleadas em MIME + BaCl2 tratados TA muscular, com expressão de GFP de pouco ou nenhum, sugere que estas fibras são o resultado provável de myogenesis (ou regeneração) com contribuição significativa de GFP - células miogênico. Essas observações podem ser verificadas ainda mais em imagens de alta ampliação dos campos selecionados (C-F; C e D e E e F, respectivamente, estão se sobrepondo as regiões de seriais seções transversais; código de cores das bordas da imagem denotar a localização dessas regiões na e B). Barras de escala = 100 µm (A-B) e 50 µm (C-F). Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui, apresentamos um protocolo detalhado para a nova técnica experimental conhecido como MIME, desenvolvido em nosso laboratório, para implantar o tecido muscular de doador no tecido de músculo do hospedeiro. Esta é uma adaptação de um músculo aberto enxertia técnica que já provou para ser eficaz na promoção myogenesis doador-mediada por células em um anfitrião músculo9,10,17.
O objetivo do MIME é para não permitir a enxertia de doador tecido muscular em si no músculo hospedeiro (atualmente não sabemos se isso ocorre), mas sim para fornecer uma fonte de doadores SCs que podem contribuir para myogenesis no músculo hospedeiro em condições que estimulam m regeneração uscle. Nossa esperança é que, depois de MIME foi optimizado e testado em estudos básicos e pré-clínicos, ele poderia fornecer informações valiosas para orientar as terapias clínicas que visam aumentar a regeneração muscular nos músculos esqueléticos que sofreram perda muscular miogênico.
Existem inúmeras questões que ainda precisam ser respondidas sobre como MIME pode ser traduzido em uma terapia clínica, por exemplo: como seria nós controlamos a qualidade do tecido doador? Como iria controlar rejeição imune de células e tecidos do doador? É o tecido do doador limpo depois de fornecer células para myogenesis ou sai por trás de uma cicatriz fibrótica? O tipo de fibra do músculo doador ou hospedeiro afeta o myogenesis doador-mediada por células? Que músculos praticamente podem beneficiar de MIME? Atualmente estamos expandindo nossos estudos para avaliar se o MIME é segura e eficaz, identificar tratamentos adjuvante que podem aumentar myogenesis derivados de doador e responder a muitas das perguntas, listadas acima.
Depois de completar nossos testes do rato para transplante alogênico com MIME, nosso próximo passo é executar o MIME humano-a-mouse com tecido humano cadavérico para avaliar o potencial miogênico de tecido muscular cadavérico. Esperamos que estas experiências conduzirá a uma nova linha de pesquisa básica e translacional, que envolve o tecido muscular de doadores, que são registrados em iniciativas como o programa de doação de corpo para a educação e o programa Gift of Life para doação de órgãos .
Os dados representativos apresentados neste manuscrito sugerem que em 14 dias depois de MIME, existem vários myofibers viáveis que falta GFP ou têm níveis baixos de GFP. Nossa interpretação destes dados é que as células satélite de GFP-doador contribuiu para o myogenesis no músculo do hospedeiro. Realizamos esta experiência em preparação para implantação de tecido humano de fetos morto em um músculo de rato do anfitrião. Para demonstrar inequivocamente que as células satélites do doador contribuir para myogenesis no músculo hospedeiro seguindo MIME, que seria útil para implante tecido doador que expressa um repórter fluorescente, que pode ser facilmente distinguida das GFP (por exemplo, vermelha proteína fluorescente expressando tecido de doador implantado em GFP + músculo hospedeiro).
Esta técnica é limitada principalmente pela natureza das SCs presentes no tecido doador. Se o SCs no tecido doador são viáveis, que a técnica é susceptível de facilitar myogenesis doador-mediada por células, enquanto se não são viáveis, myogenesis não pode ocorrer. No entanto, desde SCs são muito resistentes e são viáveis para cerca de 2 semanas após a morte, é muito provável que, para fins experimentais, o tecido do doador que é implantado em poucos minutos após a colheita irá facilitar doador-mediada por células myogenesis13 . Além disso, como aludido acima, é possível que, desde o tecido de músculo inteiro (que contém SCs, maduro de fibras musculares, bem como residente no músculo fibroblastos) é incorporado no músculo hospedeiro, fibrose pode ocorrer. No entanto, esta hipótese precisa ser examinado empiricamente. A literatura sobre lesão muscular decorrentes de contrações prejudiciais, cryoinjury e myotoxins experimental, sugere que as células imunes (macrófagos principalmente) são capazes de efetivamente limpando restos celulares das fibras danificadas e remodelar a matriz extracelular18. Portanto, é possível que após a injeção de MIME e BaCl2 , enquanto as células imunes do hospedeiro têm acesso às fibras de músculo doador degeneram, eles poderiam limpar escombros, deixando para trás apenas o doador SCs. Finalmente, a extensão do doador-derivado myogenesis é dependente da quantidade de tecido muscular doador que está incorporado no músculo do hospedeiro. Em ordem para o compartimento de músculo de anfitrião ser totalmente repovoada por doador-derivado de células myofibers, exigiria um método como X - ou irradiação gama para ablate músculo hospedeiro SCs e também requerem procedimentos repetidos de MIME.
Foi demonstrado que expor cirurgicamente um músculo de anfitrião e suturar um pedaço de tecido de doador no músculo do hospedeiro podem facilitar doador-mediada por células myogenesis9,10,17. Esta abordagem cirúrgica aberta tem sido usada no passado para controlar a progressão de myogenesis e para gerar modelos de rato de doenças músculo humano. O aspecto inovador da técnica MIME é que é minimamente invasivo e não envolve expor cirurgicamente o músculo do hospedeiro. Isso reduz o risco de infecção iatrogênica e o grau de desconforto no animal hospedeiro, portanto, tornando-se mais viável para executar o MIME repetidamente sobre o mesmo músculo de acolhimento, se necessário.
Prevemos que a técnica MIME pode ser um refinamento adequado para a abordagem cirúrgica aberta que atualmente é seguido para implante de tecido muscular de doador para um rato de anfitrião. Isso poderia acelerar a geração de modelos de rato humanizado, incorporando uma biópsia muscular humano em músculo de rato do anfitrião. Além disso, com base em nossos dados preliminares do rato-para enxertia, prevemos que o MIME será eficaz em alcançar myogenesis doador-mediada por células do tecido de doador cadavérico humano enquanto doador SCs são viáveis. Finalmente, com validação e testes adicionais, esperamos que a técnica MIME ajudará a desenvolver novas terapias para facilitar myogenesis doador-mediada por células em seres humanos com doenças musculares.
O sucesso da técnica MIME é criticamente dependente precisamente a incorporação do tecido doador dentro do compartimento fascial (epimísio) do músculo do hospedeiro. Só se o tecido do doador é colocado no compartimento do músculo de acolhimento, será capaz de fornecer SCs no músculo do hospedeiro de forma precisa. Se o tecido do doador é colocado fora do músculo de anfitrião, é incerto sobre o que seria o seu destino. Em nosso modelo experimental para MIME, usamos o músculo TA como o músculo do hospedeiro, uma vez que é proeminente e superficialmente colocada no aspecto ântero-lateral da perna. O tamanho, a orientação e a posição anatômica do músculo TA, torna mais fácil para confirmar que o tecido do doador é colocado corretamente dentro do músculo do anfitrião TA depois MIME. Neste trabalho, nós fornecemos evidências experimentais que o tecido do doador rerede incorporada dentro o host músculo TA na pós-mímica 3 dias e que lá é mediada por células-doador myogenesis no músculo do hospedeiro em 14 dias pós-MIME.
Divulgações
Os autores têm sem interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi feito possível por uma concessão do piloto da Aliança para regenerativa pesquisa de reabilitação e treinamento (AR3T) e um pacote de inicialização do corpo docente da Wayne State University a jarra. AR3T é suportado pelo Eunice Kennedy Shriver National Institute de saúde infantil e desenvolvimento humano (FORMULADORES), Instituto Nacional de Disorders Neurological e Stroke (NINDS) e Instituto Nacional de imagem biomédica e bioengenharia (NIBIB ) dos institutos nacionais de saúde, sob número P2CHD086843 Award. O conteúdo é exclusivamente da responsabilidade dos autores e não representa necessariamente a opinião oficial do institutos nacionais da saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| NSG-GFP mice | The Jackson Laboratory (Bar Harbor, ME) | Stock #021937 | Immunodeficient host mice that ubiquitously express green fluorescent protein |
| C57BL/6J mice | The Jackson Laboratory (Bar Harbor, ME) | Stock #000664 | Control donor mice |
| Tabletop isoflurane vaporizer | VetEquip (Livermore, CA) | Item #901801 | Inhaled anesthesia system |
| Magic depilatory crea | Softsheen Carson (New York, NY) | N/A | Razorless hair removal cream |
| 4-0 Silk, black, braided, non-absorbable sutures | Roboz Surgical Instrument Co, Inc. (Gaithersburg, MD) | SUT106631 | Guiding sutures for donor tissue |
| VetBond veterinary tissue adhesive | 3M (Maplewood, MN) | Catalog #1469Sb | Veterinary tissue adhesive for sutureless skin closure |
| Barium chloride | Ricca Chemical Company (Arlington, TX) | Product #R0854000-500A 854-16 | Myotoxin to induce muscle damage and stimulate regeneration |
| Deltaphase isothermal gel heating pad | Braintree Scientific (Braintree, MA) | Item #39DP | Heating pad to provide thermal support to animals while under anesthesia |
| HM525NX cryostat | ThermoFisher (Waltham, MA) | Catalog #HM525NX | Cryostat to make frozen sections of muscle |
| Vectashield Antifade Medium | Vector Laboratories, Inc. (Burlingame, CA) | Catalog Number: H-1000 | Antifade medium to preserve fluorescence in immunofluorescently labeled samples |
| Rabbit anti Desmin Antibody | Labvision Thermo Scientific (Fremont, CA) | RB9014P | Rabbit anti desmin antibody for desmin immunofluorescent labeling |
| Goat anti Rabbit Alexa 568 Antibody | ThermoFisher (Waltham, MA) | Catalog#: A-21069 | Goat anti rabbit secondary antibody for desmin immunofluorescent labeling |
| 4',6-diamidino-2-phenylindole (DAPI) | Seracare (Milford, MA) | Catalog #5930-0006 or 71-03-01 | Reagent for fluorescent labeling of nuclei |
| Axio Scope.A1 microscope | Carl Zeiss (Peabody, MA) | Product #Axio Scope.A1 | Light and fluorescence microscope |
| Photoshop CS4 | Adobe Systems (San Jose, CA) | Photoshop CS4 | Imaging Software for perform image tiling |
| Image J | National Institutes of Health (Bethesda, MD) | Image J for Windows 64-bit Operating System | Imaging Software for quantitative fluorescence analysis |
Referências
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Robertson, T. A., Grounds, M. D., Papadimitriou, J. M. Elucidation of aspects of murine skeletal muscle regeneration using local and whole body irradiation. J Anat. 181 (Pt 2), 265-276 (1992).
- Charge, S. B., Rudnicki, M. A. Cellular and molecular regulation of muscle regeneration. Physiol Rev. 84 (1), 209-238 (2004).
- Brack, A. S., Rando, T. A. Tissue-specific stem cells: lessons from the skeletal muscle satellite cell. Cell Stem Cell. 10 (5), 504-514 (2012).
- Krag, T. O., Hauerslev, S., Sveen, M. L., Schwartz, M., Vissing, J. Level of muscle regeneration in limb-girdle muscular dystrophy type 2I relates to genotype and clinical severity. Skelet Muscle. 1 (1), 31 (2011).
- Skuk, D., et al. Dystrophin expression in myofibers of Duchenne muscular dystrophy patients following intramuscular injections of normal myogenic cells. Mol Ther. 9 (3), 475-482 (2004).
- Beauchamp, J. R., Morgan, J. E., Pagel, C. N., Partridge, T. A. Dynamics of myoblast transplantation reveal a discrete minority of precursors with stem cell-like properties as the myogenic source. J Cell Biol. 144 (6), 1113-1122 (1999).
- Sakellariou, P., et al. Neuromuscular electrical stimulation promotes development in mice of mature human muscle from immortalized human myoblasts. Skelet Muscle. 6 (1), 4 (2015).
- Collins, C. A., et al. Stem cell function, self-renewal, and behavioral heterogeneity of cells from the adult muscle satellite cell niche. Cell. 122 (2), 289-301 (2005).
- Zhang, Y., et al. Human skeletal muscle xenograft as a new preclinical model for muscle disorders. Hum Mol Genet. 23 (12), 3180-3188 (2014).
- Juhas, M., Engelmayr, G. C., Fontanella, A. N., Palmer, G. M., Bursac, N. Biomimetic engineered muscle with capacity for vascular integration and functional maturation in vivo. Proc Natl Acad Sci U S A. 111 (15), 5508-5513 (2014).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Eng Part A. 20 (17-18), 2402-2411 (2014).
- Latil, M., et al. Skeletal muscle stem cells adopt a dormant cell state post mortem and retain regenerative capacity. Nat Commun. 3, 903 (2012).
- Maykel, J., et al. NOD-scidIl2rg (tm1Wjl) and NOD-Rag1 (null) Il2rg (tm1Wjl) : a model for stromal cell-tumor cell interaction for human colon cancer. Dig Dis Sci. 59 (6), 1169-1179 (2014).
- Casar, J. C., et al. Heparan sulfate proteoglycans are increased during skeletal muscle regeneration: requirement of syndecan-3 for successful fiber formation. J Cell Sci. 117 (Pt 1), 73-84 (2004).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PLoS One. 11 (1), e0147198 (2016).
- Roberts, P., McGeachie, J. K., Grounds, M. D., Smith, E. R. Initiation and duration of myogenic precursor cell replication in transplants of intact skeletal muscles: an autoradiographic study in mice. Anat Rec. 224 (1), 1-6 (1989).
- Tidball, J. G. Mechanisms of muscle injury, repair, and regeneration. Compr Physiol. 1 (4), 2029-2062 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados