Method Article
Minimal-Invasive Muskel einbetten (MIME) - eine neuartige experimentelle Technik, Spender-Zell-vermittelten Myogenesis zu erleichtern
In diesem Artikel
Zusammenfassung
Wir beschreiben eine neuartige experimentelle Technik, die nennen wir Minimal Invasive Muskel einbetten (MIME), basiert auf dem Beweis Skelettmuskelgewebe lebensfähige myogen Zellen enthält, die Spender-Zell-vermittelten Myogenesis bei implantiert erleichtern können Ein Host-Muskel.
Zusammenfassung
Skelettmuskel besitzt Regenerationsfähigkeit durch Gewebe-Resident, Muskel-Faser-Generierung (myogen) Satelliten-Zellen (SCs), die neuen Muskelfasern unter den richtigen Bedingungen bilden können. Obwohl SCs aus Muskelgewebe geerntet werden können und in Vitrokultiviert, sind die daraus resultierenden Myoblast Zellen nicht sehr effektiv bei der Förderung von Myogenesis wenn in Host Muskel verpflanzt. Chirurgisch Freilegung des Host-Muskels und Pfropfung Segmente des Spenders Muskelgewebe oder isolierter Muskelfasern mit ihren SCs auf Host Muskel, fördert die bessere Myogenesis im Vergleich zu Myoblast Transplantation. Wir haben eine neuartige Technik entwickelt, die wir Minimal Invasive Muskel einbetten (MIME) nennen. MIME beinhaltet Übergabe einer chirurgischen Nadel durch den Host-Muskel, zeichnen ein Stück Muskel Spendergewebe Durchgangsgleis Nadel und dann verlassen das Spendergewebe in der Host-Muskel eingebettet, so dass es als eine Quelle der SCs für den Host-Muskel fungieren kann. Hier beschreiben wir ausführlich die Schritte bei der Durchführung von MIME in einem immungeschwächte Mausmodell, die ein grünes fluoreszierendes Protein (GFP) ausdrückt, in allen seinen Zellen. Immunschwäche in der Host-Maus reduziert das Risiko der Immunabwehr das Spendergewebe, und GFP Ausdruck ermöglicht einfache Identifizierung der Host Muskelfasern (GLP +) und Spender Zelle abgeleitet Muskelfasern (GFP-). Unser pilot Daten zufolge MIME verwendet werden, um ein Beinstrecker m.digitorum Longus (EDL) Muskel von einem Spender-Maus in den m. Tibialis anterior (TA) Muskel Mausklick Host Implantat. Unsere Daten deuten auch, dass wenn ein Myotoxin (Barium Chlorid, BaCl2) nach MIME in der Host-Muskel injiziert wird, gibt es Anzeichen für Spender-abgeleitete Myogenesis in der Host-Muskulatur, mit ca. 5 %, 26 %, 26 % und 43 % der Fasern in einem einzigen Host TA Muskel zeigen keine Host Beitrag, minimale Host Beitrag moderate Host Beitrag und maximale Host Beitrag bzw..
Einleitung
Gesunde Skelettmuskulatur, obwohl nach dem mitotischen besitzt ausgezeichnete Regenerationsfähigkeit aufgrund des Vorhandenseins von Gewebe-Resident myogen Zellen bekannt als Satellitenzellen (SCs)1,2; und in3,4überprüft werden. Jedoch unter pathologischen Bedingungen verursacht durch Muskeldystrophien, Trauma oder beschleunigte Alterung der Muskelregeneration kann nicht mithalten mit Muskelabbau, und progressive Muskelfaser Verlust tritt somit5. Obwohl wirksame Methoden entwickelt wurden, um SCs von Muskel zu isolieren und in der Kultur, große Anzahl von Myoblasten (und später Myotubes) generieren zu erweitern, haben Versuche, physiologisch relevanten Anzahl von Muskelfasern im Host Muskel generieren ergab nur minimalen Erfolg6. Wie mit vielen anderen Zelltypen, wenn Myoblasten Wirtsgewebe, alleine injiziert werden die meisten Zellen nicht7,8Einheilungschancen. Wir haben gezeigt, dass Neuromuskuläre Elektrostimulation (NMES) Spender-abgeleitete Myogenesis in Host Regeneration-defizienten Maus Muskel ermöglicht, die mit menschlichen Myoblasten8injiziert wurde. Andere haben gezeigt, dass chirurgisch Pfropfen biopsiert Muskel- oder einzelne Muskelfasern mit angehängten SCs erleichtern moderate Myogenesis auch ohne NMES, darauf hindeutet, dass ganze Muskelfasern mit SCs Implantation möglicherweise vorteilhafter als die Implantation myogen Zellen allein9,10. Da Spender oder veränderter Muskelgewebe veredelt in Host Muskel bessere Ergebnisse als die Transplantation von Zellen allein produziert, ist es möglich, dass Gewebe oder Gewebe-artige Strukturen entscheidende Hinweise für Spender-Zelle Engraftment bieten könnte; ein Konzept, das in Zell-Therapie-Studien mit verschiedenen Zelle Arten10,11,12immer deutlicher wird.
Aktuellen Daten geht hervor, dass SCs erhalten von Menschen, die mehr als 2 Wochen post-mortem Myotubes Kultur13erstellen. Deshalb wollen wir prüfen, ob die Implantation von Post-Mortem-Muskel Gewebe geerntet in einen lebenden Wirt Muskelfaser Verlust umkehren wird. Wir entwickelten eine neuartige Technik namens MIME um Spender Muskelgewebe in Skelettmuskelgewebe eines lebenden Hosts einzupflanzen, um Spender Zelle abgeleitet Myogenesis zu fördern. MIME geht vorbei an einer chirurgischen Nadel durch den Host Muskel um eine Nadel Spur erstellen; zeichnen einen kleinen Ausschnitt des Spenders Muskelgewebe Durchgangsgleis Nadel; verlassen das Spendergewebe eingebettet in der Host-Muskel; und Schließen der Nadellöcher mit Gewebe-Klebeband. Nach dem Üben der Technik bei euthanasierten Mäusen untersucht in anderen Experimenten, wir haben jetzt MIME in live Mäuse, die immungeschwächt sind durchgeführt und ubiquitär express ein grünes fluoreszierendes Protein (GFP) und Follow-up bei 3 bis 14 Tagen Post-MIME. Bei 3 Tage Post-Pantomime bestätigen wir, dass Spender Maus (GFP)-EDL Muskel Host Maus (GLP +) TA Muskel, bleibt in der Host-Muskel eingebettet implantiert. Bei 14 Tagen Post-Pantomime bestätigen nach BaCl2 Myotoxin Verletzung, Schaden und Myogenesis, induzieren wir, dass ca. 5 %, 26 %, 26 % und 43 % der Fasern in einem einzigen Host TA Muskel keine Host Beitrag, minimale Host Beitrag, moderate Host zeigen Beitrag und maximaler Beitrag, bzw. veranstalten. Zentrales Keimbildung (ein Marker der Degeneration und anschließende Regeneration) sieht in etwa 95 % der Muskelfasern TA nach MIME und Myotoxin Injektion.
Wir studieren TA Muskeln 14 Tage nach MIME + BaCl2 , weil diesem Zeitpunkt die Zwischenstufe der Regeneration, fängt wenn eine Mehrheit der regenerierten Fasern sind zentral kernhaltigen. Wir studieren GFP + Mäuse als Gastgeber für Pantomime, damit wenn wir schließlich menschlichen cadaveric Muskel in Host-Mäuse Transplantation, wir leicht Muskelfasern Host und Spender Herkunft unterscheiden können. Wir verwenden Sie die Maus EDL Muskel als experimentelle Spendergewebe, da einzelne Fasern aus dieser Muskel größeres myogen Potenzial als TA Muskeln9gezeigt haben. Die EDL-Muskel ist auch synergistische an den TA-Muskel und hat ähnliche Fasertyp Zusammensetzung. Unsere vorläufigen Daten zufolge MIME Spender-abgeleitete Myogenesis in der Host-Muskel zu erleichtern vermag.
Protokoll
alle Studien, die mit lebenden Tieren sind von der Institution Animal Care und Nutzung Committee (IACUC) an der Wayne State University, Detroit, Michigan, USA, zugelassen und werden gemäß dem Leitfaden für die Pflege und Verwendung von Labortieren ( 8. Auflage, 2011, veröffentlicht von National Academies Press, 500 Fifth Street, NW, Washington, DC 20055, USA Lockbox 285). Gemäß den genehmigten IACUC Protokolle wurden Verfahren im Zusammenhang mit Schmerzen und/oder Bedrängnis unter Vollnarkose, durchgeführt, die induziert wird und gepflegt von Isofluran Inhalation (1,5-5 % auf Effekt). Narkose wurde vom Rücktrittsrecht bis zu den Zehen zusammendrücken, und mangelnde palpebrale verifiziert oder Tasthaare Antworten (der Prozentsatz der Isofluran wurde erhöht, wie notwendig, um den Effekt zu erhalten). Aufgrund des minimal-invasiven Charakters der Protokolle ein " sterile Tipps " Technik folgte. Während Tiere in Narkose waren, wurde Vaseline auf die Augen, um Trockenheit zu verhindern angewendet. Keine speziellen Behandlungen waren erforderlich; jedoch wurde Diät Gel bereitgestellt, um die Tiere für 24 h nach Verfahren, die allgemeine Anästhesie., die der Prüfer zugelassen ist, durch die IACUC beteiligt zurückzuhalten, Analgesie nach MIME, da das Verfahren nicht chirurgisch Freilegung des Hosts Muskel, da es eine Megalosauridae beschränkt ist und hat keinen Einfluss auf die normale Funktion und viele gemeinsame schmerzstillende Medikamente bekannt sind, um normale Muskelregeneration zu beeinflussen.
1. Tiermodelle
- Host Mäuse für MIME
- Verwendung NSG-GFP Mäuse (8-10 Wochen, männliche) als Gastgeber für den Muskelaufbau Transplantationen Studien.
Hinweis: Diese Mäuse sind ideale Gastgeber für allogene Muskel Transplantationen, denn sie Reifen T- und B-Lymphozyten und funktionale natürliche Killerzellen fehlen, einen Mangel an Cytokine signaling haben und habe für Allografting oder Xenografting nicht-Muskelzellen durch andere < sup Klasse = "Xref" > 14. Allgegenwärtige GFP Ausdruck ermöglicht einfache Identifizierung der Host (GLP +) und Spender Zelle abgeleitet (GFP)-Muskelfasern.
- Verwendung NSG-GFP Mäuse (8-10 Wochen, männliche) als Gastgeber für den Muskelaufbau Transplantationen Studien.
- Spender Mäuse für MIME
- Verwendung C57BL/6J Mäuse (12-16 Wochen) als Spender Mäuse.
Hinweis: Diese Mäuse sind Spenderin Mäuse, denn sie eine vollständig zugeordnete Genom haben, nicht bekannt sind, haben alle Skelettmuskeln Pathologie leicht verfügbar und wirtschaftlich sind und nicht, GFP ausdrücken.
- Verwendung C57BL/6J Mäuse (12-16 Wochen) als Spender Mäuse.
2. Vorbereitung der Spender Muskelgewebe
- binden Guiding Nähte und Harvesting Spender EDL Muskeln
- einschläfern die Spender-Mäuse durch zervikale Dislokation und Thorakotomie unter Vollnarkose verabreicht durch eine Tischplatte durchgeführt Isofluran Vaporizer angetrieben von medizinischem Sauerstoff (inhalative Isofluran; 2-5 % Wirkung).
- EDL-Muskeln, Zugang zu verwenden chirurgische Schere, um die Haut über die Vorderfläche des Beines zu öffnen. Suchen Sie den TA-Muskel am vorderen Bein und entfernen um die EDL-Muskel zu visualisieren, der hinter der TA-Muskel befindet. Schieben Sie die Spitze eines Paares von Zangen hinter der EDL-Muskel und anwenden sanfte Traktion um festzustellen, ob die Zehen erweitern (Dies bestätigt, dass der Muskel der EDL).
Hinweis: Spender Gewebebereich sollte chirurgisch, aseptisch vorbereitet vor der Ernte werden. - Einsatz ~ 10 cm Segmente von 4-0 Seide, geflochtene, nicht resorbierbar, sterile Naht und zwei Doppelknoten machen die leitenden Fäden auf die proximalen und distalen Sehnen des Muskels EDL anwenden. ( Abbildung 1A).
- Die distalen EDL-Sehne, reflektieren die EDL-Muskel und schneiden die proximale Sehne.
- Ort des Spenders EDL in einer Petrischale Muskeln mit Maus-Ringer-Lösung gefüllt.
3. Vorbereitung Host Mäuse für MIME
- Anästhesie
- der Host Maus unter Vollnarkose (inhalative Isofluran; 1,5-5 % auf Effekt) durch eine Tischplatte Isofluran-Verdampfer, angetrieben von medizinischem Sauerstoff verabreicht.
- Induzieren Anästhesie in einer Kammer Induktion und dann die Maus auf einem Prüfkopf weiterhin die Narkose beim Ausführen von anderen Verfahren auf das Tier übertragen. Thermische unterstützen mit einem isothermen Gel, Heizkissen, während das Tier in Narkose ist.
- Vorbereitung der Haut
- , das Tier zu entfernen ' s fur, wenden Sie eine Enthaarungscreme über den vorderen Aspekt des linken Hinterbeines. Das rechte Bein dient als ein Steuerelement Bein für nachfolgende Verfahren.
- Lassen die Enthaarungscreme auf für 2 min. sauber aus der Enthaarungscreme zusammen mit den freistehenden Fell mit Tücher getränkt in Phosphat gepufferte Kochsalzlösung (PBS). Nach dem Fell entfernen, Peeling die Haut mit drei wechselnden Tücher von Povidon-Jod Wäsche Lösung und 70 % Ethanol.
- Einen Nadel-Track in der Host-TA-Muskel anlegen
- Pass ein 18-Gauge (1 x in lang) chirurgische Nadel durch die Mitte des Wirtes TA Muskel entlang der Muskel ' s langen Achse ( Abbildung 1 b). Führen Sie die Nadel in eine Cephalo-kaudalen Richtung, entlang der Länge des Muskels TA und durch die Mitte des Bauches Muskel ( Abbildung 1 b).
Hinweis: Dieser Schritt soll einen Nadel-Track zu erstellen, in dem ein Stück Spender Muskel eingebettet werden kann. Einbettung der Spendergewebe in der Mitte des Muskels TA würde möglicherweise erlauben die SCs aus dem Spendergewebe migrieren und erleichtern Myogenesis über den gesamten Host TA Muskel.
- Pass ein 18-Gauge (1 x in lang) chirurgische Nadel durch die Mitte des Wirtes TA Muskel entlang der Muskel ' s langen Achse ( Abbildung 1 b). Führen Sie die Nadel in eine Cephalo-kaudalen Richtung, entlang der Länge des Muskels TA und durch die Mitte des Bauches Muskel ( Abbildung 1 b).
- Embedding Spendergewebe in der Nadel-Spur der Host TA Muskel
- sobald die chirurgische Nadel innerhalb des Hosts TA Muskel ist, passieren die leitenden Fäden an einem Ende des Spendergewebe durch das Lumen der chirurgische Nadel in eine Caudo-cephalic Richtung ( Abbildung 1).
- Das Spendergewebe Durchgangsgleis Nadel zu zeichnen, wie die Nadel aus dem Host TA Muskel in eine Caudo-cephalic Richtung zurückgenommen wird.
- Verwenden die leitenden Fäden an den kaudalen und cephalic enden das Spendergewebe um die Platzierung der Spendergewebe anzupassen. Sicherzustellen, dass das Spendergewebe innerhalb des Hosts TA Muskel ( Abbildung 1) eingenistet ist.
- Sobald die Spender Gewebe Platzierung optimiert ist, die leitenden Fäden abschneiden letzten Anpassungen an die Spender-Gewebe-Platzierung mit feinen Spitzen Pinzette machen.
- Dichtung kutanen Nadel Wunden ( Abb. 1E -F) durch Annäherung an den Rand der Wunde mit der Pinzette und tierärztliche Gewebe Kleberauftrag mit einer 27-Gauge chirurgische Nadelspitze.
4. Intramuskuläre Injektion von Myotoxin zu induzieren konzertierte Muskeldegeneration und Regeneration
- nach MIME, 50-60 µL 1,2 % BaCl 2 (Myotoxin) in den Host TA Muskel induzieren umfangreiche Muskelfaser Schäden in der Host-Muskel injizieren und das Spendergewebe eingebettet 15.
- Injizieren BaCl 2 an 3 Standorten entlang der Länge des Wirtes TA Muskel (proximalen, mittleren und distalen Drittel des Muskels Bauches).
Hinweis: Injektion von Myotoxins wie BaCl 2, Cardiotoxins und Notexin in Skelettmuskulatur induziert konzertierte Muskelfaser Schaden gefolgt von Regeneration 16.
- Injizieren BaCl 2 an 3 Standorten entlang der Länge des Wirtes TA Muskel (proximalen, mittleren und distalen Drittel des Muskels Bauches).
5. Post-prozedurale Animal Care
- nach MIME und BaCl 2 Injektion, reinigen Sie die Host Maus ' s linken hinteren Bein mit Ethanol und eine dünne Schicht Vaseline auf die Haut zu schützen.
- Nach Post-prozedurale Hautpflege, entfernen Sie die Host-Maus aus die Bugnase.
- Platzieren Sie den Mauszeiger in eine einsame Erholung Käfig ohne Bettwäsche. Bieten thermische Unterstützung für das Wiederherstellen von Tier durch einen isothermen Gel Heizkissen gesetzt unter die Hälfte des Käfigs Erholung.
Hinweis: Eine Hälfte ist nicht beheizt, so dass das Tier vom das Heizkissen bewegen kann, wenn nötig. - Nach Host Maus vollständig aus der Narkose, erholt hat das Tier seinen ursprünglichen Käfig zurück. Legen Sie das Tier zurück in die Tierstation bis Follow-up-Versuche durchgeführt werden. Host Maus täglich zu überwachen, bis zur Serienreife für Follow-up – Beispiel: bei 3-14 Tage Post-MIME. Nach MIME, Tiere werden überwacht von Laborpersonal sowie von Tierärzten – dabei vor allem der Beurteilung, ob Tiere hell, aufmerksam und entgegenkommend sind; und auch beurteilen, ob Tiere offensichtliche für Schmerzen Anzeichen sind oder bewegen Schwierigkeiten, Fütterung, trinken und pflegend.
6. Gewebe-Sammlung
- Ernte Host Muskel
- einschläfern die Host-Mäuse durch zervikale Dislokation und Thorakotomie unter Vollnarkose verabreicht durch eine Tischplatte Isofluran-Verdampfer, angetrieben von medizinischem Sauerstoff (durchgeführt inhalative Isofluran; 2-5 % auf Effekt). der Prüfer hat auch IACUC Zustimmung zur Ernte TA Muskeln unter Vollnarkose vor Euthanasie.
- für den Zugriff auf den Host TA Muskeln verwenden chirurgische Schere, um die Haut über die Vorderfläche des Beines zu öffnen. Suchen Sie den TA-Muskel am vorderen Bein, schneiden die distale Sehne, den Muskel zu reflektieren und schneiden die proximalen Muskeln Anlagen (siehe Abschnitt 2.1).
- Erfassen (experimentell) links und rechts (Kontrolle) TA Muskeln.
- Frostige geerntete Muskeln reißen
- wiegen die geernteten Muskeln, indem man auf Papier wiegen und Waage.
- Tauchen kurz die Muskeln in Mineralöl für Cryoprotection. Tupfen Sie das überschüssige Öl.
- Ort-Muskeln auf Aluminiumfolie und Snap frieren die Muskeln durch schnell eintauchen in flüssigem Stickstoff gefüllt in eine Dewar. Die Proben auf beschriftete Cryovials übertragen und speichern Sie die Proben in einem-80 ° C Gefrierschrank für das spätere Studium.
7. Histologische Studien
- Kryoschneiden Muskelgewebe, serieller Querschnitte zu sammeln
- übertragen die Proben von-80 ° C Gefrierschrank auf einem Kryostat indem man sie in einem mit flüssigem Stickstoff Dewar.
- In der Kryostat eine Probe gleichzeitig verarbeiten. Mit eine kalten Rasierklinge (Klinge in Kryostat gespeichert) schneiden die Stichprobe zweimal in der Mitte Bauch des TA-Muskels, ein Segment des Muskels zu produzieren, die ca. 1-2 mm dick ist. Dieses Segment für die Herstellung der Kryostat Abschnitte beibehalten und die übrigen Teile des Muskels wieder seine Cryoröhrchen.
- Mit der optimalen Arbeitstemperatur (OCT) zusammengesetzte Einfrieren, sichern dicken Segment der Gewebe auf einem Kryostat Objektplatte. Legen Sie die Objektplatte auf Probenhalter.
- Rau-Gesicht der Stichprobe von 20 µm-Abschnitte schneiden. Sammeln Sie ein paar 20 µm Abschnitte auf Objektträger für den Kryostaten Abschnitten.
- Wenn die Qualität der 20 µm Abschnitte zufriedenstellend ist, ändern die Schnittstärke bis 5 µm und sammeln ein paar Abschnitte, um die Qualität zu beurteilen. Wenn die 5 µm-Abschnitte in Qualität zufriedenstellend sind, sammeln Sie Schnittserien. 2-3 Sektionen pro Folie zu sammeln und sammeln genug Abschnitte für 3 Dias.
- Abschnitte von experimentellen (links) und Steuerung (rechts) TA Muskeln jedes Tieres sammeln.
- Studium der GFP Ausdruck
Hinweis: benennen Sie einen Satz unterschiedliche Musterpräparate (Ziffer 7.1), GFP Ausdruck in den Muskelfasern zu studieren.- Gelten ~ 50 µL Anti-Fade Medium auf den Abschnitten und einem Glas Deckgläschen. Die Deckglas Schnittflächen mit klaren Nagellack versiegeln.
- Das Licht und fluoreszierende Mikroskop (siehe Tabelle der Materialien), die Abschnitte mit einem 10-fach Ziel und einen entsprechenden Filter zur Visualisierung von GFP zu studieren.
- Sammeln digitale Bilder (~ 15) von überlappenden Gesichtsfeld um den gesamten Querschnitt des TA-Muskels abzudecken. Sammeln die Phasenbilder Kontrast für jedes Visual-Felder durch den Wechsel von Fluoreszenz, Phase Kontrast am Mikroskop.
- Öffnen Sie Bilder mit einer geeigneten Bildbearbeitungssoftware, die einzelnen Bilder, um ein einzelnes zusammengesetztes Bild; produzieren Fliesen kann z. B. Nutzung der " Photomerge " Option im Menü "Datei" in der imaging-Software in der Tabelle der Materialien aufgeführt.
- Öffnen der GFP Fluoreszenzbilder mit einer geeigneten Bildanalyse-Software (z. B. ImageJ). Kreis einzelne Muskelfasern mit Hilfe der " ROI-Tool " und Aufzeichnen der Fluoreszenzintensität bedeuten für jede Faser.
- Berechnen der maximalen GFP (Fluoreszenz) Intensität mit dem Durchschnitt der bedeuten Fluoreszenzintensität von 10 Fasern, die zeigen hohe GFP Expression und haben normale Morphologie. Berechnen Sie % GFP Beihilfehöchstintensität für jede Faser, indem meine Blüte Intensität für jede Faser durch die Beihilfehöchstintensität GFP dividiert und mit 100 multipliziert. Tabellieren die GFP Analyseergebnisse für jeden TA-Muskel, wie in Abbildung 3E gezeigt.
- Studium der Muskelfaser Integrität und Myonuclear Lage von Immunofluorescent Kennzeichnung von Desmin und 4 ', 6-Diamidino-2-Phenylindole (DAPI), beziehungsweise.
Hinweis: Legen Sie einen Satz Folien vorbereitet, wie oben beschrieben, zu studieren, die Desmin-Kennzeichnung in den Muskelfasern.- Fix Abschnitte mit 2 % Paraformaldehyd in PBS für 10 min. in den Abschnitten dreimal mit PBS waschen.
Achtung: Tragen geeigneten persönlichen Schutzausrüstung (PSA) bei der Handhabung im Umgang mit Paraformaldehyd. - Mit 3 % Rinderserumalbumin in PBS mit 0,01 % verdünnt Blockabschnitte Triton-X100 für 30 min. Diese blockierende Lösung wird im folgenden bezeichnet. Das primäre Verdünnungsmittel.
- Verdünnen die Kaninchen Anti-Desmin Immunglobulin G (IgG) in das primäre Verdünnungsmittel (1: 200).
- Nach der Sperrung abgeschlossen ist, gelten die verdünnte Primärantikörper auf Abschnitte und Inkubation über Nacht im Kühlschrank bei ~ 4 ° c waschen in den Abschnitten einmal (5 min) mit PBS mit 0,1 % Triton x-100. Diese Lösung wird im folgenden die ersten Waschpuffer bezeichnet.
- In den Abschnitten 3 Mal (5 min pro Waschgang) mit PBS waschen.
- Vorbereitung der Sekundärantikörper durch Verdünnung Ziege anti-Kaninchen-IgG (konjugiert, roten Fluoreszenzfarbstoff) in PBS mit 0,01 % Triton x-100.
- Wenden Sie die verdünnte Sekundärantikörper auf den Abschnitten und Inkubation bei Raumtemperatur (~ 23 ° C) für 60 min.
- In den Abschnitten einmal (5 min) mit der ersten Waschpuffer waschen. In den Abschnitten 3 Mal (5 min pro Waschgang) mit PBS waschen.
- Anwenden DAPI für 3 min. Waschen in den Abschnitten 3 Mal (1 min pro Waschgang) mit PBS. Anwenden ~ 50 µL des Mediums Anti-Fade auf den Abschnitten und Glas Deckglas anwenden. Die Deckglas Schnittflächen mit klaren Nagellack versiegeln.
- Das Licht und fluoreszierende Mikroskop (siehe Tabelle der Materialien), Studium der Schnittserien mit einem 10-fach Ziel und einen entsprechenden Filter zur Visualisierung von roten Fluoreszenzfarbstoff.
- Sammeln die Digitalbilder (~ 15) der überlappenden Visual Felder decken den gesamten Querschnitt des TA-Muskels. Sammeln die Fluoreszenzbilder DAPI Beschriftung für jedes Visual-Felder durch die Umstellung auf die entsprechenden Filtereinstellung.
- Öffnen und analysieren Sie die Bilder mit einer geeigneten Bildbearbeitungssoftware wie 7.2.3 - 7.2.4 beschrieben.
Hinweis: Studieren Bilder zu identifizieren, welche Muskelfasern sind beschädigt (Desmin negativ), welche Muskelfasern haben zentrales Keimbildung (Desmin positiv Fasern, die mit der Bezeichnung von DAPI Kerne intern als peripher gelegen haben), und welche Bereiche des Abschnitts Entzündung und/oder Fibrose (Bereiche, die viele DAPI-Label Kerne zusammen gruppiert, aber frei von Muskelfasern).
- Fix Abschnitte mit 2 % Paraformaldehyd in PBS für 10 min. in den Abschnitten dreimal mit PBS waschen.
Ergebnisse
Bei 3 Tage Post-Pantomime ist der Spender EDL, das durch MIME implantiert wird innerhalb der Host TA Muskel Fach (Abbildung 2A–C) enthalten. Wie erwartet, die Querschnitte des TA Muskels von Spender-Mäusen unter Fluoreszenz-Optik, grün fluoreszieren nicht zeigen, weil sie nicht ausdrücken GFP (Abb. 2D). Im Gegensatz dazu die Querschnitte des TA Muskels von Host-Mäusen, die nicht mit Spendergewebe, implantiert werden zeigen einheitlich grün fluoreszieren in den TA Muskelfasern, wie die Fasern GFP (Abb. 2E) ausdrücken. In den Querschnitten der Muskeln durch MIME mit Spendergewebe Muskel implantiert ist eine Linie der Abgrenzung zwischen dem Host Muskelfasern (GLP +) und Spender Muskelfasern (GFP-). Phase kontrastreiche Bilder gezeigt in Abb. 2D–F Visual-Felder werden in Abbildung 2Epräsentiert "–F' und vermuten, dass es in der Tat Muskelfasern vorhanden in den Regionen wo es keine GFP Signal.
Bei 14 Tagen Post-MIME und BaCl2 Injektion durch das Studium der seriellen Kreuz Abschnitte des TA-Muskels, die Links sind stumme oder sind beschriftet mit Antikörpern gegen Desmin (Abbildung 3), erfahren wir, dass das GFP-Signal durch die Muskelfasern in ausgedrückt ist die unbehandelte Muskel von Host-Mäusen, aber nicht in den MIME-behandelten Muskel (rote Desmin Kennzeichnung erkennt tragfähige Muskelfasern). Im Host TA Muskel mit MIME und BaCl2 Injektion behandelt, Spender Zelle abgeleitet Myogenesis zeigt das Vorhandensein von vielen desmin(+) Muskelfasern, die keine nachweisbaren GFP-Signals zu zeigen (Abbildung 3–D, 3 C " –D'). Chimären Muskelfasern, die sich ergeben aus der wahrscheinlich Fusion von Host und Spender myogen Zellen können durch die geringe auf moderatem Niveau der GFP Fluoreszenz ausgestellt durch diese Fasern erkannt werden. Zahlreiche Chimäre Fasern erscheinen über den gesamten Durchmesser von der TA Muskel darauf hindeutet, dass der Spender SCs mehrere hundert Mikrometer innerhalb der Epimysium des Muskels Host migrieren können. Quantifizierung der GFP + Fasern zeigt Abbildung 3E. Abbildung 4 zeigt die hohe Vergrößerung Bilder serieller Querschnitte eine gesamte MIME + BaCl2 behandelt TA Muskel.
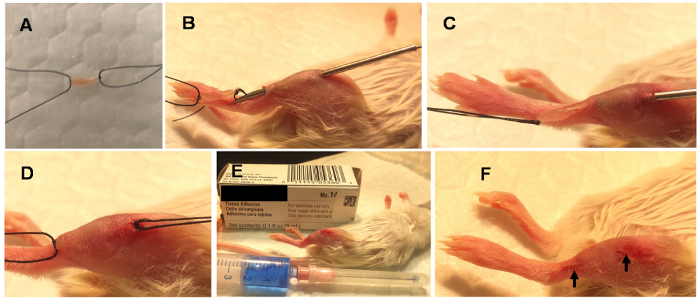
Abbildung 1 . Schritte in Minimal Invasive Muskel einbetten (MIME).
MIME wird unter Vollnarkose durchgeführt. Es geht um ~ 10 mg des Spenders Muskel (Spender Maus EDL) in Ringer-Lösung und die leitenden Fäden an seinen Enden (A)zu binden. Eine 18-Gauge-Nadel wird durch die Längsachse des Host-Muskels (B) bestanden und das Spendergewebe wird durch die Nadel-Strecke (C)gezogen. Das Spendergewebe ist links in der Host-Muskel (D)eingebettet, die leitenden Fäden schneiden und der Nadellöcher sind mit Gewebe-Klebeband versiegelt (E). Die versiegelten Nadel Wunden werden mit Pfeilen (F)angegeben. Bitte klicken Sie hier für eine größere Version dieser Figur.
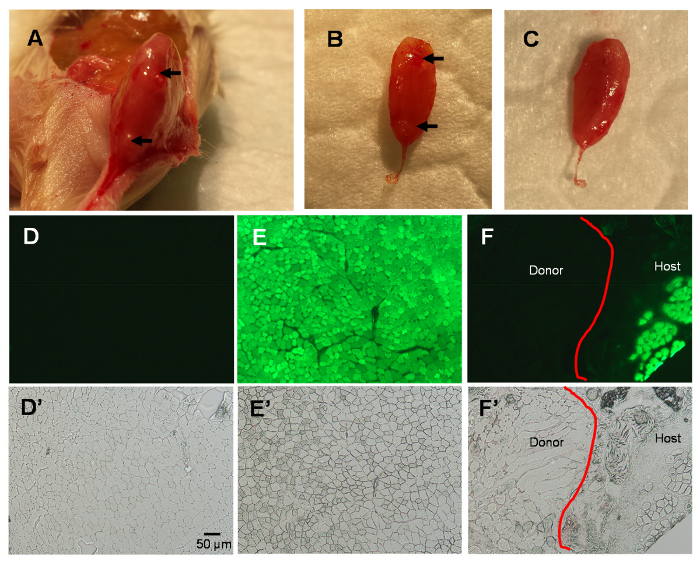
Abbildung 2 . Studien des Muskels TA 3 Tage nach MIME.
Host-Muskel gesammelt 3 Tage nach MIME; Hinweis Nadel markiert auf Host TA (Pfeile; A-B). Weitere Daten bestätigen, dass die eingebettete Spender Maus EDL innerhalb der TA-Muskel-Fach (B-C) eingebettet ist. Fluoreszenzbilder der TA Muskel Querschnitte zeigen keine grünen Fluoreszenz in Wildtyp TA Muskel (D), hell grün fluoreszieren im NSG-GFP TA Muskel (E)und eine Unterscheidung zwischen Host und Spender im NSG-GFP TA Muskel Muskel-3 Tage Post-MIME (F). Gezeigt sind die Phase Kontrast Bilder des Gesichtsfeldes in D-F in D'-F', beziehungsweise. Die rote Linie in Platten F und F' zeigt die Linie der Abgrenzung zwischen dem Host und Spender Gewebe. Maßstabsleiste = 50 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
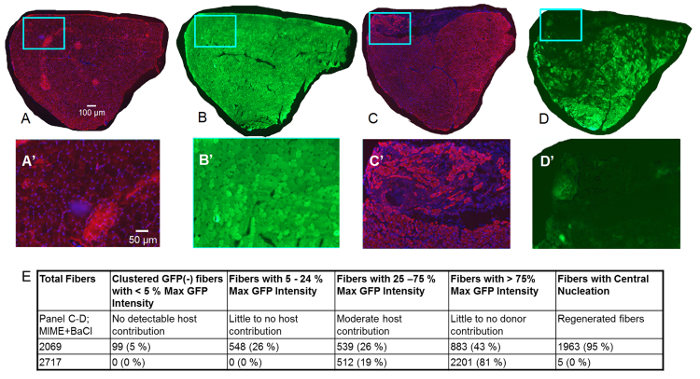
Abbildung 3 . Studien der TA Muskel 14 Tage nach MIME.
Die Datenerhebung 14 Tage Post-MIME werden vorgestellt. Das rote Signal ist von immunofluorescent Kennzeichnung von Desmin (ein positives Signal für Desmin gibt an, dass Myofibers entwicklungsfähig sind), die blaue Signal von DAPI (Flecken Kerne), und das grüne Signal ist von GFP. In Control TA Muskel (richtige Megalosauridae) geerntet von der Gastgeber-Maus, wie erwartet sind fast alle Myofibers positiv für Desmin, was darauf hindeutet, dass diese Myofibers lebensfähig sind (A; rotes Signal). Darüber hinaus basierend auf DAPI-Färbung, es ist offensichtlich, dass Myonuclei von fast allen Myofibers sind peripher gelegen, wie im gesunden Muskel (A; blau Signal) zu erwarten wäre. Serienschnitte von der Steuerung TA Muskel zeigen, dass fast alle Muskelfasern leuchtend grün sind, was bedeutet, dass sie positiv für GFP sind. In MIME + BaCl2 -behandelt TA Muskel (linke Megalosauridae), Spender-Zell-vermittelten Myogenesis ergibt sich aus dem Vorhandensein von vielen desmin(+) Muskelfasern, die keine nachweisbaren GFP Fluoreszenz zeigen (C-D, C'-D'). Desmin(+) Muskelfasern mit niedrigen bis moderaten GFP Fluoreszenz (Chimären Muskelfasern) sind vorhanden, über den Durchmesser des gesamten TA Muskels, was darauf hindeutet, dass MIME Spender SCs bietet, die innerhalb der Epimysium des Muskels TA zu migrieren und zu fördern Spender-abgeleitete Myogenesis. A'-D' sind hohe Vergrößerung Bilder der Regionen in den blauen Feldern in A-D. Quantifizierung von GFP(+) Fasern und zentral kernhaltigen Fasern werden in Eangezeigt. Skalieren von Balken = 100 µm (A-D) und 50 µm (A'-D'). Bitte klicken Sie hier für eine größere Version dieser Figur.
RC="/Files/ftp_upload/55731/55731fig4.jpg" / >
Abbildung 4 . Beweise für Regeneration und erheblichen Sachschaden 14 Tage nach der Injektion von MIME und BaCl2 .
Hohe Vergrößerung werden serielle Querschnitte eine gesamte MIME + BaCl2 behandelt TA Muskel vorgestellt. Die Daten zeigen, dass viele Muskelfasern, die mäßig oder stark GFP + haben zentral Kerne (A-B; rot Signal a ist von Desmin, blaue Signal a ist von DAPI und grünes Signal b ist von GFP). Diese Daten deuten darauf hin, dass Degeneration und Regeneration nach BaCl2 Injektion GFP Ausdruck nicht beeinflusst. In diesem Zusammenhang schlägt das Vorhandensein von zentral kernhaltigen Muskelfasern in MIME + BaCl2 behandelt TA Muskel mit wenig bis kein GLP Ausdruck, dass diese Fasern das wahrscheinliche Ergebnis des Myogenesis (oder Regeneration) mit bedeutenden Beitrag von GFP - myogen Zellen. Diese Beobachtungen können überprüft werden, weiter in starker Vergrößerung Bilder ausgewählter Felder (C-F; C und D, E und F, bzw. überlappen Regionen von serieller Querschnitte; farbliche Kennzeichnung der Bildränder bezeichnen die Lage jener Regionen in A und B). Skalieren von Balken = 100 µm (A-B) und 50 µm (C-F). Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Hier präsentieren wir Ihnen ein detailliertes Protokoll für die neuartige experimentelle Technik bekannt als MIME, in unserem Labor entwickelt, Spender Muskelgewebe in Host Muskelgewebe zu implantieren. Dies ist eine Adaption von einer offenen Muskel Pfropfung Technik, die bereits bewährt hat bei der Förderung von Spender-Zell-vermittelten Myogenesis in einem Host Muskel9,10,17.
Das Ziel von MIME ist nicht Engraftment des Spenders Muskelgewebes selbst in den Host-Muskel aktivieren (wir weiß derzeit nicht, wenn dies der Fall ist), sondern eine Quelle des Spenders SCs bieten, die Myogenesis in der Host-Muskel Bedingungen beitragen können, die stimulieren m Uscle Regeneration. Unsere Hoffnung ist, dass nach MIME wurde optimiert und getestet in Grund- und präklinischen Studien, es könnte liefern wertvolle Erkenntnisse führen Therapien zur Erhöhung der Muskelregeneration in der Skelettmuskulatur, die myogen Muskelabbau unterzogen wurden.
Es gibt zahlreiche Fragen, die noch nicht beantwortet werden, bezüglich wie MIME eine klinische Therapie, zum Beispiel übersetzt werden könnte: wie würden wir kontrollieren die Qualität von Spendergewebe? Wie würden wir Immunabwehr von Spendergewebe und Zellen kontrollieren? Erlischt das Spendergewebe nach Bereitstellung von Zellen für Myogenesis oder hinterlässt es eine fibrotische Narbe? Wirkt der Fasertyp Spender bzw. Gastgeber Muskel der Spender-Zell-vermittelten Myogenesis? Welche Muskeln können praktisch von MIME profitieren? Derzeit erweitern wir unsere Studien zu beurteilen, ob MIME sicher und wirksam ist, identifizieren Zusatztherapie Behandlungen, die können Spender abgeleitet Myogenesis zu erweitern, und viele der oben aufgeführten Fragen zu beantworten.
Nach Abschluss unserer Tests der Maus-Maus allogenen Transplantation mit MIME, ist unser nächster Schritt führen Sie Mensch-Maus-MIME mit cadaveric menschliches Gewebe um das myogen Potenzial von cadaveric Muskelgewebe zu bewerten. Wir gehen davon aus, dass diese Experimente zu einer neuen Linie von Grundlagen- und translationale Forschung führt die Muskelgewebe von Spendern, beinhaltet, die sich in Initiativen wie der Körper Vermächtnis für die Bildung und das Geschenk des Lebens-Programm für Organspende registriert sind .
Die repräsentativen Daten in dieser Handschrift legen nahe, dass 14 Tage nach MIME, gibt es einige brauchbare Myofibers, die entweder keine GFP oder niedrige GFP haben. Unsere Interpretation dieser Daten ist, dass die GFP-Spender Satellitenzellen, die Myogenesis in der Host-Muskel beigetragen. Wir haben dieses Experiment in der Vorbereitung für die Implantation von menschlichem cadaveric Gewebe in einen Host Maus Muskel durchgeführt. Um eindeutig zu demonstrieren, dass die Spenderzellen Satelliten zur Myogenesis in der Host-Muskel nach MIME beitragen, wäre es sinnvoll, Spendergewebe Implantat, das fluoreszierende Reporter, die von GFP (z. B.leicht unterschieden werden können drückt, rot fluoreszierenden Proteins mit dem Ausdruck Spendergewebe in GFP + Host Muskel implantiert).
Diese Technik wird vor allem durch die Art der SCs in das Spendergewebe vorhanden begrenzt. Wenn die SCs in das Spendergewebe lebensfähig, die Technik sind zu Spender-Zell-vermittelten Myogenesis erleichtern dürfte, zwar sind sie nicht lebensfähig, Myogenesis kann nicht auftreten. Jedoch da SCs sehr widerstandsfähig sind und für ca. 2 Wochen Post-Mortem lebensfähig sind, ist es sehr wahrscheinlich, dass das Spendergewebe, das innerhalb weniger Minuten nach der Ernte implantiert wird zu Versuchszwecken, Spender-Zell-vermittelten Myogenesis13 erleichtert . Zusätzlich, wie oben erwähnt, ist es möglich, die seit der ganze Muskelgewebe (das SCs, Reife Muskelfasern sowie Muskel-Resident Fibroblasten enthält) in den Host-Muskel eingebettet ist Fibrose auftreten könnte. Diese Annahme muss jedoch empirisch untersucht werden. Literatur über Muskelschäden, die von schädigenden Kontraktionen, Cryoinjury und experimentelle Myotoxins geht hervor, dass Immunzellen (hauptsächlich Makrophagen) in der Lage, effektiv clearing Zelltrümmer aus beschädigten Fasern und Umgestaltung der extrazelluläre Matrix18. Daher ist es möglich, dass nach MIME und BaCl2 Injektion, solange die Immunzellen Host Zugriff auf degenerierenden Spender Muskelfasern haben sie Trümmer, hinterließ nur der Spender SCs klar könnte. Schließlich ist das Ausmaß der Spender abgeleitet Myogenesis abhängig von der Menge an Spender Muskelgewebe, das in der Host-Muskel eingebettet ist. In Reihenfolge für die Host Muskel Fach vollständig von Spender-Zelle-derived Myofibers aufgefüllt werden müsste eine Methode wie X oder Gamma-Bestrahlung zu Host Muskel SCs abtragen und auch wiederholte MIME-Verfahren erfordern.
Es wurde nachgewiesen, dass chirurgisch Freilegung eines Host-Muskels und Nähen ein Stück Spendergewebe auf der Host-Muskel Spender-Zell-vermittelten Myogenesis9,10,17erleichtern können. Dieser offene chirurgische Ansatz hat in der Vergangenheit, das Fortschreiten der Myogenesis zu verfolgen und Maus-Modellen der menschlichen Muskelkrankheiten zu generieren verwendet worden. Der innovative Aspekt der MIME-Technik ist, dass es minimal invasiv ist und nicht chirurgisch Freilegung des Host-Muskels. Dies reduziert das Risiko der iatrogenen Infektion und dem Grad der Beschwerden in das Wirtstier, daher macht es mehr möglich, MIME wiederholt auf den gleichen Host Muskel durchgeführt, bei Bedarf.
Wir gehen davon aus, dass die MIME-Technik eine geeignete Verfeinerung auf dem offenen chirurgischen Ansatz sein könnte, das derzeit gefolgt wird, um das Implantat-Spender Muskelgewebe in eine Host-Maus. Dies könnte die Generation der humanisierte Mausmodelle, beschleunigen, indem Sie einbetten biopsierten menschlichen Muskel im Host Maus Muskel. Darüber hinaus erwarten basiert auf unseren vorläufigen Daten von Maus-Maus Pfropfen, wir, dass MIME wirksam bei der Erreichung von Spender-Zell-vermittelten Myogenesis von menschlichen cadaveric Spendergewebe solange Spender SCs sind lebensfähig sein wird. Zu guter Letzt mit zusätzlichen Tests und Validierung hoffen wir, dass die MIME-Technik hilft, Entwicklung neuer Therapien um Spender-Zell-vermittelten Myogenesis bei Menschen mit Muskelerkrankungen zu erleichtern.
Der Erfolg der MIME-Technik ist kritisch abhängig genau das Spendergewebe innerhalb der Faszien Fach (Epimysium) des Muskels Host einbetten. Nur wenn das Spendergewebe innerhalb der Host-Muskel-Fach befindet, werden SCs Gastgeber Muskel präzise anbieten. Wenn das Spendergewebe außerhalb der Host Muskel platziert wird, ist es unklar, was sein Schicksal sein würde. In unserem experimentellen Modell für MIME verwenden wir den TA-Muskel als Host Muskel, da es prominente und oberflächlich in den anterolateralen Aspekt des Beines ist. Größe, Ausrichtung und anatomische Position des TA-Muskels macht es einfach zu bestätigen, dass das Spendergewebe korrekt innerhalb der Host TA Muskel nach MIME sitzt. In diesem Papier haben wir experimentelle Beweise zur Verfügung gestellt, die das Spendergewebe reMains Host TA Muskel auf 3 Tage Post-MIME, und dass es eingebettet ist Spender-Zell-vermittelten Myogenesis im Muskel auf 14 Tage nach dem MIME-Host.
Offenlegungen
Die Autoren haben keinen finanziellen Interessenkonflikt.
Danksagungen
Diese Arbeit wurde durch einen Pilot-Zuschuss von der Allianz für Regenerative Rehabilitation Research (AR3T) und eine Fakultät für Startup-Paket von der Wayne State University zu JAR ermöglicht. AR3T wird von Eunice Kennedy Shriver National Institute of Child Health und menschlichen Entwicklung (NICHD), National Institute of Neurological Disorders und Schlaganfall (NINDS) und National Institute of Biomedical Imaging und Bioengineering (NIBIB unterstützt. ) von den National Institutes of Health unter Nummer P2CHD086843 Award. Der Inhalt ist ausschließlich in der Verantwortung der Autoren und nicht unbedingt die offizielle Meinung der National Institutes of Health.
Materialien
| Name | Company | Catalog Number | Comments |
| NSG-GFP mice | The Jackson Laboratory (Bar Harbor, ME) | Stock #021937 | Immunodeficient host mice that ubiquitously express green fluorescent protein |
| C57BL/6J mice | The Jackson Laboratory (Bar Harbor, ME) | Stock #000664 | Control donor mice |
| Tabletop isoflurane vaporizer | VetEquip (Livermore, CA) | Item #901801 | Inhaled anesthesia system |
| Magic depilatory crea | Softsheen Carson (New York, NY) | N/A | Razorless hair removal cream |
| 4-0 Silk, black, braided, non-absorbable sutures | Roboz Surgical Instrument Co, Inc. (Gaithersburg, MD) | SUT106631 | Guiding sutures for donor tissue |
| VetBond veterinary tissue adhesive | 3M (Maplewood, MN) | Catalog #1469Sb | Veterinary tissue adhesive for sutureless skin closure |
| Barium chloride | Ricca Chemical Company (Arlington, TX) | Product #R0854000-500A 854-16 | Myotoxin to induce muscle damage and stimulate regeneration |
| Deltaphase isothermal gel heating pad | Braintree Scientific (Braintree, MA) | Item #39DP | Heating pad to provide thermal support to animals while under anesthesia |
| HM525NX cryostat | ThermoFisher (Waltham, MA) | Catalog #HM525NX | Cryostat to make frozen sections of muscle |
| Vectashield Antifade Medium | Vector Laboratories, Inc. (Burlingame, CA) | Catalog Number: H-1000 | Antifade medium to preserve fluorescence in immunofluorescently labeled samples |
| Rabbit anti Desmin Antibody | Labvision Thermo Scientific (Fremont, CA) | RB9014P | Rabbit anti desmin antibody for desmin immunofluorescent labeling |
| Goat anti Rabbit Alexa 568 Antibody | ThermoFisher (Waltham, MA) | Catalog#: A-21069 | Goat anti rabbit secondary antibody for desmin immunofluorescent labeling |
| 4',6-diamidino-2-phenylindole (DAPI) | Seracare (Milford, MA) | Catalog #5930-0006 or 71-03-01 | Reagent for fluorescent labeling of nuclei |
| Axio Scope.A1 microscope | Carl Zeiss (Peabody, MA) | Product #Axio Scope.A1 | Light and fluorescence microscope |
| Photoshop CS4 | Adobe Systems (San Jose, CA) | Photoshop CS4 | Imaging Software for perform image tiling |
| Image J | National Institutes of Health (Bethesda, MD) | Image J for Windows 64-bit Operating System | Imaging Software for quantitative fluorescence analysis |
Referenzen
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Robertson, T. A., Grounds, M. D., Papadimitriou, J. M. Elucidation of aspects of murine skeletal muscle regeneration using local and whole body irradiation. J Anat. 181 (Pt 2), 265-276 (1992).
- Charge, S. B., Rudnicki, M. A. Cellular and molecular regulation of muscle regeneration. Physiol Rev. 84 (1), 209-238 (2004).
- Brack, A. S., Rando, T. A. Tissue-specific stem cells: lessons from the skeletal muscle satellite cell. Cell Stem Cell. 10 (5), 504-514 (2012).
- Krag, T. O., Hauerslev, S., Sveen, M. L., Schwartz, M., Vissing, J. Level of muscle regeneration in limb-girdle muscular dystrophy type 2I relates to genotype and clinical severity. Skelet Muscle. 1 (1), 31(2011).
- Skuk, D., et al. Dystrophin expression in myofibers of Duchenne muscular dystrophy patients following intramuscular injections of normal myogenic cells. Mol Ther. 9 (3), 475-482 (2004).
- Beauchamp, J. R., Morgan, J. E., Pagel, C. N., Partridge, T. A. Dynamics of myoblast transplantation reveal a discrete minority of precursors with stem cell-like properties as the myogenic source. J Cell Biol. 144 (6), 1113-1122 (1999).
- Sakellariou, P., et al. Neuromuscular electrical stimulation promotes development in mice of mature human muscle from immortalized human myoblasts. Skelet Muscle. 6 (1), 4(2015).
- Collins, C. A., et al. Stem cell function, self-renewal, and behavioral heterogeneity of cells from the adult muscle satellite cell niche. Cell. 122 (2), 289-301 (2005).
- Zhang, Y., et al. Human skeletal muscle xenograft as a new preclinical model for muscle disorders. Hum Mol Genet. 23 (12), 3180-3188 (2014).
- Juhas, M., Engelmayr, G. C. Jr, Fontanella, A. N., Palmer, G. M., Bursac, N. Biomimetic engineered muscle with capacity for vascular integration and functional maturation in vivo. Proc Natl Acad Sci U S A. 111 (15), 5508-5513 (2014).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Eng Part A. 20 (17-18), 2402-2411 (2014).
- Latil, M., et al. Skeletal muscle stem cells adopt a dormant cell state post mortem and retain regenerative capacity. Nat Commun. 3, 903(2012).
- Maykel, J., et al. NOD-scidIl2rg (tm1Wjl) and NOD-Rag1 (null) Il2rg (tm1Wjl) : a model for stromal cell-tumor cell interaction for human colon cancer. Dig Dis Sci. 59 (6), 1169-1179 (2014).
- Casar, J. C., et al. Heparan sulfate proteoglycans are increased during skeletal muscle regeneration: requirement of syndecan-3 for successful fiber formation. J Cell Sci. 117 (Pt 1), 73-84 (2004).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PLoS One. 11 (1), e0147198(2016).
- Roberts, P., McGeachie, J. K., Grounds, M. D., Smith, E. R. Initiation and duration of myogenic precursor cell replication in transplants of intact skeletal muscles: an autoradiographic study in mice. Anat Rec. 224 (1), 1-6 (1989).
- Tidball, J. G. Mechanisms of muscle injury, repair, and regeneration. Compr Physiol. 1 (4), 2029-2062 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten