Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un método de análisis celular para el cóndilo Mandibular murino y morfométricos
En este artículo
Resumen
Este manuscrito presenta métodos para el análisis morfométrico y cambios celulares en el cóndilo mandibular de roedores.
Resumen
La articulación temporomandibular (ATM) tiene la capacidad de adaptarse a estímulos externos, y cambios de carga puede afectar la posición de los cóndilos, así como los componentes celulares y estructurales del cartílago condilar mandibular (MCC). Este manuscrito describe métodos para el análisis de estos cambios y un método para alterar la carga de la ATM en ratones (es decir, a la compresión estática ATM carga). La evaluación estructural ilustrada aquí es un enfoque morfométrico simple que utiliza el software Digimizer y se realiza en las radiografías de huesos pequeños. Además, el análisis de celulares cambia principales alteraciones en la expresión de colágeno, el remodelado óseo, la división celular y se describe la distribución de proteoglicanos en el MCC. La cuantificación de estos cambios en las secciones histológicas - contando los pixeles fluorescentes positivos utilizando software y la cartografía de la distancia de medición de la imagen y manchado la zona con Digimizer - también se demuestra. Los métodos que se muestran aquí no están limitados a la ATM murina, pero podrían ser utilizados en los huesos más pequeños de animales de experimentación y en otras regiones de la osificación endocondral.
Introducción
La ATM es una articulación de carga única situada en la región craneofacial y está formada por fibrocartílago. El MCC de la ATM es esencial para la función de las articulaciones, incluyendo movimiento de mandíbula sin trabas al hablar y masticar, pero comúnmente es afectado por enfermedades degenerativas, incluyendo artrosis1. La ATM tiene la capacidad de adaptarse a estímulos externos y alteraciones de la carga, conduce a cambios estructurales y celulares para los componentes del MCC2,3,4,5. Las propiedades de carga de la MCC se pueden explicar por las interacciones entre sus componentes, incluyendo el agua, la red de colágeno y densamente poblado de proteoglicanos. El MCC tiene cuatro zonas de celulares distintas que expresan diferentes tipos de proteínas no colágeno y colágeno: 1) la zona superficial o articular; 2) la zona proliferativa, compuesto por células mesenquimales indiferenciadas y responde a la carga de demandas; 3) la zona de prehypertrophic, compuesto por condrocitos maduros expresan colágeno de tipo 2; y 4) la hipertrófica de la zona, la región donde los condrocitos hipertróficos expresan colágeno tipo mueren 10 y someterse a la calcificación. La región no mineralizado es rica en proteoglicanos que ofrecen resistencia a fuerzas de compresión6.
Existe mineralización continua en la zona hipertrófica de la MCC, donde se produce la transición de condrogénesis osteogénesis, garantizando la robusta estructura mineral del hueso subcondral del cóndilo mandibular7. Cambios celulares en las regiones mineralizadas y no mineralizadas en última instancia conducen a cambios morfológicos y estructurales en el cóndilo mandibular y la mandíbula. Mantenimiento de la homeostasis de todas las regiones celulares del MCC y la mineralización de la porción subcondral son esenciales para la salud, capacidad de carga e integridad de la ATM.
El modelo de ratón transgénico de colágeno múltiple (según lo descrito por Utreja et al.) 8 es una gran herramienta para entender los cambios en la expresión de colágeno porque todos los transgenes se expresan en el MCC. Para una evaluación histológica a fondo, manchas histológicas se utilizan para estudiar la deposición de matriz, mineralización, proliferación celular y apoptosis, así como expresión de la proteína en las diferentes capas del MCC.
En este manuscrito, histológico y análisis morfométrico se utilizan para evaluar los cambios celulares y estructurales en el MCC y subcondral del hueso del cóndilo mandibular de los ratones. Además, se describe un método de cuantificación de células, para el análisis de imágenes histológicas fluorescentes y para el mapeo de portaobjetos de microscopio de luz. La resistencia a la compresión ATM estática carga del método, que causa cambios celulares y morfológicos en el MCC y subcondral hueso9, se ilustra también para validar nuestros métodos.
Los métodos descritos aquí pueden utilizarse para determinar la morfometría y cambios histológicos en el cóndilo mandibular y la mandíbula de roedores o analizar otras regiones de la osificación endocondral y la morfología de los tejidos mineralizados adicionales.
Access restricted. Please log in or start a trial to view this content.
Protocolo
El Comité institucional de cuidado animal del Universidad de Connecticut Health Center aprobó todos los procedimientos animales.
1. resistencia a la compresión estática ATM carga: Boca forzada abierta
Nota: Se utilizaron ratones transgénicos de cuatro semanas de edad que reporteros fluorescentes de colágeno (Col2a1XCol10a1), amablemente cedidas por el Dr. David Rowe (Universidad de Connecticut), para los experimentos descritos en este manuscrito (n = 8; 4 machos y 4 hembras). Transgén Col2a1 cian (azul) se expresa en las células de la zona prehypertrophic de la CCM, mientras que el Col10a1 cereza células (rojo) están presentes en la región hipertrófica8 (figura 1). Ratones fueron divididos igualmente en dos grupos: 1) el grupo cargado, donde ratones fueron sometidos a compresión estática TMJ cargando (se describe en el paso 2) y 2) el grupo de control, donde los ratones no recibieron ninguna intervención.
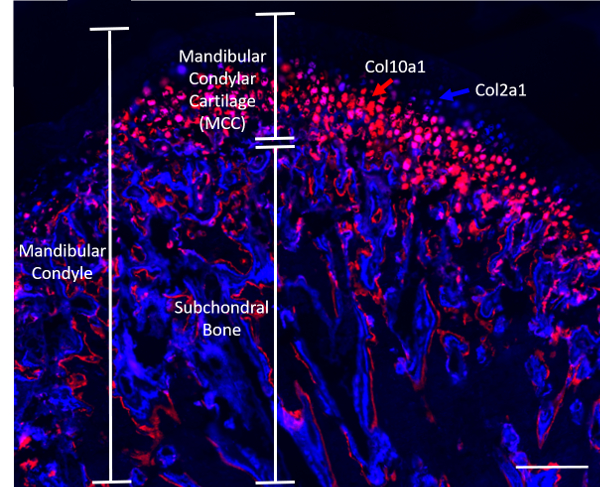
Figura 1. Representante sagital del cóndilo de un ratón reportero fluorescente doble de colágeno (Col2a1XCol10a1). Barra de escala = 200 μm. haga clic aquí para ver una versión más grande de esta figura.
- Fabricar arcos de aleación de titanio resortes usingbeta (0.017 x 0.025 pulgadas) (figura 2A).
- Anestesiar los animales experimentales por una inyección intraperitoneal de una mezcla de ketamina (90 mg/kg peso corporal) y xilacina (13 mg/kg peso corporal).
- Suavemente la boca de los ratones e inserte los resortes, a los lazos en los incisivos maxilares y mandibulares (figura 2B y C).
- Inducir resistencia a la compresión estática carga de TMJ manteniendo los resortes en los incisivos de los ratones anestesiados por 1 h. Repita este procedimiento durante 5 días.
- Inyectar los ratones con 5-ethnyl-2'-desoxiuridina (EdU; 30 mg/kg p.v.) por vía intraperitoneal para el análisis de la proliferación celular 2 días y 1 día antes de la eutanasia.
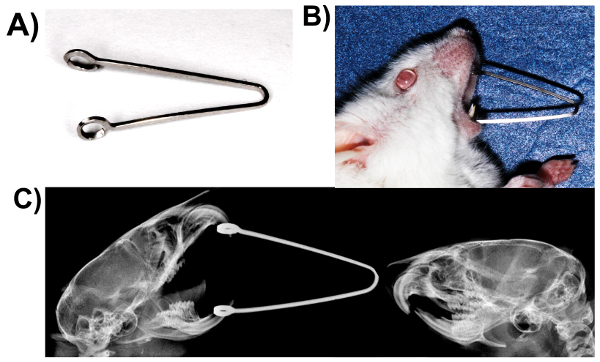
Figura 2. Resistencia a la compresión estática carga de TMJ: boca forzada abierta modelo. (A) muelle fabricado de 0.017 x 0.025 alambre de aleación de titanio beta. (B) ratón cargado con resorte. (C) radiografía de cargado y los ratones de control mostrando diferencias en el posicionamiento de la mandíbula. Haga clic aquí para ver una versión más grande de esta figura.
2. mandíbula disección y fijación
- Al final de los procedimientos de forzada boca, eutanasia a los animales experimentales por un método aprobado.
- Diseccionar las mandíbulas cortando el accesorio muscular sin raspar el cartílago del cóndilo.
- Colocar las mandíbulas limpias en formalina al 10% durante 24 h para la fijación.
PRECAUCIÓN: La formalina es un irritante; Use equipo de protección personal.
3. radiografía proyección de imagen y las mediciones morfométricas
- Colocar las mandíbulas en un recipiente plano (por ejemplo, un plato de Petri 55 mm x 16 mm) y tomar radiografías de las muestras mediante un sistema de gabinete de rayos x en una 26 kV 5 s.
Nota: Coloque una barra de escala antes de guardar las imágenes. - Realizar las mediciones morfométricas de las mandíbulas con un software de análisis de imagen (véase la Tabla de materiales).
Nota: Antes de realizar cualquier medición, utilice la barra de escala en la radiografía para determinar la unidad. Este paso es importante para medir correctamente las estructuras anatómicas. Haga clic en el botón "Unit" (figura 3A). - Seleccione los puntos anatómicos utilizando el marcador estilo"2" en el software de proyección de imagen (figura 3B). Para seguir el método descrito en este documento, seleccione los siguientes puntos (figura 3B):
- Seleccione el Condilion (punto 1), el punto más posterior del cóndilo mandibular;
- Seleccione el proceso incisivo (punto 2);
- Seleccione el punto más profundo en la muesca sigmoidea (punto 3);
- Seleccione el punto más profundo en la concavidad de la rama mandibular (punto 4);
- Seleccione el punto más anterior de la superficie articular condilar (punto 5); y
- Seleccione el punto más posterior de la superficie articular condilar (punto 6).
- Después de seleccionar los puntos anatómicos, realizar las mediciones morfométricas utilizando la herramienta de «longitud», pero para la longitud de la cabeza condilar, utilice la herramienta "línea perpendicular" de puntos (3) y (4) (figura 3C).
- Mida la longitud mandibular, desde el Condilion (1) para el proceso de la incisivo (2).
- Medir la longitud de la cabeza del cóndilo - la distancia perpendicular desde el Condilion (1) hasta una línea trazada desde el punto más profundo en la muesca sigmoidea (3) al punto más profundo en la concavidad de la rama mandibular (4).
- Medir el ancho de cabeza de cóndilo - la distancia desde el máximo anterior el punto más posterior de la superficie articular condilar (5-6).
- Copiar las medidas de la "lista de la medida" a la derecha de la pantalla (figura 3C).
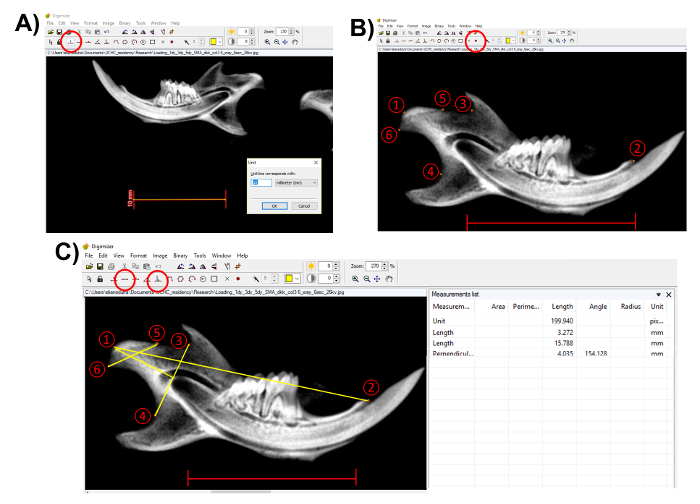
Figura 3 . Representación de las mediciones morfométricas de la mandíbula. (A) utilice la barra de escala de la radiografía para determinar la unidad (un círculo rojo, barra de escala: 10 mm). (B) Seleccione los puntos anatómicos utilizando el marcador estilo"2" (un círculo rojo). 1) Condilion; 2) proceso incisivo; 3) punto más profundo en la muesca sigmoidea; 4) punto más profundo en la concavidad de la rama mandibular; 5) punto anterior más de la superficie articular condilar; 6) punto posterior la mayoría de la superficie articular condilar. Barra de escala: 10 mm.(C) realizar las mediciones con la "longitud" y "perpendiculares" herramientas (un círculo rojo). Medidas desde el punto 1 al 2: longitud de la mandíbula; del punto 5 al 6: anchura condilar; perpendicular del punto 1 al 4 - 3: longitud de la cabeza condilar. Guarda las mediciones de la "lista de medida". Barra de escala = 10 mm. haga clic aquí para ver una versión más grande de esta figura.
4. cóndilo incrustar
Nota: Después de tomar las imágenes radiográficas, las mandíbulas pueden ser integradas y seccionadas para análisis histológico.
- Colocar mandíbulas undecalcified (que se ha fijado en el paso 2.3) en sacarosa al 30% en PBS durante la noche antes de la inclusión.
- Diseccionar cualquier exceso de tejido suave y cuidadosamente corte el cóndilo mandibular.
- Verter algunos resina de empotrar (suficiente para cubrir la muestra) en moldes de plástico desechables y colocar la superficie medial del cóndilo contra la base del molde, colocación de la muestra paralela a la parte inferior del molde.
- Fijar a la muestra en el lugar correcto con un pedazo de hielo seco.
- Llenar el molde con incrustación de resina y colocar el molde con la muestra fija en frío 2-metil-butano, que pueden ser previamente enfriada en un congelador de-20 ° C o -80 ° C o en hielo seco.
- Almacenar a las muestras a-20 ° C o a-80 ° C hasta el seccionamiento.
5. cóndilo sagital corte y preparación de los portaobjetos
- Crear secciones congeladas sagitales de los cóndilos (5-7 μm) y transferir las muestras a la diapositiva utilizando la cinta transferencia método10,11.
- Adherir los cortes histológicos a la cinta utilizando el método UV-curable10.
6. histológico de tinción y la proyección de imagen microscópica
Nota: La mayoría de la tinción histológica se realiza como se describe en la sección histológica del papel por Dyment et al10.
- Para el escaneo de la línea de base, el primer paso es a la imagen para el Col2a1 y Col10a1 transgenes, descrito por Dyment et al10 .
- Coloque el cubreobjetos sobre el portaobjetos en 30% de glicerol y PBS. Realizar el microscopio de fluorescencia ofthesectionswitha proyección de imagen base y filtros adecuados.
- Realizar tinción fluorescente fosfatasa ácida tartrato resistente (TRAP).
Nota: La trampa es expresada por células hematopoyéticas, incluyendo el hueso resorbing células, los osteoclastos12. El propósito de esta mancha es analizar MCC y remodelación de hueso subcondral.- Quite el cubreobjetos de las diapositivas por remojo en PBS. Lave los portaobjetos en PBS tres veces por 5 minutos cada uno.
- Disolución de acetato de sodio anhidro (9,2 g) y sodio L-tartrato Dibasico dihidrato (11,4 g) en 1 L de agua destilada para preparar buffer de trampa 1. Ajustar el pH a 4.2 con ácido acético y almacenar el buffer de trampa 1 a 4 ° C.
- Preparar el tampón de trampa 2 recién disolución de nitrito de sodio (40 mg) en 1 mL de agua destilada.
- Preparar buffer de sustrato trampa (justo antes de la tinción) mezclando 7,5 mL de buffer 1 y 150 μL de tampón 2. Aplique esta solución (200 μL) a cada diapositiva 10 min a temperatura ambiente.
- Preparar el tampón de reacción trampa mezclando 1,840 mL de buffer de sustrato y 23 μl de sustrato fluorescente (consulte la Tabla de materiales).
Nota: La substrategeneratesayellowfluorescentsignal fluorescente para la actividad de la trampa. - Elimine el exceso trampa sustrato tampón transfiriendo suavemente la solución.
- Incube los portaobjetos con 200 μL de tampón de reacción de trampa durante 5 minutos bajo luz negra UV fuente bulbo.
- Lave los portaobjetos en PBS tres veces por 5 minutos cada uno.
- Colocar cubreobjetos sobre el portaobjetos en glicerol al 30% en PBS y realizar proyección de imagen microscópica10.
- Realizar tinción de proliferación celular.
Nota: En este ensayo, la timidina modificado análogo 5-ethynyl-2'-desoxiuridina (EdU) se incorpora en el ADN recién sintetizado: células divisorias están marcadas con un colorante fluorescente.- Después de la proyección de imagen de trampa, quitar el cubreobjetos y lave el portaobjetos en PBS tres veces por 5 minutos cada uno. Siga los pasos del kit de proliferación de la célula 5-ethynyl-2'-desoxiuridina para teñir los cortes histológicos.
- Preparar una reacción coctel añadiendo 430 μl de 1 X de tampón de reacción, 20 μl de CuSO4, 1,2 μl de colorante fluorescente y 50 μl de 1 X buffer añadido (un volumen total de 500 μl es suficiente para que una diapositiva).
Nota: El fabricante recomienda añadir los ingredientes en el orden aquí descrito. - Incube los portaobjetos con los cócteles preparados por 30 min a temperatura ambiente, protegido de la luz.
- Lave los portaobjetos en PBS tres veces por 5 minutos cada uno.
- Coloque el cubreobjetos sobre el portaobjetos en glicerol al 30% en PBS con 1:1,000 DAPI.
Nota: DAPI (4', 6-diamidino-2-phenylindole) es un colorante nuclear fluorescente azul que se une a regiones ricas en AT de ADN.
- Realizar tinción de azul de toluidina (TB).
Nota: TB tinción revela la distribución de proteoglicanos en el MCC.- Enjuagar el portaobjetos indistilledwater para quitar el cubreobjetos.
- Después de quitar el cubreobjetos, lave los portaobjetos en agua destilada tres veces durante 5 minutos cada uno para eliminar completamente las sales del PBS.
- Preparación de buffer de trabajo TB haciendo un (28,4 g de fosfato de sodio dibásico en 1 L de agua destilada se disuelven), solución y solución B (27,6 g de fosfato de sodio monobásico en 1 L de agua destilada se disuelven). Mezcla 94.7 mL de solución A con 5,3 mL de solución B. diluir esta solución 1:1 en agua destilada para hacer 200 mL de 0.1 M tampón de trabajo. Corregir el pH a 8.0 mediante la adición de hidróxido de sodio hasta que el pH se fija.
- Preparar 1% stock TB: mezclar 1 g de TB en 100 mL de agua destilada.
- Preparar solución de trabajo de TB mediante la mezcla de 40 mL de tampón de trabajo de 0.1 M en 3 mL de 1% stock TB.
- Incubar los portaobjetos en la solución de trabajo de TB s 14-17.
Nota: Esta mancha es tiempo muy sensible; el tiempo de incubación puede necesitar ser ajustado para evitar overstaining. - Lave los portaobjetos en agua destilada tres veces durante 5 minutos cada uno.
- Colocar el cubreobjetos sobre el portaobjetos en glicerol al 30% en agua destilada. Realizar10la proyección de imagen de microscopio de luz.
Nota: No no cubreobjetos las diapositivas manchadas para TB en glicerol + PBS. PBS elimina este tipo de mancha.
7. fluorescente cuantificación histológica
- Realizar cuantificación histológica de imágenes fluorescentes mediante un software de análisis de imagen (véase la Tabla de materiales).
Nota: El principio básico de cuantificación histológica en este método es dividir el número de píxeles fluorescentes de interés por el número total de píxeles de la zona de interés y multiplica al número obtenido por 100, lo que resulta en un porcentaje de los píxeles positivos dentro de esa región. - Realizar la cuantificación de la expresión Col10a1 en el MCC de secciones sagitales de los cóndilos.
- Cuando la cuantificación de todos los tipos de células y las manchas usando este método, seleccione el área a ser cuantificada. Abra las imágenes histológicas en un software de análisis de imagen y seleccione el área usando el "Lasso herramienta (L)" (figura 4A). Para los análisis descritos aquí, seleccione la región MCC después de seleccionar la zona, se mostrará el número total de píxeles en el cuadro de "Histograma" en la pantalla del software (figura 4A). Guardar el número de píxeles en el área de interés.
- Seleccione los píxeles Col10a1 rojo mediante la herramienta de muestreo. Haga clic en "Select" en el panel superior y luego "Gama de colores." Haga clic en la "herramienta Cuentagotas", seleccione la muestra de color para el píxel de interés en la imagen y haga clic en "Aceptar". Todas las áreas positivas para el color de píxeles elegido será seleccionan (figura 4B). Copie el número de píxeles fluorescentes (se muestra en el cuadro de "Histograma" de la pantalla) y pegarlos en una hoja de cálculo o software estadístico para el análisis.
- Dividir el número de píxeles fluorescentes sobre el número de píxeles de la zona de interés y multiplique este número por 100: fluorescentes píxeles / píxeles en el área de interés * 100.
Nota: Otro tipo de células, tales como azul Col2a1, puede cuantificarse con este mismo método, pero los píxeles azul deben ser seleccionados en lugar de los píxeles Col10a1 rojo.
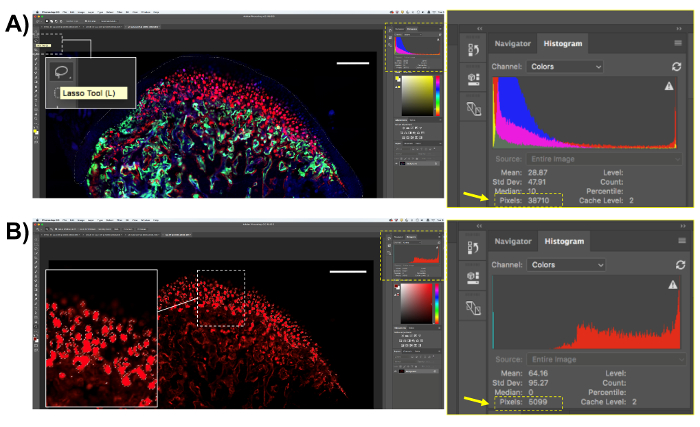
Figura 4 . Representación del transgén Col10a1 cuantificación. (A) Seleccione el área de interés con la "herramienta lazo" (L). Para las células Col10a1 positivos, seleccionar el cartílago conjunto mandibular. Guardar el número de píxeles en el cuadro de "histograma". (B) Seleccione el píxel de interés, en este caso, los píxeles de Col10a1 fluorescentes rojo. Tenga en cuenta que se seleccionará sólo los píxeles rojos dentro del área de interés. Guardar el número de píxeles en rojo desde la caja de "histograma". Barra de escala = 200 μm. haga clic aquí para ver una versión más grande de esta figura.
- Realizar la cuantificación de la actividad de la trampa en el MCC y subcondral del hueso.
- Siga el procedimiento descrito en el paso 8.2, pero en lugar de seleccionar sólo el área MCC, seleccione las regiones de hueso de cartílago y subcondral (figura 5A).
- Para el análisis de la actividad de trampa, seleccione los píxeles amarillos generados por el substrato ELF97, como se describe en el paso 8.2.2 (figura 5B); copia el número de píxeles positivos; y pegarlos en una hoja de cálculo o software estadístico para el análisis.
- Obtener el porcentaje de píxeles de la trampa-positivo dividiendo el número de píxeles amarillos por el número total de píxeles en la región del hueso subcondral y multiplicando por 100.
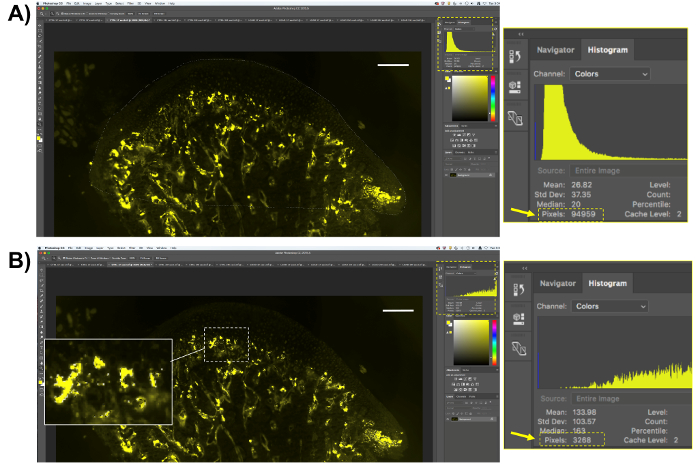
Figura 5 . Representación de cuantificación fluorescente de trampa. (A) Seleccione el área de interés (hueso mandibular del cartílago y subcondral) y guardar el número de píxeles de la región. (B) Seleccione los píxeles fluorescentes amarillo, que representa la actividad de la trampa. Tenga en cuenta que sólo los píxeles positivos trampa será seleccionarlos. Guardar el número de píxeles seleccionados. Barra de escala = 200 μm. haga clic aquí para ver una versión más grande de esta figura.
- Realizar la cuantificación de células positivas de EdU.
- Diapositivas manchadas EdU son contratinción con DAPI, así que en lugar de contar el número total de píxeles en la región de interés, seleccione los píxeles positivos DAPI para calcular el porcentaje de píxeles de la EdU-positivo. Seleccione el área de interés, como se describe en el paso 8.2, pero no guarde el número total de píxeles. Seleccionar el pixel DAPI azul como el color muestreado, como se describe en el paso 8.2.2; copiar el número de píxeles de DAPI-positivo (figura 6A); y pegarlos en una hoja de cálculo o software estadístico para el análisis.
- A continuación, seleccione los píxeles de la EdU-positivo (amarillo fluorescentes píxeles) y guardar el número de píxeles en el cuadro de "histograma" (figura 6B).
- Calcular el porcentaje de píxeles de EdU dividiendo el número de píxeles de la EdU-positivos por el número de píxeles de DAPI-positivo y multiplicar al número obtenido por 100.
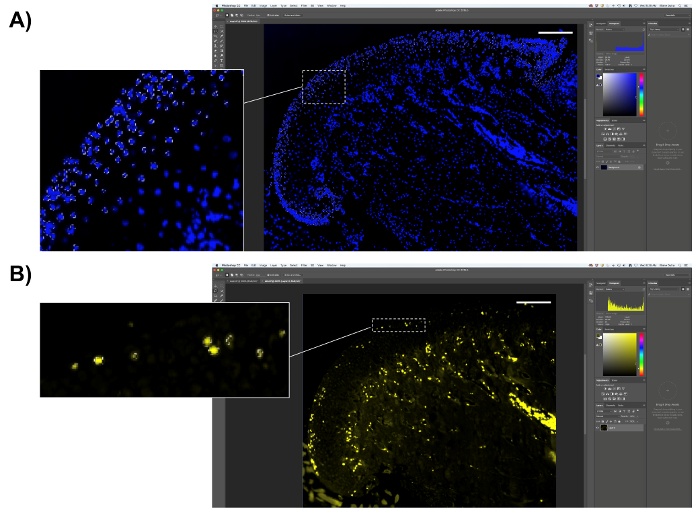
Figura 6 . Representación de cuantificación de EdU. (A) seleccione la región proliferativa del MCC (la capa externa de cartílago). Seleccionar píxeles positivas DAPI y guardar el número de píxeles. (B) seleccionar píxeles de EdU-positivo (amarillo fluorescente) y guardar el número de píxeles. Barra de escala = 200 μm. haga clic aquí para ver una versión más grande de esta figura.
8. cuantificación de cartílago grueso y de distribución de proteoglicanos
- Analizar el grosor del cartílago (asignación de distancia) y el área de teñido de azul de toluidina utilizando el software de imagen Digimizer.
Nota: Utilice la barra de escala en la imagen histológica para determinar la unidad (figura 7A). - Realizar una medición de distancia asignación.
Nota: La medida de asignación la distancia proporcionará el grosor del cartílago en el cóndilo mandibular. En el método descrito aquí, se seleccionan cinco regiones de la MCC, dando un promedio del espesor total del MCC. El investigador puede medir tres diferentes regiones, o incluso una sola región en el centro del MCC.- Con la herramienta de "longitud", mida la longitud del cartílago de la superficie exterior hasta el final de la toluidina teñido de azul (figura 7B) en cinco regiones, o en tantos lugares como se prefiera.
- Copiar las mediciones de la longitud de la "lista de medida".
Nota: El software también proporciona un promedio de las mediciones (figura 7B).
- Medir el área de teñido de azul de toluidina.
Nota: En la medición del área de teñido de azul de toluidina, se obtendrá el área de proteoglicanos en el MCC.- Seleccione la herramienta "área" y el área de teñido de azul de toluidina (figura 7C) del contorno.
- Copiar las mediciones de área de la "lista de medida".
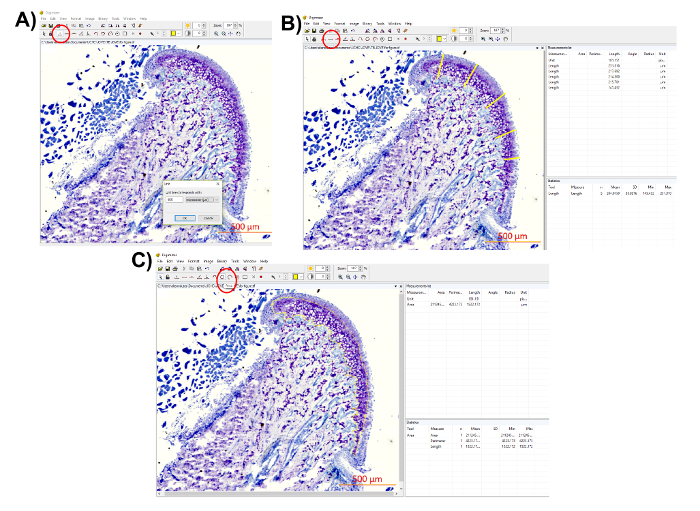
Figura 7 : Representación de cuantificación distribución de proteoglicanos. (A) utilice la barra de escala de la imagen histológica para determinar la unidad haciendo clic en el botón "unit" (un círculo rojo, unidad seleccionada: 500 μm). (B) medir el grosor del cartílago en diferentes lugares mediante la herramienta de "longitud" (un círculo rojo). Guardar las medidas de la lista de"medición" en el panel derecho superior. El software también proporciona "estadísticas" en la parte inferior derecha, por lo que la media y las mediciones pueden obtenerse directamente. (C) medir el área de teñido de azul de toluidina utilizando la herramienta "área" (un círculo rojo). Círculo el área de interés y ahorrar la medición de la "lista de medida". Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Se realizaron estadísticas descriptivas para examinar la distribución de las mediciones morfométricas (longitud mandibular, cóndilo longitud, anchura condilar) y análisis histológicos. Se compararon los resultados entre el grupo cargado (es decir, ratones sometidos a una carga compresiva con el resorte de titanio beta) y el grupo de control (es decir, que los ratones control que no recibió ningún procedimiento). Diferencias estadísticamente significativas entre ...
Access restricted. Please log in or start a trial to view this content.
Discusión
Este manuscrito describe métodos para la medición morfométrica y análisis celular de cóndilos mandibulares murinos y mandíbulas. Las mediciones radiográficas morfométricas también pueden utilizarse para analizar otros huesos de animales pequeños. Además, el análisis celular (celular cuantificación y mapeo de distancia cartílago) no se limitan a cóndilo mandibular roedor, pero puede utilizarse para cuantificar las secciones histológicas de numerosos tejidos.
Modelos de ratón tr...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores tienen intereses financieros que compiten.
Agradecimientos
Los autores desean agradecer a Dr. David Rowe por amablemente que los ratones transgénicos y Li Chen la asistencia histológica.
La investigación en esta publicación fue apoyada por el Instituto Nacional de Dental & investigación craneofacial de los institutos nacionales de salud bajo la concesión número K08DE025914 y por la Asociación Americana de ortodoncia Fundación a Sumit Yadav.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| MX20 Radiography System | Faxitron X-Ray LLC | ||
| Digimizer Image software | MedCalc Software | ||
| Shandon Cryomatrix embedding resin | Thermo Scientific | 6769006 | |
| Manual microscope Axio Imager Z1 | Carl Zeiss | 208562 | |
| yellow fluorescent protein filter - EYFP | Chroma Technology Corp | 49003 | |
| cyan fluorescent protein filter - ECFP | Chroma Technology Corp | 49001 | |
| red fluoresecent protein filter - Cy5 | Chroma Technology Corp | 49009 | |
| sodium acetate anhydrous | Sigma-Aldrich | S2889 | |
| sodium L-tartrate dibasic dihydrate | Sigma-Aldrich | 228729 | |
| sodium nitrite | Sigma-Aldrich | 237213 | |
| ELF97 substrate | Thermo Fisher Scientific | E6600 | |
| ClickiT EdU Alexa Fluor 594 HCS kit | Life Technologies | C10339 | includes EdU (5-ethynyl-2'-deoxyuridine) |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Thermo Scientific | D1306 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S3264 | |
| Sodium phosphate monobasic | Sigma-Aldrich | 71505 | |
| Toluidine Blue O | Sigma-Aldrich | T3260 | |
| Adobe Photoshop | Adobe Systems Incorporated | ||
| Phosphate buffered saline tablets (PBS) | Research Products International | P32080-100T | |
| CNA Beta III Nickel-Free Archwire | Ortho Organizers, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. |
Referencias
- LeResche, L. Epidemiology of Temporomandibular Disorders: Implications for the Investigation of Etiologic Factors. Crit Rev Oral Biol Med. 8 (3), 291-305 (1997).
- Chen, J., et al. Altered functional loading causes differential effects in the subchondral bone and condylar cartilage in the temporomandibular joint from young mice. Osteoarthr Cartil. 17 (3), 354-361 (2009).
- Pirttiniemi, P., Kantomaa, T., Sorsa, T. Effect of decreased loading on the metabolic activity of the mandibular condylar cartilage in the rat. Eur J Orthod. 26 (1), 1-5 (2004).
- Chavan, S. J., Bhad, W. A., Doshi, U. H. Comparison of temporomandibular joint changes in Twin Block and Bionator appliance therapy: a magnetic resonance imaging study. Prog Orthod. 15 (57), (2014).
- Dutra, E. H., et al. Cellular and Matrix Response of the Mandibular Condylar Cartilage to Botulinum Toxin. PLoS ONE. 11 (10), 0164599(2016).
- Benjamin, M., Ralphs, J. R. Biology of fibrocartilage cells. Int Rev Cytol. 233, 1-45 (2004).
- Shen, G., Darendeliler, M. A. The Adaptive Remodeling of Condylar Cartilage- A Transition from Chondrogenesis to Osteogenesis. J Dent Res. 84 (8), 691-699 (2005).
- Utreja, A., et al. Cell and matrix response of temporomandibular cartilage to mechanical loading. Osteoarthr Cartil. 24 (2), 335-344 (2016).
- Kaul, R., et al. The Effect of Altered Loading on Mandibular Condylar Cartilage. PLoS ONE. 11 (7), 0160121(2016).
- Dyment, N. A., et al. High-Throughput, Multi-Image Cryohistology of Mineralized Tissues. J Vis Exp. , e54468(2016).
- Kawamoto, T. Use of a new adhesive film for the preparation of multi-purpose fresh-frozen sections from hard tissues, whole-animals, insects and plants. Arch Histol Cytol. 66 (2), 123-143 (2003).
- Hayman, A. R. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity. 41 (3), 218-223 (2008).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados