Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine morphometrische und zelluläre Analysemethode für das Murine mandibulares Kondylus
In diesem Artikel
Zusammenfassung
Dieses Manuskript stellt Methoden für die Analyse morphometrische und zelluläre Veränderungen innerhalb des Unterkiefers Kondylus von Nagetieren.
Zusammenfassung
Das Kiefergelenk (TMJ) hat die Fähigkeit zur Anpassung an äußere Reize und laden Änderungen beeinflussen die Position der Kondylen sowie die strukturelle und zellulären Komponenten des Unterkiefers kondylären Knorpels (MCC). Dieses Manuskript beschreibt Methoden für die Analyse dieser Veränderungen und eine Methode für das Laden des Kiefergelenks in Mäusen (d. h. zusammenpressende statische TMJ laden) zu verändern. Die strukturellen Bewertung hier abgebildete ist eine einfach morphometrische Ansatz, der nutzt die Digimizer-Software und wird in Röntgenaufnahmen kleiner Knochen durchgeführt. Darüber hinaus die Analyse der zellulären ändert führt zu Veränderungen im Kollagen Ausdruck, Knochenaufbau, Zellteilung und Proteoglykan Verteilung im MCC beschrieben. Die Quantifizierung dieser Änderungen in histologischen Abschnitten - durch zählen der positiven fluoreszierenden Pixeln mit Software und messen die Entfernung Zuordnung von Bildern und gefärbten Bereich mit Digimizer - wird auch demonstriert. Die hier gezeigten Methoden beschränken sich nicht auf das murine TMJ, aber auf zusätzliche Knochen der kleinen Versuchstieren und in anderen Regionen der Endochondral Verknöcherung verwendet werden konnte.
Einleitung
Kiefergelenk ist ein einzigartiges tragende Gelenk in der kraniofazialen Region gelegen und besteht aus Faserknorpel gebildet. Die MCC des Kiefergelenks ist unerlässlich für die Funktion der Gelenke, einschließlich ungehindert Kieferbewegung beim sprechen und arbeiten, aber es ist häufig von degenerativen Erkrankungen wie Arthrose1betroffen. Kiefergelenk hat die Fähigkeit zur Anpassung an äußere Reize und laden Umbauten, führt zu strukturellen und zellulären Veränderungen auf die Komponenten des MCC2,3,4,5. Die tragenden Eigenschaften des MCC lässt sich durch die Wechselwirkungen zwischen seinen Bestandteilen, einschließlich Wasser, das Kollagennetz und dicht gepackte Proteoglykane. Der MCC hat vier verschiedene zelluläre Zonen, die verschiedene Arten von Kollagen und nicht-Kollagen Proteine ausdrücken: 1) der oberflächlichen oder artikuläre Zone; (2) die proliferative Zone, bestehend aus undifferenzierten mesenchymalen Zellen und das reagiert auf Anforderungen laden; (3) die prehypertrophic Zone, bestehend aus Reife Chondrozyten Kollagen Typ 2 zum Ausdruck zu bringen; und 4) die hypertrophen zone, die Region, wo die hypertrophen Chondrozyten auszudrücken Kollagen Typ 10 sterben, und Verkalkung zu unterziehen. Die nicht mineralisierten Region ist reich an Proteoglykanen, die Resistenz gegen Druckkräfte6zur Verfügung zu stellen.
Gibt es kontinuierliche Mineralisierung in der hypertrophen Zone des MCC, wo der Übergang von werden zur Osteogenesis auftritt, garantiert die robuste mineralische Struktur des subchondralen Knochens des Unterkiefers Kondylus7. Zellveränderungen in den Regionen Latein und mineralisierten führen letztlich zu morphologischen und strukturelle Veränderungen in den Unterkiefer Kondylus und Unterkiefer. Aufrechterhaltung der Homöostase der alle zellulären Regionen des MCC und die Mineralisierung des subchondralen Teils sind unerlässlich für die Gesundheit, die Tragfähigkeit und die Integrität des Kiefergelenks.
Die mehrere Kollagen transgenen Mausmodell (wie von Utreja Et Al.beschrieben) 8 ist ein großartiges Werkzeug verwenden, um Veränderungen im Kollagen Ausdruck zu verstehen, weil alle transgene im MCC ausgedrückt werden. Für eine eingehende histologische Bewertung werden histologische Flecken zur Matrix Deposition, Mineralisierung, Zellproliferation, Apoptose, sowie Protein-Expression in den verschiedenen Zellschichten des MCC zu studieren.
In diesem werden Manuskript, histologische und morphometrische Analysen zur zelluläre und strukturelle Veränderungen in der MCC und subchondralen Knochen des Unterkiefers Kondylus von Mäusen zu bewerten. Darüber hinaus wird eine Zelle Quantifizierungsmethode, für die Analyse von fluoreszierenden histologische Bilder und für die Zuordnung von leichten Objektträger, beschrieben. Zusammenpressende statische Kiefergelenk laden-Methode, die zelluläre und morphologische Veränderungen an der MCC und subchondralen Knochen9verursacht, wird auch veranschaulicht, um unsere Methoden zu überprüfen.
Die hier beschriebenen Methoden einsetzbar, morphometrische und histologische Veränderungen im Unterkiefer Kondylus und Unterkiefer von Nagetieren zu bestimmen oder zu anderen Regionen der Endochondral Verknöcherung und die Morphologie der zusätzlichen mineralisierten Gewebe zu analysieren.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Die institutionelle Pflege der Tiere von der University of Connecticut Gesundheitszentrum gebilligten alle tierischer Verfahren.
1. zusammenpressende statische TMJ Loading: Mund gewaltsam geöffnet
Hinweis: Vier Wochen alten transgene Mäuse beherbergen fluoreszierende Reporter für Kollagen (Col2a1XCol10a1), freundlicherweise zur Verfügung gestellt von Dr. David Rowe (University of Connecticut), dienten für die Experimente in diesem Manuskript beschrieben (n = 8; 4 Rüden und 4 Hündinnen). Col2a1 Cyan (blau) Transgens drückt sich in den Zellen in der prehypertrophic Zone des MCC, während der Col10a1 Kirsche (rote) Zellen sind in der hypertrophen Region8 (Abbildung 1). Mäuse wurden ebenso in zwei Gruppen eingeteilt: (1) der geladenen Gruppe, wo Mäuse zusammenpressende statische TMJ laden (beschrieben in Schritt 2) und 2) der Kontrollgruppe, wo Mäuse keine Intervention erhielt unterzogen wurden.
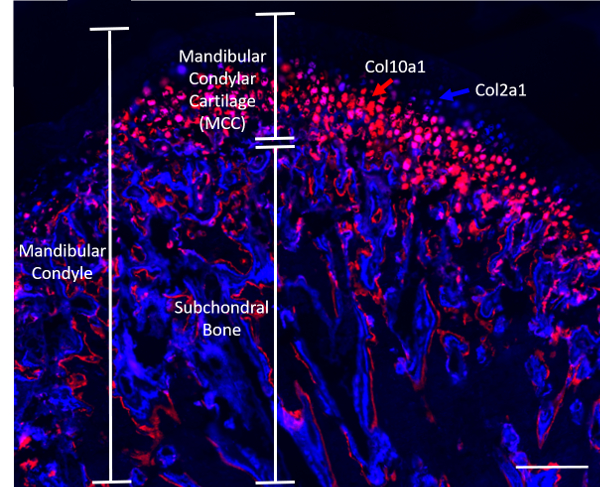
Abbildung 1. Vertreter des Kondylus eine Doppel-Kollagen fluoreszierende Reporter-Maus (Col2a1XCol10a1) sagittale. Maßstabsleiste = 200 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Fabrizieren Sie Federn Usingbeta Titan-Legierung Bögen (0,017 x 0,025 Zoll) (Abb. 2A).
- Betäuben Sie die Versuchstiere durch eine intraperitoneale Injektion einer Mischung von Ketamin (90 mg/kg Körpergewicht) und Xylazin (13 mg/kg Körpergewicht).
- Sanft öffnen Sie den Mund der Mäuse und legen Sie die Federn, engagieren die Loops in den Oberkiefer und Unterkiefer Schneidezähne (Abbildung 2B und C).
- Induzieren Sie zusammenpressende TMJ Statik durch die Federn in die Schneidezähne der narkotisierten Mäuse zu halten, für 1 Stunde wiederholen Sie diesen Vorgang für 5 Tage.
- Injizieren Sie die Mäuse mit 5-Ethnyl-2'-Deoxyuridine (EdU, 30 mg/kg Körpergewicht) intraperitoneal für Verbreitung Zellanalyse 2 Tage und 1 Tag vor der Euthanasie.
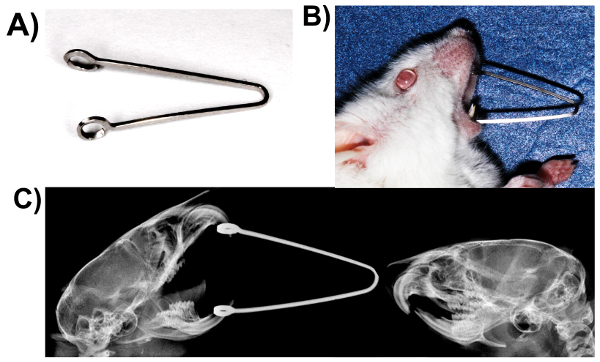
Abbildung 2. Druckfestigkeit TMJ Statik: Mund gezwungen offenes Modell. (A) Frühling hergestellt von 0,017 x 0,025 Beta-Titan-Legierung Bracketslot. (B) geladenen Maus mit Feder. (C) Röntgenaufnahme geladen und Kontroll-Mäusen zeigen Unterschiede in der Positionierung des Unterkiefers. Bitte klicken Sie hier für eine größere Version dieser Figur.
2. Unterkiefer Dissektion und Fixierung
- Am Endpunkt der gezwungen offenen Mund Verfahren einschläfern Sie Versuchstiere durch eine anerkannte Methode.
- Die Mandibeln durch Schneiden die muskuläre Anlage ohne Schaben des Knorpels des Kondylus zu sezieren.
- Legen Sie die gereinigten Mandibeln in 10 % Formalin für 24 h zur Fixierung.
Achtung: Formalin ist reizend; tragen Sie geeignetsten persönliche Schutzausrüstung.
(3) x-ray Imaging und morphometrische Messungen
- Die Mandibeln in einen flachen Behälter (z. B. ein 55 mm x 16 mm Petrischale) und Röntgenaufnahmen der Proben mit einem Kabinett Röntgensystem um eine 26 kV für 5 s.
Hinweis: Platzieren Sie eine Maßstabsleiste vor dem Speichern der Bilder. - Morphometrische Messungen von den Mandibeln mit einer Bildanalyse-Software durchführen (siehe die Tabelle der Materialien).
Hinweis: Bevor Sie Messungen durchführen, verwenden Sie die Maßstabsleiste auf der Röntgenaufnahme, um das Gerät zu bestimmen. Dieser Schritt ist wichtig, die anatomischen Strukturen richtig zu messen. Klicken Sie auf die Schaltfläche "Einheit"(Abbildung 3). - Wählen Sie die anatomische Punkte mit dem "Marker-Stil 2" in der imaging-Software (Abbildung 3B). Um die Methode in diesem Dokument beschriebenen folgen, wählen Sie die folgenden Punkte (Abbildung 3B):
- Wählen Sie die Condylion (Punkt 1), die am hinteren Punkt des Unterkiefers Kondylus;
- Wählen Sie den Schneidezahn-Prozess (Punkt 2);
- Wählen Sie den tiefsten Punkt der sigmoid Kerbe (Punkt 3);
- Wählen Sie den tiefsten Punkt der Konkavität mandibulares Ramus (Punkt 4);
- Wählen Sie den vorderen Punkt des kondylären Gelenkfläche (Punkt 5); und
- Wählen Sie den am hinteren Punkt der kondylären Gelenkfläche (Punkt 6).
- Nach der Auswahl der anatomische Punkte, morphometrische Messungen mit dem Längenwerkzeug "", aber für den Kondylus Kopf Länge, verwenden Sie das "senkrechte Linie" Werkzeug aus Punkte (3) und (4) (Abb. 3C).
- Messen Sie die mandibuläre Länge, von der Condylion (1) an den Schneidezahn-Prozess (2).
- Messen Sie die Kondylus Kopf Länge - der senkrechte Abstand von der Condylion (1) zu einer Linie vom tiefsten Punkt an der sigmoid Kerbe (3) auf den tiefsten Punkt in der Konkavität des mandibulares Ramus (4) zurückgeführt.
- Messen Sie den Kondylus Kopfbreite - der Abstand von den meisten anterior am hinteren Punkt der kondylären Gelenkfläche (5-6).
- Kopieren Sie die Messungen aus der "Messung-Liste" auf der rechten Seite des Bildschirms (Abb. 3C).
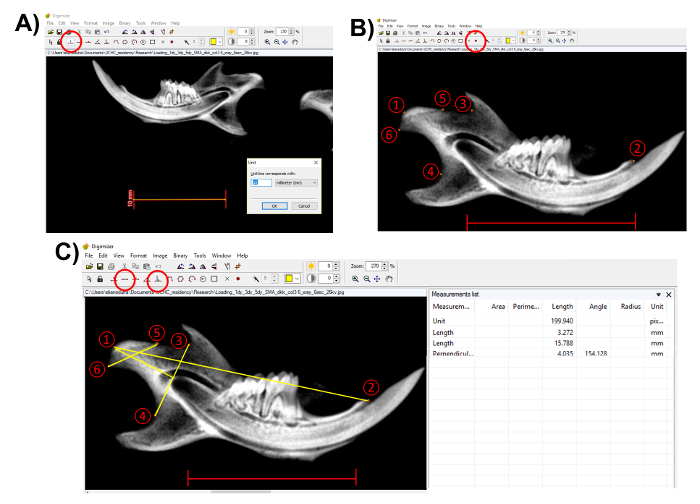
Abbildung 3 . Darstellung der morphometrische Messungen des Unterkiefers. (A) der Maßstab der Röntgenaufnahme verwenden, um das Gerät zu bestimmen (eingekreist in rot, Maßstabsleiste: 10 mm). (B) wählen Sie die anatomische Punkte mit dem "Marker-Stil 2" (rot eingekreist). (1) Condylion; (2) Schneidezahn Prozess; (3) tiefsten Punkt an der sigmoid Kerbe; (4) tiefsten Punkt in der Konkavität des mandibulares Ramus; (5) am vorderen Punkt des kondylären Gelenkfläche; (6) am hinteren Punkt der kondylären Gelenkfläche. Maßstab: 10 mm.(C) führen Messungen mit der "Länge" und "senkrecht" Werkzeuge (rot eingekreist). Messungen von Punkt 1 bis 2: mandibuläre Länge; ab Punkt 5 bis 6: kondylären breite; senkrecht von Punkt 1 bis 4 - 3: kondylären Kopf Länge. Speichern der Messungen aus der "Messung Liste." Maßstabsleiste = 10 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.
(4) Kondylus einbetten
Hinweis: Nach der Einnahme der radiologischen Bilder, die Mandibeln eingebettet und werden für histologische Analyse geschnitten.
- Legen Sie undecalcified Mandibeln (die in Schritt 2.3 behoben wurden) in 30 % Saccharose in PBS über Nacht vor dem einbetten.
- Sezieren Sie alle überschüssigen Weichteile zu und schneiden Sie vorsichtig die mandibuläre Kondylus.
- Gießen Sie einige Einbetten von Harz (genug, um die Probe) in Einweg-Kunststoff-Formen und der medialen Fläche des Kondylus gegen die Basis des Schimmels, Positionierung der Probenmaterials parallel zum unteren Rand der Form.
- Befestigen Sie die Probe an der richtigen Stelle mit einem Stück von Trockeneis.
- Füllen Sie den Schimmel mit Harz einbetten und legen Sie die Form mit festen Probe in kalten 2-Methyl-Butan, die vorgekühlt in-20 ° C oder-80 ° C Gefrierschrank oder in Trockeneis kann.
- Speichern Sie die Proben bei-20 ° C oder bei-80 ° C bis zu schneiden.
(5) Kondylus sagittaler Schnitt und Dia-Vorbereitung
- Erstellen Sie sagittale Gefrierschnitte der Kondylen (5-7 µm) und übertragen Sie die Proben auf die Folie mit Klebeband Übertragung Methode10,11.
- Halten Sie die histologischen Abschnitten auf das Band mithilfe von UV-härtender Methode10übertragen.
(6) histologische Färbung und mikroskopische Bildgebung
Hinweis: Die meisten der histologischen Färbung erfolgt wie im histologischen Abschnitt des Papiers durch Dyment Et Al10beschrieben.
- Für das Scannen von Grundlinie ist der erste Schritt für die Col2a1 und Col10a1 Bild transgene, wie durch Dyment Et Al10 beschrieben.
- Legen Sie Deckgläsern auf den Folien in 30 % Glycerin und PBS. Durchführen Sie Grundlinie bildgebende Ofthesectionswitha fluoreszierenden Mikroskop und entsprechende Filter.
- Führen Sie fluoreszierende Tartrat-resistente saure Phosphatase (TRAP) Färbung.
Hinweis: TRAP wird durch hämatopoetischen Zellen, einschließlich des Knochens resorbing Zellen, die Osteoklasten12ausgedrückt. Dieser Fleck soll MCC und subchondralen Knochenaufbau zu analysieren.- Entfernen Sie das Deckglas der Folien durch Einweichen in PBS. Waschen Sie die Folien drei Mal für 5 min in PBS.
- Bereiten Sie TRAP Puffer 1 durch Natriumacetat wasserfrei (9,2 g) und Natrium L-Tartrat Diabas-Dihydrat (11,4 g) in 1 L destilliertem Wasser auflösen. Einstellen Sie des pH-Werts auf 4.2 mit Essigsäure und TRAP-Puffer 1 bei 4 ° C.
- Bereiten Sie TRAP Puffer 2 durch frisch Natriumnitrit (40 mg) in 1 mL destilliertem Wasser auflösen.
- Bereiten Sie TRAP Substratpuffer (kurz vor der Färbung), durch das Mischen von 7,5 mL Puffer 1 und 150 µL Puffer 2. Wenden Sie diese Lösung (200 µL) auf jeder Folie für 10 min bei Raumtemperatur.
- Bereiten Sie TRAP Reaktion Puffer durch Mischen 1,840 mL Substratpuffer und 23 µL fluoreszierende Substrat (siehe die Tabelle der Materialien).
Hinweis: Die fluoreszierenden Substrategeneratesayellowfluorescentsignal für TRAP Aktivität. - Entfernen Sie überschüssige TRAP Substratpuffer durch sanft pipettieren die Lösung.
- Inkubieren Sie die Folien mit 200 µL TRAP Reaktion Puffer für 5 min unter Schwarzlicht UV Quelle Birne.
- Waschen Sie die Folien drei Mal für 5 min in PBS.
- Folien in 30 % Glycerin in PBS Deckgläsern aufsetzen und mikroskopische Bildgebung10durchzuführen.
- Führen Sie Zelle Verbreitung Färbung.
Hinweis: In diesem Test ist die modifizierte Thymidin analoge 5-Ethynyl-2'-Deoxyuridine (EdU) in neu synthetisierte DNA integriert: teilende Zellen sind mit einer Leuchtstofffärbung beschriftet.- Nach dem Imaging für TRAP, entfernen Sie die Deckgläsern und waschen Sie Folien drei Mal für 5 min in PBS. Führen Sie die Schritte aus dem 5-Ethynyl-2'-Deoxyuridine Cell Proliferation Kit, die histologische Abschnitte zu beflecken.
- Bereiten Sie eine Reaktion durch Zugabe von 430 cocktail µL 1 X Reaktion Puffer, 20 µL CuSO4, 1,2 µL Fluoreszenzfarbstoff und 50 µL 1 X buffer Additiv (ein Gesamtvolumen von 500 µL ist genug für eine Folie).
Hinweis: Der Hersteller empfiehlt die Zutaten in der hier beschriebenen Reihenfolge hinzufügen. - Inkubieren Sie die Folien mit der zubereitete Cocktails für 30 min bei Raumtemperatur, vor Licht geschützt werden.
- Waschen Sie die Folien drei Mal für 5 min in PBS.
- 30 % Glycerin in PBS mit 1:1,000 DAPI entgegenbringen Sie Deckgläsern auf den Folien.
Hinweis: DAPI (4', 6-Diamidino-2-Phenylindole) ist eine fluoreszierende nuklearen Bläue, die AT-reiche Regionen in der DNA bindet.
- Führen Sie Toluidin blau (TB) Färbung.
Hinweis: TB Färbung der Proteoglykan-Distribution bei der MCC enthüllt.- Spülen Sie die Folien-Indistilledwater um den Deckgläsern zu entfernen.
- Nach dem Entfernen der Deckgläsern, waschen Sie die Folien in destilliertem Wasser drei Mal für 5 min um die Salze von PBS zu entfernen.
- TB arbeiten Puffer vorzubereiten, indem man eine (auflösen 28,4 g in 1 L destilliertes Wasser Diabas-Natriumphosphat) und Lösung B (27,6 g Natrium Phosphat monobasic in 1 L destilliertem Wasser auflösen). Mix-94.7 mL der Lösung A mit 5,3 mL der Lösung B. verdünnt diese Lösung 1:1 in destilliertem Wasser, 200 mL 0,1 M Puffer arbeiten zu machen. Korrigieren Sie den pH-Wert auf 8.0 durch Zugabe von Natriumhydroxid, bis der pH-Wert behoben ist.
- Bereiten Sie 1 % Lager TB: TB 1 g in 100 mL destilliertem Wasser mischen.
- Bereiten Sie TB funktionierende Lösung durch Mischen 40 mL 0,1 M arbeiten Puffer in 3 mL 1 % Lager TB.
- Inkubieren Sie die Folien in der TB-Arbeitslösung für 14-17 s.
Hinweis: Dieser Fleck ist sehr zeitkritisch; Die Inkubationszeit kann müssen angepasst werden, um overstaining zu verhindern. - Waschen Sie die Objektträger in destilliertem Wasser drei Mal für 5 min.
- Legen Sie die Deckgläsern auf den Folien in 30 % Glycerin in destilliertem Wasser. Durchzuführen Sie Lichtmikroskop imaging10.
Hinweis: Führen Sie nicht die Folien für TB in Glycerin + PBS gebeizt Deckglas. PBS wäscht aus dieser Art von Fleck.
(7) fluoreszierende histologischen Quantifizierung
- Histologischen Quantifizierung der fluoreszierenden Bilder mithilfe einer Bildanalyse-Software ausführen (siehe die Tabelle der Materialien).
Hinweis: Das Grundprinzip der histologischen Quantifizierung bei dieser Methode ist es, die Anzahl der fluoreszierenden Pixel des Interesses durch die Gesamtzahl der Pixel des Gebiets von Interesse teilen und multiplizieren Sie die erhaltene Zahl durch 100, was in einem Prozentsatz der positiven Pixel innerhalb dieser Region. - Führen Sie die Quantifizierung des Col10a1 Ausdrucks im MCC sagittale Abschnitte der Kondylen.
- Bei allen Arten von Zellen und Flecken, die mit dieser Methode, wählen Sie den Bereich quantifiziert werden. Öffnen Sie die histologische Bilder in einer Bildanalyse-Software und wählen Sie den Bereich mithilfe der "Lasso-Werkzeug (L)" (Abb. 4A). Wählen Sie für die hier beschriebenen Analyse der MCC-Region nur; nach Auswahl des Bereichs, wird die Gesamtzahl der Pixel im Feld "Histogramm" auf dem Bildschirm der Software (Abb. 4A) angezeigt. Speichern Sie die Anzahl der Pixel im Bereich von Interesse.
- Wählen Sie die Col10a1 rote Pixel mit dem Sampling-Tool. Klicken Sie auf "Auswählen" auf der Oberseite und dann "Farbbereich". Klicken Sie auf die "Pipette", wählen Sie die Probe Farbe des Pixels in der Bild, und klicken Sie auf "OK". Positiv für die gewählten Pixelfarbe werden alle Bereiche ausgewählt (Abbildung 4B). Kopieren Sie die Anzahl der fluoreszierenden Pixel (im Feld "Histogramm" auf dem Bildschirm angezeigt) und fügen Sie sie in einem Arbeitsblatt oder einer Statistik-Software für die Analyse.
- Verteilen Sie die Anzahl der fluoreszierenden Pixel über die Anzahl der Pixel des Bereichs des Interesses und multiplizieren Sie diese Zahl mit 100: fluoreszierende Pixel / Pixel im Interessenbereich * 100.
Hinweis: Andere Art von Zellen, wie blaue Col2a1 kann mit dieser Methode quantifiziert werden, aber die blauen Pixel gewählt werden, anstatt die Col10a1 rote Pixel.
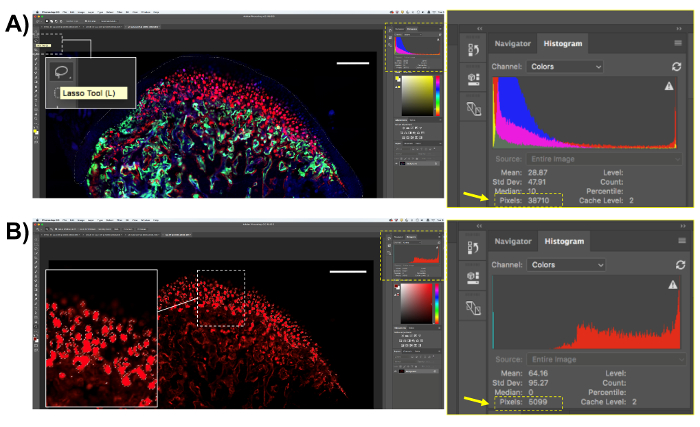
Abbildung 4 . Darstellung des Transgens Col10a1 Quantifizierung. (A) wählen Sie den gewünschten Bereich mit dem "Lasso-Werkzeug" (L). Col10a1-positiven Zellen wählen Sie in des gesamten Unterkiefers Knorpels. Speichern Sie die Anzahl der Pixel aus dem Feld "Histogramm". (B) wählen Sie die Pixel von Interesse, in diesem Fall die rote fluoreszierende Col10a1 Pixel. Beachten Sie, dass nur die roten Pixel in den gewünschten Bereich ausgewählt werden. Speichern Sie die Anzahl der roten Pixel vom Feld "Histogramm". Maßstabsleiste = 200 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Führen Sie die Quantifizierung der TRAP-Aktivität im MCC und subchondralen Knochen.
- Folgen Sie den Anweisungen in Schritt 8.2 beschrieben, aber anstatt nur die MCC-Bereich auszuwählen, wählen Sie die Knorpel und subchondralen Knochen Regionen (Abb. 5A).
- Wählen Sie für TRAP Aktivitätsanalyse die gelbe Pixel generiert durch das ELF97 Substrat, wie unter Schritt 8.2.2 (Abb. 5B); Kopieren Sie die Anzahl der positiven Pixel; und fügen Sie sie in einem Arbeitsblatt oder einer Statistik-Software für die Analyse.
- Erhalten Sie den Prozentsatz der TRAP-positiven Pixel durch die Anzahl der gelben Pixel durch die Gesamtzahl der Pixel in der subchondralen Knochen Region dividiert und mit 100 multipliziert.
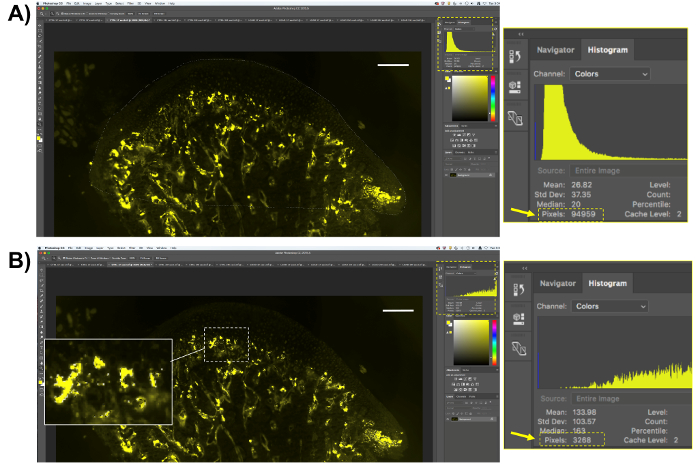
Abbildung 5 . Darstellung der fluoreszierenden TRAP Quantifizierung. (A) wählen Sie den gewünschten Bereich (mandibularis Knorpel und subchondralen Knochen) und speichern Sie die Anzahl der Pixel dieser Region. (B) wählen Sie die gelb fluoreszierende Pixel, TRAP Aktivität darstellt. Beachten Sie, dass nur TRAP-positiven Pixel wählen werden. Speichern Sie die Anzahl der ausgewählten Pixel. Maßstabsleiste = 200 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Führen Sie die Quantifizierung der EdU-positiven Zellen.
- EdU-gefärbten Folien sind counterstained mit DAPI, statt zählen die Gesamtzahl der Pixel in der Region von Interesse, wählen Sie das DAPI-positiven Pixel zur Berechnung des Anteils der EdU-positiven Pixel. Wählen Sie den Bereich von Interesse, wie unter Punkt 8.2 beschrieben, aber nicht speichern Sie die Gesamtzahl der Pixel. Wählen Sie das DAPI blaue Pixel als die aufgenommene Farbe, wie in Schritt 8.2.2 beschrieben; Kopieren Sie die Anzahl der Pixel DAPI-positiv(Abbildung 6); und fügen Sie sie in einem Arbeitsblatt oder einer Statistik-Software für die Analyse.
- Als nächstes wählen Sie die EdU-positiven Pixel (gelb fluoreszierende Pixel) und speichern Sie die Anzahl der Pixel im Feld "Histogramm" (Abb. 6B).
- Berechnen Sie den Prozentsatz der EdU Pixel, indem die Anzahl der Pixel der EdU-positiv durch die Anzahl der Pixel DAPI-positiv und die erhaltene Zahl mit 100 multipliziert.
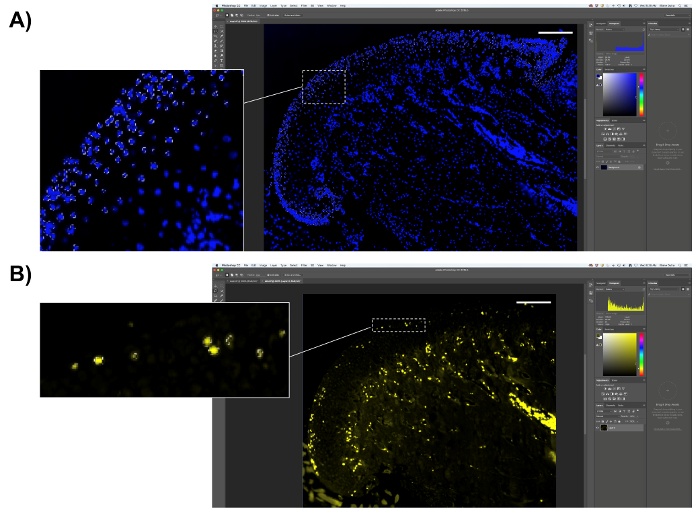
Abbildung 6 . Darstellung der EdU Quantifizierung. (A) wählen Sie die proliferative Region des MCC (die äußere Schicht des Knorpels). Wählen Sie DAPI-positiven Pixel und speichern Sie die Anzahl der Pixel. (B) wählen Sie EdU-positiven Pixel (gelb fluoreszierend) und speichern Sie die Anzahl der Pixel. Maßstabsleiste = 200 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
(8) Quantifizierung der Knorpel Dicke und Proteoglykan Verteilung
- Analysieren Sie die Knorpel-Dicke (Entfernung Zuordnung) und Toluidin blau gefärbten Bereich mit der Digimizer Bild-Software.
Hinweis: Verwenden der Maßstab im histologischen Bild um zu bestimmen, die Einheit(Abbildung 7). - Führen Sie eine Zuordnung Entfernungsmessung.
Hinweis: Die Distanzmessung Zuordnung wird die Dicke des Knorpels an den Unterkiefer Kondylus bieten. In dem hier beschriebenen Verfahren sind fünf Regionen des MCC ausgewählt, geben durchschnittlich die Gesamtdicke des MCC. Die Forscher können drei verschiedene Regionen, oder auch nur eine einzige Region in der Mitte des MCC zu messen.- Mit dem "" Längenwerkzeug messen Sie die Länge des Knorpels von der äußeren Oberfläche bis zum Ende des Toluidin blau gefärbten Bereich (Abb. 7B) in fünf Regionen oder in möglichst vielen Orten als bevorzugte.
- Kopieren Sie die Längenmessungen aus der "Messung Liste."
Hinweis: Die Software bietet auch einen Mittelwert der Messungen (Abb. 7B).
- Messen Sie den Toluidin blau gefärbten Bereich.
Hinweis: Bei der Messung des Bereichs Toluidin blau gefärbten Bereich Proteoglykan im MCC erhalten.- Wählen Sie das Werkzeug "Fläche" und Kontur Toluidin blau gefärbten Bereich (Abb. 7C).
- Kopieren Sie die Flächenmaße aus der "Messung Liste."
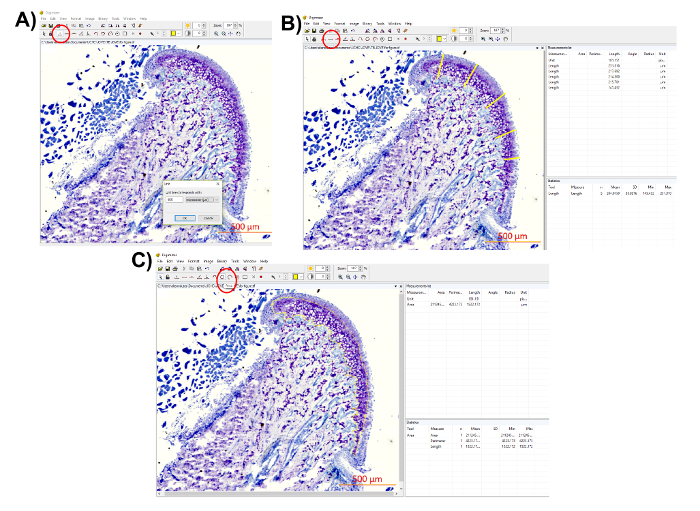
Abbildung 7 : Darstellung der Proteoglykan Verteilung Quantifizierung. (A) der Maßstab des histologischen Bildes verwenden, um das Gerät zu bestimmen, indem Sie auf die Schaltfläche "Einheit" (eingekreist in rot, gewählte Einheit: 500 µm). Messen Sie (B) die Dicke des Knorpels an verschiedenen Orten mit dem "Länge" Tool (rot eingekreist). Speichern Sie die Messungen aus der "Messung Liste" im rechten oberen Bereich. Die Software bietet auch "Statistik" im unteren rechten Bereich, also den Mittelwert und SD der Messungen direkt bezogen werden können. Messen Sie (C) den Toluidin blau gefärbten Bereich mit dem "Bereich" Tool (rot eingekreist). Kreisen Sie den gewünschten Bereich und speichern Sie die Messung aus der "Messung Liste." Bitte klicken Sie hier für eine größere Version dieser Figur.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Deskriptive Statistik wurden durchgeführt, um die Verteilung der morphometrische Maße (mandibularis Länge, kondylären Länge, kondylären Breite) und histologische Analysen untersuchen. Ergebnisse wurden im Vergleich zwischen den geladen (z.B. Mäuse ausgesetzt zusammenpressende Belastung mit der Beta-Titan-Feder) und Kontrollgruppe (z.B. passende Kontroll-Mäusen, die keinem Eingriff erhalten haben). Statistisch signifikante Unterschiede zwischen den waren bestimmt ...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Dieses Manuskript beschriebenen Verfahren zur Messung der morphometrische und zelluläre Analyse der murinen mandibulares Kondylen und Mandibeln. Die radiologischen morphometrische Maße können auch verwendet werden, andere Knochen aus kleinen Versuchstieren zu analysieren. Darüber hinaus die zelluläre Analyse (Zelle Quantifizierung und Knorpel Entfernung Zuordnung) beschränken sich nicht auf das Nagetier mandibulares Kondylus, sondern kann zur histologischen Abschnitte von zahlreichen Geweben zu quantifizieren.
...Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keinen finanziellen Interessenkonflikt.
Danksagungen
Die Autoren möchten Dr. David Rowe danken, dass freundlicherweise die transgene Mäuse und Li Chen für die histologische Unterstützung.
Die Forschung berichtet in dieser Publikation wurde vom nationalen Institut der Dental & Craniofacial Forschung von den National Institutes of Health unter Preis Anzahl K08DE025914 und der amerikanischen Vereinigung der kieferorthopädischen Foundation zur Sumit Yadav unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| MX20 Radiography System | Faxitron X-Ray LLC | ||
| Digimizer Image software | MedCalc Software | ||
| Shandon Cryomatrix embedding resin | Thermo Scientific | 6769006 | |
| Manual microscope Axio Imager Z1 | Carl Zeiss | 208562 | |
| yellow fluorescent protein filter - EYFP | Chroma Technology Corp | 49003 | |
| cyan fluorescent protein filter - ECFP | Chroma Technology Corp | 49001 | |
| red fluoresecent protein filter - Cy5 | Chroma Technology Corp | 49009 | |
| sodium acetate anhydrous | Sigma-Aldrich | S2889 | |
| sodium L-tartrate dibasic dihydrate | Sigma-Aldrich | 228729 | |
| sodium nitrite | Sigma-Aldrich | 237213 | |
| ELF97 substrate | Thermo Fisher Scientific | E6600 | |
| ClickiT EdU Alexa Fluor 594 HCS kit | Life Technologies | C10339 | includes EdU (5-ethynyl-2'-deoxyuridine) |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Thermo Scientific | D1306 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S3264 | |
| Sodium phosphate monobasic | Sigma-Aldrich | 71505 | |
| Toluidine Blue O | Sigma-Aldrich | T3260 | |
| Adobe Photoshop | Adobe Systems Incorporated | ||
| Phosphate buffered saline tablets (PBS) | Research Products International | P32080-100T | |
| CNA Beta III Nickel-Free Archwire | Ortho Organizers, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. |
Referenzen
- LeResche, L. Epidemiology of Temporomandibular Disorders: Implications for the Investigation of Etiologic Factors. Crit Rev Oral Biol Med. 8 (3), 291-305 (1997).
- Chen, J., et al. Altered functional loading causes differential effects in the subchondral bone and condylar cartilage in the temporomandibular joint from young mice. Osteoarthr Cartil. 17 (3), 354-361 (2009).
- Pirttiniemi, P., Kantomaa, T., Sorsa, T. Effect of decreased loading on the metabolic activity of the mandibular condylar cartilage in the rat. Eur J Orthod. 26 (1), 1-5 (2004).
- Chavan, S. J., Bhad, W. A., Doshi, U. H. Comparison of temporomandibular joint changes in Twin Block and Bionator appliance therapy: a magnetic resonance imaging study. Prog Orthod. 15 (57), (2014).
- Dutra, E. H., et al. Cellular and Matrix Response of the Mandibular Condylar Cartilage to Botulinum Toxin. PLoS ONE. 11 (10), 0164599(2016).
- Benjamin, M., Ralphs, J. R. Biology of fibrocartilage cells. Int Rev Cytol. 233, 1-45 (2004).
- Shen, G., Darendeliler, M. A. The Adaptive Remodeling of Condylar Cartilage- A Transition from Chondrogenesis to Osteogenesis. J Dent Res. 84 (8), 691-699 (2005).
- Utreja, A., et al. Cell and matrix response of temporomandibular cartilage to mechanical loading. Osteoarthr Cartil. 24 (2), 335-344 (2016).
- Kaul, R., et al. The Effect of Altered Loading on Mandibular Condylar Cartilage. PLoS ONE. 11 (7), 0160121(2016).
- Dyment, N. A., et al. High-Throughput, Multi-Image Cryohistology of Mineralized Tissues. J Vis Exp. , e54468(2016).
- Kawamoto, T. Use of a new adhesive film for the preparation of multi-purpose fresh-frozen sections from hard tissues, whole-animals, insects and plants. Arch Histol Cytol. 66 (2), 123-143 (2003).
- Hayman, A. R. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity. 41 (3), 218-223 (2008).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten