このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
形態とマウスの下顎頭軟骨細胞解析法
要約
この原稿は、形態および齧歯動物の下顎内携帯電話の変更を分析するための方法を示します。
要約
顎の関節 (顎関節) は外部からの刺激に適応する能力と顆の位置だけでなく、下顎頭軟骨 (MCC) の構造および細胞のコンポーネントに影響を与えることができます変更を読み込んでいます。本稿では、これらの変更、マウス (すなわち、読み込んで圧縮の静的顎) の顎関節の荷重を変更するためのメソッドを分析するためのメソッドについて説明します。ここで示した構造の評価は Digimizer ソフトウェアを使用して、小さな骨のレントゲン写真で実行される単純な形態計測学的アプローチです。さらに、携帯の解析式コラーゲン、骨、細胞分裂の変化にリードを変更してクライアントにおけるプロテオグリカンの分布を説明しました。使用して肯定的な蛍光ピクセルを数えることでの組織学的セクションでこれらの変更の定量化画像ソフトウェアと測定距離マッピングとすすけるエリア Digimizer - でも実証されています。ここに示すメソッドは、マウスの顎関節に限定されないが、追加骨実験用小動物の軟骨内骨化の他の地域で使用できます。
概要
顎関節は顎顔面領域に位置するユニークな荷重関節で、線維軟骨の形成されます。顎関節の MCC が話すと、咀嚼しながら妨害されていない顎運動を含む関節の機能的な変性疾患、変形性関節症1を含む一般受けます。顎関節 MCC2,3,4、5のコンポーネントの構造および細胞の変更につながる外部刺激や負荷の変化に適応する能力があります。MCC の荷重特性は、水入り、コラーゲン ネットワークやプロテオグリカンが密集、成分間の相互作用によって説明できます。MCC はコラーゲンと非コラーゲン蛋白質の種類を表す 4 つの異なる細胞地帯: 1) 表在性または関節ゾーン;2) 増殖のゾーン、未分化間葉系細胞の構成要求の読み込みに対応します。3) prehypertrophic のゾーン、コラーゲン タイプ 2; を表現する成熟した軟骨細胞から成る・ 4)、肥大ゾーン、コラーゲンを表現する肥大軟骨細胞が死ぬ 10 を入力領域と石灰化を受けます。非鉱化地域は圧縮力6への抵抗を提供するプロテオグリカンが豊富です。
肥大軟骨軟骨から骨への転移が発生する MCC の継続的な鉱化作用がある7下顎頭の軟骨下骨の堅牢なミネラル構造を保証します。Unmineralized と鉱化地域の細胞の変化は、最終的に下顎頭および下顎骨の形態・構造の変化に します。クライアントのすべての携帯電話地域と軟骨部分の鉱化作用の恒常性の維持は、顎関節の健康、荷重容量性に不可欠です。
(前述の Utrejaらによって) 複数のコラーゲン トランスジェニック マウス モデル8は、すべての遺伝子は、MCC で表されるのでコラーゲン発現の変化を理解するを使用する素晴らしいツールです。詳細な病理組織学的評価、マトリックス析出、鉱化作用、細胞増殖、アポトーシス、MCC の異なる細胞層でのタンパク質発現を研究する組織学的汚れが使用されます。
この原稿、病理組織学的および形態計測学的解析はマウスの下顎の MCC と軟骨下骨の細胞および構造の変化を評価する使用されます。さらに、蛍光組織標本画像の分析や顕微鏡スライドをマッピングするためのように、セル定量化の方法を説明します。MCC と軟骨下骨9時細胞と形態学的変化が原因で、メソッドを読み込み、圧縮静的顎関節は、我々 の方法を検証するも示されています。
下顎頭および齧歯動物の下顎の組織変化と形態を決定するため、軟骨内骨化の他の地域とその他の硬組織の形態を分析したり、ここで説明する方法を使用できます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
コネチカット大学健康センターの制度上のアニマル ・ ケア委員会は、動物のすべてのプロシージャを承認しました。
1. 圧縮静的顎関節負荷: 口強制オープン
注: 博士デビッド ・ ロウ (コネチカットの大学)、によって提供されたコラーゲン (Col2a1XCol10a1)、蛍光レポーターを抱いて 4 週齢トランスジェニック マウス実験この原稿に記載のために使用された (n = 8; 4 男女各 4 名)。Col2a1 シアン (青) 遺伝子は MCC の prehypertrophic ゾーンでセルで表されます、Col10a1 しながら桜 (赤) 細胞肥大領域8 (図 1) に存在しています。マウスも同様に 2 つのグループに分けられた: 1) ロードのグループ、(に記載されている手順 2) と 2) の介入を受けたマウスがない、コントロール グループを読み込んで圧縮静的顎関節にマウスを供した。
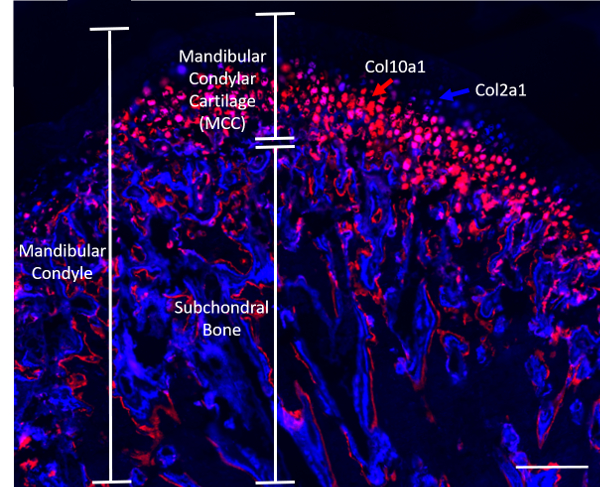
図 1。代表 (Col2a1XCol10a1) ダブル コラーゲン蛍光レポーター マウスの下顎の矢状。スケール バー = 200 μ m.この図の拡大版を表示するのにはここをクリックしてください。
- スプリング usingbeta チタン合金アーチワイヤ (0.017 × 0.025 インチ) (図 2A) を作製します。
- ケタミン (90 mg/kg 体重) とキシラジン (13 mg/kg 体重) の混合物の腹腔内投与による実験動物を麻酔します。
- 軽くマウスの口を開くし、上顎と下顎の切歯 (図 2B と C) のループを魅力的なばねを挿入します。
- 1, 5 日間のこの手順を繰り返します、麻酔下のマウスの前歯でスプリングを保つことによって圧縮静的顎関節負荷を誘発します。
- 5-ethnyl-2'-デオキシウリジン (EdU; 30 mg/kg 体重) と腹腔内細胞増殖解析 2 日間、1 日安楽死前に、のマウスを挿入します。
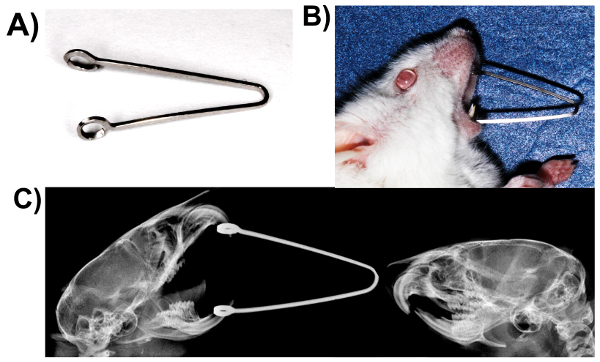
図 2。圧縮静的顎関節負荷: 口強制オープン モデル。(A)春は 0.017 0.025 β チタン合金ワイヤー x の製作。(B)春に読み込まれたマウス。(C)読み込まれてレントゲンと下顎骨の位置の違いを示すコントロール マウス。この図の拡大版を表示するのにはここをクリックしてください。
2. 下顎骨の解剖と固定
- 口を強制的に開けプロシージャのエンドポイントに承認された法による実験動物を安楽死します。
- 下顎頭の軟骨をこすることがなく筋肉の添付ファイルを切断することによって、顎を解剖します。
- 10% ホルマリン固定のために 24 時間に掃除の下顎骨を配置します。
注意: ホルマリンは刺激;適切な保護具を着用します。
3. x 線イメージングと地形計測
- (例えば、 55 mm × 16 mm のペトリ皿に) 平らな容器で下顎骨を配置し、26 でキャビネット x 線システムを使用してサンプルのレントゲン写真を取る 5 kV s。
注: は、画像を保存する前に、スケール バーを配置します。 - 画像解析ソフトを用いた下顎骨の形態計測学的測定 (材料の表を参照してください)。
注: 任意の測定を実行する前にバーを使用してスケール レントゲン写真で単位を確認します。この手順は、解剖学的構造を正しく測定することが重要です。「ユニット」ボタン (図 3A) をクリックしてします。 - (図 3B) は、イメージング ソフトウェアで「マーカー スタイル 2」を使用して解剖学的ポイントを選択します。この記事で示した方法に従う、次の点 (図 3B) を選択します。
- Condylion (ポイント 1) 下顎; の最も後方の点を選択します。
- 選択して切歯プロセス (ポイント 2)
- S 状結腸のノッチ (3 ポイント) で最も深いポイントを選択します。
- 下顎枝 (ポイント 4); の凹みに最も深いポイントを選択します。
- (ポイント 5) 下顎頭関節面の最も前方の点を選択します。そして
- 下顎頭関節面 (6 ポイント) の最も後方の点を選択します。
- 解剖学的ポイントを選択した後「長さ」ツールを使用してください地形計測を実行、顆頭長ポイント (3) と (4) (図 3C) から「垂直線」ツールを使用してください。
- 切歯プロセス (2) に (1) condylion から、下顎の長さを測定します。
- 顆頭の長さ - condylion (1) から (4) 下顎枝の凹部の最深部に s 状結腸のノッチ (3) の最も深いポイントからトレース ラインまでの垂直距離を測定します。
- 顆頭の幅 - 前方顆の関節面 (5-6) の最も後方の点からの距離を測定します。
- 画面 (図 3C) の右側にある「測定リスト」からの測定値をコピーします。
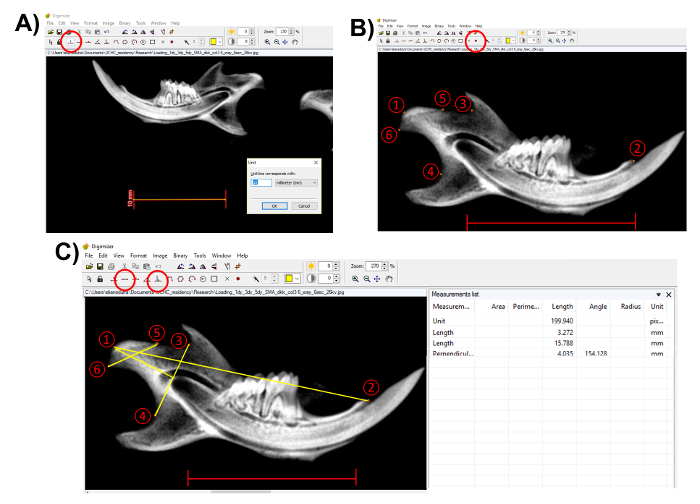
図 3.下顎骨の形態計測の表現。(A)エックス線像のスケール バーを使用して、単位を決定する (赤、スケール バーで囲まれて: 10 mm)。(B)は、「マーカーのスタイル 2」(赤丸部分) を使用して解剖学的ポイントを選択します。1) Condylion;2) 切歯プロセス;3) 最も深いポイントで s 状結腸のノッチ;4) 最深部凹部下顎枝;5) 下顎頭関節表面の前部ポイント下顎頭関節面の 6) ほとんど後方点。スケール バー: 10 mm(C)実行測定「長さ」と「垂直」ツール (赤丸部分)。1 に 2 のポイントからの測定: 下顎の長さ;5 に 6 をポイントから: 下顎頭の幅;垂直ポイント 1-4 3: 下顎頭長。「測定リスト」からの測定値をを保存します。スケール バー = 10 mmこの図の拡大版を表示するにはここをクリックしてください。 。
4. 下顎頭を埋め込む
注: 放射線画像を服用後下顎骨埋め込まれて、組織学的解析の断面します。
- 埋め込む前に一晩 30% スクロースを PBS で頭骨下顎骨 (つまりステップ 2.3 で修正されています) を配置します。
- 任意の余分な軟部組織を解剖し、下顎を慎重にカットします。
- 使い捨てのプラスチック金型のいくつかの埋め込み樹脂 (サンプルをカバーするために十分な) を注ぎ、サンプルを金型の下に平行に位置決め、金型のベースに対して顆の内側面を置きます。
- ドライアイスの部分で正しい場所で試料を固定します。
- 樹脂を埋め込むことで金型を埋めるし、場所固定サンプルと金型冷 2-メチル-ブタン、-80 ° C または-20 ° C のフリーザーまたはドライアイス中古冷蔵できます。
- 断面まで-80 ° c または-20 ° C で標本を保存します。
5. 下顎矢状断面とスライドの準備
- 冷凍の矢状顆 (5-7 μ m) セクションを作成し、サンプルをテープ転送方法10,11を使用してスライドに転送します。
- Uv 法10を使用してテープに転送される組織学的セクションを遵守します。
6. 組織染色と顕微鏡イメージング
注: Dymentら10紙の組織学的セクションの説明に従って、組織染色のほとんどが実行されます。
- ベースライン スキャンの最初のステップは、画像の Col2a1 と Col10a1 の遺伝子、Dymentら10で説明されているようにです。
- 30% のグリセロールと PBS でスライド上に coverslips を配置します。ベースライン イメージング ofthesectionswitha 蛍光顕微鏡および適切なフィルターを実行します。
- 蛍光酒石酸耐性酸フォスファターゼ (TRAP) 染色を実行します。
注: トラップは造血細胞、骨細胞、破骨細胞の12を含むによって表されます。この汚れの目的は、MCC と軟骨下骨のリモデリングを分析することです。- PBS でそれらを浸すことによってスライドの coverslip を削除します。3 回各 5 分間、PBS でスライドを洗ってください。
- 酢酸ナトリウム無水 (9.2 g) とナトリウム酒石酸二塩基二水和物 (11.4 g) 蒸留水 1 L に溶解してトラップ バッファー 1 を準備します。酢酸で 4.2 に pH を調整し、4 ° C でトラップ バッファー 1 を格納
- トラップ バッファー 2 を準備するには、新鮮な亜硝酸ナトリウム (40 mg) 中、蒸留水 1 mL を溶解します。
- 2 バッファーのバッファー 1、150 μ L の 7.5 mL を混ぜて (染色) 前だけに、トラップ基板バッファーを準備します。このソリューション (200 μ L) を室温で 10 分間の各スライドに適用されます。
- 基板バッファーの 1.840 mL と蛍光性基質の 23 μ L を混合することによってトラップ反応バッファーを準備 (材料の表を参照してください)。
注: TRAP 活性の蛍光 substrategeneratesayellowfluorescentsignal。 - ソリューションを軽くピペッティングして余分なトラップ基板バッファーを削除します。
- UV ソース電球ブラック ライトの下で 5 分間反応バッファーをトラップの 200 μ L でスライドを孵化させなさい。
- 3 回各 5 分間、PBS でスライドを洗ってください。
- PBS で 30% のグリセロールのスライドの coverslips を置き、顕微鏡イメージング10を実行します。
- 細胞増殖の染色を行います。
注: このアッセイで新たに合成された DNA に組み込まれて、変更されたチミジン アナログ 5-エチニル-2'-デオキシウリジン (EdU): 分裂細胞が蛍光染料と分類されます。- トラップのイメージング後、coverslips を取り外し、PBS で 3 回各 5 分のスライドを洗います。組織切片を染色する 5-エチニル-2'-デオキシウリジン細胞増殖キットから手順に従います。
- 反応を準備 430 を追加することによってカクテル μ L 反応バッファー、CuSO4の 20 μ L、蛍光染料、1.2 μ、50 μ L 1 X の X 1 のバッファー (500 μ L の総ボリュームは十分な 1 つのスライド) 添加剤。
注: 製造元は、ここで説明した順序で食材を追加することを推奨します。 - 光から保護、室温で 30 分間準備のカクテルとスライドを孵化させなさい。
- 3 回各 5 分間、PBS でスライドを洗ってください。
- 縮尺 DAPI で PBS で 30% のグリセロールでスライド上に coverslips を配置します。
注: DAPI (4', 6-diamidino-2-phenylindole) は、AT リッチ領域の dna に結合する青い蛍光核染色です。
- (TB) トルイジン ブルー染色を実行します。
注: TB 染色クライアントでプロテオグリカンの分布を明らかにします。- Coverslips を削除するスライド indistilledwater をすすいでください。
- Coverslips を除去した後 3 回 PBS から塩を完全に削除する各 5 分の蒸留水でスライドを洗います。
- TB 作業バッファーを準備することによってソリューション (溶解 1 l 蒸留水の二塩基リン酸ナトリウムの 28.4 g) と B (溶解 27.6 g ナトリウムりん酸 1 l 蒸留水の一) ソリューション。B. Dilute このソリューション 1:1 蒸留水に 200 mL の 0.1 m のバッファーを使用するソリューションの 5.3 ml 溶液 A ミックス 94.7 mL。8.0 pH を pH が修正されるまで、水酸化ナトリウムを追加することによって修正します。
- 株式 1 %tb を準備: 100 mL の蒸留水に TB の 1 g を混ぜます。
- 40 mL の 1% 株式 TB 3 mL に 0.1 M 作業バッファーを混ぜて TB 作業ソリューションを準備します。
- 14-17 s のための TB 作業ソリューション内のスライドを孵化させなさい。
注: この染みは非常に時間に敏感です。インキュベーション時間は overstaining を防ぐために調整する必要があります。 - 3 回各 5 分の蒸留水でスライドを洗います。
- 蒸留水で 30% のグリセロールでスライド上に coverslips を配置します。10をイメージング顕微鏡を実行します。
注: はありませんスライド染色 TB グリセリン + PBS coverslip ないです。PBS は、このタイプの汚れを洗います。
7. 蛍光組織定量化
- 画像解析ソフトを使用して蛍光画像の組織の定量化を実行 (材料の表を参照してください)。
注: この方法で組織定量化の基本的な原理は、関心のある領域のピクセルの総数によって興味の蛍光ピクセル数を分割し、肯定的なピクセルのパーセンテージに 100 で得られた数を乗算その域内。 - 下顎矢状セクションの MCC の Col10a1 式の定量化を実行します。
- セルの汚れこのメソッドを使用してすべての種類を設定するときを定量化する領域を選択します。組織学的イメージ画像解析ソフトで開き、「なげなわツール (L)」(図 4A) を使用して、領域を選択します。ここで説明する分析、クライアント領域のみを選択します。地域を選択すると、ピクセルの合計数は、ボックスを画面 (図 4A) ソフトウェアの「ヒストグラム」で上映。関心のある領域のピクセル数を保存します。
- 赤 Col10a1 ピクセルをサンプリング ツールを使用して選択します。上部パネルと、「色の範囲」で「選択」をクリックサンプル、画像内のピクセルの色を指定し、"ok"を選択「スポイト ツール」をクリックします。選択されたピクセル カラーになります肯定的なすべての領域を選択 (図 4B)。蛍光ピクセル (画面の「ヒストグラム」ボックスに表示されます) の数をコピーしてスプレッドシートまたは分析のための統計解析ソフトウェアでそれらを貼り付けます。
- 関心のある領域のピクセル数を蛍光ピクセル数を分割し、この番号を乗算 100: 蛍光ピクセル/関心の領域のピクセル * 100。
注: この同じ方法では、青色の Col2a1 などの細胞の他のタイプを示すことができるが Col10a1 赤のピクセルではなく青色の画素を選択必要があります。
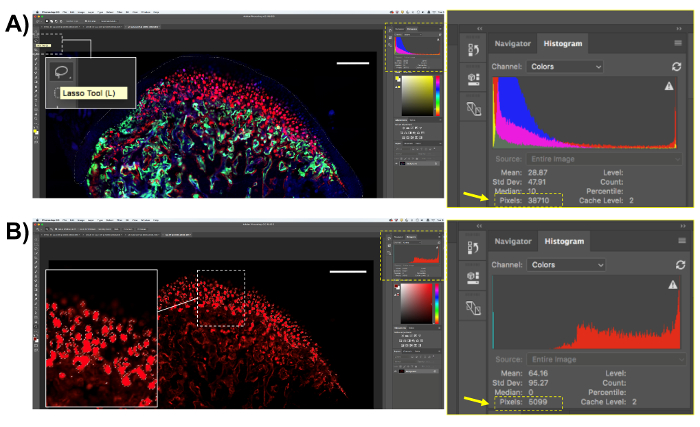
図 4.遺伝子 Col10a1 数量の表現。(A) 「なげなわツール」(L) 関心領域を選択します。Col10a1 陽性細胞全体下顎軟骨を選択します。「ヒストグラム」ボックスからのピクセル数をを保存します。(B)は、この例では、赤い蛍光 Col10a1 ピクセルを対象のピクセルを選択します。関心のある分野内赤のピクセルだけが選択されますに注意してください。「ヒストグラム」ボックスから赤のピクセルの数をを保存します。スケール バー = 200 μ m.この図の拡大版を表示するのにはここをクリックしてください。
- MCC と軟骨下骨の TRAP 活性の定量化を実行します。
- 8.2 の手順で説明されている手順に従いますが、クライアント領域の選択だけで、代わりに、軟骨と軟骨下骨領域 (図 5A) を選択します。
- トラップのアクティビティ解析、8.2.2 (図 5B) の手順の説明に従って ELF97 基板によって生成された黄色のピクセルを選択します。肯定的なピクセルの数をコピーします。スプレッドシートまたは分析のための統計解析ソフトウェアでそれらを貼り付けます。
- 軟骨下骨の領域内のピクセルの合計数で黄色のピクセル数に分割し、100 を掛けることによって TRAP 陽性ピクセルのパーセンテージを取得します。
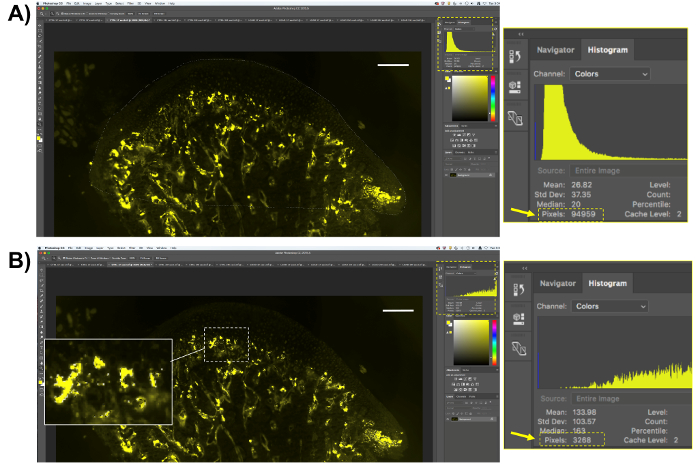
図 5.蛍光トラップ数量の表現。(A) (下顎軟骨と軟骨下骨) の関心の領域を選択し、この領域のピクセル数を保存します。(B)は、TRAP 活性を表す黄色の蛍光のピクセルを選択します。TRAP 陽性のピクセルだけが選択されることに注意してください。選択したピクセル数を保存します。スケール バー = 200 μ m.この図の拡大版を表示するのにはここをクリックしてください。
- エドゥ陽性細胞の定量を行います。
- DAPI でエドゥ染色スライド、counterstained、ので興味の領域内のピクセルの合計数をカウントするには、代わりにエドゥ正ピクセルのパーセンテージを計算する DAPI 正ピクセルを選択します。8.2 の手順で説明されているように関心のある分野を選択、総ピクセル数を保存しないようにします。8.2.2; の手順で説明するよう、サンプル色として DAPI 青ピクセルを選択します。DAPI 正ピクセル (図 6A) 数をコピーします。スプレッドシートまたは分析のための統計解析ソフトウェアでそれらを貼り付けます。
- 次に、エドゥ正ピクセル (黄色蛍光ピクセル) を選択し、(図 6B)「ヒストグラム」ボックスにピクセル数を保存します。
- DAPI 正ピクセル数でエドゥ肯定的なピクセルの数で除算して得られた数を乗じて 100 エドゥ ピクセルの割合を計算します。
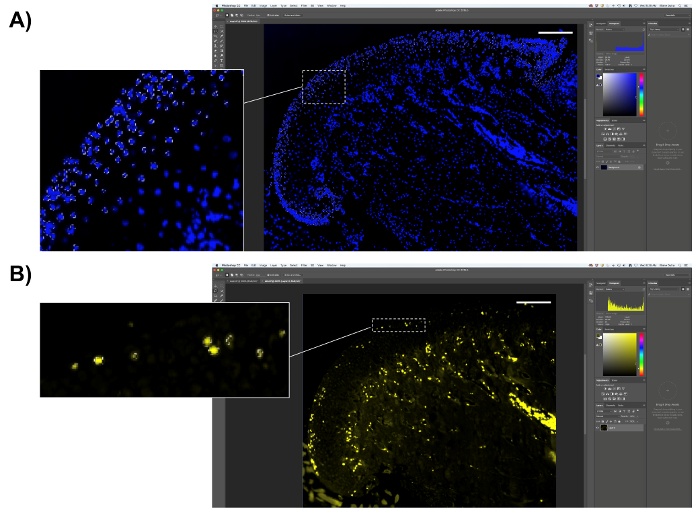
図 6.エドゥ数量の表現。(A) MCC (軟骨の外側の層) の増殖領域を選択します。DAPI 正ピクセルを選択し、ピクセル数を保存します。(B)は、エドゥ正ピクセル (蛍光イエロー) を選択し、ピクセル数を保存します。スケール バー = 200 μ m.この図の拡大版を表示するのにはここをクリックしてください。
8. 軟骨厚さとプロテオグリカン分布の定量化
- 軟骨厚さ (距離マッピング) とトルイジン ブルー染色領域 Digimizer イメージ ソフトウェアを使用して分析します。
注: は、ユニット (図 7A) を決定するのに組織学的イメージのスケール バーを使用します。 - 距離マッピング測定を実行します。
注: 距離マッピング測定は, 下顎頭の軟骨の厚さを提供します。ここで説明したメソッド、MCC の 5 つの領域が選択されている MCC の全面的な厚さの平均を与えること。研究者は、3 つの地域、またはクライアントの真ん中にも一つの領域を測定することができます。- 「長さ」ツールを使用して、トルイジン ブルー染色領域 (図 7B) 5 つの地域、または優先として多くの場所からの最後に外面から軟骨の長さを測定します。
- 「測定リスト」から長さ測定をコピー
注: ソフトウェアはまた測定 (図 7B) の平均を提供します。
- トルイジン ブルー染色領域を測定します。
注: トルイジン ブルー染色領域の測定、MCC のプロテオグリカン領域取得されます。- 「エリア」ツールを選択し輪郭のトルイジン ブルー染色領域 (図 7C)。
- 「測定リスト」から面積ををコピーします。
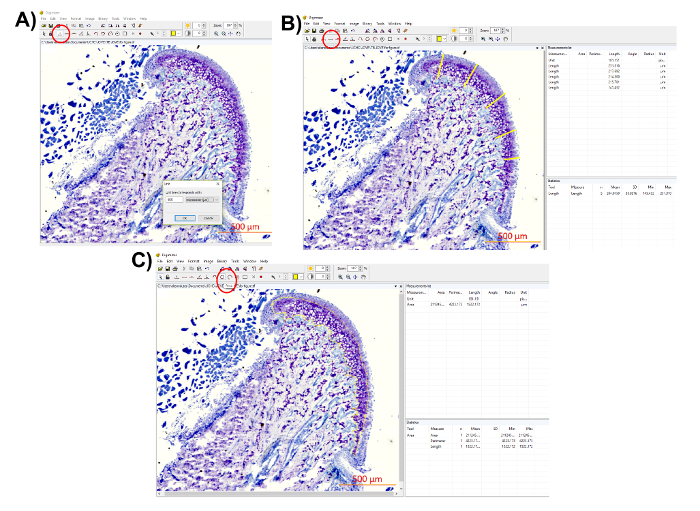
図 7: プロテオグリカン配布数量の表現。(A) 「ユニット」ボタンをクリックしてユニットを決定する組織学的イメージのスケール バーを使用して (選択した赤、ユニットに囲まれて: 500 μ m)。(B)は、(赤丸部分)「長さ」ツールを使用して別の場所で軟骨の厚さを測定します。右上のパネルに「測定リスト」からの測定値を保存します。ソフトウェアは、平均値と測定値の SD を直接取得できるので、右下のパネルで「統計」をまた提供します。(C)は (赤丸部分)「エリア」ツールを使用してトルイジン ブルー染色領域を測定します。関心のある分野のサークル、「測定リスト」からの測定値を保存この図の拡大版を表示するのにはここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
結果
記述統計を行った地形計測 (下顎長, 顆頭長, 顆頭幅) と組織学的解析の分布を調べる。結果は、読み込まれたグループ (すなわち、 β チタン スプリング圧縮荷重を受けるマウス) および制御グループ (すなわち、任意のプロシージャを受けなかったコントロール マウスと一致する) を比較した.対になっていない t 検定の p 値、平均値の間に統計的有意差?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
この原稿は、形態計測およびマウス下顎頭および下顎骨の細胞分析のための方法を説明します。撮影形態計測は、実験用小動物から他の骨を分析する使用できます。また、細胞解析 (細胞の定量化と軟骨の距離マッピング) 齧歯動物の下顎に限定されないが多数の組織の組織学的セクションを定量化する使用ことができます。
蛍光レポーターを表現するトランスジェニッ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は競合する金融興味を持ってないです。
謝辞
著者は、博士デビッド ・ ロウ提供いただきありがとうございます親切トランスジェニック マウスと李陳組織の援助をしたいと思います。
この出版物で報告された研究はだった国立歯科頭蓋顔面研究賞を受賞番号 K08DE025914 の下で健康の国民の協会 · スミット ・ ヤーダブに矯正基礎のアメリカ協会でサポートされています。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| MX20 Radiography System | Faxitron X-Ray LLC | ||
| Digimizer Image software | MedCalc Software | ||
| Shandon Cryomatrix embedding resin | Thermo Scientific | 6769006 | |
| Manual microscope Axio Imager Z1 | Carl Zeiss | 208562 | |
| yellow fluorescent protein filter - EYFP | Chroma Technology Corp | 49003 | |
| cyan fluorescent protein filter - ECFP | Chroma Technology Corp | 49001 | |
| red fluoresecent protein filter - Cy5 | Chroma Technology Corp | 49009 | |
| sodium acetate anhydrous | Sigma-Aldrich | S2889 | |
| sodium L-tartrate dibasic dihydrate | Sigma-Aldrich | 228729 | |
| sodium nitrite | Sigma-Aldrich | 237213 | |
| ELF97 substrate | Thermo Fisher Scientific | E6600 | |
| ClickiT EdU Alexa Fluor 594 HCS kit | Life Technologies | C10339 | includes EdU (5-ethynyl-2'-deoxyuridine) |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Thermo Scientific | D1306 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S3264 | |
| Sodium phosphate monobasic | Sigma-Aldrich | 71505 | |
| Toluidine Blue O | Sigma-Aldrich | T3260 | |
| Adobe Photoshop | Adobe Systems Incorporated | ||
| Phosphate buffered saline tablets (PBS) | Research Products International | P32080-100T | |
| CNA Beta III Nickel-Free Archwire | Ortho Organizers, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. |
参考文献
- LeResche, L. Epidemiology of Temporomandibular Disorders: Implications for the Investigation of Etiologic Factors. Crit Rev Oral Biol Med. 8 (3), 291-305 (1997).
- Chen, J., et al. Altered functional loading causes differential effects in the subchondral bone and condylar cartilage in the temporomandibular joint from young mice. Osteoarthr Cartil. 17 (3), 354-361 (2009).
- Pirttiniemi, P., Kantomaa, T., Sorsa, T. Effect of decreased loading on the metabolic activity of the mandibular condylar cartilage in the rat. Eur J Orthod. 26 (1), 1-5 (2004).
- Chavan, S. J., Bhad, W. A., Doshi, U. H. Comparison of temporomandibular joint changes in Twin Block and Bionator appliance therapy: a magnetic resonance imaging study. Prog Orthod. 15 (57), (2014).
- Dutra, E. H., et al. Cellular and Matrix Response of the Mandibular Condylar Cartilage to Botulinum Toxin. PLoS ONE. 11 (10), 0164599(2016).
- Benjamin, M., Ralphs, J. R. Biology of fibrocartilage cells. Int Rev Cytol. 233, 1-45 (2004).
- Shen, G., Darendeliler, M. A. The Adaptive Remodeling of Condylar Cartilage- A Transition from Chondrogenesis to Osteogenesis. J Dent Res. 84 (8), 691-699 (2005).
- Utreja, A., et al. Cell and matrix response of temporomandibular cartilage to mechanical loading. Osteoarthr Cartil. 24 (2), 335-344 (2016).
- Kaul, R., et al. The Effect of Altered Loading on Mandibular Condylar Cartilage. PLoS ONE. 11 (7), 0160121(2016).
- Dyment, N. A., et al. High-Throughput, Multi-Image Cryohistology of Mineralized Tissues. J Vis Exp. , e54468(2016).
- Kawamoto, T. Use of a new adhesive film for the preparation of multi-purpose fresh-frozen sections from hard tissues, whole-animals, insects and plants. Arch Histol Cytol. 66 (2), 123-143 (2003).
- Hayman, A. R. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity. 41 (3), 218-223 (2008).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved