Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir xarakteristikaları ve fare çene kemiğinde düzgün için hücresel analiz yöntemi
Bu Makalede
Özet
Bu el yazması xarakteristikaları ve kemirgenler çene kemiğinde düzgün içinde hücresel değişikliklerin analizi için yöntemler sunar.
Özet
Temporomandibuler eklem (TME) dış uyaranlara karşı uyum kapasitesine sahiptir ve değişiklikleri yükleme condyles konumunu, hem de yapısal ve hücresel bileşenleri, çene kemiğinde condylar kıkırdak (mm) etkileyebilir. Bu el yazması bu değişiklikleri ve farelerde (yüklemeYani, basınç statik TME) TME yüklenmesini değiştirme yöntemi analiz yöntemlerini açıklar. Burada resimli yapısal değerlendirme Digimizer yazılım kullanan ve küçük kemik ilerlemenin içinde gerçekleştirilen bir basit xarakteristikaları yaklaşımdır. Buna ek olarak, hücresel analizi önde gelen değişiklikler kollajen ifade, kemik remodeling, hücre bölünmesi olarak değiştirir ve proteoglikan dağıtım mm içinde anlatılan. Bu değişiklikler histolojik bölümlerde - kullanarak pozitif floresan piksel sayma tarafından miktar görüntü yazılım ve mesafe eşleme ölçme ve alan lekeli Digimizer ile - de gösterdi. Burada gösterilen yöntemleri için fare TME sınırlı değildir, ancak ek kemikleri küçük deneysel hayvan ve diğer bölgelerinde endochondral ossifikasyon üzerinde kullanılabilir.
Giriş
TME kraniyofasiyal bölgesinde bulunan benzersiz bir taşıma ortak ve fibrocartilage oluşturulur. TME mm için eklem fonksiyonu engellenmemiş çene hareket konuşma ve masticating, dahil olmak üzere, gerekli olduğunu ancak sık osteoartrit1de dahil olmak üzere dejeneratif hastalıklar tarafından etkilenir. TME yapısal ve hücresel değişiklik mm2,3,4,5bileşenlerine önde gelen dış uyaranlara ve yükleme değişiklikler, uyum kapasitesine sahiptir. MM taşıyıcı özelliklerini su, kollajen ağ da dahil olmak üzere ve yoğun Proteoglikanlar Paketli onun bileşenlerinin arasındaki etkileşimler tarafından açıklanabilir. MM olan kolajen ve kollajen olmayan proteinlerin farklı türleri hızlı dört ayrı hücresel bölgeleri: 1) Yüzeysel veya eklem bölgesi; 2) farklılaşmamış Mezenkimal hücreler ve bu oluşan proliferatif bölge talepleri yükleme için yanıt verir; 3) prehypertrophic bölge, kollajen tip 2 ifade olgun kondrosit oluşur; ve 4) Hipertrofik bölge, kollajen ifade Hipertrofik kondrosit 10 die girildiği bölge ve kalsifikasyon tabi. Mineralize olmayan bölge basınç Kuvvetleri6direnç sağlayan Proteoglikanlar zengindir.
İşte osteogenesis chondrogenesis geçiş oluştuğu, mm, Hipertrofik bölgede sürekli Qafqaz subchondral kemik çene kemiğinde düzgün7sağlam mineral yapısını güvence altına alınması. Unmineralized ve mineralize bölgelerde hücresel değişiklikler sonuçta çene kemiğinde düzgün ve çene kemiği morfolojik ve yapısal değişikliklere yol açar. Tüm hücresel bölgelerin MCC ve subchondral bölümü Qafqaz homeostazı bakımından temel sağlık, taşıma kapasitesi ve TME bütünlüğünü.
(Utreja ve ark.tarafından açıklandığı gibi) birden çok kollajen transgenik fare modeli 8 tüm transgenes mm ifade edilir çünkü kollajen ifade değişiklikleri anlamak için kullanmak için harika bir araçtır. Derinlemesine bir histolojik değerlendirme için histolojik lekeleri matris ifade, Qafqaz, hücre çoğalması ve Apoptozis yanı sıra protein ifadesi, farklı hücre katmanları MCC incelemek için kullanılır.
El yazması, histolojik ve xarakteristikaları analizleri bu farelerin çene kemiğinde düzgün mm ve subchondral kemik hücresel ve yapısal değişimler değerlendirmek için kullanılır. Buna ek olarak, floresan histolojik görüntüleri analiz etmek için ve ışık mikroskobu slaytlar, eşleme için bir hücre miktar yöntemi açıklanmıştır. Hangi hücresel ve morfolojik değişiklik mm ve subchondral kemik9neden olan, yöntemi, yükleme basınç statik TME da bizim yöntemleri doğrulamak için gösterilmiştir.
Yöntem tanımlamak burada xarakteristikaları ve çene kemiğinde düzgün ve mandibula kemirgenler histolojik değişiklikler belirlemek için veya diğer bölgelerinde endochondral ossifikasyon ve morfolojisi ek mineralize dokuların analiz etmek için kullanılabilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Connecticut Üniversitesi Sağlık Merkezi Kurumsal hayvan bakımı Komitesi tüm hayvan prosedürleri onayladı.
1. basınç statik TME yükleme: Ağız açık zorla
Not: 4-hafta-yaşlı transgenik fareler lütfen Dr David Rowe (Connecticut Üniversitesi), tarafından sağlanan kollajen (Col2a1XCol10a1), floresan muhabirleri barındıran bu el yazması açıklanan deneyler için kullanılan (n = 8; 4 ve 4 erkek). Col2a1 siyan (mavi) transgene mm prehypertrophic bölgede hücrelerdeki ifade edilir, Col10a1 kiraz (kırmızı) Hipertrofik bölge8 ' (şekil 1) mevcut hücrelerdir. Fare eşit iki gruba ayrıldı: nerede fareler nerede fareler alınan herhangi bir müdahale kontrol grubu (açıklandığı adım 2) ve 2) yükleme basınç statik TME maruz yüklü 1) grubu.
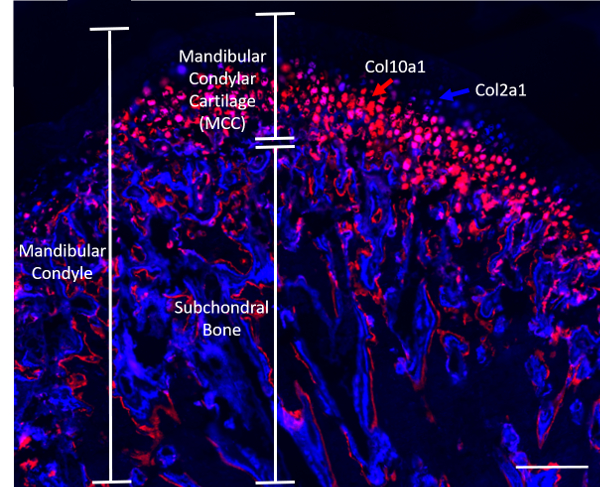
Şekil 1. Temsilcisi (Col2a1XCol10a1) bir çift-kollajen floresan muhabir fare düzgün sagittal. Ölçek çubuğu 200 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
- Yaylar usingbeta titanyum alaşım archwires (0.017 x 0,025 inç) (Şekil 2A) imal.
- Deneysel hayvan ketamin (90 mg/kg vücut ağırlığı) ve xylazine (13 mg/kg vücut ağırlığı) karışımı bir mayi enjeksiyonu ile anestezi.
- Yavaşça fare ağız açın ve döngüler üst ve Altçene ön dişler içinde (Şekil 2B ve C) ilgi çekici kaplıcaları yerleştirin.
- Basınç statik TME yükleme ikna etmek için 5 gün için bu yordamı yineleyin 1 h. yaylar imzalat fareler ön dişler içinde tutarak.
- Fareler 5-ethnyl-2'-deoxyuridine ile (EdU; 30 mg/kg vücut ağırlığı) intraperitoneally Hücre proliferasyonu analiz 2 gün ve 1 gün önce ötenazi için enjekte et.
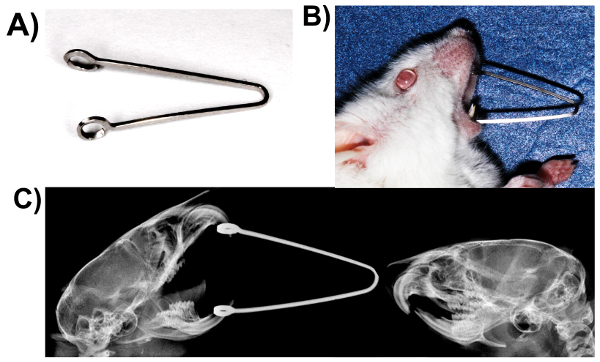
Şekil 2. Basınç statik TME yükleme: ağız açık modeli zorladı. (A) x 0.025 beta titanyum alaşım archwire 0.017, Bahar fabrikasyon. (B) yüklü fare ile bahar. (C) yüklü grafisi ve mandibula konumlandırmada farkları gösteren denetim fareler. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
2. alt çene diseksiyon ve fiksasyon
- Zorla-açık ağız yordamlar uç noktada deneysel hayvan tarafından onaylanmış bir yöntem ötenazi.
- Sapa kas ek düzgün kıkırdak kazıma olmadan kesim tarafından parçalara.
- Temizlenmiş sapa % 10 formalin fiksasyon için 24 h için yerleştirin.
Dikkat: Formalin tahriş edici olduğunu; uygun kişisel koruyucu ekipman giymek.
3. röntgen görüntüleme ve xarakteristikaları ölçümleri
- Sapa (örn., 55 mm x 16 mm Petri kabına bir) düz bir kapsayıcı yerleştirin ve ilerlemenin bir 26, bir kabin röntgen sistemi kullanarak örnekleri almak için 5 kV s.
Not: bir ölçek çubuğu görüntüleri kaydetmeden önce yerleştirin. - Bir görüntü analiz yazılımı kullanarak sapa xarakteristikaları ölçümleri gerçekleştirmek ( Tablo reçetesigörmek).
Not: herhangi bir ölçüm yapmadan önce ölçek çubuğu grafisi, birim belirlemek için kullanın. Bu adım düzgün anatomik yapıları ölçmek önemlidir. "Birim" düğmesinde (şekil 3A) tıklatın. - "İşaret stili 2" ile anatomik noktaları görüntüleme yazılımı (şekil 3B) seçin. Bu makalede açıklanan yöntemi takip etmek için aşağıdaki noktaları (şekil 3B) seçin:
- Condylion (nokta 1), çene kemiğinde düzgün en arka noktası seçin;
- Seçme kesici oluşum (nokta 2);
- Sigmoid çentik (3 nokta); en derin noktasında seçin
- Çene kemiğinde ramus (nokta 4); çukurluk içinde en derin noktası seçin
- Condylar eklem yüzeyi (5 puan); en ön noktası seçin ve
- Condylar eklem yüzeyi (noktası 6) en arka noktasını seçin.
- Anatomik noktaları seçtikten sonra "uzunluk" aracını kullanarak xarakteristikaları ölçüleri gerçekleştirir, ancak düzgün baş uzunluğu için puan (3) ve (4) (şekil 3C) "dikey çizgi" aracını kullanın.
- Condylion (1) için kesici diş işlem (2) dan çene kemiğinde uzunluğu ölçmek.
- Düzgün baş uzunluğu - sigmoid çentik (3), en derin noktasından en derin noktasına çene kemiğinde ramus (4) çukurluk içinde izlenen bir çizgi condylion (1) dikey mesafe ölçmek.
- Düzgün kafa genişliği - en iyi condylar eklem yüzeyi (5-6) en arka turistik anterior mesafe ölçmek.
- Ölçümleri "ölçüm listesinde" (şekil 3C) ekranın sağ tarafında kopyalayın.
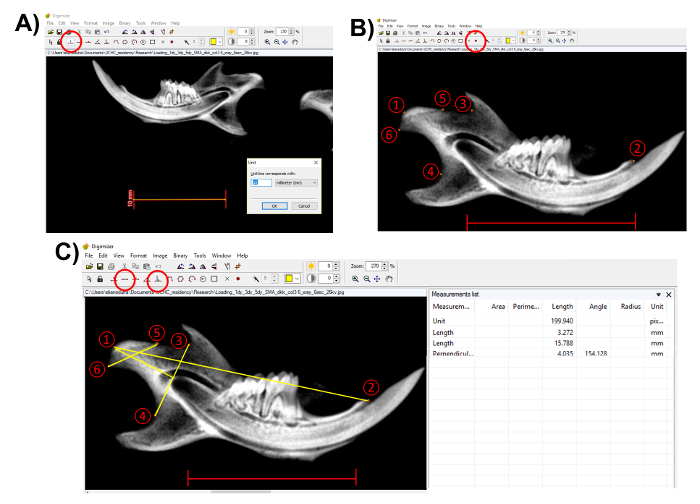
Şekil 3 . Çene xarakteristikaları ölçümleri gösterimi. (A) birim belirlemek için grafisi ölçek çubuğu kullanın (kırmızı, ölçek çubuğunda Daire: 10 mm). (B) "(kırmızı daire içinde) işaret stili 2" ile anatomik noktaları seçin. 1) Condylion; 2) kesici süreç; 3) sigmoid çentik en derin noktasında; 4) çene kemiğinde ramus çukurluk en derin noktası; 5) condylar eklem yüzeyi çoğu ön amacı; 6) condylar eklem yüzeyi çoğu posterior noktası. Ölçek çubuğu: 10 mm.(C) gerçekleştir ölçümleri "uzunluk" ve "dikey" araçları (kırmızı daire içinde). 1-2 noktadan ölçüler: çene kemiğinde uzunluğu; 5-6 noktası: condylar genişliği; dik gelen gelin 1-4 - 3: condylar baş uzunluğu. Ölçümler listesinden"ölçüm." Kaydet Ölçek çubuğu 10 mm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
4. düzgün katıştırma
Not: radyografik görüntüler aldıktan sonra sapa olabilir gömülü ve histolojik analiz için kesitli.
- (Bu adım 2.3 sabit olmuştur) undecalcified sapa PBS % 30 Sükroz gecede katıştırma önce yerleştirin.
- Herhangi bir aşırı yumuşak doku teşrih ve çene kemiğinde düzgün dikkatle kesin.
- Bazı gömme reçine (örnek kapak için yeterli) tek kullanımlık plastik kalıpları dökün ve düzgün üssüne örnek paralel kalıp altına konumlandırma kalıp, medial yüzeyine yerleştirin.
- Örnek doğru yerde bir parça kuru buz ile düzeltmek.
- Kalıp reçine gömme ile doldurun ve sabit örnek ile kalıp soğuk 2-metil-bütan içinde hangi bir-20 ° C veya-80 ° C dondurucu veya kuru buz önceden soğutulmuş olabilir yerleştirin.
- -20 ° c veya-80 ° C'de numune kesit kadar saklayın.
5. düzgün Sagittal kesit ve slayt hazırlama
- Condyles (5-7 µm) dondurulmuş sagittal bölümleri oluşturmak ve örnekleri bant aktarım yöntemi10,11kullanarak slayt aktarın.
- UV tedavi edilebilir yöntemi10kullanarak teybe histolojik kesitler uygun.
6. histolojik boyama ve mikroskobik görüntüleme
Not: çoğu histolojik boyama Dyment ve ark10tarafından kağıt histolojik bölümünde açıklandığı gibi yapılır.
- Temel tarama için ilk adım Col2a1 ve Col10a1 için transgenes, Dyment ve ark10 tarafından açıklandığı gibi görüntü etmektir.
- % 30 gliserol ve PBS coverslips slaytlar üzerine yerleştirin. Satır taban çizgisi görüntüleme ofthesectionswitha floresan mikroskop ve uygun filtreler uygulayın.
- Floresan tartarat dayanıklı asit fosfataz (tuzak) Boyama gerçekleştirmek.
Not: Tuzak kemik hücreleri, Osteoklastlar12resorbing de dahil olmak üzere hematopoetik hücreler tarafından ifade edilir. Bu leke amacı mm ve subchondral kemik remodeling analiz etmektir.- Coverslip slaytların PBS içinde ıslatarak kaldırın. Slaytları üç kez 5 min için her PBS içinde yıkayın.
- Tuzak arabelleği 1 sodyum asetat susuz (9.2 g) ve sodyum tartarat L dibasic dihydrate (11,4 g) 1 L distile su içinde çözülerek hazırlayın. PH Asetik asit ile 4.2 için ayarlamak ve 4 ° C'de tuzak arabelleği 1 mağaza
- Tuzak arabelleği 2 taze sodyum nitrit (40 mg) 1 mL distile su içinde çözülerek hazırlayın.
- (Sadece boyama önce) tuzak substrat arabellek arabellek 1 ve 150 µL arabelleğinin 2 7,5 mL karıştırılarak hazır olun. Bu çözüm (200 µL) her slayt, oda sıcaklığında 10 dakika için geçerli.
- TUZAK tepki arabellek 1.840 mL substrat arabelleği ve floresan substrat 23 µL karıştırarak hazırlayın ( Tablo reçetesigörmek).
Not: Tuzak etkinliği için floresan substrategeneratesayellowfluorescentsignal. - Fazla tuzak substrat arabellek yavaşça çözüm pipetting tarafından kaldırın.
- TUZAK tepki arabelleği UV kaynak ampul siyah ışık altında 5 min için 200 µL slaytlarla kuluçkaya.
- Slaytları üç kez 5 min için her PBS içinde yıkayın.
- Coverslips % 30 gliserol PBS içinde slaytları yerleştirin ve mikroskobik görüntüleme10gerçekleştirmek.
- Hücre çoğalması boyama gerçekleştirmek.
Not: Bu tahlil, yeni sentezlenmiş DNA'ya değiştirilmiş timidin analog 5-ethynyl-2'-deoxyuridine (EdU) kurulmuştur: sayesinde bunun bölünen hücreler floresan bir boya ile etiketlenir.- TUZAK için görüntüleme sonra coverslips kaldırmak ve slaytları PBS içinde üç kez 5 min için her yıkayın. Histolojik kesitler leke 5-ethynyl-2'-deoxyuridine Hücre proliferasyonu Seti'nden adımları.
- Bir tepki hazırlamak 430 ekleyerek kokteyl µL 1 X reaksiyon arabellek, 20 µL CuSO4, floresan boya 1.2 µL ve 1 X 50 µL arabellek katkı (500 µL toplam hacmi bir slayt için yeterli).
Not: Burada açıklanan sırayla malzemeleri ekleyerek üretici önerir. - Işıktan korunan oda sıcaklığında 30 dk için hazırlanmış kokteyller ile slaytlar kuluçkaya.
- Slaytları üç kez 5 min için her PBS içinde yıkayın.
- PBS içinde % 30 gliserol 1:1,000 DAPI ile coverslips slaytlar üzerine yerleştirin.
Not: AT-zengin bölgelerde DNA bağlar mavi bir floresan nükleer leke DAPI (4', 6-diamidino-2-phenylindole) dir.
- Toluidin Blue (TB) Boyama gerçekleştirmek.
Not: TB boyama mm, proteoglikan dağılım gösterir.- Coverslips kaldırmak için slaytlar indistilledwater yıkayın.
- Coverslips çıkardıktan sonra slaytlar tuzları PBS tamamen kaldırmak için her 5 min için üç kez distile suda yıkayın.
- TB çalışma tampon yaparak hazırlamak çözüm bir (erime 28,4 g sodyum fosfat 1 litre saf su dibasic) ve çözüm B (erime 27,6 g sodyum fosfat 1 litre saf su yem mono). Mix 94.7 mL A ile 5.3 mL lik çözüm B. 200 mL 0.1 M arabellek çalışma yapmak Dilute bu çözüm 1: distile suda 1. 8,0 pH pH düzeltilene kadar sodyum hidroksit ekleyerek düzeltmek.
- % 1'stok TB hazırlamak: TB 1 g 100 ml distile su karışımı.
- TB çalışma çözüm 40 mL % 1'stok TB 3 mL 0.1 M çalışma arabellekte karıştırarak hazırlayın.
- 14-17 s TB çalışma çözüm slaytları kuluçkaya.
Not: Bu leke çok hassas zamanı; kuluçka süresi overstaining önlemek için ayarlanması gerekebilir. - Slayt 5 min için üç kez distile suda yıkayın.
- Distile su içinde % 30 gliserol coverslips slaytlar üzerine yerleştirin. Işık mikroskobu10Imaging gerçekleştirin.
Not: slaytlar TB için lekeli gliserol + PBS coverslip etmeyin. PBS leke bu tür yıkar.
7. floresan histolojik miktar
- Histolojik miktar floresan görüntü bir görüntü analiz yazılımı kullanarak gerçekleştirmek ( Tablo reçetesigörmek).
Not: Bu yöntemde histolojik miktar temel prensibi faiz floresan piksel piksel ilgi alanının toplam sayısına göre sayısına bölün ve 100, pozitif piksel bir yüzdesi olarak sonuçlanan tarafından elde edilen sayı çarpma etmektir Bu bölge içinde. - Col10a1 ifade miktar condyles sagittal bölümlerini mm içinde gerçekleştirin.
- Hücreleri ve bu yöntemi kullanarak lekeler her türlü miktarının, sayısal için alanı seçin. Histolojik görüntüleri bir görüntü analiz yazılımı açın ve "Kement aracı (L)" (şekil 4A) kullanarak alanı seçin. Burada açıklanan analizi için mm bölge yalnızca seçin; alanı seçtikten sonra toplam piksel sayısını (şekil 4A) yazılım ekranında "Çubuk" kutusu gösterilecek. Piksel sayısı ilgi alanı kaydedin.
- Col10a1 kırmızı piksel örnekleme aracını kullanarak seçin. "Seç" tıklayın üst panel ve sonra "Renk aralığı." Tıklatın "Damlalık aracı üzerinde" seçin örnek faiz Görüntüdeki piksel için renk ve "Tamam" ı tıklayın. Tüm alanları için seçilen piksel renk olacak olumlu (şekil 4B) seçilmiş. Floresan piksel (ekran "Çubuk" kutusunda gösterilen) kopyalayabilir ve bir elektronik tablo veya çözümleme için istatistiksel yazılım yapıştırabilirsiniz.
- İlgi alanı piksel sayısı üzerinden floresan piksel sayısına bölün ve bu sayıyı 100 ile çarpmak: floresan piksel / piksel cinsinden ilgi alanı * 100.
Not: Mavi Col2a1 gibi hücrenin diğer tür ile bu aynı yöntem sayılabilir, ancak mavi piksel yerine Col10a1 kırmızı piksel seçili olmalıdır.
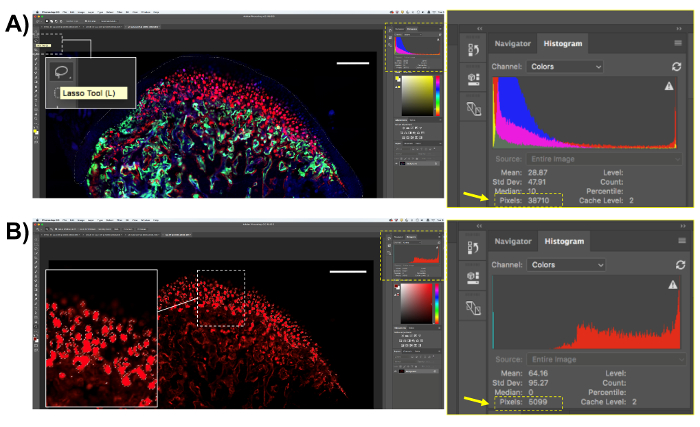
Şekil 4 . Transgene Col10a1 miktar gösterimi. (A) "Lasso Tool" (L) ile ilgi alanı seçin. Col10a1-pozitif hücreler için tüm çene kemiğinde kıkırdak seçin. "Çubuk" kutusundan piksel sayısını kaydedin. (B) faiz, bu durumda, kırmızı floresan Col10a1 piksel piksel seçin. Not yalnızca kırmızı pikselleri ilgi alanı içinde seçilecektir. "Çubuk" kutusundan kırmızı piksel sayısını kaydedin. Ölçek çubuğu 200 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
- TUZAK faaliyet miktar mm ve subchondral kemik gerçekleştirin.
- 8.2. adımda açıklanan yordamı izleyin ama sadece mm alanı seçmek yerine, kıkırdak ve subchondral kemik bölgeleri (şekil 5A) seçin.
- 8.2.2 (şekil 5B); adımda anlatıldığı gibi tuzak etkinlik analizi için ELF97 substrat tarafından oluşturulan sarı pikselleri seçme pozitif piksel sayısını kopyalayın; ve bir elektronik tablo veya çözümleme için istatistiksel yazılım yapıştırabilirsiniz.
- TUZAK-pozitif piksel yüzdesi sarı piksel piksel subchondral kemik bölgedeki toplam sayısına bölünüp 100 ile çarparak elde edilir.
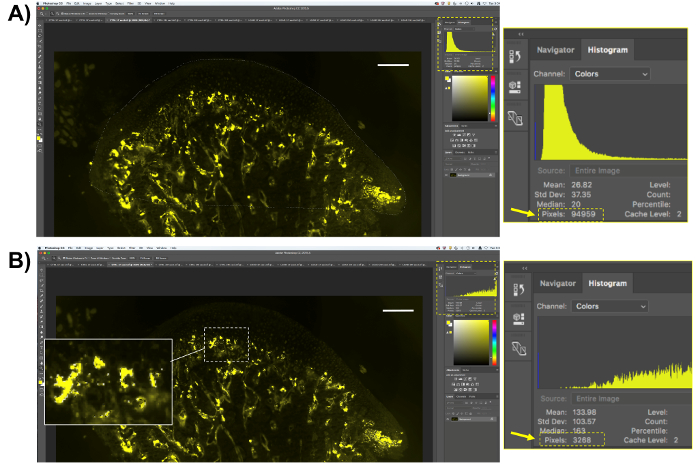
Şekil 5 . Floresan tuzak miktar gösterimi. (A) (çene kemiğinde kıkırdak ve subchondral kemik) ilgi alanı seçin ve bu bölgenin piksel sayısını kaydedin. (B) tuzak faaliyet gösteren sarı floresan pikselleri seçin. Sadece tuzak-pozitif piksel seçim olacaktır. Seçilen piksel sayısını kaydedin. Ölçek çubuğu 200 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
- EdU-pozitif hücrelerinin miktar gerçekleştirin.
- EdU-lekeli slaytlar DAPI ile counterstained, yani toplam faiz ve bölgedeki piksel sayısını sayma yerine, EdU-pozitif piksel yüzdesini hesaplamak için DAPI pozitif piksel seçin. 8.2. adımda açıklandığı gibi ilgi alanı seçin, ancak toplam piksel sayısını kaydetmeyin. 8.2.2. adımda açıklandığı gibi DAPI mavi piksel örneklenen renk seçin; kopyalama DAPI pozitif piksel (şekil 6A); ve bir elektronik tablo veya çözümleme için istatistiksel yazılım yapıştırabilirsiniz.
- Ardından, EdU-pozitif piksel (sarı floresan piksel) ve piksel sayısını "çubuk" kutusunda (şekil 6B) kaydedin.
- EdU-pozitif piksel DAPI pozitif piksel sayısına göre bölünüp 100 ile elde edilen sayıyı çarpmadan EdU piksel yüzdesini hesaplamak.
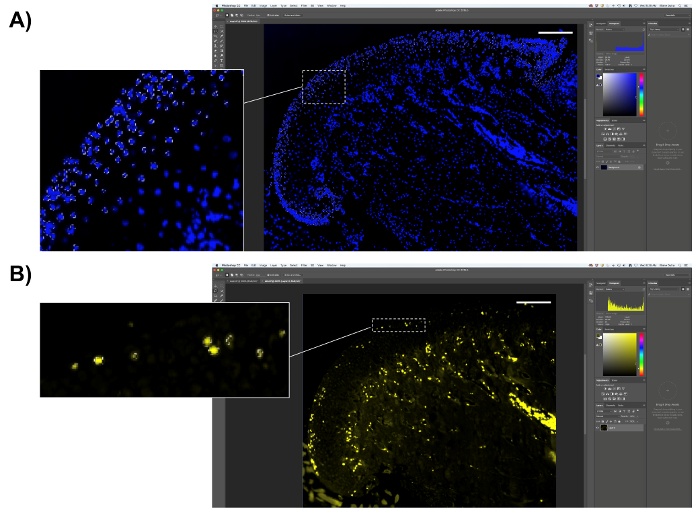
Şekil 6 . EdU miktar gösterimi. (A) mm (kıkırdak dış tabakası) proliferatif bölgeyi seçin. DAPI pozitif piksel seçin ve piksel sayısını kaydedin. (B) EdU-pozitif piksel (sarı floresan) seçin ve piksel sayısını kaydedin. Ölçek çubuğu 200 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
8. miktar kıkırdağı kalınlığı ve proteoglikan dağıtım
- Kıkırdak kalınlığı (mesafe eşleştirme) ve Digimizer görüntü yazılımı kullanarak toluidin mavi lekeli alan analiz.
Not: ölçek çubuğu histolojik görüntü birimi (Şekil 7A) belirlemek için kullanın. - Bir mesafe eşleme ölçümleri gerçekleştirmek.
Not: Kıkırdak, çene kemiğinde düzgün kalınlığı mesafe eşleme ölçümleri sağlayacaktır. Burada açıklanan yöntemde mm genel kalınlığı ortalama veren MCC beş bölge seçilir. Araştırmacı üç farklı bölge veya mm ortasında bile bir tek bölge ölçmek seçebilirsiniz.- "Uzunluk" aracını kullanarak, dış yüzeyinden kıkırdak toluidin mavi lekeli alan (Şekil 7B) beş bölge veya tercih edilen olarak birçok yerler sonuna uzunluğunu ölçmek.
- Uzunluk ölçüleri "ölçüm listesinde" kopyalama
Not: Yazılımın da ortalama ölçüleri (Şekil 7B) sağlar.
- Toluidin mavi lekeli alan ölçmek.
Not: mavi lekeli toluidin alan ölçüm mm proteoglikan alanında elde edilir.- "Alanı" aracını seçin ve toluidin mavi lekeli alan (Şekil 7C) kontur.
- Kopyalama alanı ölçümleri "ölçüm listesinde."
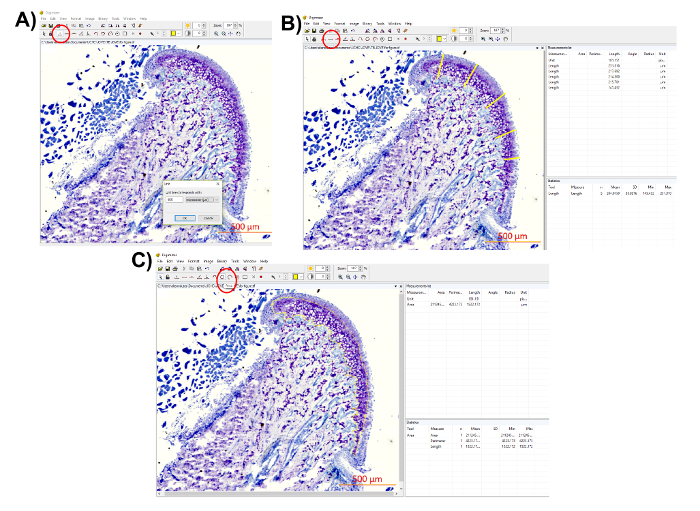
Şekil 7 : Proteoglikan dağıtım miktar gösterimi. (A) ölçek çubuğu histolojik görüntü birimi "birim" butonuna basarak belirlemek için kullanın (Seçili kırmızı, birim çember: 500 µm). (B) farklı konumlarda bulunan kıkırdak kalınlığı (kırmızı daire içinde) "uzunluk" aracını kullanarak ölçün. Ölçümleri "ölçüm listesinde" üst sağ panelde kaydedin. Ortalama ve SD ölçümlerin doğrudan elde edilebilir belgili tanımlık bilgisayar yazılımı da "istatistik" alt sağ bölmedeki sağlar. (C) tedbir toluidin mavi lekeli alan (kırmızı daire içine alınmış) "alan" aracını kullanarak. İlgi alanı daire ve ölçüm "ölçüm listesinde" Kaydet Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Tanımlayıcı istatistik xarakteristikaları ölçümleri (çene kemiğinde uzunluğu, condylar uzunluğu, condylar genişlik) ve histolojik analizler dağıtımını incelemek için yapıldı. Sonuçlar yüklü grup (Örneğin, beta titanyum bahar ile basınç yükleme tabi fareler) ve kontrol grubu (did değil almak herhangi bir yordam denetim fareler eşleşenYani ) arasında karşılaştırıldı. Ortalamaları arasındaki istatistiksel olarak anlamlı fark tespit u...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu el yazması xarakteristikaları ölçüm ve fare çene kemiğinde condyles ve sapa hücresel analizi için yöntemler açıklanmıştır. Radyografik xarakteristikaları ölçümleri de diğer küçük deneysel hayvan kemiklerinden analiz etmek için kullanılabilir. Buna ek olarak, hücresel analizi (hücre miktar ve kıkırdak mesafe eşleme) kemirgen çene kemiğinde düzgün sınırlı değildir, ama çok sayıda dokuların histolojik kesitler ölçmek için kullanılabilir.
Floresan ga...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar hiçbir rakip mali ilgi alanlarına sahip.
Teşekkürler
Yazar Dr David Rowe nazikçe transgenik fareler ve Li Chen'e histolojik yardım için sağlamak için teşekkür etmek istiyorum.
Bu yayında bildirilen Araştırma Ulusal Enstitüsü diş ve ulusal sağlık Enstitüleri Ödülü numarası K08DE025914 altında kraniyofasiyal araştırma ve Amerikan Derneği Sumit Yadav ortodontik Foundation'a tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| MX20 Radiography System | Faxitron X-Ray LLC | ||
| Digimizer Image software | MedCalc Software | ||
| Shandon Cryomatrix embedding resin | Thermo Scientific | 6769006 | |
| Manual microscope Axio Imager Z1 | Carl Zeiss | 208562 | |
| yellow fluorescent protein filter - EYFP | Chroma Technology Corp | 49003 | |
| cyan fluorescent protein filter - ECFP | Chroma Technology Corp | 49001 | |
| red fluoresecent protein filter - Cy5 | Chroma Technology Corp | 49009 | |
| sodium acetate anhydrous | Sigma-Aldrich | S2889 | |
| sodium L-tartrate dibasic dihydrate | Sigma-Aldrich | 228729 | |
| sodium nitrite | Sigma-Aldrich | 237213 | |
| ELF97 substrate | Thermo Fisher Scientific | E6600 | |
| ClickiT EdU Alexa Fluor 594 HCS kit | Life Technologies | C10339 | includes EdU (5-ethynyl-2'-deoxyuridine) |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Thermo Scientific | D1306 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S3264 | |
| Sodium phosphate monobasic | Sigma-Aldrich | 71505 | |
| Toluidine Blue O | Sigma-Aldrich | T3260 | |
| Adobe Photoshop | Adobe Systems Incorporated | ||
| Phosphate buffered saline tablets (PBS) | Research Products International | P32080-100T | |
| CNA Beta III Nickel-Free Archwire | Ortho Organizers, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. |
Referanslar
- LeResche, L. Epidemiology of Temporomandibular Disorders: Implications for the Investigation of Etiologic Factors. Crit Rev Oral Biol Med. 8 (3), 291-305 (1997).
- Chen, J., et al. Altered functional loading causes differential effects in the subchondral bone and condylar cartilage in the temporomandibular joint from young mice. Osteoarthr Cartil. 17 (3), 354-361 (2009).
- Pirttiniemi, P., Kantomaa, T., Sorsa, T. Effect of decreased loading on the metabolic activity of the mandibular condylar cartilage in the rat. Eur J Orthod. 26 (1), 1-5 (2004).
- Chavan, S. J., Bhad, W. A., Doshi, U. H. Comparison of temporomandibular joint changes in Twin Block and Bionator appliance therapy: a magnetic resonance imaging study. Prog Orthod. 15 (57), (2014).
- Dutra, E. H., et al. Cellular and Matrix Response of the Mandibular Condylar Cartilage to Botulinum Toxin. PLoS ONE. 11 (10), 0164599(2016).
- Benjamin, M., Ralphs, J. R. Biology of fibrocartilage cells. Int Rev Cytol. 233, 1-45 (2004).
- Shen, G., Darendeliler, M. A. The Adaptive Remodeling of Condylar Cartilage- A Transition from Chondrogenesis to Osteogenesis. J Dent Res. 84 (8), 691-699 (2005).
- Utreja, A., et al. Cell and matrix response of temporomandibular cartilage to mechanical loading. Osteoarthr Cartil. 24 (2), 335-344 (2016).
- Kaul, R., et al. The Effect of Altered Loading on Mandibular Condylar Cartilage. PLoS ONE. 11 (7), 0160121(2016).
- Dyment, N. A., et al. High-Throughput, Multi-Image Cryohistology of Mineralized Tissues. J Vis Exp. , e54468(2016).
- Kawamoto, T. Use of a new adhesive film for the preparation of multi-purpose fresh-frozen sections from hard tissues, whole-animals, insects and plants. Arch Histol Cytol. 66 (2), 123-143 (2003).
- Hayman, A. R. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity. 41 (3), 218-223 (2008).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır