Method Article
Comportamiento de la fase de vesículas cargadas en solución simétrica y asimétrica condiciones monitoreadas con microscopía de fluorescencia
En este artículo
Resumen
Experimentos en fase separado unilaminar gigantes vesículas (2.fino) con frecuencia descuidan las condiciones de solución fisiológica. Este trabajo presenta enfoques para estudiar el efecto de tampón de alta salinidad en separación de la fase líquido-líquido en 2.fino multicomponente cargada como una función de asimetría de membrana trans-solución y la temperatura.
Resumen
Separados por fase gigante unilaminar vesículas (2.fino) exponiendo que coexiste líquido-ordenaron y dominios trastorno del líquido son una herramienta común biofísica para investigar la hipótesis de balsa lipídica. Numerosos estudios, sin embargo, descuidan el impacto de las condiciones de solución fisiológica. Por eso, el presente trabajo presenta el efecto de la asimetría de solución tampón y trans membrana alta salinidad sobre la separación de fases líquido-líquido en 2.fino cargada de dioleylphosphatidylglycerol, huevo de esfingomielina y colesterol. Los efectos fueron estudiados bajo condiciones de temperatura isotérmica y variables.
Describimos el equipo y estrategias experimentales aplicables para el monitoreo de la estabilidad de dominios líquidas coexistentes en vesículas cargadas bajo condiciones de la solución de alta salinidad simétricos y asimétricos. Esto incluye un enfoque para preparar carga 2.fino multicomponente en buffer de alta salinidad a altas temperaturas. El protocolo implica la opción de realizar un cambio parcial de la solución externa por un paso de la simple dilución y reducir al mínimo la dilución de la vesícula. Un enfoque alternativo se presenta utilizando un dispositivo de microfluidos que permite un intercambio de solución externa completa. También se estudiaron los efectos de la solución en la separación de la fase bajo diferentes temperaturas. Con este fin, presentamos el diseño básico y la utilidad de una cámara de control de temperatura construido casa. Además, reflexionamos sobre la evaluación del estado de fase GUV, trampas asociada y cómo evitarlos.
Introducción
Desde la observación de los dominios de tamaño micrométrico en vesículas de líquido-líquido separados fase gigante unilaminar (2.fino) por microscopía de fluorescencia, 2.fino se han utilizado como sistema modelo para investigar los lípidos balsa hipótesis1,2 , 3 . Como el área de su bicapa independiente miente en la gama eso de células biológicas, son imitadores adecuados de las membranas del plasma con las balsas hipotéticas. Se han realizado numerosos estudios en tal 2.fino con vesículas dispersadas en agua pura, sacarosa o con soluciones de baja salinidad4,5,6,7,8. Estas condiciones, sin embargo, no reflejan exposición fisiológicamente relevante de biomembranas a ambientes de alta salinidad y trans membrana solución asimetría como son las condiciones para las células.
En este trabajo y en una publicación anterior de nuestro grupo9, los Estados de la fase de carga multicomponente 2.fino fueron examinados en función de la presencia de asimetría sal y solución a través de la membrana. 2.fino fueron preparado de mezclas de diferentes proporciones de dioleoylphosphatidylglycerol (DOPG), huevo esfingomielina (eSM) y colesterol (Chol) en solución de sacarosa (con osmolaridad de 210 mOsm/kg) o buffer de alta salinidad (100 mM NaCl, 10 mM Tris, pH 7,5, 210 mOsm/kg). La elección de lípidos fue justificada por los datos ya obtenidos en el diagrama de fase de esta mezcla6,8.
Un número de métodos para la preparación de 2.fino está disponible en la literatura10,11,12 (tenga en cuenta que aquí, no consideramos aquellos que impliquen transferencia de lípidos de una base de aceite a una fase acuosa 13 , 14 debido al peligro inherente de los residuos de aceite restante en la membrana que puede afectar el comportamiento de fase). La preparación de 2.fino en buffer de alta salinidad se asocia a desafíos específicos. Para las soluciones de baja fuerza iónica, el método de electroformation15,16 presenta una forma rápida de preparar a 2.fino en altos rendimientos con poco defectos10,17. El método se basa en depositar una capa de lípidos en una superficie conductora (el electrodo), secado de los mismos y les hidratante con una solución acuosa durante la aplicación de un campo AC. Sin embargo, este método requiere ajustes si la sal está presente en la solución acuosa18,19. Se supone que la fuerza impulsora para el crecimiento de la vesícula por electroformation es de electroosmosis16 que se ve dificultada en alta conductividad20. Por lo tanto, electroswelling de 2.fino en soluciones de alta salinidad no es un enfoque sencillo ya que requiere optimización para diferentes concentraciones de sal presentes en la solución de hinchazón. Gel-asistida vesícula inflamación21,22 es una alternativa potencial a electroformation con los tiempos de formación aún más rápidos. Este enfoque se basa en la hidratación de la película de lípidos mejorado cuando un gel (agarosa o alcohol de polivinilo (PVA)) se utiliza como sustrato. Estos enfoques, sin embargo, vienen con el riesgo de contaminación de la membrana en el caso basado en la agarosa hinchazón23 y temperatura límites como en el caso de la hinchazón basadas en PVA. Asimismo, un protocolo para crecer a 2.fino sobre un sustrato de papel de celulosa ha sido recientemente establecido24. Cuestiones generales de este método son la falta de control sobre la pureza del sustrato, así como el uso de grandes cantidades de lípidos. En este trabajo, vamos a introducir y presentar las ventajas del método más tradicional para la preparación de GUV, a saber, la espontánea inflamación método25,26. Consiste en una capa de lípidos en un sustrato lipophobic, hidratante en atmósfera de vapor de agua y la posterior hinchazón en la deseada solución hinchazón de secado (ver figura 1 y detalle en la sección de protocolo). Este método no ofrece control sobre la distribución de tamaño de la vesícula y resulta en general más pequeñas vesículas en comparación con los métodos donde la producción es asistida por campo eléctrico, sustrato de polímero o microfluídicos significan. Sin embargo, la calidad de la vesícula y el tamaño es apropiado para examinar el estado de fase de membrana como explorada aquí.
Creación de asimetría entre las soluciones a través de la membrana de la vesícula se asocia con ciertos retos. Un método comúnmente usado es la dilución directa de la suspensión de la vesícula en la deseada solución externa27,28. Sin embargo, esto también disminuye la densidad de la distribución de vesículas. Otra estrategia es cambiar lentamente la solución externa alrededor 2.fino colocado en la parte inferior de una celda de flujo que permite la solución dentro y saliente. Para evitar molestar o incluso perder las vesículas con el flujo, las tasas de flujo bajas son aplicada8, que representa este enfoque tiempo ineficiente. Por otra parte, ninguno de estos métodos garantiza intercambio de solución completa externa. Una solución obvia es inmovilizar las vesículas con el fin de evitar la pérdida durante un intercambio de solución externa. Por ejemplo, biotinilado 2.fino puede ser atado a una superficie recubierta estreptavidina29. Sin embargo, este enfoque puede conducir a variaciones composicionales en la adherida y por lo tanto la membrana no adherido segmentos30,31. La aplicación de magnéticos o campos eléctricos para retener resultados de vesículas en la imposición de la membrana de tensión32. Empleando pinzas ópticas para atrapar una vesícula requiere tener una manija unida (es decir, un cordón), mientras que el uso de separadores ópticos puede incluir calefacción local33. Captura de 2.fino puede lograrse también por cultivo en alambres de platino sin desprendimiento final34. Sin embargo esto produce vesículas que no son aislados y que generalmente están conectados a los cables u otras vesículas por los tubos del lípido fina (amarres).
El trabajo presentado destaca estrategias para superar las limitaciones mencionadas. En primer lugar presentamos una descripción detallada del método inflamación espontánea adaptado y optimizado para la producción de 2.fino en almacenadores intermediarios de alta salinidad. A continuación presentamos dos enfoques para crear eficientemente condiciones asimétricas solución por dilución simple o la utilización de un dispositivo de microfluidos. Porque nuestro objetivo es el análisis del membrana fase estado 2.fino en condiciones diferentes de la solución, las secciones siguientes describen criterios para el análisis estadístico exitoso y presente sugerencias para evitar falsa categorización.
Los análisis se realizaron bajo condiciones isotérmicas como en diferentes temperaturas. Mientras que la temperatura de control se emplea comúnmente, información sobre cámaras de control de la temperatura experimental es raramente descrita. Aquí, se presenta una configuración construida casa observar 2.fino en diferentes condiciones de temperatura.
Protocolo
1. inflamación espontánea de 2.fino
Nota: cloroformo es una sustancia nociva, que es altamente volátil. Realizar todas las operaciones que implican cloroformo bajo una campana de humos. No utilice plástico para laboratorio tales como pipetas o envases de plástico para la transferencia o almacenamiento de soluciones de cloroformo. Cloroformo disuelve el plástico, que contamina la solución. Usar jeringas de vidrio y envases de vidrio en su lugar. Por otra parte, trabajar lo más limpio posible para evitar la introducción de impurezas como pueden interactuar con las membranas. Tenga en cuenta que las concentraciones de lípidos típica en los preparativos finales de GUV están en el rango micromolar, así impurezas en ese rango de concentración pueden tener un efecto fuerte sobre el comportamiento de la membrana.
- Aparte el equipamiento básico, tienen los siguientes elementos listos.
- Prepare un polytetrafluorethylene (PTFE, comúnmente conocido como teflón) placa para la deposición de lípidos de tamaño ~1.5 cm x 1,5 cm y espesor apropiado. Ponga áspera la placa en un lado con papel de lija fino.
Nota: PTFE es lipophobic y no ser mojado por soluciones de cloroformo si suave. Ambos lados de la placa PTFE pueden ser rugosa para evitar confusiones sobre el lado correcto para la deposición de lípidos. El grueso de la placa debe ser elegido para el fácil manejo, por ejemplo, que no es muy flexible y puede ser fácilmente cubierto por la solución de hidratación (ver figura 1). Aquí utilizamos placas de ~ 2 mm de espesor. Una vez rugosa, la placa PTFE se puede reutilizar para nuevas experiencias después de la limpieza apropiada (paso 1.3). - Preparar un frasco de vidrio sellable de volumen adecuado (~ 15 mL) para el crecimiento de hidratación y vesículas de lípidos final película.
- Preparar un recipiente de vidrio herméticos en el cual se ajusta el frasco de cristal ~ 15 mL; se utilizará para crear un ambiente saturado de agua para la hinchazón de lípidos película, vea la figura 1.
- Prepare un polytetrafluorethylene (PTFE, comúnmente conocido como teflón) placa para la deposición de lípidos de tamaño ~1.5 cm x 1,5 cm y espesor apropiado. Ponga áspera la placa en un lado con papel de lija fino.
- Preparar 4 mM las reservas de lípidos en la proporción deseada de 1, 2 - dioleoyl - sn - glycero - 3 - fosfo-(1 ' - rac - glicerol) (sal sódica) (DOPG), huevo (eSM) de esfingomielina y colesterol (Chol), con adicional 0,1 mol % 1,1 ′ - dioctadecyl - 3 , 3, 3 ′, 3 ′-tetramethylindocarbocyanine perclorato (DiIC 18) a una concentración total de lípidos de 4 mM. Usar cloroformo como solvente. Consulte la tabla de materiales.
- Enjuagar la placa PTFE y el envase de cristal con detergente comercial, etanol y cloroformo en ese orden y finalmente secarlos.
- Utilizando una jeringa de vidrio, depósito y distribuida uniformemente 10-15 μl de material lipídico en la parte rugosa de la placa PTFE para crear una película uniforme de lípidos. Utilice la aguja de la jeringa para distribuir la solución si es necesario.
- Coloque la placa PTFE sobre una superficie limpia y secar junto con la película de lípidos depositados por 2 h a 60 ° C para eliminar el cloroformo. Por conveniencia, depositar la placa en el recipiente de vidrio limpio y sin sellar 15 mL durante la desecación.
Nota: La temperatura alta asegura que la película de lípidos está en un estado solo líquido homogéneo en esta y en todas las medidas subsecuentes. - Después de la desecación, llene el recipiente de vidrio previamente hinchazón con agua desionizada hasta un nivel que no permite la flotabilidad al caer el frasco de cristal ~ 15 mL (~ 1 cm), vea la figura 1.
- Puso el vidrio ~ 15 mL frasco con la placa de PTFE en el recipiente y cubrirlo para que pueda surgir una atmósfera saturada de agua, ver figura 1B.
Nota: El agua condensada en las paredes del envase interno da una buena indicación de saturación de vapor de agua éxito. - Deje la película de lípidos depositados previamente se hinchan dentro del envase de vidrio a 60 ° C durante 4 horas. Dentro de este período de tiempo preparar la solución deseada hinchazón.
Nota: Para preparaciones de vesícula que pueden llevarse a cabo a temperatura más baja, este tiempo puede ser extremadamente acortado - hasta unos pocos minutos - si caliente saturada de agua nitrógeno o argón se utiliza para la inflamación de la en su lugar.- Prepare 200 mM sacarosa o 100 mM NaCl, 10 mM Tris, pH 7,5 ajustado con HCl y calor a 60 ° C para hacer la solución hinchazón.
- Después de la inflamación previa, tomar el vaso de ~ 15 mL con la placa de PTFE fuera del contenedor. Con una jeringa conectada a un filtro de 0.45 μm, añadir ~ 5 mL de la solución de hinchazón en el frasco de vidrio de 15 mL para hidratar la película lipídica.
Nota: Fijar una aguja al filtro facilita la inserción de la solución de hinchazón. Precalentamiento de la jeringa y el filtro puede ser recomendable para garantizar un estado de fase de líquido solo de la película de lípidos añadiendo la solución hinchazón. Filtrado de la solución reduce al mínimo (en-) orgánica contaminación de bacterias o precipitado sal etc. - sellar el frasco de cristal ~ 15 mL sostiene la película de hidratada del lípido en la placa de PTFE para minimizar la evaporación. Si es necesario, utilizar película de parafina para mejorar el sellado. Espere la película lipídica hidratado a 60 º C durante la noche final GUV hinchazón.
2. Cosecha 2.fino
Nota: la agregación de 2.fino hinchado y separado de los resultados de sustrato PTFE en un bosquecillo de nube como de pequeño (~ 1 mm) visible por el ojo. Aparece blanquecina cuando no se utiliza ningún colorante de fluorescencia. De lo contrario, es de color según el espectro de absorción del fluoróforo. La adición de DiIC 18 rinde la nube color de rosa (ver figura 2). Las vesículas se concentran en conjunto y lo cosecha maximiza el rendimiento de la vesícula.
~1/10- fresco abajo las vesículas a la temperatura ambiente dentro de ~ 1 h. Corte el extremo puntiagudo de una pipeta plástica del pistón para el cluster o el agregado de vesículas para caber a través del orificio.
Nota: La velocidad de enfriamiento es particularmente importante si la separación de fases sólido-líquido se espera ya que altera el tamaño de los dominios sólidos. Aquí, para reducir la velocidad de enfriamiento, colocamos la muestra en contacto con un bloque de metal de tamaño 5 cm x 9,5 cm x 7.5 cm (H x L x W) que enfríe a temperatura ambiente en 1 h. - Pipeta hasta el cluster junto con un volumen adecuado de solución de la hinchazón (ver figura 2). Resuspenda el agregado en la solución hinchazón para crear las condiciones de solución simétrica o deseados solución iso-osmótica para crear condiciones asimétricas solución.
Nota: El límite inferior del volumen está limitado por el tamaño del agregado para ser cosechadas completamente. Se diluye la solución externa y para evaluar la concentración exacta, el volumen de la solución de la vesícula tiene que ser tomado en cuenta.
3. Observación de 2.fino para fase estatal evaluación utilizando microscopía de fluorescencia
Nota: el 2.fino fueron dopado con DiIC 18 como un marcador fluorescente. Este fluoróforo se reparte preferentemente en la fase líquida desordenada de (Ld). Esto permite la observación de la microscopia de fluorescencia de dominios resultantes de la separación de fase en el 2.fino. Se realizó evaluación de estado de fase con microscopía de epifluorescencia. En principio, estas observaciones son también factibles mediante láser confocal de barrido microscopía (CLSM), que también permite la cuantificación de la señal (por ejemplo, para determinar unilamellarity de membrana). Sin embargo, CLSM requiere equipos más sofisticados y (generalmente) observaciones de epi-fluorescencia antes de la exploración son útiles en cualquier caso.
- Decidir un objetivo (por ejemplo 40 X aumentos con una apertura numérica de 0,6 (NA) como usado aquí) para observar la 2.fino y usarlo constantemente al comparar Estados de fase de la misma composición en diferentes solutionúmeros condiciones. Usar filtros adecuados de longitud de onda de excitación y emisión para permitir observaciones de la fluorescencia con el fluoróforo utilizado (por ejemplo excitación en 560 ± 40 nm y 630 ± 75 nm con un divisor de viga nm 585 entre utilizado para DiIC 18).
Nota: Límites de estado la fase dentro de un diagrama de fase dependerá de la resolución que el objetivo se logra ya que define el tamaño mínimo de micro dominios para ser detectado. - Para el análisis, sólo seleccione 2.fino que satisfacen los siguientes criterios de calidad.
- Velar unilamellarity de la membrana GUV por observación visual de diferentes vesículas y comparar sus intensidades; las vesículas con la menor intensidad de emisión de fluorescencia son más probables propiedades.
Nota: Inflamación espontánea puede producir lotes de vesícula donde una gran parte de las vesículas gigantes no son propiedades. - Realizar una comprobación adicional mediante la cuantificación de la intensidad de emisión de fluorescencia de supuestamente unilaminar vesículas gigantes y Compruebe la señal correspondiente para la dispersión de la población. Si no entero entre diferentes 2.fino se observaron diferencias, todos ellos suelen ser propiedades.
Nota: Si las vesículas están preparadas de lípidos convencionales utilizando un método establecido como inflamación espontánea, el enfoque descrito anteriormente para la detección de las vesículas de propiedades es suficiente. Si establecer un nuevo protocolo de preparación de GUV o usar lípidos no convencionales, estudios más detallados deberán confirmar unilamellarity. Por ejemplo, las señales de fluorescencia de membrana de las vesículas con preparado por un nuevo protocolo podrían compararse a los de 2.fino preparado por un método establecido; o el poro de la membrana proteína α-hemolisina puede insertarse en las membranas de vesículas 24. Colorante añadido a la parte exterior de las vesículas luego entraría su interior o no, dependiendo de la presencia de uni - o vesículas multilamellar, respectivamente. - Asegurarse de que el GUV tiene un diámetro mínimo razonable para los dominios que aún reconocibles.
- Asegurarse de que el GUV no tiene (casi) defectos como partes salientes o adheridas o estructuras internas.
- Velar unilamellarity de la membrana GUV por observación visual de diferentes vesículas y comparar sus intensidades; las vesículas con la menor intensidad de emisión de fluorescencia son más probables propiedades.
- Transferir una alícuota de la suspensión GUV en un portaobjetos de microscopio y sellar correctamente. Preparar una cámara de observación.
- Depositar la muestra en el portaobjetos. Lo rodean por un separador de silicona con un hueco circular central. Para evitar contaminación, asegúrese de que el espaciador no queda en contacto con la muestra. Sello interior colocando un cubreobjetos sobre el separador de silicona.
Nota: En lugar de la silicona espaciador se puede utilizar grasa de silicona o los espaciadores caseros polydimethysiloxane (PDMS). La cámara de sellado asegura la mínima evaporación de la muestra y mantiene las condiciones iso-osmolar. - Dejo la muestra ~ 5 minutos para volver a equilibrar posibles dominios.
Nota: La tensión mecánica de pipeteo puede mezclar los dominios de membrana, que necesitan tiempo para reforma. - Coloque el portaobjetos con la muestra sobre la platina del microscopio y analiza el estado de fase del lote GUV en un enfoque estadístico. Observar más de 30 2.fino por lote y determinar su estado de fase según los siguientes criterios para la evaluación de estado de fase GUV con DiIC 18 ( figura 3).
Nota: Después de su crecimiento, las vesículas pueden cambiar sus composiciones individuales debido a (por ejemplo) dominio budding off o intercambio de material de la membrana a través de nanotubos. 2.fino exhibe por lo tanto las variaciones composicionales dentro del mismo lote 35.- Solo líquido fase siendo ya sea líquido ordenada (Lo) o líquido-desordenada (Ld): Asegúrese de que la forma general de GUV es esférico y liso y DiIC 18 se distribuye homogéneamente en la membrana (en primer lugar imágenes en los paneles superior e inferior en < fuerte clase = "xfig" > Figura 3).
- Estado de coexistencia de dos fases Lo + Ld: asegurar que las vesículas exhiben dominios que parecen circulares con límites suaves; según el DiIC 18 repartir comportamiento dominios son (Ld) color rojo brillante o rojo oscuro/negro (Lo) (segundo imágenes en la parte superior y paneles inferiores en la figura 3, en falso color). Compruebe que los dominios son libres de difundir en la superficie de la vesícula y pueden fusionarse.
- Dos fases sólido (S) + estado de coexistencia líquido (S + Lo o S + Ld): asegurarse de que los dominios pueden aparecer digitiformes o roundish pero con límites angulares (tercera imágenes en los paneles superior e inferior en la figura 3). Observar líquidos dominios (rojo) sobre un fondo sólido (negro) que no mostrará la difusión. Al contrario, dominios de sólido (negro) será libres de difuso sobre un fondo líquido (rojo).
- Coexistencia de tres fases S + Lo + Ld: observar tres tipos de dominios que aparecen: dominios negro (i) angulares (S), incrustado en el dim (ii) (Lo) y (iii) brillante (Ld) dominios rojo.
- Dad de la población de 2.fino al estado de fase que se ha determinado que ser dominante entre una muestra aleatoria, como en los ejemplos siguientes:
- 20 si se observa 2.fino solo líquido y 15 Lo + Ld 2.fino, considerar el lote a ser un solo líquido fase.
- Se observan si 10 S + L 2.fino, 30 2.fino Lo + Ld y 25 solo líquido 2.fino, considerar el lote que un Lo + LD
4. Observación de GUV en dispositivo microfluídico
Nota: fabricar en primer lugar el dispositivo microfluídico, detalles del diseño del dispositivo de microfluidos y montaje se han dado en otros lugares 36 , 37; Vea la figura 4 para una breve descripción.
- Preparar fresco GUV hinchazón solución (sal o sacarosa según paso 1.8.1) y filtrar con un filtro de 0.45 μm.
Nota: Las impurezas en las soluciones que pueden obstruir el dispositivo microfluídico. - Pistón de corte 200 μL pipeta plástico consejos y colóquelos en los orificios de la parte PDMS del dispositivo. Añadir 100 μl y 5 μl de la fresca y filtrada hinchazón solución al depósito (ver figura 5A) y cada uno de lo corte pipeta extremidades, respectivamente. Centrifugue el dispositivo entero a 900 x g por 10 min en una centrífuga de rotor swing para llenar el dispositivo y eliminar aire.
- Llenar la jeringa de vidrio de 1 mL y une el tubo con la solución de hinchazón y mover el émbolo a 0 mL.
- Coloque la tubería en la salida de fluídica del dispositivo y coloque la jeringa en la bomba de la jeringuilla.
Nota: La opción de jeringa bomba marca y jeringa no es importante. Sin embargo, las jeringas de vidrio son más precisas y la bomba debe ser capaz de operar en el rango de flujo μl/min. - Conecte una unidad de control de la presión medida en las 8 entradas del control microfluídicos capas (ver figura 5A). Ajuste la presión a la unidad de control de presión a 3 bar (aire, nitrógeno o argón), pero ponga las válvulas en el dispositivo de microfluidos para la posición de cerrado.
- Coloque el dispositivo de microfluidos, ahora conectado a la jeringa bomba y presión central, en un escenario de microscopio confocal invertido.
- Uso un objetivo con el mismo aumento y NA como durante las observaciones a granel. Controlar si las estadísticas de estado de fase como se explica en el paso 3.7 siguen siendo los mismos si se utiliza otro objetivo para evitar artefactos de observación que se basan en resoluciones diferentes.
- La 2.fino la carga en el dispositivo de.
- Primera, pipeta lejos todo pero 25 a 50 μl de la solución que ha permanecido en el depósito. Añadir 150 μL de la solución GUV (en sacarosa o sal según paso 1.8.1, pero que la solución usada para llenar el dispositivo en el paso 4.1) para el depósito y mezclar mediante pipeteo suave. Ajuste la jeringa de 10 μl/min caudal en retirar modo por aproximadamente 20 min o hasta más de 90% de las trampas están ocupado.
Nota: El depósito no se debe funcionar en seco. Si esto sucede, las burbujas de aire entrará en los canales de micro. Añadir más solución GUV para el depósitor durante la carga pero tenga cuidado de no para introducir burbujas de aire cuando el pipeteo en el dispositivo de.
- Primera, pipeta lejos todo pero 25 a 50 μl de la solución que ha permanecido en el depósito. Añadir 150 μL de la solución GUV (en sacarosa o sal según paso 1.8.1, pero que la solución usada para llenar el dispositivo en el paso 4.1) para el depósito y mezclar mediante pipeteo suave. Ajuste la jeringa de 10 μl/min caudal en retirar modo por aproximadamente 20 min o hasta más de 90% de las trampas están ocupado.
- Abra todas las válvulas de unidad de control de presión para cerrar las válvulas de anillo microfluídicos en trampas/2.fino. Ajustar la bomba de jeringa de 0 μL/min. Después de 1 h, observar la 2.fino y grabar imágenes confocales. Excitar y detectar a 2.fino según el fluoróforo utilizado (por ejemplo excitación en 561 nm y detección entre 580-620 nm como DiIC 18). Utilizar los mismos criterios de selección del paso 3.6 , y tenga cuidado de marcar la ubicación de cada GUV (es decir, la columna y fila del número, vea la figura 4)
- intercambiar la solución que rodea el 2.fino .
- Ajustar la bomba de jeringa de 0 μL/min y pipetear a todos pero 25 a 50 μl de la solución GUV del depósito. Añadir 150 μL de la solución 2 (en sacarosa o sal según paso 1.8.1, dependiendo de la solución deseada fuera la 2.fino) al depósito y mezclar mediante pipeteo suave. Pipetear a todos pero 25 a 50 μl de la solución tampón de la reserva.
Nota: Esta solución debe ser filtrada con un filtro de 0.45 μm también.
- Ajustar la bomba de jeringa de 0 μL/min y pipetear a todos pero 25 a 50 μl de la solución GUV del depósito. Añadir 150 μL de la solución 2 (en sacarosa o sal según paso 1.8.1, dependiendo de la solución deseada fuera la 2.fino) al depósito y mezclar mediante pipeteo suave. Pipetear a todos pero 25 a 50 μl de la solución tampón de la reserva.
- Repita el paso anterior al menos 5 veces a sustituir completamente la solución en el depósito. Establecer la jeringa de 10 μl/min caudal en retirar modo ~ 10 min sustituir la solución en los canales de micro.
- Reducir el caudal a 1 μl/min abre las 8 presión unidad válvulas de control para 2 s y cerrar otra vez (resultando en apertura y cierre de las válvulas del anillo de microfluídica). Fijar el caudal de 0 μL/min otra vez.
- Después de 1 h, observar la 2.fino y grabar imágenes confocales. Otra vez, tenga cuidado de observar la columna y fila de la micro cámara donde se encuentra para permitir comparaciones de GUV mismo antes y después del cambio de buffer externo cada GUV.
5. Diseño y calibración de la cámara de control de la temperatura
Nota: un compartimiento conveniente para el control de la temperatura puede ser obtenido comercialmente o casa construida. Control de temperatura se logra mediante acoplamiento térmico de la cámara con la muestra GUV a un baño de agua o un elemento Peltier. Aquí, describimos el diseño y la caracterización de una cámara de fabricación casera-control de la temperatura con un termostato externo de agua. Estos termostatos están disponibles en muchos laboratorios o se puede salvar de un equipo viejo como láseres o espectrómetros.
- Montar una cámara de flujo de calor, aquí, hechas de un bloque de aluminio, con conectores para un baño de agua como se muestra en la figura 6. Sellar las aberturas en la parte superior e inferior y permiten una observación de campo claro de la muestra al pegar vidrios de cubierta en el bloque.
- Tirón de la cámara de flujo en el lado donde la muestra se colocará y pipeta una gota de cerca de 100 μl de la solución usada en experimentos según paso 1.8.1. Opcionalmente, introduzca una sonda de temperatura óptica de fibra (e.g. FISO FTI-10) o añadir un tinte sensible a la temperatura en una concentración adecuada, por ejemplo, 500 μm rodamina B.
- Montar la cámara de observación de GUV con grasa de silicona en forma de anillo o algún otro separador (PTFE o caucho) y sellar con un vidrio de cubierta de 0,17 μm. Asegúrese de que la caída no está en contacto con el agente de sellado o el espaciador para evitar la introducción de impurezas.
- Lentamente invierta el montaje y conexión del termostato externo de agua con tubería apropiada a ella. Preste especial atención a cualquier fuga de agua.
- La más baja temperatura en el termostato de agua deseada y deje que el sistema se equilibre hasta que la lectura del sensor de temperatura es estable, el tiempo necesario para equilibrar le dará una estimación del tiempo de respuesta mínima del sistema.
- Realizar experimentos de control al menos una vez antes de comenzar a utilizar la cámara de.
- Medir la temperatura de la solución (por ejemplo, con una sonda de fibra de vidrio) y se compara con la lectura del termostato en el rango de temperatura de interés.
- Busque un mínimo desplazamiento de la lectura del termostato y la linealidad de las temperaturas medidas.
- Busque un gradiente de temperatura dentro de la cámara de observación usando un colorante sensible de la temperatura. Medir la temperatura de la solución mediante la intensidad de fluorescencia o por vida de la fluorescencia microscopía (FLIM) para diferentes distancias de la parte inferior cubierta slip 40 la proyección de imagen. Comprobar además si hay cualquier gradiente de la temperatura en la región de GUV observación, como se muestra en la figura 7.
6. GUV observaciones a diferentes temperaturas
Nota: por lo general, para 2.fino cuyas membranas potencialmente fase separada y que parece ser homogéneo en temperatura T de observación obs, separación de fases inducida por debajo de T obs (si se observa depende de la gama de temperaturas investigada). Viceversa, fase separada vesículas deben ser homogéneas a una temperatura superior a T obs. Sin embargo, esto no necesita ser el caso de una composición de lípidos (complejo) particular y que puede ser interesante siempre analizar la temperatura todo accesible gama 38. El protocolo de observación y evaluación de las temperaturas de transición de fase no se basa en el método específico utilizado para controlar la temperatura.
- Montar la cámara de observación de la temperatura según la sección 5, omitiendo la sonda de temperatura óptica de fibra o el fluoróforo sensible a la temperatura.
- Ajuste el baño María de agua a temperatura ambiente (23 ° C) y deje que el sistema se equilibre durante 10-15 min.
- Cuenta el número de vesículas de fase separada utilizando los criterios del paso 3.6; la fase general de estado de la población de GUV dará una pista sobre la región de la temperatura de transición del sistema. Si el estado de fase entre la población de vesícula es bastante heterogéneo vaya directamente al paso 6.5.
- Aumentar (si la mayoría de vesículas separadas por fase) o disminuir (si la mayoría de las vesículas es homogénea) la temperatura en intervalos de gruesos (por ejemplo, 1-2 ° C) y deje que el sistema se equilibren por unos 2 minutos volver a evaluar el estado de la fase de la población de GUV por medio de al azar muestra y variar la temperatura hasta que la población de vesícula muestra un estado de fase heterogénea.
- Una vez que la población está cerca del punto de transición de fase (es decir, la fase Estados entre 2.fino individual son más bien heterogéneos), disminuir el intervalo de temperatura (por ejemplo, 0,5 ° C) para aumentar la resolución. Deje que el sistema equilibre durante 2 min y volver a evaluar el estado de la fase de la población de GUV mediante una muestra aleatoria.
- Una vez que se pasa el punto de transición de fase, mantener variando la temperatura hasta que todos 2.fino ahora homogénea o separados por fase, respectivamente.
- Busque histéresis evaluar si los tiempos de equilibrio son suficientes.
Exploración
- cambiar la dirección de la temperatura, i.e. si el análisis se realizó para aumentar la temperatura, hacer la exploración por la disminución de la temperatura.
- Elegir al menos un subconjunto de temperaturas para determinar la razón de estado de fase GUV población (por ejemplo 80% separados por fase).
- Si las desviaciones substanciales entre ambas direcciones de la relación de estado de fase indican histéresis, reducir el tamaño de paso de la temperatura o aumentar el tiempo de equilibrado en los pasos 6.4 y 6.5.
- Si no hay ninguna histéresis indicado por iguales razones, considere aumentar el tiempo de tamaño o equilibrado paso.
- Trama de las relaciones de estado de fase contra la temperatura. Para la cuantificación, ajustar los datos a un modelo apropiado ( figura 8).
Nota: Las curvas de transición de fase comúnmente cuentan con una trayectoria sigmoidal y el modelo sigmoidal de Boltzmann proporciona un conjunto de parámetros de montaje:
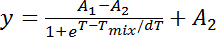
y: fracción de uniforme/fase-separated 2.fino
1: el valor de la fracción inicial
2: el valor fracción final
T: temperatura
T de la mezcla: temperatura media máxima y
Como y es la fracción de 2.fino homogénea, A 1 y A 2 deben fijarse a 0 y 1, respectivamente. Como la miscibilidad transición supone ser sigmoidales, una vez que el valor de la fracción se mide para ser 0 a una cierta temperatura que todos los valores de fracción de la gama de temperaturas abajo se consideran 0. Viceversa, una vez que el valor de la fracción es 1 a una temperatura particular, todos los valores de fracción de la temperatura anterior se supone que son 1.
Resultados
GUV hinchazón
Con el enfoque inflamación espontáneo que se describe aquí, 2.fino compuesto por DOPG, eSM, y Chol fueron cultivadas durante la noche en 210 mM sacarosa o 100 mM NaCl, 10 mM Tris, pH 7,5, formando un agregado visible. Cosecha el agregado asegura vesícula altos rendimientos. La resuspensión de la hinchazón solución daba como resultado condiciones de solución simétrica trans-membrana. Para crear condiciones asimétricas, el agregado se resuspendió en una solución alta salinidad o iso-osmolar sacarosa respectivamente (figura 2). La dilución resultante corresponde a un intercambio de solución externa casi al tiempo que minimiza la dilución del número de 2.fino.
Trazado de diagrama de fase de 2.fino utilizando microscopía de fluorescencia
La presencia de 0,1 mol % de la fase específica DiIC18 la 2.fino permitió la observación de sus Estados de fase mediante microscopía de fluorescencia de campo amplio. Las vesículas que la separación de la fase S + L se observaron a través de una x 63 / 1.2NA para poder resolver finamente estructurado dedo-como dominios. Para todos los restantes casos, un 40 x / 0.6 objetivo NA fue utilizado. Para evitar artefactos durante la inspección visual de 2.fino y maximizar la reproducibilidad, ciertos criterios se establecieron que determinó que las vesículas a considerar para el análisis de estado de fase (paso de protocolo 3.6).
2.fino preparado de mezclas ternarias de DOPG/eSM/Chol de una amplia gama de cocientes hinchado en sacarosa o solución de alta salinidad y observado a temperatura ambiente exhibió homogénea Lo o fases de Ld, Lo + Ld y S + L de separación de fases, consulte la figura 3. Figura 9 muestra las vesículas exemplarily defectuosas, que no deben incluirse en el análisis de datos y también enseña a identificar las vesículas multilamellar.
Debido a su desconocida historia, 2.fino suelen exhibir de variación composicional dentro de lote35. Por lo tanto, el estado general de la fase de una composición particular se determinó en un enfoque estadístico. GUV poblaciones de una cierta composición de lípidos fueron adscritos al estado de fase que fue observado para ser dominante en una muestra aleatoria (paso de protocolo 3.6). Sin embargo, composiciones cerca de la región de coexistencia de Lo + Ld habían rendido a menudo lotes donde el estado dominante de la fase formado por una estrecha mayoría. Para tales casos vagas, se repitió la inspección visual con por lo menos tres muestras independientes. La fracción de vesículas con estado de fase idénticos (e.g. separación expositora fase Lo + Ld) presente en las muestras al azar fue promediada sobre el número de ensayos que fue tomado como el resultado final (figura 10).
Los protocolos descritos resultaron en un crecimiento suficiente a GUV sobre una amplia gama de diferentes proporciones de DOPG, eSM y Chol en soluciones de alta salinidad y sacarosa. Extensas regiones en el diagrama de fases ternario podrían asignarse bajo condiciones de la solución de alta salinidad tanto simétrica como asimétrica (figura 11). Las diferencias en el comportamiento de fase de vesícula observado bajo condiciones diferentes de solución fueron discutidas en otros lugares en detalle9.
Observaciones de comportamiento de fase después de intercambio de memoria intermedia completa utilizando el método de microfluidos
La creación de las condiciones de solución asimétrica por dilución resulta en residuos de la solución hinchazón fuera. Nuestro enfoque de microfluidos permite un intercambio de solución externa completa. Figura 5A muestra el dispositivo de microfluidos completamente montado en la platina del microscopio confocal junto con toma de corriente fluídica y entradas de control de presión. Los tubos se conectan mediante tubos de metal de 90 ° para permitir espacio para transmitir imágenes luz desde arriba.
Para la observación dentro del dispositivo de microfluidos, un microscopio confocal con 63 x / 1.2NA objetivo de inmersión de agua fue implementado. Como con las observaciones anteriores a granel, DiIC18 fue utilizado para teñir la membrana. Al hacer observaciones de la fase estatal de 2.fino atrapado en el dispositivo, debe tener cuidado no malinterpretar los datos. Debido a la proximidad de la 2.fino a los postes, los caminos de la luz de excitación y emisión pueden estar bloqueados parcialmente por el PDMS conduce a la falsa apariencia de dominios (figura 12). Aquí, la detección de luz transmitida es útil para verificar la posición de la 2.fino en los puestos. Este efecto indeseado es particularmente prominente para 2.fino pequeñas de menos de 10 μm de diámetro. En estos casos, los datos fueron rechazados. La imagen confocal en la Figura 13A muestra una sección de vesículas planas que cruza un dominio de Lo presente en la vesícula GUV. En este caso, sección planar exploraciones aún más por encima o debajo de la sección no habría demostraron el dominio debido a su pequeño tamaño comparado con el de GUV, por qué habría sido perdido y la vesícula considera que en un estado de fase homogénea. Por lo tanto, debe utilizarse una z-pila confocal para inspeccionar toda la superficie GUV. Para microscopía de amplio campo, no puede ser un problema porque la vesícula entera puede ser reflejada a la vez.
Por último, se dan ejemplos de 2.fino antes y después del intercambio de la solución externa donde es evidente que la fase de los Estados de las membranas son (figura 14). Cada dispositivo tiene 60 cámaras (cada uno con un par de posts para atrapar una sola GUV), permitiendo que decenas de experimentos por dispositivo (ver figura 4). Sin embargo, algunos 2.fino puede perderse durante el intercambio de la solución externa. Esto puede ser minimizado por los siguientes pasos: 1) con capa de albúmina de suero bovino (BSA) para evitar la adherencia GUV, ruptura en los puestos; revestimiento se realiza exponiendo las paredes de la cámara a 20 mg/mL BSA durante 60 minutos y enjuague posterior con el tampón de trabajo. Otra molécula adhesiva que es poly(L-lysine)-injerto-poly(ethylene glycol)39. 2) cuidado de emparejar osmótica de las soluciones internas y externas para evitar a 2.fino flácida, lo que podría pasar a través del centro de los postes o el estallido de 2.fino. 3) optimizar el procedimiento de preparación de GUV para obtener vesículas mayores de 8 μm de diámetro para evitar el paso por el centro de los postes.
Diseño y caracterización de cámara de temperatura controlada para la observación de GUV Estados de fase
Hemos diseñado una cámara de flujo simple, que cuenta con las conexiones al termostato externo de agua (figura 6). Se obtuvieron loscámara de fresado de un bloque de aluminio. En general, el material de cámara no necesita ser calor conductivo, como la muestra se acopla a la bañera de agua por el vidrio de cubierta inferior como se muestra en la Figura 6B y 6C.
Independientemente del diseño exacto, debe evaluarse el desempeño de la cámara. Específicamente se comprobó la linealidad de la temperatura de la muestra con la temperatura exterior-set, cualquier desplazamiento sistemático de la temperatura y un gradiente de temperatura dentro de la cámara. Los dos primeros puntos fueron abordados por la medida directa de temperatura dentro de la cámara por una sonda de temperatura óptica de fibra (e.g. FISO FTI-10). También se comprobó para un gradiente de temperatura dentro de la suspensión GUV. Tal gradiente puede provienen de flujo de calor hacia el exterior de la cámara. Medidas de la temperatura espacial resuelto puede obtenerse un fluoróforo sensible de temperatura40, véase la figura 7.
Ploteo de datos y colocación para obtener Tmezcla de fase separada 2.fino
Trazar la fracción de 2.fino homogénea sobre el rango de temperatura observado dio lugar a una trayectoria de punto de datos en forma sigmoidally. Ajustar los datos al modelo de Boltzmann (protocolo sección 6.8) de que la Tde la mezcla podría ser deducida ()figura 8).
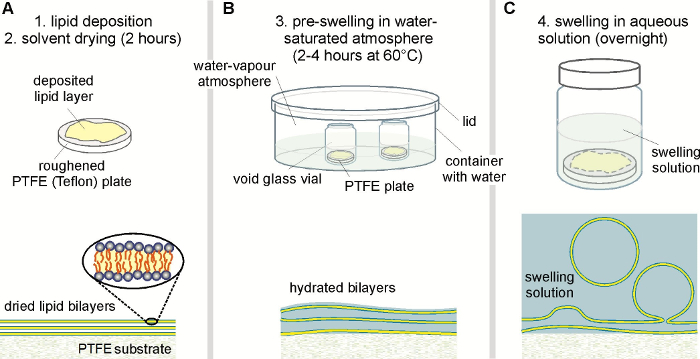
Figura 1: pasos experimentales durante el protocolo inflamación espontáneo (panel superior) con la correspondiente etapa de crecimiento de la vesícula (panel inferior). (A) A lipídica homogénea película es extendido sobre una placa de PTFE rugosa y seca de cualquier solvente. Película (B) el lípido seco entonces es previamente hinchada en un ambiente saturado de agua en un recipiente cerrado con agua para facilitar la hidratación de la bicapa. El frasco de cristal vacío contiene la placa PTFE y permanece abierto durante este paso de hidratación. Película (C) lípidos previamente hinchado finalmente se convierte en totalmente hidratada por la adición de la solución deseada de la inflamación en la placa PTFE recubiertos de lípidos dentro del frasco de vidrio. Para evitar la evaporación, el frasco de vidrio se sella correctamente durante la incubación durante la noche. Para minimizar las variaciones composicionales dentro de un lote, todas las medidas deben realizarse a una temperatura donde la mezcla de lípidos es totalmente miscible. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: GUV cosecha. (A) A depositar la película lípidos consisten en DOPG/eSM/Chol en relaciones molares de 20/60/20 con 0.1 mol % DiIC18 hinchada en buffer de alta salinidad compuesto por 100 mM NaCl, 10 mM Tris, pH 7,5. Además fue sellada la tapa del envase de vidrio con película de parafina. La región ampliada de interés contiene el agregado GUV resultante. Su aspecto rojo es una consecuencia de la presencia de DiIC18. (B) el 2.fino fueron cosechada con una punta de pipeta truncada. En esta imagen, el agregado se pipetea junto con 50 μl de solución, la hinchazón que fueron transferidos en un vial nuevo. (C) crear trans-membrana asimétrica condiciones de solución, el agregado se diluyó en otra isotónica solución externa. Aquí, el agregado junto con 50 μl de solución de la hinchazón se resuspendió en solución de sacarosa μl 950 lo que resulta en una dilución de 20 x de la solución de hinchazón. Haga clic aquí para ver una versión más grande de esta figura.
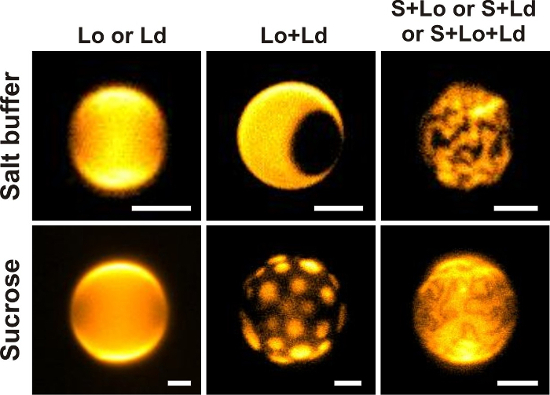
Figura 3: imagen de GUV. Ancho de campo imágenes de fluorescencia de 2.fino dopado con 0.1 mol % DiIC18 preparado y observado en sal simétrico o soluciones de sacarosa de diferentes proporciones de DOPG, eSM y Chol (en tampón salino, de izquierda a derecha: 40/20/40; 50/20/30 30/60/10; en sacarosa, de izquierda a derecha: 30/30/40; 20/60/20; 40/50/10). Las imágenes representan 2.fino en diferentes Estados de fase (coexistente) evaluados según los criterios en el paso de protocolo 3.6. Aquí, las vesículas se reflejada a través de una de 40 X / 0.6 objetivo de NA. Barras de la escala = 5 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 4: esquema de diseño de canal microfluídico. 2.fino entrar la capa fluídica más baja (canales contorneados) mediante la entrada debajo de un depósito. Un filtro bloquea desechos no deseados desde el dispositivo. Luego entran en una matriz de 60 cámaras (8 filas y 15 columnas) cada mensajes que contienen para la sola captura GUV (ver insertar). Cada cámara puede ser aislado dentro de una anillo la válvula accionada por una capa de control (canales negro rellenas) sobre la capa fluídica. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: dispositivo de microfluidos. (A) fotografía de un dispositivo de microfluidos trampa para atrapar a 2.fino única y totalmente intercambio de la solución externa. Las etiquetas indican el depósito para añadir soluciones (1), 8 x entradas de presión conectado a la presión control (2), y la salida del neumático conectado a la jeringa y la bomba (3). Panel (B) muestra la unidad de control de presión con 8 válvulas cada uno regular 1 tubo conectado al dispositivo de microfluidos. Aquí las válvulas #1 y #2 están abiertas y por lo tanto se cierran las válvulas anillo correspondiente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: cámara de control de temperatura. (A) cámaraantes de la Asamblea. (B) cámara de montado (hacia arriba) con 2 mm cubierta vidrios pegados en la parte superior e inferior. El espaciador de goma naranja mide 0,5 mm de altura y se sella con un cubreobjetos 0.17 m m para la observación de la suspensión GUV cerrada. En esta imagen se inserta una sonda de temperatura para propósitos de calibración (fibra marrón que salen de la cámara a la derecha). (C) Montaje Final en el escenario de un microscopio invertido sin la sonda de temperatura. El espaciador de goma naranja ahora es hacia abajo. La goma es suficientemente para mantener la muestra en su lugar. Tenga en cuenta que la luz puede transmitirse a través de la muestra que permite observaciones de campo brillante y epi-fluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
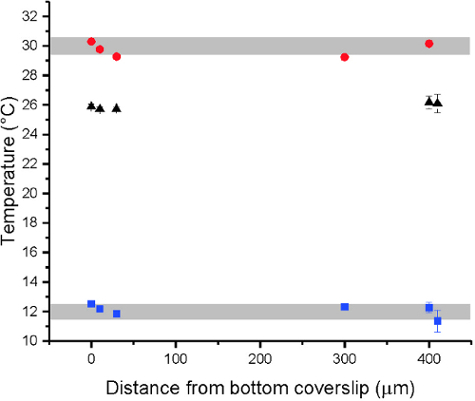
Figura 7: datos de temperatura espacial resuelto dentro de la cámara de observación obtienen por mediciones de FLIM de un colorante sensible de temperatura (aquí: 500 μm RHODAMINA B) 40. los puntos de datos obtienen a 0, 10, 30, 300 y 400 μm por encima del parte inferior del cubreobjetos. Los puntos rojos y azules fueron medidos para la temperatura de la bañera de agua situada a 30 ° C y 12 ° C, respectivamente. Los puntos negros indican a la izquierda del baño de agua se equilibren a temperatura ambiente. Variaciones de temperatura a lo largo de la cámara fueron observadas pero se quedó por debajo de 0,5 ° C (barras grises). La altura total de la cámara es alrededor de 500 μm según el espesor de espaciador (véase arriba). Las barras de error indican la desviación estándar. Haga clic aquí para ver una versión más grande de esta figura.
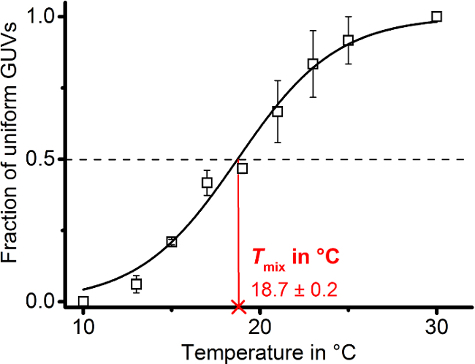
Figura 8: localización de la temperatura de miscibilidad. El gráfico muestra los puntos de datos individuales homogéneos (solo líquido Estado) la fracción de 2.fino preparado de DOPG/eSM/Chol en una proporción de 30/40/30 dopada con 0,1 mol % DiIC18 de tres muestras al azar independientes (N = 20-40). Barras de error representan el error estándar de los medios. Puntos de datos se ajustaron a Boltzmann modelo descrito en el paso 6.8 (línea negra continua) de que el dominio mezcla temperatura Tde la mezcla se deduce (línea continua roja siga a abscisa) según el medio máximo de la sigmoidal curva en la ordenada (línea negra discontinua). Los valores iniciales y finales (1 y2) fueron fijados a 0 y 1, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
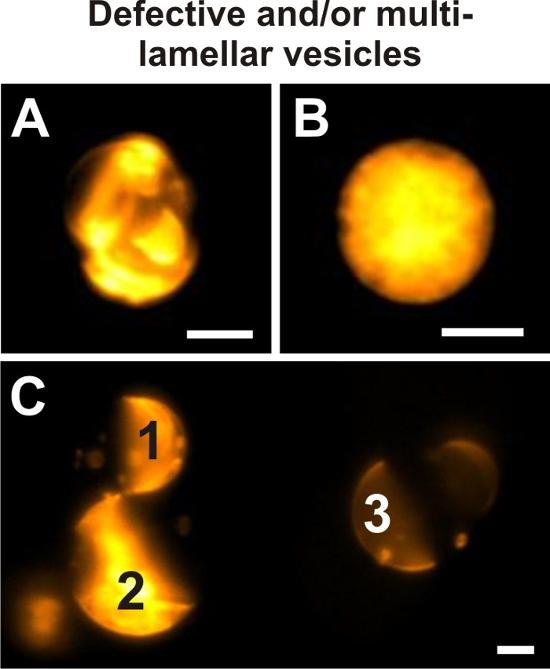
Figura 9: vesículas defectuosas. Ejemplos de vesículas gigantes prepararon a partir de 20/60/20 DOPG/eSM/Chol y dopado con 0,1 mol % si DiIC18 que no cumplen los criterios establecido en el paso 4.2 imagen por microscopía de fluorescencia de campo amplio. Rangos de intensidad pantalla de imágenes individuales fueron optimizados para la intensidad de fluorescencia de la vesícula representada cada vez. Debido a la presencia de material adicional de la membrana y vesículas más pequeñas encapsuladas, el estado de la fase de la vesícula en (A) no puede ser claramente definido. La aparición de esta vesícula gigante no permite cualquier inspección visual confiable para lamellarity. Panel (B) muestra una vesícula que el interior está lleno de material de la membrana. Como consecuencia, la señal de fluorescencia de la membrana exterior de la vesícula se superpone con su señal interna, haciendo imposible una visualización de dominios posibles y lamellarity. (C) se muestran las intensidades de fluorescencia de tres diferentes vesículas gigantes en comparación directa en el mismo rango de intensidad de pantalla. Esta imagen muestra que las vesículas de multilamellar gigante (1, 2) pueden ser identificadas por su señal de fluorescencia mayor comparado con el GUV (3). Aquí, multilamellar, así como propiedades gigantes vesículas muestra separación de fases Lo + Ld. Vesículas en todas las imágenes fueron reflejadas a través de una de 40 x / 0.6 objetivo de NA. Barras de la escala = 5 μm. haga clic aquí para ver una versión más grande de esta figura.
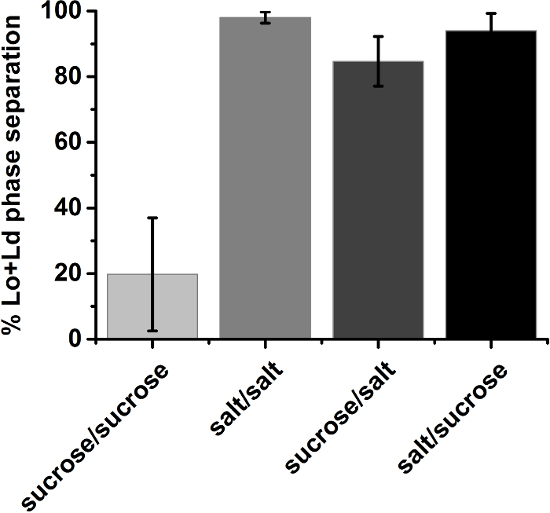
Figura 10: fracción de fase Lo + Ld separados 2.fino promediada sobre al menos tres muestras independientes. Vesículas se compone de 30/40/30 DOPG/eSM/Chol, cerca de la frontera de la región de coexistencia de Lo + Ld. Las barras de error para condiciones simétricas sacarosa ilustran la dispersión de lote a lote. La etiqueta de la ordenada describe soluciones dentro/fuera de las vesículas; sacarosa: sacarosa de 210 mM; sal: 100 mM NaCl, 10 mM Tris, pH 7,5; Barras de error indican la desviación estándar. Haga clic aquí para ver una versión más grande de esta figura.

Figura 11: Diagrama de fases de 2.fino preparado de DOPG, eSM y Chol asignan condiciones solución diferente utilizando sacarosa (sucrosa) de 210 mM y 100 mM NaCl, 10 mM Tris, pH 7,5 (sal). Los Estados fueron exploradas en sucrosa/sacarosa (A; sección superior), GUV fase sacarosa/sal (entrada/salida) (A; inferior sección poligonal), sal/sal (B; sección superior) y sal/sacarosa (B; sección poligonal inferior). Los dibujos animados muestran el patrón de dominio dominante dentro de las secciones destacadas y las condiciones de solución correspondientes. Estados de fase de vesícula en las secciones inferiores de la poligonales se observaron condiciones solución asimétrica sobre la dilución de GUV x 20. Adaptado de referencia9. Haga clic aquí para ver una versión más grande de esta figura.
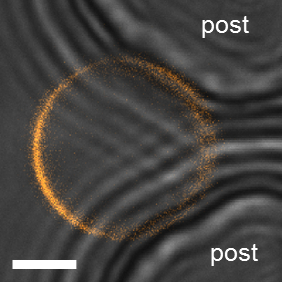
Figura 12: artefactos en 2.fino atrapado. Ejemplo de un GUV pequeño donde se aprecia un dominio falso debido a la proximidad con los postes (DOPG/eSM/Chol 60/20/20). El brillante-campo transmite luz imagen mostrando los puestos (grEY) se superponen con la imagen de fluorescencia confocal de GUV (naranja). Los postes se ven para crear un patrón de interferencia en la imagen de campo claro. La señal de fluorescencia más cerca los puestos (derecha) se reduce dando el aspecto de separación de fases. Barra de escala = 5 μm.
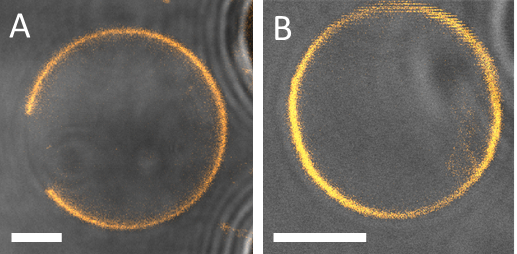
Figura 13: ejemplos de dos diferentes 2.fino capturado por los posts PDMS donde son claramente visibles los Estados de fase. Lo (A) + Ld fase vesícula separada de DOPG/eSM/Chol 60/20/20. (B) una vesícula de 30/40/30 que Ld o Lo monofásico. Una z-pila confocal de la vesícula entera fue examinada para confirmar que no hay dominios (fuera de foco) estaban presentes. Los bordes de los puestos se ven a la derecha de las imágenes (gris). Barra de escala = 5 μm.
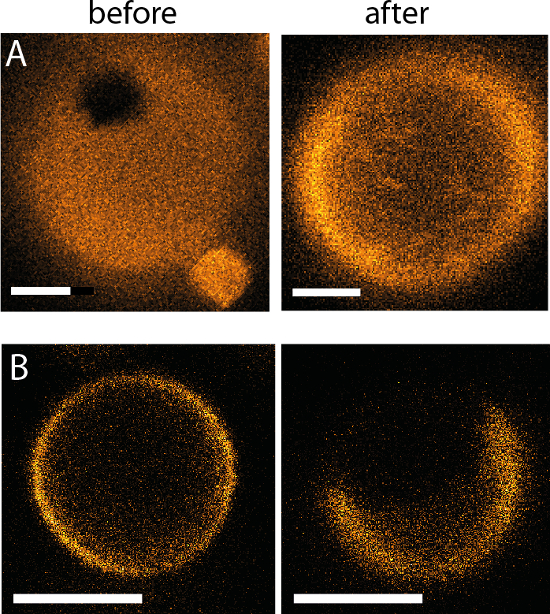
Figura 14: comportamiento de fase resultante después de un intercambio neumático completado utilizando el dispositivo microfluídico. El mismo GUV se muestra antes y después del intercambio de solución (A) simétricas sal/sal (entrada/salida) a la sal/sacarosa (entrada/salida) (DOPG/eSM/Chol 60/20/20, barra de escala es el μm 2) y (B) simétrica sucrosa/sacarosa (entrada/salida) a la sal de sacarosa (en/hacia fuera) (DOPG / eSM/Chol 30/40/30, escala de la barra = 3 μm). Adaptado de referencia9.
Discusión
Exitosa producción de 2.fino observaciones estado de fase en condiciones de alta salinidad simétricas y asimétricas
Los protocolos presentados aquí presenta una estrategia para evaluar la influencia de la asimetría de tampón y la solución de alta salinidad en el estado de la fase de membrana de 2.fino cargada sobre una amplia gama de composiciones. Uno de los retos más importantes hacia el logro de este objetivo era la producción de 2.fino cargada en tampones de alta salinidad.
Produjo con éxito 2.fino en solución de sacarosa y alta-solución salina tampón por un simple acercamiento inflamación espontáneo, que incluye un paso de la hidratación previa de la película de lípidos depositados y un paso final de la hidratación durante la noche para el crecimiento de la vesícula. Es importante tener en cuenta que la deposición de lípidos debe hacerse en una placa PTFE rugosa para asegurar incluso lípidos que se separa para producir vesículas unilaminar. Además, es esencial para llevar a cabo cada paso durante la preparación de la vesícula a una temperatura donde la película lipídica está en un estado de fase homogénea y fluida. Otra cosa, la población de vesícula puede polidispersas en composición y sesgar el análisis de estado de fase final de la población. El protocolo específico para la inflamación espontánea de 2.fino rendimientos un bosquete de vesícula que por un lado ofrece la posibilidad de volver a suspenderlo en pequeños volúmenes para obtener dispersiones de vesícula de alta concentración y por otro lado proporciona solución asimétrica condiciones a través de la membrana y reducir al mínimo la dilución de las vesículas8,28. Es esencial que durante la dilución de la vesícula o solución externa de intercambio, dentro y fuera de osmolarities permanecen emparejados como morfología cambios causados por desajustes de la osmolaridad pueden inducir o evitar Lo + Ld fase separación41 o, en caso de hipotónica condiciones, puede conducir a la ruptura de la vesícula.
Aquí, intenta optimizar protocolos de electroformation en la solución de alta salinidad resultó en la producción de no 2.fino mientras hinchazón PVA-asistida rindió las vesículas multilamellar. Aunque requiere tiempo de preparación y resultados en lotes de vesícula de inferior calidad10,17, la exitosa producción de vesículas cargadas de espontánea inflamación viene con ventajas adicionales. Exige un esfuerzo mínimo y resultando en rendimientos suficientes para los análisis estadísticos por lotes y, a diferencia de electroformation, equipos sofisticados ni optimización no fueron requeridos. Por otra parte, no hay contaminación por oxidación de lípidos se han observado42,43. Según la literatura existen diferencias entre las composiciones lipídicas de las vesículas y las acciones correspondientes de que ellos crecieron7,17. Además, la formación de vesículas sobre un sustrato PTFE no pide la inclusión de cualquier contaminación en contraste con métodos hinchazón asistida gel donde las moléculas extranjeras pueden introducirse por el sustrato23. Electroformation viene con más inconvenientes relacionados con la dilución excesiva de la vesícula al crear las condiciones de solución asimétrica. 2.fino producida por electroformation está generalmente presente como una dispersión homogénea (en contraste con la suspensión de vesícula altamente concentrada en la forma de un grupo formado durante inflamación espontánea). Cualquier dilución de la solución externa diluiría considerablemente el número de vesículas así. Además, en el transcurso de este trabajo que se observó que DOPG/eSM/Chol 2.fino producido por electroformation de sacarosa llegó a ser inestable si diluido en buffer de alta salinidad. Fluorescencia de parches de lípidos en el portaobjetos del microscopio indica que las vesículas estallaría antes de su inspección visual posible. Esa inestabilidad puede atribuirse a una tensión elevada de la membrana de las vesículas preparado por electroformation en comparación con los obtenidos por inflamación espontánea10.
Aunque la dilución de la vesícula es un enfoque fácil y rápido para crear condiciones de solución GUV asimétricas, sólo logra un intercambio parcial solución externa, aunque con una alta fracción (aquí: 95%, figura 2), como sobre la dilución, las huellas de la hinchazón de la solución permanecerá. La elección del grado del cambio de la solución externa es una relación inversa entre pipeteado hasta el grupo de vesícula junto con la solución hinchazón (sección 2) y no diluir demasiado. Por lo tanto, hemos introducido un enfoque alternativo microfluídicos discutido en otros lugares en detalle37 que permite un intercambio rápido y completa solución externa durante observaciones de estado GUV fase para comprobar las fase estado observaciones para diluir vesículas. Las observaciones de las variaciones de estado de fase al cambiar de simétrico a las condiciones de solución asimétrica de hecho fueron observadas para estar de acuerdo. Además, ambos métodos para generar condiciones de solución asimétrica son comparable rápido (Comparar Ref.8) y vienen con ningún riesgo conocido de las alteraciones de composición local (Comparar referencias30,31), aumento de tensión (Comparar referencia32) de membrana, o calentamiento local (Comparar referencia33), en cuanto a los métodos alternativos discutida en la introducción. Durante la captura de microfluidos, un balance osmótico entre la vesícula interior y exterior no es esenciales sólo para evitar artefactos de estado de fase como se mencionó anteriormente, sino la deflación causada por las condiciones de solución hipertónica pueden causar el atrapado 2.fino deslizarse a través de los postes después de un intercambio de solución externa.
Aunque inflamación espontánea ha sido aplicado con éxito para crecer sin cargar las vesículas de un sistema eSM/DOPC/Chol, en otros casos, la ausencia de cargos pueden perjudicar a GUV hinchazón debido a la consiguiente falta de repulsión entre las bicapas individuales44 . Extender el período de la hinchazón o la introducción contiene lípidos voluminosos puede contrarrestar este tema45. Además, puede variar la estabilidad de la vesícula después de su dilución en soluciones diferentes a la que se usa para hinchazón de lípidos diferentes composiciones y los medios de dilución, que no hemos investigado aquí. También no hemos explorado la posibilidad de templar el diámetro promedio de GUV con el método de preparación presentado aquí. Pero parámetros tales como la composición de la vesícula e inflamación solución son capaces de influir en los resultados. La aplicación de métodos alternativos46 puede producir grandes vesículas de lípidos y soluciones utilizadas aquí, sin embargo, vienen con otros inconvenientes asociados con el método. El enfoque descrito anteriormente para producir a 2.fino en condiciones de alta salinidad simétricas y asimétricas proporciona una herramienta potencial para futuros estudios de vesículas de composiciones de diferentes lípidos y dispersa en diferentes medios de comunicación. Como no hemos explorado las posibilidades, los ensayos futuros mostrará cómo generalmente pueden aplicarse los métodos de preparación y dilución de GUV.
Observación de la separación de la fase a diferentes temperaturas
Existen diferentes configuraciones experimentales adecuadas estudiar a 2.fino a diferentes temperaturas. Aunque estas configuraciones no son comúnmente se describe en detalle dentro de la literatura, el presente trabajo presenta un montaje básico aplicable para dichos estudios.
control mediciones muestran que la temperatura de este en el local diseñado y construido cámara precisamente es controlada por un termostato y gradientes de temperatura dentro de la cámara dentro de la resolución experimental de la temperatura. Se asegura que las condiciones térmicas experimentales son consistentes con la lectura del termostato.
Durante la evaluación de GUV Estados de fase en un rango amplio de temperatura, es importante que las vesículas observadas están bien equilibradas después de que la temperatura ha cambiado. Una forma posible de asegurar esto es verificar la histéresis. Si hay histéresis, deben reducirse las medidas de temperatura o aumentaron de tiempos de equilibrado. Como temperatura control en este trabajo se establece por un termostato a base de agua, la gama de temperaturas de trabajo es ideal limitada 0 - 100 ° C. Esta gama se puede ampliar mediante el uso de otros líquidos de control de temperatura tales como aceite o mediante el empleo de otras configuraciones, por ejemplo, un dispositivo Peltier. En la práctica, la temperatura de trabajo está limitada también por la posible condensación o evaporación. Además, para temperaturas lejos de temperatura, la ocurrencia de un gradiente de temperatura de estado estacionario a través de la cámara de observación se convierte en más. Además, el equipo de proyección de imagen puede resultar lesionado en las temperaturas extremas. Para rangos de temperatura típicos del apropiada para estudios de vesícula lipídica (~ 10-50 ° C7,9) daños a los equipos de observación se deben considerar pero por lo general no se espera.
Artefactos de observación de dominio de vesícula
Hay un número de fuentes para los artefactos de observación mediante microscopía de fluorescencia de campo amplio. En primer lugar, uno debe ser consciente de que la resolución máxima r del objeto aplicado para la inspección visual de los Estados de fase de vesícula determina el límite de detección de los dominios de lípidos según:
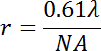
donde λ es la longitud de onda de emisión, y NA es la apertura numérica del objetivo. Un objetivo típico con una de 40 aumentos y un NA de 0,6 que detecta la emisión verde luz alrededor 560 nm alcanzaría una resolución óptica de ~0.6 μm. por lo tanto, estudios que comparan los Estados de la fase de vesículas de mezclas de lípidos particularmente entre diferentes condiciones deben utilizar el mismo objetivo para la misma mezcla de lípidos.
Otro artefacto es la aparición de los dominios de lípidos como consecuencia de la foto-oxidación lipídica debido a una exposición prolongada a la luz de excitación41. Foto daño ocurre preferentemente en moléculas de lípidos de hidrocarburo no saturado. De hecho, algunas composiciones de lípidos, tal formación dominio de vesículas inicialmente homogéneas se observó aquí tras un largo periodo de exposición a la luz la excitación (~ 30 s). Para contrarrestar este problema, la luz de excitación se mantuvo enfocada en un campo de visión durante sólo unos segundos para la evaluación de estado de fase. Por lo tanto, DiIC18 era conveniente para nuestros propósitos. Otros tintes, sin embargo, pueden ser mucho más sensibles y pueden necesitar manejar intensidades de excitación más bajas y con tiempos más cortos de exposición a la luz de excitación.
Tensión de esquileo mecánico de la transmisión de la pipeta de las vesículas potencialmente mezcla dominios temporalmente, de tal modo que distorsionan el comportamiento de fase de vesícula evidente. Algunos lotes, vesículas diferentes mostraron comportamientos diferentes fase 0 min y 5 min después de la pipeta de transferencia sobre el cubreobjetos microscopio. También se ha demostrado el esfuerzo cortante inducido por el flujo flúido en el dispositivo de microfluidos en dominio mezcla47. Vesículas se deben dejar tranquilas para una cantidad suficiente de tiempo para equilibrar antes de observación. Dentro de este estudio, vesículas atrapadas en el dispositivo de microfluidos quedaron inalteradas durante 1 h después de la carga de la vesícula y los intercambios de solución antes de observación.
Para evitar algunas de las dificultades antes mencionadas, así como la restricción impuesta por el límite de difracción de luz, métodos alternativos como la resonancia magnética nuclear espectroscopia48 o de técnicas de microscopía de resolución super49 podría ser empleado.
Conclusión y perspectivas
El trabajo presentado muestra un conjunto de métodos que permite el análisis de la influencia de las condiciones de alta salinidad solución simétrica y asimétrica en la separación de la fase de membrana. Todos los métodos presentados son adecuados para otras aplicaciones. Por ejemplo, el dispositivo de microfluidos ofrece una plataforma para estudiar la cinética de formación del dominio y la desaparición en la inducción de la asimetría de la solución. Además, apariencia de dominio como función de la concentración de la sal podría ser examinado así. Todos los métodos podrían utilizarse también mirar la influencia en el comportamiento de fase con otras soluciones de interés.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo forma parte del consorcio MaxSynBio, que es financiado conjuntamente por el Ministerio Federal de educación y de investigación de Alemania y de la sociedad Max Planck.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-phospho-(1'-rac-glycerol), sodium salt | Avanti Polar Lipids | 840475C | abbreviated as DOPG in the text |
| chicken egg sphingomyelin | Avanti Polar Lipids | 860061 | abbreviated as eSM |
| cholesterol (ovine wool, > 98 %) | Avanti Polar Lipids | 700000 | abbreviated as Chol |
| 1,1'-dioctadecyl-3,3,3',3'-tetramethylindocarbocyanine perchlorate | Molecular Probes | D-282 | abbreviated as DiIC18 |
| Chloroform, HPLC grade (≥ 99.8 %) | Merck | ||
| NaCl (> 99.8 %) | Roth | ||
| HCl (37 %) | Roth | ||
| Tris (≥ 99.9 %) | Roth | ||
| Sucrose (≥ 99.5 %) | Sigma Aldrich | ||
| Parafilm | |||
| Threaded vial 45x27 mm, 15 mL | Kimble | Soda flat bottom, white screw cap | |
| pH meter | Mettler Toledo | MP220 | |
| Osmometer | Gonotec | Osmomat030 | |
| Epi-fluorescence microscope | Zeiss | Axio Observer D1 | |
| Confocal laser scanning microscope | Leica | TCS SP5 | |
| Objective 40x, 0.6 NA | Zeiss | LD Achroplan | |
| Objective 40x, 0.75 NA | Leica | 506174 | |
| Objective 63x, 0.9 NA | Leica | 506148 | |
| Microscope slide, 56x26 mm, 0.17 ± 0.01 mm | Menzel-Gläser | ||
| Cover slip, 22x22 mm, 0.17 ± 0.01 mm | Menzel-Gläaser | ||
| Parafilm "M" | Bremix Flexible Packaging | ||
| Syringes, 5 mL, 10 mL | Braun | ||
| 0.45 µm syringe filter | GVS North America | Cameo 25AS, 1213723 | Acetate, sterile |
Referencias
- Dietrich, C., et al. Lipid rafts reconstituted in model membranes. Biophys J. 80 (3), 1417-1428 (2001).
- Bagatolli, L. A. To see or not to see: lateral organization of biological membranes and fluorescence microscopy. Biochim Biophys Acta. 1758 (10), 1541-1556 (2006).
- Carquin, M., D'Auria, L., Pollet, H., Bongarzone, E. R., Tyteca, D. Recent progress on lipid lateral heterogeneity in plasma membranes: From rafts to submicrometric domains. Prog Lipid Res. 62, 1-24 (2016).
- Baumgart, T., Hess, S. T., Webb, W. W. Imaging coexisting fluid domains in biomembrane models coupling curvature and line tension. Nature. 425 (6960), 821-824 (2003).
- Bacia, K., Schwille, P., Kurzchalia, T. Sterol structure determines the separation of phases and the curvature of the liquid-ordered phase in model membranes. Proc Natl Acad Sci U S A. 102 (9), 3272-3277 (2005).
- Vequi-Suplicy, C. C., Riske, K. A., Knorr, R. L., Dimova, R. Vesicles with charged domains. Biochim Biophys Acta. 1798 (7), 1338-1347 (2010).
- Blosser, M. C., Starr, J. B., Turtle, C. W., Ashcraft, J., Keller, S. L. Minimal effect of lipid charge on membrane miscibility phase behavior in three ternary systems. Biophys J. 104 (12), 2629-2638 (2013).
- Pataraia, S., Liu, Y., Lipowsky, R., Dimova, R. Effect of cytochrome c on the phase behavior of charged multicomponent lipid membranes. Biochim Biophys Acta. 1838 (8), 2036-2045 (2014).
- Kubsch, B., Robinson, T., Lipowsky, R., Dimova, R. Solution Asymmetry and Salt Expand Fluid-Fluid Coexistence Regions of Charged Membranes. Biophys J. 110 (12), 2581-2584 (2016).
- Dimova, R., et al. A practical guide to giant vesicles. Probing the membrane nanoregime via optical microscopy. J Phys Condens Matter. 18 (28), S1151-S1176 (2006).
- Liu, A. P., Fletcher, D. A. Biology under construction: in vitro reconstitution of cellular function. Nat Rev Mol Cell Biol. 10 (9), 644-650 (2009).
- Walde, P., Cosentino, K., Engel, H., Stano, P. Giant Vesicles: Preparations and Applications. Chembiochem. 11 (7), 848-865 (2010).
- van Swaay, D., deMello, A. Microfluidic methods for forming liposomes. Lab Chip. 13 (5), 752-767 (2013).
- Stein, H., Spindler, S., Bonakdar, N., Wang, C., Sandoghdar, V. Production of Isolated Giant Unilamellar Vesicles under High Salt Concentrations. Front Physiol. 8, 63 (2017).
- Angelova, M. I., Dimitrov, D. S. Liposome Electroformation. Faraday Discuss. 81, 303-311 (1986).
- Dimitrov, D. S., Angelova, M. I. Lipid swelling and liposome formation mediated by electric fields. Bioelectrochemistry and Bioenergetics. 19, 323-336 (1988).
- Rodriguez, N., Pincet, F., Cribier, S. Giant vesicles formed by gentle hydration and electroformation: a comparison by fluorescence microscopy. Colloids Surf B Biointerfaces. 42 (2), 125-130 (2005).
- Montes, L. R., Alonso, A., Goni, F. M., Bagatolli, L. A. Giant unilamellar vesicles electroformed from native membranes and organic lipid mixtures under physiological conditions. Biophys J. 93 (10), 3548-3554 (2007).
- Pott, T., Bouvrais, H., Meleard, P. Giant unilamellar vesicle formation under physiologically relevant conditions. Chem Phys Lipids. 154 (2), 115-119 (2008).
- Green, N. G., Ramos, A., Gonzalez, A., Morgan, H., Castellanos, A. Fluid flow induced by nonuniform ac electric fields in electrolytes on microelectrodes. I. Experimental measurements. Phys Rev E Stat Phys Plasmas Fluids Relat Interdiscip Topics. 61 (4 Pt B), 4011-4018 (2000).
- Horger, K. S., Estes, D. J., Capone, R., Mayer, M. Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength. J Am Chem Soc. 131 (5), 1810-1819 (2009).
- Weinberger, A., et al. Gel-Assisted Formation of Giant Unilamellar Vesicles. Biophys J. 105 (1), 154-164 (2013).
- Lira, R. B., Dimova, R., Riske, K. A. Giant Unilamellar Vesicles Formed by Hybrid Films of Agarose and Lipids Display Altered Mechanical Properties. Biophys J. 107 (7), 1609-1619 (2014).
- Kresse, K. M., Xu, M., Pazzi, J., Garcia-Ojeda, M., Subramaniam, A. B. Novel Application of Cellulose Paper As a Platform for the Macromolecular Self-Assembly of Biomimetic Giant Liposomes. ACS Appl Mater Interfaces. 8 (47), 32102-32107 (2016).
- Reeves, J. P., Dowben, R. M. Formation and properties of thin-walled phospholipid vesicles. J Cell Physiol. 73 (1), 49-60 (1969).
- Needham, D., Evans, E. Structure and Mechanical-Properties of Giant Lipid (DMPC) Vesicle Bilayers from 20-Degrees-C Below to 10-Degrees-C above the Liquid-Crystal Crystalline Phase-Transition at 24-Degrees-C. Biochemistry. 27 (21), 8261-8269 (1988).
- Manneville, J. B., et al. COPI coat assembly occurs on liquid-disordered domains and the associated membrane deformations are limited by membrane tension. Proc Natl Acad Sci U S A. 105 (44), 16946-16951 (2008).
- Wollert, T., Wunder, C., Lippincott-Schwartz, J., Hurley, J. H. Membrane scission by the ESCRT-III complex. Nature. 458 (7235), 172 (2009).
- Kuhn, P., et al. A facile protocol for the immobilisation of vesicles, virus particles, bacteria, and yeast cells. Integr Biol (Camb). 4 (12), 1550-1555 (2012).
- Sarmento, M. J., Prieto, M., Fernandes, F. Reorganization of lipid domain distribution in giant unilamellar vesicles upon immobilization with different membrane tethers. Biochim Biophys Acta. 1818 (11), 2605-2615 (2012).
- Lipowsky, R., Rouhiparkouhi, T., Discher, D. E., Weikl, T. R. Domain formation in cholesterol-phospholipid membranes exposed to adhesive surfaces or environments. Soft Matter. 9 (35), 8438 (2013).
- Korlach, J., Reichle, C., Muller, T., Schnelle, T., Webb, W. W. Trapping, deformation, and rotation of giant unilamellar vesicles in octode dielectrophoretic field cages. Biophys J. 89 (1), 554-562 (2005).
- Delabre, U., et al. Deformation of phospholipid vesicles in an optical stretcher. Soft Matter. 11 (30), 6075-6088 (2015).
- Fidorra, M., Garcia, A., Ipsen, J. H., Hartel, S., Bagatolli, L. A. Lipid domains in giant unilamellar vesicles and their correspondence with equilibrium thermodynamic phases: a quantitative fluorescence microscopy imaging approach. Biochim Biophys Acta. 1788 (10), 2142-2149 (2009).
- Bezlyepkina, N., Gracia, R. S., Shchelokovskyy, P., Lipowsky, R., Dimova, R. Phase diagram and tie-line determination for the ternary mixture DOPC/eSM/cholesterol. Biophys J. 104 (7), 1456-1464 (2013).
- Eyer, K., Kuhn, P., Stratz, S., Dittrich, P. S. A microfluidic chip for the versatile chemical analysis of single cells. J Vis Exp. (80), e50618 (2013).
- Robinson, T., Kuhn, P., Eyer, K., Dittrich, P. S. Microfluidic trapping of giant unilamellar vesicles to study transport through a membrane pore. Biomicrofluidics. 7 (4), 44105 (2013).
- Veatch, S. L., Gawrisch, K., Keller, S. L. Closed-loop miscibility gap and quantitative tie-lines in ternary membranes containing diphytanoyl PC. Biophys J. 90 (12), 4428-4436 (2006).
- Kolesinska, B., et al. Interaction of beta(3) /beta(2) -peptides, consisting of Val-Ala-Leu segments, with POPC giant unilamellar vesicles (GUVs) and white blood cancer cells (U937)--a new type of cell-penetrating peptides, and a surprising chain-length dependence of their vesicle- and cell-lysing activity. Chem Biodivers. 12 (5), 697-732 (2015).
- Robinson, T., et al. Removal of background signals from fluorescence thermometry measurements in PDMS microchannels using fluorescence lifetime imaging. Lab Chip. 9 (23), 3437-3441 (2009).
- Morales-Penningston, N. F., et al. GUV preparation and imaging: minimizing artifacts. Biochim Biophys Acta. 1798 (7), 1324-1332 (2010).
- Zhou, Y., Berry, C. K., Storer, P. A., Raphael, R. M. Peroxidation of polyunsaturated phosphatidyl-choline lipids during electroformation. Biomaterials. 28 (6), 1298-1306 (2007).
- Breton, M., Amirkavei, M., Mir, L. M. Optimization of the Electroformation of Giant Unilamellar Vesicles (GUVs) with Unsaturated Phospholipids. J Membr Biol. 248 (5), 827-835 (2015).
- Lasic, D. D., Needham, D. The "stealth" liposome: a prototypical biomaterial. Chemical Reviews. 95, 2601-2628 (1995).
- Needham, D., McIntosh, T. J., Lasic, D. D. Repulsive interactions and mechanical stability of polymer-grafted lipid membranes. Biochim Biophys Acta. 1108 (1), 40-48 (1992).
- Akashi, K., Miyata, H., Itoh, H., Kinosita, K. Preparation of giant liposomes in physiological conditions and their characterization under an optical microscope. Biophys J. 71 (6), 3242-3250 (1996).
- Sturzenegger, F., Robinson, T., Hess, D., Dittrich, P. S. Membranes under shear stress: visualization of non-equilibrium domain patterns and domain fusion in a microfluidic device. Soft Matter. 12 (23), 5072-5076 (2016).
- Veatch, S. L., Polozov, I. V., Gawrisch, K., Keller, S. L. Liquid domains in vesicles investigated by NMR and fluorescence microscopy. Biophys J. 86 (5), 2910-2922 (2004).
- Owen, D. M., Magenau, A., Williamson, D., Gaus, K. The lipid raft hypothesis revisited--new insights on raft composition and function from super-resolution fluorescence microscopy. Bioessays. 34 (9), 739-747 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados