Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un método estandarizado para medir el área de la superficie pulmonar interna mediante neumonectomía y prótesis de ratón
En este artículo
Resumen
El área de superficie pulmonar interna (ISA) es un criterio crítico para evaluar la morfología pulmonar y la fisiología en las enfermedades pulmonares y la regeneración alveolar inducida por lesiones. Describimos aquí un método estandarizado que puede minimizar el sesgo de medición para ISA tanto en neumonectomía pulmonar como en modelos de ratón de implantación de prótesis.
Resumen
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introducción
La función fundamental del pulmón es el intercambio de oxígeno y dióxido de carbono entre los vasos sanguíneos y la atmósfera. Las enfermedades pulmonares como la displasia broncopulmonar (BPD), la enfermedad pulmonar obstructiva crónica (EPOC) y las infecciones respiratorias agudas, resultan en una disminución de la ISA 2 . Los investigadores que estudian la enfermedad pulmonar han desarrollado varios métodos cuantitativos para evaluar los cambios morfológicos en los pulmones, incluyendo MLI, ILV, el número de unidades de intercambio de gases, ISA, y el tejido pulmonar cumplimiento [ 2 , 3] . Los estudios pioneros de Weibel et al. 4 y Duguid et al. 5 juntos establecieron que la ISA puede usarse como una medida directa de la capacidad de intercambio de gas pulmonar en los pulmones humanos y puede usarse como criterio para determinar la gravedad del enfisema. Varios estudios publicados en los últimos cinco años han utilizado parámetros morfológicos pulmonares ( por ejemplo, ISA y MLI) para evaluar los cambios morfológicos y funcionales en los pulmones de los ratones durante el desarrollo 6 y durante la recuperación de la lesión PNX 1 , 7 . ISA se calcula utilizando la ecuación 1 8 , 9 :
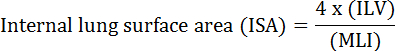
, Donde ILV es el volumen pulmonar interno y MLI es un parámetro intermedio que representa el espacio periférico pulmonar tamaño 10 .
La PNX, la extirpación quirúrgica de uno o más lóbulos pulmonares, ha sido ampliamente reportada para inducir la regeneración alveolar en muchas especies, incluyendo humanos 11 , ratones 1 , perros 12 , ratas 13 y conejos 14 , 15 . Un sementalY de los pulmones de ratones a los catorce días post-PNX mostró que tanto la expansión de los alvéolos pre-existentes y la formación de novo de los alvéolos contribuir a la restauración de ISA, ILV, y el número de alveolos en los tejidos pulmonares restantes [ 1] . Nosotros y otros hemos demostrado que la inserción de materiales como esponja, cera o una prótesis personalizada en la cavidad torácica vacía después de PNX ( es decir , la implantación de la prótesis) impide la regeneración alveolar. Ahora está firmemente establecido que la fuerza mecánica funciona como uno de los factores más importantes para iniciar la regeneración alveolar 1 , 16 , 17 . Tales estudios han puesto de relieve la eficacia del uso de los valores ISA de los pulmones tratados con PNX y prótesis implantada como criterio para evaluar cuantitativamente la regeneración alveolar.
Se sabe que el sesgo del observador influye significativamente en la vaPara los parámetros morfológicos pulmonares ( por ejemplo , MIL e ILV). Se pueden utilizar protocolos estandarizados para obviar este sesgo en la determinación de ILV y MLI, que son los dos parámetros utilizados en el cálculo de ISA. Aquí, proporcionamos protocolos altamente detallados y estandarizados para medir estos parámetros pulmonares. Es importante destacar que la capacidad de cuantificar con precisión ISA promete mejorar la fiabilidad y la reproducibilidad de los estudios de la función pulmonar en modelos de regeneración alveolar inducidos por lesiones y facilitar los descubrimientos mecanísticos en múltiples enfermedades pulmonares.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los procedimientos utilizados en este protocolo se llevaron a cabo de acuerdo con las recomendaciones de las Directrices para el Cuidado y Uso de Animales de Laboratorio del Instituto Nacional de Ciencias Biológicas de Beijing. Se alojaron ratones machos CD-1 de 8 semanas de edad en una instalación libre de patógenos específicos (SPF) hasta que se llevaron a cabo los experimentos. Las cirugías se realizaron utilizando ratones completamente anestesiados ( es decir , sin ninguna respuesta pellizcadora del dedo). Después de la cirugía, los ratones se mantuvieron en una habitación cálida y húmeda con suficiente comida y agua dulce. Los ratones se sacrificaron usando una sobredosis de anestésico administrado por inyección intraperitoneal.
1. Cirugía de ratón PNX
- Anestesiar completamente a los ratones con fenobarbital sódico (120 mg / kg de peso corporal) y buprenorfina (0,1 mg / kg de peso corporal) mediante inyección intraperitoneal (IP). Realizar la cirugía cuando los ratones ya no reaccionan a pellizcar el dedo.
- Quitar el pelo en el tórax izquierdo de los ratones con dep(3 x 3 cm 2 de área).
- Asegure cada ratón en una plataforma de intubación con su lado ventral hacia el operador ( Figura 1A ).
- Saque la lengua del ratón e ilumine las cuerdas vocales con un pequeño laringoscopio animal que contiene una muesca para guiar los catéteres 18 ( Figura 1A ).
- Distinguir las cuerdas vocales observando los movimientos de las cuerdas vocales durante la respiración. Inserte suavemente una cánula de intubación intravenosa de 20 G en la tráquea con un ángulo anterior 19 .
- Coloque los ratones en una posición recostada lateral derecha y conecte la cánula a un ventilador mecánico ( por ejemplo, controlado por presión, consulte la Tabla de materiales ). Compruebe la inserción de la cánula en la tráquea observando los movimientos respiratorios del tórax del ratón ( Figura 1B ).
- Ajuste la presión inspiratoria of el ventilador a 12 cm H 2 O y establecer la frecuencia respiratoria de 120 respiraciones por minuto (Figura 1B).
- Descontaminar la piel en el área quirúrgica con betadina y etanol al 70%.
- Hacer una incisión posterolateral de 2 - 3 cm en el espacio en el 5 º espacio intercostal, cortado a través de la piel y los músculos con tijeras de primavera Noyes (borde de corte: 14 mm, diámetro de la punta: 0,275 mm) ( Figura 2B , C ). Los instrumentos quirúrgicos utilizados para el procedimiento de toracotomía se esterilizan antes del uso.
- Hacer una incisión de 1,5 cm en el espacio intercostal 5º para exponer el pulmón izquierdo (Figura 2D, E). Durante la operación, use un cauterizador de alta temperatura para detener el sangrado.
- Levante un tercio del lóbulo pulmonar izquierdo del tórax con una pinza de punta roma ( Figura 2F ) y luego use un hisopo de algodón para extraer la totalidad de la izquierdaPulmón ( Figura 2G ).
- Identificar la arteria pulmonar y los bronquios del lóbulo pulmonar izquierdo ( Figura 2G ).
- Se liga ligeramente los bronquios y vasos en el hilio con una sutura quirúrgica de seda y se corta el lóbulo pulmonar izquierdo a 3-4 mm de la ligadura ( Figura 2H , I ).
NOTA: Tenga cuidado de no cortar los nudos de sutura en el hilio izquierdo, lo que puede causar neumotórax ( es decir , aire o gas en la cavidad del tórax) . - Cierre la pared torácica con 1 sutura y luego sutura la capa muscular y la capa de la piel secuencialmente, usando 5 a 6 suturas interrumpidas. Deje una separación de 3 a 4 mm entre cada sutura ( Figura 2M , 2N ).
NOTA: Mantenga la aguja de sutura quirúrgica lejos del corazón; La punción cardiaca inadvertida causará la muerte inmediata. - Desinfectar el área quirúrgica con povidona yodada.
- AfteR la operación quirúrgica, coloque el ratón sobre una almohadilla térmica de 38 ° C y conecte el ratón al ventilador hasta que comiencen los movimientos respiratorios espontáneos ( Figura 2O ).
2. Implantación de prótesis
- Realice los pasos 1.1 - 1.13 del procedimiento PNX (es decir, hasta el punto en que se elimina el lóbulo pulmonar izquierdo del ratón).
- Abrazadera del centro de la prótesis de silicona (cliente hecho, 12 mm de largo, 3 mm de espesor, 7 mm de ancho, 0,2 g, de forma elipsoide) con fórceps rombo ( Figura 2J ). Esterilizar la prótesis de silicona antes de la inserción.
- Sostenga la costilla con fórceps con una mano para exponer la cavidad torácica, e inserte la prótesis en la cavidad torácica vacía izquierda con otra mano.
NOTA: El ángulo de inserción es de aproximadamente 45 grados entre el plano frontal de la prótesis y la superficie torácica ( Figura 2K ,L). Sea muy suave al insertar la prótesis. La fuerza excesiva resultará en rotura pleural. - Ajuste la orientación de la prótesis con fórceps romos para asegurar que la prótesis ocupe la cavidad torácica vacía izquierda.
- Realice los pasos 1.14 - 1.16 del procedimiento PNX del ratón.
3. Medición de ILV
- Prepare un dispositivo personalizado ("tubo de inflado") que consiste en un émbolo extraído de una pipeta serológica desechable (10 ml), un tubo flexible de 40 cm de largo con un adaptador de aguja, una válvula de control de caudal y una aguja de 18 G. Después del montaje, asegure la pipeta en una tabla con cinta adhesiva ( Figura 3A ). La distancia entre la parte superior de la pipeta y el banco experimental debe ser de al menos 30 cm.
- Preparar una solución de fijación de paraformaldehído (PFA) al 4% fresco disolviendo 20 g de PFA en 500 ml de solución salina tamponada con fosfato 1x 1x (PBS) precalentada en un baño de agua a 55ºC, agitando manualmenteCe cada 10 min hasta que la solución sea clara. Después de enfriar a temperatura ambiente, se filtra la solución con un filtro de 0,45 μm.
PRECAUCIÓN: Use equipo protector personal (EPP) apropiado cuando maneje PFA. - Sacrifique a los ratones con una inyección de sobredosis de anestésico (0,8% de fenobarbital sódico, 1.000 U / ml de heparina).
- Asegure cada ratón en una placa de disección de poliestireno y rocíe con alcohol al 70%.
- Cuidadosamente abra el pecho del ratón y corte el esternón con tijeras para exponer a fondo los lóbulos del pulmón.
- Retire el tejido excesivo con una tijera para exponer la tráquea. Asegúrese de separar la tráquea del esófago.
- Corte la aorta abdominal e inserte una aguja de calibre 25 en el ventrículo derecho del corazón; Conecte la aguja a una jeringa de 20 ml antes de esta inserción. Lentamente empuje 1x PBS en el corazón para eliminar las células sanguíneas hasta que los pulmones se vuelvan blancos. Típicamente, se requiere 5 - 10 ml de PBS para limpiar los vasos sanguíneos pulmonares.
- LlenarE tubo de inflado construido a la medida con 4% de PFA fresco y eliminar todas las burbujas del tubo de inflado.
- Inserte la aguja calibre 18 del tubo de inflado en la tráquea y clip de la tráquea con clips de vaso para evitar fugas de líquido.
- Inflar los pulmones con PFA al 4% a una presión transpulmonar constante de 25 cm / H 2 O 2 , 20 . Incubar los pulmones a temperatura ambiente durante 2 h para lograr pulmones completamente expandidos. Este paso de "pre-fijación" es crítico para preservar la morfología pulmonar.
- Mediante la monitorización del tubo de inflado, registre el valor del volumen inicial de 4% de PFA y registre el volumen final. El volumen pulmonar interno es igual al volumen inicial de 4% de PFA menos el volumen final de 4% de PFA.
- Ligate la tráquea y con tijeras, disecar suavemente los pulmones (manteniendo los pulmones intactos) de los tejidos conectivos circundantes. Sea muy suave para evitar dañar los pulmones.
- IncuBate los pulmones en un tubo cónico de 50 ml lleno de PFA al 4% durante 12 h a 4 ° C con agitación suave en un agitador (50 rpm). Proceder al procesamiento y tinción de los tejidos (ver sección 4).
4. Incorporación de tejidos, secciones y tinción con hematoxilina y eosina (H & E)
- Después de la fijación, utilice las tijeras del resorte de Noyes para recortar el corazón y los tejidos conectivos excesivos de los pulmones. Separar suavemente los lóbulos pulmonares individuales cortando el bronquio que conecta los lóbulos pulmonares con la tráquea.
- Lavar extensamente los lóbulos pulmonares 3 - 4 veces en 50 mL 1x PBS (30 min / lavado) en un agitador orbital (50 rpm).
- Después del lavado final, crioprotect los lóbulos pulmonares sumergiéndolos en una solución de sacarosa al 30% (en 1x PBS) a 4 ° C hasta que el tejido se hunde hasta el fondo de los tubos cónicos de 50 mL (aproximadamente 12 h).
- Antes de incrustar y cryosectioning los tejidos, quitar las muestras de lóbulo pulmonar de los tubos con fórceps, conservar el accesoPara el análisis histológico, se seca la solución de sacarosa restante de la superficie de las muestras de lóbulo accesorio y luego se sumerge bien la muestra en una placa de Petri que contiene el compuesto de temperatura de corte óptimo (OCT) durante aproximadamente 30 min.
- Congelar las muestras de lóbulo accesorio OCT-embedded en nitrógeno líquido usando cryomolds. Coloque la mayor superficie del lóbulo paralela a la parte inferior del molde.
- Prepare un total de tres secciones de 10 μm de espesor para cada muestra durante la criosección para análisis histológico. Deseche los primeros 1 mm de tejido, recoja una sección de 10 μm de espesor, deseche 0,5 mm de tejido, recoja otra sección, deseche 0,5 mm de tejido y recoja la tercera sección (final).
- Secar al aire las secciones durante 1 h antes de realizar la tinción con H & E.
- Realizar la tinción de H & E
- Lavar las secciones en 3-4 cambios de agua del grifo y luego teñir las secciones en hematoxilina fresca durante 2 min; Enjuague la sección debajo del agua corriente del grifo; Sumerja la sección dos veces en una disolución de etanol al 1% al 70% para eliminar el exceso de hematoxilina.
- Mancha la sección en eosina fresca durante 3 min; Deshidratar las secciones con dos lavados sucesivos de 30 s en etanol al 95% y dos lavados de 30 segundos con etanol al 100%; Limpiar las secciones en xileno durante 30 s, repetir el paso de limpieza una vez en xileno fresco; Monte las diapositivas con el medio de montaje utilizando cubreobjetos de vidrio.
5. Cuantificación del MLI
- Adquirir imágenes digitales de las secciones del lóbulo accesorio manchado de H & E (ampliación 20X) usando un microscopio de campo brillante.
- Para cuantificar el MLI, seleccione un total de 15 vistas no superpuestas (1,000 μm x 1.000 μm) aleatoriamente de las áreas adecuadas (sin arterias y venas, vías aéreas principales y conductos alveolares) de 3 secciones.
- Coloque una cuadrícula con 10 líneas verticales uniformemente distribuidas y 10 líneas horizontales igualmente distribuidas de len definidoGth (1.000 μm) en las áreas de visión elegidas usando una herramienta de regla; Cada línea está así separada 100 μm entre sí ( Figura 4B ).
- Defina el valor de un intercepto como la longitud lineal entre dos epitelios alveolares adyacentes. Mida los valores de todas las interceptaciones a lo largo de cada línea de 1.000 μm de longitud.
- Para cada cuadrícula, cuantifique los valores de todas las interceptaciones entre las 10 líneas horizontales de 1.000 μm de longitud y las 10 líneas verticales de 1.000 μm de longitud.
NOTA: MLI es el valor promedio de las longitudes de interceptación de un total de 15 redes analizadas entre las 3 secciones preparadas para cada uno de los lóbulos accesorios.
6. Cálculo de ISA
- Calcular el ISA utilizando la ecuación 1 (véase la introducción ). Consulte la sección 3 para la medición de ILV y consulte la sección 5 para la cuantificación de MLI.
Access restricted. Please log in or start a trial to view this content.
Resultados
Realizamos aquí un experimento con un grupo tratado con PNX y un grupo de implantación de prótesis (implante de prótesis). Estas agrupaciones son las mismas que las agrupaciones utilizadas en un estudio previamente publicado por nuestro grupo de investigación 14 .
Los procedimientos de implante de PNX de ratón y prótesis se muestran en la Figura 2 . Ratones mac...
Access restricted. Please log in or start a trial to view this content.
Discusión
En este protocolo, proporcionamos descripciones detalladas sobre la medición de los parámetros pulmonares después de la PNX del pulmón izquierdo del ratón y la implantación de la prótesis. La ISA se considera ahora una métrica clave para la evaluación de la función respiratoria en muchas enfermedades pulmonares y en la regeneración alveolar inducida por lesiones. Sin embargo, aunque la comunidad de investigación pulmonar está de acuerdo sobre la utilidad de la ISA como una métrica útil, hasta la fecha, ha...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer el apoyo del Instituto Nacional de Ciencias Biológicas de Beijing. Este trabajo fue apoyado por la Fundación Municipal de Ciencias Naturales de Beijing (No. Z17110200040000).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 mL Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
Referencias
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. Morphometry of the Human Lung. , Springer-Verlag. Berlin Heidelberg. (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318(2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados