Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une méthode standardisée pour mesurer la surface interne du poumon par la pneumonie et la prothèse
Dans cet article
Résumé
La zone de surface pulmonaire interne (ISA) est un critère critique pour évaluer la morphologie pulmonaire et la physiologie dans les maladies pulmonaires et la régénération alvéolaire induite par les blessures. Nous décrivons ici une méthode standardisée qui peut minimiser le biais de mesure pour ISA dans les modèles de la pneumonectomie pulmonaire et de la souris implantation de la prothèse.
Résumé
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introduction
La fonction fondamentale du poumon est l'échange d'oxygène et de dioxyde de carbone entre les vaisseaux sanguins et l'atmosphère. Les maladies pulmonaires telles que la dysplasie bronchopulmonaire (BPD), la maladie pulmonaire obstructive chronique (MPOC) et les infections respiratoires aiguës entraînent une diminution de l'ISA 2 . Les chercheurs qui étudient la maladie pulmonaire ont développé plusieurs méthodes quantitatives pour évaluer les changements morphologiques dans les poumons, y compris MLI, ILV, nombre d'unités d'échange de gaz, ISA et compliance tissulaire pulmonaire 2 , 3 . Études pionnières par Weibel et al. 4 et Duguid et al. 5 établissent ensemble que l'ISA peut être utilisé comme mesure directe de la capacité d'échange de gaz pulmonaire dans les poumons humains et peut être utilisé comme critère pour déterminer la gravité de l'emphysème. Un certain nombre d'études publiées au cours des cinq dernières années ont utilisé des paramètres morphologiques pulmonaires ( p. Ex. ISA et MLI) pour évaluer les changements morphologiques et fonctionnels dans les poumons de la souris pendant le développement 6 et pendant la récupération de la lésion PNX 1 , 7 . ISA est calculé en utilisant l' équation 1 8 , 9 :
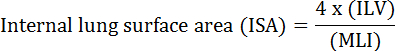
, Où ILV est le volume pulmonaire interne et MLI est un paramètre intermédiaire qui représente l'espace périphérique pulmonaire taille 10 .
PNX, l'ablation chirurgicale d'un ou plusieurs lobes de poumon, a été largement rapportés pour induire la régénération alvéolaire chez de nombreuses espèces, y compris les humains, les souris 11 1, 12 les chiens, les rats et les lapins 13, 14, 15. Un goujonY des poumons de souris à quatorze jours après la PNX a montré que l'expansion des alvéoles préexistants et la formation de novo des alvéoles contribuent à la restauration de l'ISA, de l'ILV et du nombre d'alvéoles dans les tissus pulmonaires restants 1 . Nous et d'autres ont montré que l'insertion de matériaux tels que l'éponge, la cire ou une prothèse sur mesure dans la cavité thoracique vide suivant la PNX ( c'est -à- dire l' implantation de la prothèse) entrave la régénération alvéolaire. Il est maintenant établi que la force mécanique fonctionne comme l'un des facteurs les plus importants pour l'initiation de la régénération alvéolaire 1 , 16 , 17 . De telles études ont mis en évidence l'efficacité de l'utilisation des valeurs ISA des poumons traités par la PNX et de la prothèse comme critère pour évaluer quantitativement la régénération alvéolaire.
Le biais d'observateur est connu pour influencer de manière significative les valeurs mesuréesLues pour les paramètres morphologiques pulmonaires ( p . Ex. , MIL et ILV). Des protocoles standardisés peuvent être utilisés pour éviter ce biais en déterminant à la fois ILV et MLI, qui sont les deux paramètres utilisés dans le calcul de l'ISA. Ici, nous fournissons des protocoles hautement détaillés et standardisés pour mesurer ces paramètres pulmonaires. Fait important, la capacité de quantifier avec précision l'ISA promet d'améliorer la fiabilité et la reproductibilité des études de la fonction pulmonaire dans les modèles de régénération alvéolaire induite par les blessures et devrait faciliter les découvertes mécanistes dans de multiples maladies pulmonaires.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les procédures utilisées dans ce protocole ont été effectuées conformément aux recommandations des Lignes directrices pour la prise en charge et l'utilisation des animaux de laboratoire de l'Institut national des sciences biologiques de Pékin. Les souris mâles CD-1 de 8 semaines ont été logées dans une installation spécifique de pathogène (SPF) jusqu'à ce que les expériences aient été réalisées. Les chirurgies ont été effectuées en utilisant des souris complètement anesthésiées ( c. -à- d. , Sans réponses de pincement). Après la chirurgie, les souris ont été conservées dans une pièce chaude et humide avec suffisamment de nourriture et d'eau douce. Les souris ont été sacrifiées en utilisant une overdose d'anesthésie délivrée par injection intraperitoneale.
1. La chirurgie de la souris PNX
- Anesthésier complètement les souris avec du phénobarbital de sodium (120 mg / kg de poids corporel) et de la buprénorphine (0,1 mg / kg de poids corporel) par injection intrapéritonéale (IP). Effectuer une intervention chirurgicale lorsque les souris ne réagissent plus au pincement des orteils.
- Retirer les cheveux sur le thorax gauche des souris avec dépôts chimiquesTraitement oral (~ 3 x 3 cm 2 ).
- Fixez chaque souris sur une plate-forme d'intubation avec son côté ventral face à l'opérateur ( Figure 1A ).
- Retirez la langue de la souris et illuminez les cordes vocales avec un petit laryngoscope contenant un entaille pour guider les cathéters 18 ( Figure 1A ).
- Distinguez les cordes vocales en observant les mouvements des cordes vocales pendant la respiration. Insérer doucement une canule d'intubation intraveineuse 20 G dans la trachée à un angle antérieur 19 .
- Placez les souris dans une position latérale droite et raccordez la canule à un ventilateur mécanique ( p. Ex., Contrôlé sous pression, voir la Table des matériaux ). Vérifiez l'insertion de la canule dans la trachée en observant les mouvements de respiration du coffre de la souris ( figure 1B ).
- Réglez la pression inspiratoire oF le ventilateur à 12 cm H 2 O et régler le taux respiratoire à 120 respirations par minute ( figure 1B ).
- Décontaminer la peau dans la zone chirurgicale avec de la betadine et 70% d'éthanol.
- Faire une incision thoracique post-latérale de 2 à 3 cm dans l'espace au 5 e espace intercostal, couper la peau et les muscles avec les ciseaux Noyes Spring (tranchant: 14 mm, diamètre de la pointe: 0,275 mm) ( figure 2B , C ). Les instruments chirurgicaux utilisés pour la procédure de thoracotomie sont stérilisés avant utilisation.
- Faire une incision de 1,5 cm au 5 ème espace intercostal pour exposer le poumon gauche ( Figure 2D , E ). Pendant l'opération, utilisez un cautériseur haute température pour arrêter le saignement.
- Soulevez un tiers du lobe pulmonaire gauche de la poitrine avec des pinces à pointe émoussée ( Figure 2F ), puis utilisez un coton-tige pour retirer toute la gauchePoumon ( figure 2G ).
- Identifiez l'artère pulmonaire et les bronches du lobe pulmonaire gauche ( Figure 2G ).
- Relier légèrement les bronches et les vaisseaux au hilum avec une suture chirurgicale en soie et découper le lobe du poumon gauche à 3 - 4 mm de la ligature ( Figure 2H , I ).
REMARQUE: Veillez à ne pas couper les noyaux de suture sur le hile gauche, ce qui peut provoquer un pneumothorax ( c. -à- d. , De l'air ou du gaz dans la cavité du thorax) . - Fermez le mur de la poitrine avec 1 suture, puis coupez la couche musculaire et la couche de peau séquentiellement, en utilisant 5 à 6 sutures interrompues. Laisser un intervalle de 3 à 4 mm entre chaque suture ( Figure 2M , 2N ).
REMARQUE: retirez l'aiguille de suture chirurgicale du cœur; La perforation cardiaque par inadvertance entraînera une mort immédiate. - Désinfectez la zone chirurgicale avec de la povidone-iode.
- AfteEn cas d'opération chirurgicale, placez la souris sur un tampon thermique de 38 ° C et connectez la souris au ventilateur jusqu'à ce que les mouvements de respiration spontanés commencent ( Figure 2O ).
2. Implantation de prothèse
- Effectuez les étapes 1.1 à 1.13 de la procédure PNX (c'est-à-dire jusqu'à ce que le lobe pulmonaire gauche de la souris soit supprimé).
- Serrer le centre de la prothèse de silicone (fabriqué par le client, 12 mm de longueur, 3 mm d'épaisseur, 7 mm de largeur, 0,2 g, forme ellipsoïde) à l'aide de pinces émoussées ( figure 2J ). Stériliser la prothèse de silicone avant l'insertion.
- Tenez la côte avec des pinces d'une main pour exposer la cavité thoracique, puis insérez la prothèse dans la cavité thoracique vide gauche avec une autre main.
NOTE: L'angle d'insertion est d'environ 45 degrés entre le plan frontal de la prothèse et la surface thoracique ( Figure 2K ,L). Soyez très doux lors de l'insertion de la prothèse. Une force excessive entraînera une rupture pleurale. - Ajustez l'orientation de la prothèse avec une pince serrée pour s'assurer que la prothèse occupe la cavité thoracique vide gauche.
- Effectuez les étapes 1.14 - 1.16 de la procédure PNX de la souris.
3. Mesure de l'ILV
- Préparez un périphérique personnalisé ("tube de gonflage") qui consiste en un émetteur retiré d'une pipette sérologique jetable (10 mL), d'un tube flexible de 40 cm de long avec un adaptateur à aiguille, une vanne de régulation de débit et une aiguille de 18 G. Après l'assemblage, fixez la pipette sur une carte avec du ruban adhésif ( Figure 3A ). La distance entre le haut de la pipette et le banc expérimental doit être d'au moins 30 cm.
- Préparer une solution de fixation à 4% de paraformaldéhyde fraîche (PFA) en dissolvant 20 g de PFA dans 500 ml de solution salée tamponnée au phosphate (PBS) préchauffée dans un bain d'eau à 55 ° C, en agitant manuellementTous les 10 min jusqu'à ce que la solution soit claire. Après refroidissement à température ambiante, filtrer la solution avec un filtre de 0,45 μm.
ATTENTION: Portez un équipement de protection individuelle approprié (PPE) lors de la manipulation de PFA. - Sacrifiez des souris avec une injection de surdoses d'anesthésie (0,8% de phénobarbital de sodium, 1000 U / ml d'héparine).
- Fixez chaque souris sur une plaque de dissection de polystyrène et vaporisez-la avec 70% d'alcool.
- Ouvrez soigneusement le coffre de la souris et découpez le sternum à l'aide de ciseaux pour exposer complètement les lobes pulmonaires.
- Retirer les tissus excessifs à l'aide de ciseaux pour exposer la trachée. Assurez-vous de séparer la trachée de l'œsophage.
- Couper l'aorte abdominale et insérer une aiguille de calibre 25 dans le ventricule droit du cœur; Connectez l'aiguille à une seringue de 20 mL avant cette insertion. Poussez lentement 1x PBS dans le cœur pour enlever les globules sanguins jusqu'à ce que les poumons deviennent blancs. Typiquement, 5 à 10 mL de PBS sont nécessaires pour éliminer les vaisseaux sanguins pulmonaires.
- Remplir leE tube de gonflage sur mesure avec 4% de PFA frais et éliminez toutes les bulles du tube de gonflage.
- Insérez l'aiguille de calibre 18 du tube de gonflage dans la trachée et pressez la trachée avec des clips de vaisseaux pour éviter les fuites de fluide.
- Gonfler les poumons avec 4% de PFA à une pression transpulmonaire constante de 25 cm / H 2 O 2 , 20 . Incuber les poumons à température ambiante pendant 2 h pour obtenir des poumons complètement expansés. Cette étape "pré-réparatrice" est essentielle pour préserver la morphologie pulmonaire.
- En surveillant le tube de gonflage, notez la valeur du volume initial de 4% de PFA et enregistrez le volume final. Le volume interne du poumon est égal au volume initial de 4% de PFA moins le volume final de 4% de PFA.
- Relier la trachée et utiliser des ciseaux, disséquer doucement les poumons (garder les poumons intacts) à partir des tissus conjonctifs environnants. Soyez très doux pour éviter d'endommager les poumons.
- IncuBattre les poumons dans un tube conique de 50 ml rempli de PFA à 4% pendant 12 h à 4 ° C avec un tremblement doux sur un agitateur (50 tr / min). Procédez au traitement et à la coloration des tissus (voir la section 4).
4. Implantation tissulaire, coupe et coloration de l'hématoxyline et de l'éosine (H & E)
- Après la fixation, utilisez Noyes Spring Scissors pour couper le cœur et les tissus conjonctifs excessifs hors des poumons. Séparer doucement les lobes pulmonaires individuels en coupant la bronche qui relie les lobes pulmonaires à la trachée.
- Laver extensivement les lobes pulmonaires 3 à 4 fois dans 50 mL 1x PBS (30 min / laver) sur un agitateur orbital (50 tr / min).
- Après le lavage final, cryoprotection des lobes pulmonaires en les immergeant dans une solution de saccharose à 30% (en 1x PBS) à 4 ° C jusqu'à ce que le tissu s'enfonce au fond des tubes coniques de 50 ml (environ 12 h).
- Avant d'intégrer et de cryosectionner les tissus, retirer les échantillons de lobes pulmonaires des tubes avec des pinces, conserver l'accessoireLes sels de sory pour l'analyse histologique, dab la solution de saccharose restante à partir de la surface des échantillons de lobes accessoires, puis plonger complètement l'échantillon dans une boîte de Petri contenant un composé de température de coupe optimal (OCT) pendant environ 30 minutes.
- Geler les échantillons de lobes accessoires installés OCT dans de l'azote liquide à l'aide de cryomolds. Placez la plus grande surface du lobe parallèlement au fond du moule.
- Préparez un total de trois sections de 10 μm d'épaisseur pour chaque échantillon lors de la criosection pour une analyse histologique. Jeter les premiers 1 mm de tissu, collecter une section de 10 μm d'épaisseur, jeter 0,5 mm de tissu, collecter une autre section, jeter 0,5 mm de tissu et collecter la troisième (dernière) section.
- Séchez à l'air les sections pendant 1 h avant d'effectuer une coloration H & E.
- Effectuer la coloration H & E
- Lavez les sections en 3 à 4 changements d'eau du robinet, puis tachez les sections dans de l'hématoxyline minérale pendant 2 min.; Rincez la section sous l'eau courante du robinet; Immergez la section deux fois dans une solution à 1% de HCl à 70% d'éthanol pour éliminer l'excès d'hexatoxyline.
- Couper la section en éosine fraîche pendant 3 min; Déshydrater les sections avec deux lavages successifs de 30 s dans de l'éthanol à 95% et deux 30 s de lavage à 100% d'éthanol; Nettoyer les sections en xylène pendant 30 s, répéter l'étape de déblaiement une fois dans du xylene frais; Montez les diapositives avec un support en utilisant des lamelles en verre.
5. Quantification de MLI
- Acquérir des images numériques des sections de lobes accessoires H & E (grossissement 20X) à l'aide d'un microscope à champ brillant.
- Pour quantifier le MLI, sélectionnez un total de 15 vues non chevauchantes (1000 μm x 1000 μm) de manière aléatoire dans les zones appropriées (sans artères et veines, voies respiratoires majeures et conduits alvéolaires) de 3 sections.
- Placez une grille avec 10 lignes verticales uniformément réparties et 10 lignes horizontales également réparties de lentille définieGth (1000 μm) sur les zones de vue choisies à l'aide d'un outil de règle; Chaque ligne est ainsi espacée de 100 μm ( figure 4B ).
- Définissez la valeur d'une interception en tant que longueur linéaire entre deux épithélium alvéolaire adjacent. Mesurez les valeurs de tous les interceptions le long de chaque ligne de longueur de 1000 μm.
- Pour chaque grille, quantifier les valeurs de tous les interceptions parmi les 10 lignes horizontales de 1000 μm et les 10 lignes verticales de 1000 μm.
NOTE: MLI est la valeur moyenne des longueurs d'intersection d'un total de 15 grilles analysées parmi les 3 sections préparées pour chacun des lobes accessoires.
6. Calcul de l'ISA
- Calculez l'ISA en utilisant l' équation 1 (voir Introduction ). Reportez-vous à la section 3 pour la mesure de l'ILV et se référer à la section 5 pour la quantification de MLI.
Access restricted. Please log in or start a trial to view this content.
Résultats
Nous avons effectué ici une expérience avec un groupe traité par PNX et un groupe d'implantation de prothèse (implanté en prothèse). Ces groupements sont identiques aux groupements utilisés dans une étude publiée précédemment de notre groupe de recherche 14 .
Le PNX de la souris et les procédures d'implantation de la prothèse sont présentés à la figure ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Dans ce protocole, nous fournissons des descriptions détaillées sur la mesure des paramètres pulmonaires après le PNX du poumon gauche et l'implantation de la prothèse. L'ISA est maintenant considérée comme une mesure clé pour l'évaluation de la fonction respiratoire dans de nombreuses maladies pulmonaires et dans la régénération alvéolaire induite par une blessure. Cependant, bien que la communauté de recherche pulmonaire soit d'accord sur l'utilité de l'ISA comme mesure utile, à...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Les auteurs souhaitent remercier l'Institut national des sciences biologiques de Beijing pour l'assistance. Ce travail a été soutenu par la Fondation municipale des sciences naturelles de Beijing (n ° Z17110200040000).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 mL Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
Références
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. Morphometry of the Human Lung. , Springer-Verlag. Berlin Heidelberg. (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318(2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon