JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스 폐 전 절제술 및 보철물 삽입을 통한 내시경 표면 측정을위한 표준화 된 방법
요약
내부 폐 표면적 (ISA)은 폐 질환 및 부상 유발 폐포 재생에서 폐 형태 및 생리학을 평가하는 데 중요한 기준입니다. 폐 절제술 및 인공 삽입물 마우스 모델에서 ISA의 측정 편향을 최소화 할 수있는 표준화 된 방법을 설명합니다.
초록
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
서문
폐의 기본 기능은 혈관과 대기 사이의 산소와 이산화탄소의 교환입니다. 기관지 폐 이형성증 (BPD), 만성 폐색 성 폐 질환 (COPD) 및 급성 호흡기 감염과 같은 폐 질환은 ISA 2 를 감소시킵니다. 폐 질환을 연구하는 연구자들은 MLI, ILV, 기체 교환 단위 수, ISA 및 폐 조직 적합성 2 , 3을 포함하여 폐의 형태 학적 변화를 평가하기위한 몇 가지 정량적 방법을 개발했습니다. Weibel 등의 선구자 연구 4 및 Duguid et al. 5는 함께 ISA가 인간의 폐에서 폐 가스 교환 용량의 직접 척도로 사용될 수 있음을 입증했으며 기종의 심각성을 판단하는 기준으로 사용할 수있다. 지난 5 년 동안 발표 된 여러 연구에서 폐 형태 학적 매개 변수 ( 예 : ISA 및 MLI)가 개발 중에 6 및 부상 PNX 1 (7)로부터 복구시 쥐의 폐에 형태 학적 및 기능적 변화를 평가한다. ISA는 식 1 8 , 9를 사용하여 계산됩니다.
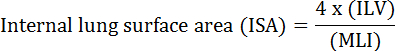
, ILV 내부 폐 용적이며 MLI는 말초 폐 공역 10 크기를 나타내는 매개 변수이다.
하나 이상의 폐엽의 외과 적 제거 인 PNX는 인간 11 , 마우스 1 , 개 12 , 쥐 13 및 토끼 14 , 15를 비롯한 많은 종에서 폐포 재생을 유도하는 것으로 널리보고되었습니다. 스터드PNX 후 14 일째 생쥐의 폐는 기존 폐포의 팽창과 폐포의 새로운 형성 모두 남아있는 폐 조직에서 ISA, ILV 및 폐포의 수를 회복시키는 데 기여한다고보고했다 1 . 우리와 다른 사람들은 스폰지, 왁스 또는 주문형 보철물과 같은 재료를 PNX ( 즉 , 보철물 삽입) 후 빈 흉부 공동에 삽입하면 폐포 재생을 손상시키는 것으로 나타났습니다. 기계적 힘은 폐포 재생을 시작하는 가장 중요한 요인 중 하나로 작용한다고 확고하게 확립되었습니다 1 , 16 , 17 . 이러한 연구는 PNX 치료 및 인공 삽입물 폐에서 ISA 값을 사용하여 폐포 재생을 정량적으로 평가하는 기준으로 사용하는 것이 효과적이라는 것을 강조했습니다.
옵서버 바이어스는 측정 된 VA에 유의 한 영향을 미치는 것으로 알려져 있습니다.폐 형태 학적 매개 변수 ( 예 : MIL 및 ILV)에 대한 정보. 표준화 된 프로토콜은 ISA 계산에 사용 된 두 가지 매개 변수 인 ILV와 MLI를 결정할 때이 편향을 없애기 위해 사용할 수 있습니다. 여기서는 이러한 폐 매개 변수를 측정하기위한 매우 상세한 표준화 된 프로토콜을 제공합니다. 중요하게도, ISA를 정확히 정량화하는 능력은 손상 유발 폐포 재생 모델에서 폐 기능 연구의 신뢰성과 재현성을 향상시키고 다중 폐 질환에서 기계적 발견을 촉진해야한다고 약속한다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
이 프로토콜에 사용 된 모든 절차는 국립 생물 과학 연구소의 실험실 동물의 관리 및 사용에 관한 지침의 권장 사항에 따라 수행되었습니다. 8 주된 CD-1 수컷 마우스를 실험이 수행 될 때까지 특정 병원균이없는 (SPF) 시설에 수용했다. 수술은 완전히 마취 된 마우스를 사용하여 수행되었습니다 ( 즉 , 발가락 핀치 반응없이). 수술 후 쥐는 충분한 음식과 담수가있는 따뜻하고 습기가 많은 방에 보관했다. 복강 내 주사에 의해 전달 된 과량의 마취제를 사용하여 마우스를 희생시켰다.
1. 마우스 PNX 수술
- 복막 내 (IP) 주사를 통해 sodium phenobarbital (120 mg / kg body weight)과 buprenorphine (0.1 mg / kg body weight)으로 마우스를 완전히 마취하십시오. 쥐가 더 이상 발가락에 눌려지지 않을 때 수술을하십시오.
- 화학 요원으로 마우스의 왼쪽 흉부에있는 머리카락을 제거하십시오.흉내 치료 (~ 3 x 3 cm 2 영역).
- 복부 측면이 조작자를 향하게하여 삽관 플랫폼에 각 마우스를 고정시킵니다 ( 그림 1A ).
- 마우스 혀를 당기고 유도 카테터 18 ( 그림 1A )에 대한 노치가 들어있는 작은 동물 후두경으로 성대를 밝히십시오.
- 호흡 중 성대의 움직임을 관찰하여 성대를 구분하십시오. 20G의 정맥 내 삽관 캐뉼라를 전방 각으로 기관에 부드럽게 삽입하십시오 19 .
- 우측 가로 누운 위치에 마우스를 위치시키고 기계적 인공 호흡기에 연결 캐 뉼러 (예를 들어, 제어 된 압력은, 재료의 도표 참조). 마우스 가슴 ( 그림 1B )의 호흡 움직임을 관찰하여 기관에 캐뉼라의 삽입을 확인합니다.
- 흡기 압력을 설정하십시오.f 인공 호흡기를 12cm H 2 O에 놓고 호흡 속도를 분당 120 회 호흡으로 설정합니다 ( 그림 1B ).
- 베타 딘과 70 % 에탄올로 수술 부위의 피부를 오염 제거하십시오.
- Noyes Spring Scissors (절삭 날 14 mm, 팁 직경 0.275 mm)로 피부와 근육을 절단하여 5 번째 늑간 간격의 공간에서 2 - 3 cm 외측 개흉술 절개를합니다 ( 그림 2B , C ). thoracotomy 절차에 사용되는 수술 악기는 사용하기 전에 소독됩니다.
- 5 번째 늑간에서 1.5 cm 절개하여 왼쪽 폐를 노출시킵니다 ( 그림 2D , E ). 수술 중 고열 소작 기계를 사용하여 출혈을 중지하십시오.
- 무뚝뚝한 팁 겸자 ( 그림 2F )와 가슴에서 왼쪽 폐엽의 3 분의 1을 들어 올린 다음 면봉을 사용하여 왼쪽 전체를 꺼내십시오폐 ( 그림 2G ).
- 왼쪽 폐엽의 폐동맥과 기관지를 확인하십시오 ( 그림 2G ).
- hilum에서 기관지와 혈관을 실크 수술 봉합사로 단단히 묶고 결찰 후 3 - 4 mm 지점에서 왼쪽 폐엽을 잘라냅니다 ( 그림 2H , I ).
참고 : 기흉을 일으킬 수있는 왼쪽 고관절의 봉합 매듭을 자르지 않도록주의하십시오 ( 즉 , 흉부의 공동에 공기 또는 가스가 발생할 수 있음) . - 1 봉합으로 가슴 벽을 닫은 다음 5 ~ 6 개의 중단 봉합을 사용하여 근육 층과 피부 층을 순차적으로 꿰맬 수 있습니다. 각 봉합사 사이에 3 - 4 mm 간격을 두십시오 ( 그림 2M , 2N ).
참고 : 외과 봉합 바늘을 심장에서 멀리 떨어지십시오. 부주의 한 심장 천자로 인해 즉시 사망 할 수 있습니다. - 포비돈 요오드로 수술 부위를 소독합니다.
- 애프터외과 수술에서 마우스를 38 ° 열 패드에 놓고 마우스를 인공 호흡 운동이 시작될 때까지 인공 호흡기에 연결하십시오 ( 그림 2O ).
2. 보형물 삽입
- PNX 절차의 1.1-1.13 단계를 수행하십시오 (즉, 마우스의 왼쪽 폐엽이 제거 될 때까지).
- 무딘 집게 ( 그림 2J )를 사용하여 실리콘 보철의 중심을 고정하십시오 (길이 12 mm, 두께 3 mm, 너비 7 mm, 0.2 g, 타원체 모양). 실리콘 삽입물을 삽입하기 전에 소독하십시오.
- 한 손으로 집게로 늑골을 잡고 흉강을 노출시킨 다음 다른 손으로 왼쪽 빈 가슴 흉강에 인공 삽입물을 삽입하십시오.
참고 : 삽입 각도는 보철의 정면과 흉부 표면 사이에서 약 45도입니다 ( 그림 2K ,L). 인공 삽입물 삽입시 매우 부드럽게하십시오. 과도한 힘은 흉막 파열로 이어질 것입니다. - 보철물이 왼쪽 빈 흉강을 차지하도록 무딘 집게로 보철물의 방향을 조정하십시오.
- 마우스 PNX 절차의 1.14-1.16 단계를 수행하십시오.
3. ILV 측정
- 일회용 혈청 피펫 (10 mL)에서 꺼낸 플런저, 바늘 어댑터가 달린 40 cm 길이의가요 관, 유속 조절 밸브 및 18 G 바늘로 구성된 맞춤 장치 ( "팽창 튜브")를 준비하십시오. 조립 후 테이프로 보드에 피펫을 고정시킵니다 ( 그림 3A ). 피펫 상단과 실험대 사이의 거리는 최소 30cm 이상이어야합니다.
- 55 ° C의 수 욕조에서 500 mL의 예비 가열 된 1x 인산 완충 생리 식염수 (PBS)에 20 g의 PFA를 용해시켜 신선한 4 % 파라 포름 알데히드 (PFA) 고정 용액을 수동으로 흔들어서 준비하십시오용액이 깨끗해질 때까지 매 10 분마다. 실온으로 냉각시킨 후, 용액을 0.45 ㎛ 필터로 여과한다.
주의 : PFA를 취급 할 때는 적절한 개인 보호 장비 (PPE)를 착용하십시오. - 과량의 마취제 (0.8 % 페노바르비탈 나트륨, 1,000 U / mL 헤파린)로 마우스를 희생시킵니다.
- 폴리스티렌 해부 플레이트에 각 마우스를 고정하고 70 % 알콜로 뿌리십시오.
- 조심스럽게 마우스 가슴을 열고 가위를 사용하여 흉골을 잘라내어 폐엽을 철저히 노출시킵니다.
- 기관을 가위로 가위로 과도한 조직을 제거하십시오. 기관과 식도를 분리하십시오.
- 복부 대동맥을 잘라 심장의 오른쪽 심실에 25 게이지 바늘을 삽입합니다. 이 삽입 전에 바늘을 20 mL 주사기에 연결하십시오. 폐가 흰색으로 변할 때까지 천천히 1x PBS를 심장에 밀어 넣어 혈액 세포를 제거하십시오. 일반적으로 폐 혈관을 치우기 위해 5 - 10 mL PBS가 필요합니다.
- 채우기e 4 % 신선한 PFA로 인플레이션 튜브를 주문 제작하고 인플레이션 튜브에서 모든 거품을 제거하십시오.
- 팽창 튜브의 18 게이지 바늘을 기관에 삽입하고 유체 누출을 피하기 위해 혈관 클립으로 기관을 클립하십시오.
- 25cm의 일정한 압력 경폐 / H 2 O 2 (20)에 4 % PFA와 폐 팽창. 완전히 확장 된 폐를 달성하기 위해 2 시간 동안 실온에서 폐를 품어. 이 "예비 고정"단계는 폐 형태를 보존하는 데 중요합니다.
- 팽창 튜브를 모니터링하여 초기 4 % PFA 볼륨의 값을 기록하고 최종 볼륨을 기록하십시오. 내부 폐 부피는 초기 4 % PFA 체적에서 최종 4 % PFA 체적을 뺀 값과 같습니다.
- 기관지를 가리고 가위로 가볍게 주변의 결합 조직에서 폐를 해부합니다 (폐를 손상시키지 않음). 폐를 손상시키지 않도록 매우 조심하십시오.
- 인큐4 ℃에서 12 시간 동안 4 % PFA로 채워진 50-mL 원추형 튜브에서 폐를 흔들어 쉐이커 (50 rpm)에서 부드럽게 흔들어줍니다. 조직 처리 및 염색으로 진행하십시오 (4 절 참조).
4. 조직 Embedding, 단면 및 Hematoxylin & Eosin (H & E) 염색
- 고정 후 Noyes Spring Scissors를 사용하여 폐에서 심장 및 과도한 결합 조직을 잘라냅니다. 폐 엽을 기관과 연결하는 기관지를 잘라내어 각 폐엽을 부드럽게 분리하십시오.
- 궤도 진탕 기 (50 rpm)에서 50 mL 1x PBS (30 분 / 세척)로 폐 엽을 3 ~ 4 회 씻어냅니다.
- 최종 세척 후, 조직이 50 ML 원추형 튜브 (약 12 H)의 바닥에 싱크 때까지 4 ° C에서 30 % 자당 솔루션 (1x PBS)에 그들을 immersing하여 폐엽을 cryoprotect.
- 조직을 임베딩하고 cryosectioning하기 전에 포셉과 튜브에서 폐엽 샘플을 제거하고, 액세스를 유지(sory lobes)을 이용하여 부엽 시료의 표면에서 남아있는 자당 용액을 추출한 다음 최적 절단 온도 (OCT) 화합물이 들어있는 페트리 접시에 시료를 약 30 분 동안 담그십시오.
- Cryomolds를 사용하여 액체 질소로 OCT 임베디드 액세서리 엽 샘플을 고정합니다. 로브의 가장 큰 표면적을 몰드 바닥에 평행하게 위치시킵니다.
- 조직학 분석을위한 cryosectioning 동안 각 샘플에 대한 총 세 μm의 두께 섹션을 준비합니다. 처음 1 mm 조직을 버리고 10 μm 두께의 부분을 하나씩 수집하고 0.5 mm 조직을 버리고 다른 부분을 수집 한 다음 0.5 mm 조직을 버리고 세 번째 (최종) 부분을 수집합니다.
- H & E 염색을하기 전에 1 시간 동안 공기 건조하십시오.
- H & E 얼룩 수행
- 수돗물을 3 ~ 4 차례 변경 한 다음 신선한 hematoxylin에서 2 분 동안 얼룩을 지우십시오; 흐르는 수돗물 아래의 섹션을 헹구십시오; 과량의 헤 마톡 실린을 제거하기 위해 1 % HCl-70 % 에탄올 용액에 2 번 섹션을 담그십시오.
- 3 분 동안 신선한 에오 신의 섹션 얼룩; 95 % 에탄올에서 2 번 연속으로 30 번 세척하고 100 % 에탄올로 2 번 30 번 세척하여 절편을 탈수시킵니다. 30 초 동안 크실렌의 단면을 깨끗이하고, 신선한 크실렌에서 1 회 제거 단계를 반복한다; 유리 coverslips를 사용하여 마운트 매체와 슬라이드를 탑재하십시오.
5. MLI의 정량화
- 명 시야 현미경을 사용하여 H & E로 염색 한 액세서리 로브 섹션 (20X 배율)의 디지털 이미지를 수집하십시오.
- MLI를 정량화하려면 3 개의 섹션으로 구성된 적절한 영역 (동맥 및 정맥, 주요기도 및 폐포 덕트 없음)에서 총 15 개의 중첩되지 않는 뷰 (1,000 μm x 1,000 μm)를 무작위로 선택하십시오.
- 10 개의 고르게 분포 된 수직선과 정의 된 len의 균등하게 분포 된 10 개의 수평선이있는 격자 배치눈금자 도구를 사용하여 선택한 영역에서 gth (1,000 μm); 따라서 각 라인은 100 μm 떨어져 있습니다 ( 그림 4B ).
- 하나의 절편 값을 인접한 두 개의 폐포 상피 사이의 직선 길이로 정의하십시오. 1,000 μm 길이 선을 따라 모든 절편 값을 측정하십시오.
- 각 그리드에 대해 가로 10 개, 세로 1,000 개, 세로 10 개 사이의 모든 절편 값을 계량화하십시오.
참고 : MLI는 각각의 액세서리 로브에 대해 준비된 3 개의 섹션 중에서 분석 된 총 15 개의 그리드로부터 절편 길이의 평균값입니다.
6. ISA의 계산
- 등식 1을 사용하여 ISA를 계산하십시오 ( 소개 참조). ILV의 측정에 대해서는 3 장을 참조하고 MLI의 정량화에 대해서는 5 장을 참조하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
우리는 여기서 PNX 치료군과 인공 삽입물 (인공 삽입물)을 사용한 실험을 수행했습니다. 이러한 그룹은 이전에 발표 된 연구 그룹의 연구에서 사용한 그룹과 동일합니다 14 .
마우스 PNX 및 보철물 삽입 절차는 그림 2에 나와 있습니다. 8 주 된 CD-1 수컷 마우스가 수술과 정량화에 사용...
Access restricted. Please log in or start a trial to view this content.
토론
이 프로토콜에서는 마우스 왼쪽 폐 PNX 및 보철물 삽입 후 폐 매개 변수 측정에 대한 자세한 설명을 제공합니다. ISA는 현재 많은 폐 질환 및 부상 유발 폐포 재생에서 호흡 기능 평가의 주요 척도로 간주됩니다. 그러나 폐 연구 공동체가 ISA의 유용성에 관해서는 유용한 척도로 동의하고 있지만 현재까지는 ISA를 계산하는 데 사용 된 두 가지 매개 변수 인 ILV 및 MLI 측정의 표준화에 대해서는 거의 고?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 북경 생물 과학 연구소 (Beijing Institute of Biological Sciences)에 도움을 청한다. 이 연구는 베이징 시립 자연 과학 재단 (No. Z17110200040000)의 지원을 받았다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 mL Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
참고문헌
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. Morphometry of the Human Lung. , Springer-Verlag. Berlin Heidelberg. (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318(2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유