É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um Método Padronizado para Medição da Superfície de Pulmão Interna via Neumonectomia de Mouse e Implante de Prótese
Neste Artigo
Resumo
A área de superfície pulmonar interna (ISA) é um critério crítico para avaliar a morfologia pulmonar e a fisiologia em doenças pulmonares e regeneração alveolar induzida por lesão. Descrevemos aqui um método padronizado que pode minimizar o viés de medição para ISA tanto na pneumonectomia pulmonar quanto nos modelos de mouse de implante de prótese.
Resumo
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introdução
A função fundamental do pulmão é a troca de oxigênio e dióxido de carbono entre os vasos sanguíneos e a atmosfera. As doenças pulmonares como a displasia broncopulmonar (DBP), a doença pulmonar obstrutiva crônica (DPOC) e as infecções respiratórias agudas resultam em diminuição da AIS 2 . Pesquisadores que estudaram doença pulmonar desenvolveram vários métodos quantitativos para avaliar alterações morfológicas nos pulmões, incluindo MLI, ILV, número de unidades de troca de gás, ISA e adesão ao tecido pulmonar 2 , 3 . Estudos pioneiros de Weibel et al. 4 e Duguid et al. 5 juntos estabeleceram que o ISA pode ser usado como uma medida direta da capacidade de troca de gás pulmonar em pulmões humanos e pode ser usado como critério para determinar a gravidade do enfisema. Uma série de estudos publicados nos últimos cinco anos utilizaram parâmetros morfológicos pulmonares ( por exemplo, ISA e MLI) para avaliar mudanças morfológicas e funcionais nos pulmões de camundongos durante o desenvolvimento 6 e durante a recuperação da lesão PNX 1 , 7 . O ISA é calculado usando a Equação 1 8 , 9 :
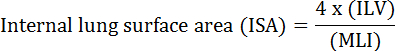
, Onde ILV é o volume pulmonar interno e MLI é um parâmetro intermediário que representa o espaço aéreo periférico do espaço 10 .
A PNX, a remoção cirúrgica de um ou mais lóbulos pulmonares, foi amplamente relatada para induzir regeneração alveolar em muitas espécies, incluindo humanos 11 , camundongos 1 , cães 12 , ratos 13 e coelhos 14 , 15 . Um galinheiroDos pulmões de ratos aos catorze dias pós-PNX mostraram que tanto a expansão dos alvéolos pré-existentes como a formação de novo de alvéolos contribuem para a restauração de ISA, ILV e o número de alvéolos nos demais tecidos pulmonares 1 . Nós e outros mostraram que a inserção de materiais como esponja, cera ou uma prótese em forma de costume na cavidade torácica vazia após PNX ( ou seja , implantação de prótese) prejudica a regeneração alveolar. Agora está firmemente estabelecido que a força mecânica funciona como um dos fatores mais importantes para iniciar a regeneração alveolar 1 , 16 , 17 . Tais estudos evidenciaram a eficácia do uso de valores ISA de pulmões tratados com PNX e Prótese implantada como critério para avaliar quantitativamente a regeneração alveolar.
Observa-se que o viés observador influencia significativamente a variaçãoLua para parâmetros morfológicos pulmonares ( por exemplo , MIL e ILV). Protocolos padronizados podem ser usados para evitar este viés na determinação de ILV e MLI, que são os dois parâmetros utilizados no cálculo de ISA. Aqui, fornecemos protocolos altamente detalhados e padronizados para medir esses parâmetros pulmonares. Importante, a capacidade de quantificar com precisão a ISA promete melhorar a confiabilidade e a reprodutibilidade dos estudos sobre a função pulmonar em modelos de regeneração alveolar induzida por lesão e deve facilitar descobertas mecanicistas em múltiplas doenças pulmonares.
Protocolo
Todos os procedimentos utilizados neste protocolo foram realizados de acordo com as recomendações das Diretrizes para o Cuidado e Uso de Animais de Laboratório do Instituto Nacional de Ciências Biológicas de Pequim. Os ratinhos macho CD-1 de 8 semanas de idade foram alojados em uma instalação específica de patógenos livres (SPF) até que os experimentos fossem conduzidos. As cirurgias foram realizadas usando camundongos completamente anestesiados ( ou seja , sem respostas de pinça do dedo do pé). Após a cirurgia, os ratos foram mantidos em uma sala quente e úmida com comida e água doce suficientes. Os ratos foram sacrificados usando uma sobredosagem de anestesia administrada por injeção intraperitoneal.
1. Cirurgia do mouse PNX
- Anestesiar completamente os camundongos com fenobarbital de sódio (120 mg / kg de peso corporal) e buprenorfina (0,1 mg / kg de peso corporal) por meio de injeção intraperitoneal (IP). Execute a cirurgia quando os camundongos já não reagem à compressão do dedo do pé.
- Remova os cabelos no tórax esquerdo dos ratos com dep. QuímicaTratamento ilatório (área de ~ 3 x 3 cm 2 ).
- Proteja cada mouse em uma plataforma de intubação com o lado ventral de frente para o operador ( Figura 1A ).
- Retire a língua do mouse e ilumine os cordões vocais com um laringoscópio de pequeno animal contendo um entalhe para guiar os cateteres 18 ( Figura 1A ).
- Distinguir as cordas vocais observando os movimentos das cordas vocais durante a respiração. Insira suavemente uma cânula de intubação intravenosa de 20 G na traquéia em ângulo anterior 19 .
- Coloque os camundongos em uma posição reclinada lateral direita e conecte a cânula a um ventilador mecânico ( por exemplo, controle de pressão, veja a Tabela de Materiais ). Verifique a inserção da cânula na tráquea observando os movimentos de respiração do peito do mouse ( Figura 1B ).
- Defina a pressão inspiratória oF o ventilador a 12 cm H 2 O e ajuste a freqüência respiratória para 120 respirações por minuto ( Figura 1B ).
- Descontaminar a pele na área cirúrgica com betadina e 70% de etanol.
- Faça uma incisão de toracotomia posterolateral de 2 a 3 cm no espaço no 5º espaço intercostal, corte a pele e os músculos com as Tesouras Noyes Spring (corte: 14 mm, diâmetro da ponta: 0,275 mm) ( Figura 2B , C ). Os instrumentos cirúrgicos utilizados para o procedimento de toracotomia são esterilizados antes do uso.
- Faça uma incisão de 1,5 cm no 5º espaço intercostal para expor o pulmão esquerdo ( Figura 2D , E ). Durante a operação, use um cauterizador de alta temperatura para parar o sangramento.
- Levante um terço do lóbulo do pulmão esquerdo do tórax com fórceps de ponta romba ( Figura 2F ) e, em seguida, use um cotonete de algodão para puxar toda a esquerdaPulmão ( Figura 2G ).
- Identificar a artéria pulmonar e brônquios do lóbulo pulmonar esquerdo ( Figura 2G ).
- Ligue ligeiramente os brônquios e vasos no hilum com uma sutura cirúrgica de seda e corte o lobo do pulmão esquerdo a 3 - 4 mm da ligação ( Figura 2H , I ).
NOTA: Tenha cuidado para não cortar os nós de sutura no hilado esquerdo, o que pode causar pneumotórax ( ou seja , ar ou gás na cavidade do tórax) . - Feche a parede torácica com 1 sutura e, em seguida, coloque a camada muscular e a camada de pele sequencialmente, usando 5 a 6 suturas interrompidas. Deixe um espaço de 3 a 4 mm entre cada sutura ( Figura 2M , 2N ).
NOTA: Mantenha a agulha de sutura cirúrgica afastada do coração; A punção cardíaca inadvertida resultará em morte imediata. - Desinfecte a área cirúrgica com povidona-iodo.
- AfteNa operação cirúrgica, coloque o mouse sobre uma almofada térmica de 38 ° C e conecte o mouse ao ventilador até que os movimentos respiratórios espontâneos comecem ( Figura 2O ).
2. Implantação de Prótese
- Execute as etapas 1.1 - 1.13 do procedimento PNX (ou seja, até o ponto em que o lobo do pulmão esquerdo do mouse é removido).
- Aperte o centro da prótese de silicone (feita pelo cliente, com 12 mm de comprimento, 3 mm de espessura, 7 mm de largura, 0,2 g, forma elipsoidal) usando fórceps bruscos ( Figura 2J ). Esterilize a prótese de silicone antes da inserção.
- Segure a costela com fórceps com uma mão para expor a cavidade torácica e, em seguida, insira a prótese na cavidade torácica vazia esquerda com outra mão.
NOTA: O ângulo de inserção é de aproximadamente 45 graus entre o plano frontal da prótese e a superfície torácica ( Figura 2K ,L). Seja muito gentil ao inserir a prótese. Força excessiva resultará em ruptura pleural. - Ajuste a orientação da prótese com fórceps sem corte para garantir que a prótese ocupe a cavidade torácica vazia esquerda.
- Execute as etapas 1.14 - 1.16 do procedimento PNX do mouse.
3. Medição de ILV
- Prepare um dispositivo personalizado ("tubo de inflado") que consiste em um êmbolo removido de uma pipeta sorológica descartavel (10 mL), um tubo flexível de 40 cm de comprimento com um adaptador de agulha, uma válvula de controle de fluxo e uma agulha de 18 G. Após a montagem, prenda a pipeta em uma placa com fita adesiva ( Figura 3A ). A distância entre o topo da pipeta e o banco experimental deve ser de pelo menos 30 cm.
- Prepare uma solução de fixação fresca de paraformaldeído a 4% (PFA), dissolvendo 20 g de PFA em 500 ml de solução salina tamponada com fosfato 1x (PBS) pré-aquecida em um banho de água a 55 ° C, agitando manualmenteCe cada 10 min até a solução ficar limpa. Após o arrefecimento até à temperatura ambiente, filtre a solução com um filtro de 0,45 μm.
CUIDADO: Use equipamento de proteção pessoal apropriado (PPE) ao manusear PFA. - Sacrifique ratos com uma injeção de overdose de anestesia (0,8% de fenobarbital de sódio, 1000 U / mL de heparina).
- Fixe cada mouse em uma placa de dissecção de poliestireno e pulverize com 70% de álcool.
- Abra cuidadosamente o baú do mouse e corte o esterno usando tesoura para expor completamente os lobos pulmonares.
- Remova o excesso de tecido usando tesoura para expor a traquéia. Certifique-se de separar a traqueia do esôfago.
- Corte a aorta abdominal e insira uma agulha de calibre 25 no ventrículo direito do coração; Conecte a agulha a uma seringa de 20 mL antes desta inserção. Empurre lentamente 1x PBS no coração para remover as células sanguíneas até que os pulmões fiquem brancos. Normalmente, 5 a 10 mL de PBS são necessários para limpar os vasos sanguíneos pulmonares.
- Preencha oE tubo de inflado personalizado e com 4% de PFA fresco e retire todas as bolhas do tubo de inflado.
- Insira a agulha de calibre 18 do tubo de inflado na traquéia e prenda a traquéia com os clipes do recipiente para evitar vazamento de fluido.
- Inflar os pulmões com PFA a 4% a uma pressão transpulmonar constante de 25 cm / H 2 O 2, 20. Incube os pulmões à temperatura ambiente durante 2 h para obter pulmões totalmente expandidos. Este passo "pré-reparo" é fundamental para preservar a morfologia pulmonar.
- Ao monitorar o tubo de inflado, registre o valor do volume inicial de 4% de PFA e registre o volume final. O volume interno do pulso é igual ao volume inicial de 4% de PFA menos o volume final de 4% de PFA.
- Ligue a traquéia e use uma tesoura, dissecando suavemente os pulmões (mantendo os pulmões intactos) dos tecidos conjuntivos circundantes. Seja muito gentil para evitar danificar os pulmões.
- IncuBate os pulmões em um tubo cônico de 50 mL preenchido com 4% de PFA por 12 h a 4 ° C com agitação suave em um agitador (50 rpm). Proceda ao processamento e à coloração dos tecidos (ver secção 4).
4. Inspeção de tecidos, secções e coloração com hematoxilina e eosina (H & E)
- Após a fixação, use Noyes Spring Scissors para cortar o coração e os tecidos conjuntivos excessivos nos pulmões. Separa delicadamente os lobos pulmonares individuais cortando o brônquio que liga os lobos pulmonares à traquéia.
- Lave extensamente os lobos pulmonares 3 a 4 vezes em 50 mL 1x PBS (30 min / lavagem) em um agitador orbital (50 rpm).
- Após a lavagem final, crioproteie os lobos pulmonares imergindo-os em uma solução de sacarose a 30% (em 1x PBS) a 4 ° C até o tecido escorrer no fundo dos tubos cônicos de 50 mL (aproximadamente 12 h).
- Antes da incorporação e criosecção dos tecidos, remova as amostras do lóbulo pulmonar dos tubos com fórceps, mantenha o acessoLóbulos sory para a análise histológica, dab a solução de sacarose restante da superfície das amostras de lóbulos acessórias, e depois mergulhe completamente a amostra em uma placa de Petri contendo um composto ótimo de temperatura de corte (OCT) por aproximadamente 30 min.
- Congele as amostras de lóbulos acessórias embutidas OCT em nitrogênio líquido usando gemelos. Posicione a maior área de superfície do lóbulo paralelamente ao fundo do molde.
- Prepare um total de três secções de 10 μm de espessura para cada amostra durante a criosecção para análise histológica. Descarte os primeiros 1 mm de tecido, coloque uma seção de 10 μm de espessura, descarte 0,5 mm de tecido, colecione outra seção, descarte 0,5 mm de tecido e colecione a terceira seção (final).
- Ar seco as secções por 1 h antes de realizar a coloração H & E.
- Execute a coloração H & E
- Lave as secções em 3 a 4 mudanças de água da torneira e depois coloque as secções em hematoxilina fresca por 2 min.; Enxague a seção sob água corrente da torneira; Mergulhe a seção duas vezes em uma solução de etanol a 1% a 70% de etanol para remover o excesso de hematoxilina.
- Mancha a seção em eosina fresca por 3 min; Desidrate as secções com duas lavagens sucessivas de 30 s em etanol a 95% e duas lavagens de 30 s com 100% de etanol; Limpe as secções em xileno durante 30 s, repita o passo de limpeza uma vez em xileno fresco; Monte as lâminas com meio de montagem usando lamínulas de vidro.
5. Quantificação da MLI
- Adquira imagens digitais das seções de lóbulos acessórias manchadas de H & E (ampliação 20X) usando um microscópio de campo brilhante.
- Para quantificar o MLI, selecione um total de 15 vistas não sobrepostas (1.000 μm x 1.000 μm) aleatoriamente das áreas adequadas (sem artérias e veias, principais vias aéreas e ductos alveolares) de 3 seções.
- Coloque uma grade com 10 linhas verticais uniformemente distribuídas e 10 linhas horizontais igualmente distribuídas de lenguas definidasGth (1.000 μm) nas áreas de visão escolhidas usando uma ferramenta de régua; Cada linha é, portanto, espaçada de 100 um de distância ( Figura 4B ).
- Defina o valor de uma intercepção como o comprimento linear entre dois epitélios alveolares adjacentes. Medir os valores de todos os interceptos ao longo de cada linha de comprimento de 1.000 m.
- Para cada grade, quantifique os valores de todas as intercepções entre as 10 linhas horizontais de 1000 μm e as 10 linhas verticais de 1000 μm.
NOTA: MLI é o valor médio dos comprimentos de interceptação de um total de 15 grades analisadas entre as 3 seções preparadas para cada um dos lobos acessórios.
6. Cálculo do ISA
- Calcule o ISA usando a Equação 1 (veja a Introdução ). Consulte a seção 3 para a medição de ILV e consulte a seção 5 para a quantificação de MLI.
Resultados
Realizamos aqui um experimento com um grupo tratado com PNX e um grupo de implante de prótese (Prótese implantada). Esses agrupamentos são os mesmos que os agrupamentos utilizados em um estudo publicado anteriormente em nosso grupo de pesquisa 14 .
O PNX do mouse e os procedimentos de implantação da prótese são mostrados na Figura 2 . Os ratos macho CD-1 de 8 s...
Discussão
Neste protocolo, fornecemos descrições detalhadas sobre a medição de parâmetros pulmonares após PNX do pulmão esquerdo do rato e implantação da prótese. Atualmente, a ISA é considerada uma métrica chave para a avaliação da função respiratória em muitas doenças pulmonares e na regeneração alveolar induzida por lesão. No entanto, embora a comunidade de pesquisa pulmonar esteja de acordo sobre a utilidade da ISA como métrica útil, até o momento, houve pouca consideração da padronização da medida...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de agradecer o Instituto Nacional de Ciências Biológicas, Pequim, pela assistência. Este trabalho foi apoiado pela Fundação Municipal de Ciências Naturais de Pequim (nº Z17110200040000).
Materiais
| Name | Company | Catalog Number | Comments |
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 mL Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
Referências
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. . Morphometry of the Human Lung. , (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -. Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados