È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un metodo standardizzato per la misurazione della superficie interna polmonare tramite la polmonite e l'impianto di protesi
In questo articolo
Riepilogo
La superficie interna polmonare (ISA) è un criterio critico per valutare la morfologia polmonare e la fisiologia delle malattie polmonari e della rigenerazione alveolare indotta da lesioni. Qui descriviamo un metodo standardizzato che può ridurre al minimo la polarizzazione di misura per ISA sia nei modelli di polmonite polmonare sia nei modelli di protesi.
Abstract
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introduzione
La funzione fondamentale del polmone è lo scambio di ossigeno e di anidride carbonica tra i vasi sanguigni e l'atmosfera. Le malattie polmonari come la displasia broncopolmonare (BPD), la malattia polmonare cronica ostruttiva (COPD) e le infezioni respiratorie acute provocano una riduzione dell'ISA 2 . I ricercatori che studiano la malattia polmonare hanno sviluppato diversi metodi quantitativi per valutare i cambiamenti morfologici nei polmoni, tra cui MLI, ILV, numero di scambiatori di gas, ISA e conformità ai tessuti polmonari 2 , 3 . Studi pionieristici di Weibel et al. 4 e Duguid et al. 5 hanno stabilito che l'ISA può essere utilizzata come misura diretta della capacità di scambio del gas polmonare nei polmoni umani e può essere utilizzata come criterio per determinare la gravità dell'emfisema. Alcuni studi pubblicati negli ultimi cinque anni hanno utilizzato parametri morfologici polmonari ( ad esempio, ISA e MLI) per valutare i cambiamenti morfologici e funzionali nei polmoni dei topi durante lo sviluppo 6 e durante il recupero da lesioni PNX 1 , 7 . L'ISA viene calcolato utilizzando l' equazione 1 8 , 9 :
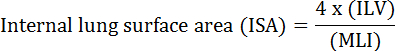
, Dove ILV è il volume polmonare interno e MLI è un parametro intermedio che rappresenta la dimensione aerospaziale periferica polmonare 10 .
La PNX, la rimozione chirurgica di uno o più lobi del polmone, è stata ampiamente riportata per indurre la rigenerazione alveolare in molte specie, tra cui gli esseri umani 11 , i topi 1 , i cani 12 , i ratti 13 e i conigli 14 e 15 . Un studY dei polmoni dei topi a quattordici giorni dopo il PNX ha mostrato che sia l'espansione di alveoli preesistenti e la de novo formazione di alveoli contribuiscono al restauro di ISA, ILV e il numero di alveoli nei restanti tessuti polmonari 1 . Noi e altri abbiamo dimostrato che l'inserimento di materiali come la spugna, la cera o una protesi a forma personalizzata nella cavità toracica vuota dopo PNX ( cioè l' impianto di protesi) compromette la rigenerazione alveolare. È ora stabilito che la forza meccanica funziona come uno dei fattori più importanti per iniziare la rigenerazione alveolare 1 , 16 , 17 . Tali studi hanno evidenziato l'efficacia dell'uso dei valori ISA da polmoni trattati con PNX e protesi da protesi come criterio per valutare quantitativamente la rigenerazione alveolare.
Il bias dell'osservatore è noto per influenzare in modo significativo la misura misurataPer i parametri morfologici polmonari ( es . MIL e ILV). I protocolli standardizzati possono essere utilizzati per ovviare a questa polarizzazione per determinare sia ILV che MLI, i due parametri utilizzati per il calcolo dell'ISA. Qui forniamo protocolli altamente dettagliati e standardizzati per misurare questi parametri polmonari. Importante, la capacità di quantificare con precisione le promesse ISA migliora l'affidabilità e la riproducibilità degli studi sulla funzionalità polmonare nei modelli di rigenerazione alveolare indotta da lesioni e dovrebbe facilitare le scoperte meccaniche in molteplici patologie polmonari.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure utilizzate in questo protocollo sono state eseguite in conformità alle raccomandazioni contenute nelle Linee Guida per la cura e l'uso degli animali da laboratorio dell'Istituto Nazionale di Scienze Biologiche di Pechino. I topi maschi CD-1 di 8 settimane sono stati alloggiati in una struttura specifica senza patogeni (SPF) fino all'esecuzione degli esperimenti. Le chirurgie sono state eseguite utilizzando topi completamente anestetizzati ( cioè , senza risposte a pizzicotto). Dopo l'intervento chirurgico, i topi sono stati tenuti in una stanza calda e umida con cibo sufficiente e acqua dolce. I topi sono stati sacrificati usando un sovradosaggio di anestetico erogato mediante iniezione intraperitoneale.
1. Mouse PNX Chirurgia
- Completa l'anestesia dei topi con fenobarbital di sodio (120 mg / kg di peso corporeo) e buprenorfina (0,1 mg / kg di peso corporeo) tramite l'iniezione intraperitoneale (IP). Effettuare la chirurgia quando i topi non reagiscono più a pizzicamento del piede.
- Togliere i capelli sul torace sinistro dei topi con la sostanza chimicaTrattamento infettivo (~ 3 x 3 cm 2 area).
- Fissare ogni mouse su una piattaforma di intubazione con il lato ventrale rivolto verso l'operatore ( Figura 1A ).
- Estrarre la linguetta del mouse e illuminare le corde vocali con un piccolo laringoscopio animale contenente una tacca per guidare i cateteri 18 ( Figura 1A ).
- Distinguete le corde vocali osservando i movimenti delle corde vocali durante la respirazione. Inserire delicatamente una cannula intubazione endovenosa da 20 G nella trachea ad un angolo anteriore 19 .
- Posizionare i topi in una posizione reclinabile laterale destra e collegare la cannula ad un ventilatore meccanico ( ad esempio, a pressione controllata, vedere la tabella dei materiali ). Controllare l'inserimento della cannula nella trachea osservando i movimenti respiratori del petto del mouse ( Figura 1B ).
- Impostare la pressione inspiratoria oF il ventilatore a 12 cm H 2 O e impostare la frequenza respiratoria a 120 breath per min ( Figura 1B ).
- Decontaminare la pelle nell'area chirurgica con betadina e il 70% di etanolo.
- Effettuare un'incisione toracotomica posterolaterale da 2 - 3 cm nello spazio al 5 ° spazio intercostale, tagliato attraverso la pelle e i muscoli con forbici a molla Noyes (tagliente: 14 mm; diametro punta: 0,275 mm) ( Figura 2B , C ). Gli strumenti chirurgici utilizzati per la procedura toracotomia vengono sterilizzati prima dell'uso.
- Effettuare un'incisione di 1,5 cm al 5 ° spazio intercostale per esporre il polmone sinistro ( Figura 2D , E ). Durante l'operazione, utilizzare un cauterizzatore ad alta temperatura per bloccare l'emorragia.
- Sollevare un terzo del lobo polmonare sinistro dal torace con punte punte sbilanciate ( Figura 2F ), quindi utilizzare un tampone di cotone per estrarre l'intera sinistraPolmone ( Figura 2G ).
- Identificare l'arteria polmonare ei bronchi del lobo polmonare sinistro ( Figura 2G ).
- Legare leggermente i bronchi ei vasi all'hilum con una sutura chirurgica di seta e tagliare il lobo polmonare sinistro a 3 - 4 mm dalla legatura ( Figura 2H , I ).
NOTA: Fare attenzione a non tagliare i nodi di sutura sull'hilum sinistro, che possono causare pneumotorace ( ossia aria o gas nella cavità del torace) . - Chiudere la parete toracica con 1 sutura e quindi cucire lo strato muscolare e lo strato della pelle in sequenza, utilizzando 5 - 6 suture interrotte. Lasciare uno spazio tra 3 e 4 mm tra ciascuna sutura ( figura 2M , 2N ).
NOTA: Tenere l'ago chirurgico di sutura lontano dal cuore; La puntura cardiaca involontaria provoca la morte immediata. - Disinfettare l'area chirurgica con povidone-iodio.
- afteR l'operazione chirurgica, posizionare il mouse su un tampone termico a 38 ° C e collegare il mouse al ventilatore fino a quando non inizieranno i movimenti respiratori spontanei ( Figura 2O ).
2. Implantologia della protesi
- Eseguire i passaggi 1.1-1.13 della procedura PNX (cioè fino al punto in cui il lobo polmonare sinistro del mouse viene rimosso).
- Fissare il centro della protesi in silicone (cliente realizzato, 12 mm di lunghezza, 3 mm di spessore, 7 mm di larghezza, 0,2 g, forma ellisse) utilizzando pinze a punta ( Figura 2J ). Sterilizzare la protesi al silicone prima dell'inserimento.
- Tenere la nervatura con le pinze con una mano per esporre la cavità toracica e poi inserire la protesi nella cavità toracica vuota sinistra con un'altra mano.
NOTA: L'angolo di inserzione è di circa 45 gradi tra il piano frontale della protesi e la superficie toracica ( Figura 2K ,L). Essere molto gentile quando si inserisce la protesi. La forza eccessiva provoca una rottura pleurica. - Regolare l'orientamento della protesi con pinze sbilanciate per assicurare che la protesi occupa la cavità toracica vuota sinistra.
- Eseguire i passaggi 1.14 - 1.16 della procedura PNX del mouse.
3. Misurazione dell'ILV
- Preparare un dispositivo personalizzato ("tubo di inflazione") costituito da uno stantuffo rimosso da una pipetta serologica usa e getta (10 mL), un tubo flessibile lungo 40 cm con adattatore a ago, valvola di controllo della portata e un ago da 18 G. Dopo l'assemblaggio, fissare la pipetta su una scheda con nastro ( Figura 3A ). La distanza tra la parte superiore della pipetta e la panca sperimentale deve essere di almeno 30 cm.
- Preparare la soluzione di fissazione del 4% di paraformaldeide (PFA), sciogliendo 20 g di PFA in 500 ml di soluzione salina fosforata tamponata pre-riscaldata (PBS) in un bagno d'acqua di 55 ° C, scuotendo manualmenteCe ogni 10 minuti fino a quando la soluzione è chiara. Dopo raffreddamento a temperatura ambiente, filtrare la soluzione con un filtro da 0,45 μm.
ATTENZIONE: Usare un adeguato dispositivo di protezione individuale (PPE) quando si maneggia PFA. - Mouse sacrificato con un'iniezione di sovradosaggio di anestetico (0,8% fenobarbital sodico, 1000 U / ml di eparina).
- Fissare ogni mouse su una piastra di dissezione in polistirene e spruzzarla con alcool al 70%.
- Aprire con cautela il petto del mouse e tagliare lo sterno con forbici per esporre completamente i lobi del polmone.
- Rimuovere il tessuto eccessivo con forbici per esporre la trachea. Assicuratevi di separare la trachea dall'esofago.
- Tagliare l'aorta addominale e inserire un ago da 25 gauge nel ventricolo destro del cuore; Collegare l'ago ad una siringa da 20 ml prima di questo inserimento. Spingere lentamente 1x PBS nel cuore per rimuovere le cellule del sangue fino a quando i polmoni diventano bianchi. Tipicamente, 5 - 10 mL di PBS è necessario per eliminare i vasi sanguigni polmonari.
- Compilare il thE tubo di infusione personalizzato con 4% di PFA fresco e rimuovere tutte le bolle dal tubo di inflazione.
- Inserire l'ago da 18 gauge del tubo di infusione nella trachea e agganciare la trachea con le clip del recipiente per evitare perdite di liquido.
- Gonfiare i polmoni con il 4% di PFA ad una pressione costante di 25 cm / H 2 O 2 , 20 . Incubare i polmoni a temperatura ambiente per 2 ore per ottenere polmoni completamente espansi. Questo passo "pre-fix" è fondamentale per la conservazione della morfologia polmonare.
- Monitorando il tubo di inflazione, registrare il valore del volume iniziale del 4% PFA e registrare il volume finale. Il volume polmonare interno equivale al volume iniziale del PFA del 4% meno il volume PFA finale del 4%.
- Legare la trachea e usando le forbici, disseccare delicatamente i polmoni (mantenendo intatti i polmoni) dai tessuti connettivi circostanti. Essere molto gentile per evitare di danneggiare i polmoni.
- incuVersare i polmoni in un tubo conico da 50 ml riempito con 4% di PFA per 12 h a 4 ° C con una leggera agitazione su un agitatore (50 rpm). Procedere alla lavorazione del tessuto e alla colorazione (vedere la sezione 4).
4. Incorporazione del tessuto, sezionamento e colorazione di ematossilina & eosina (H & E)
- Dopo la fissazione, utilizzare le forbici forensi di Noyes per tagliare il cuore e i tessuti connettivi eccessivi dai polmoni. Separare delicatamente i singoli lobi del polmone tagliando il bronco che collega i lobi del polmone alla trachea.
- Lavare ampiamente i lobi del polmone 3 - 4 volte in 50 ml di 1x PBS (30 minuti / lavaggio) su un agitatore orbitale (50 rpm).
- Dopo il lavaggio finale, crioprire i lobi del polmone immergendoli in una soluzione al 30% di saccarosio (in 1x PBS) a 4 ° C fino a quando il tessuto si affonda sul fondo dei tubi conici da 50 ml (circa 12 h).
- Prima di incollare e criocondire i tessuti, rimuovere i campioni del lobo polmone dai tubi con le pinze, mantenere l'accesI lobi per l'analisi istologica, immergere la residua soluzione di saccarosio dalla superficie dei campioni del lobo accessorio e quindi immergere completamente il campione in un piatto di Petri contenente il composto ottimale di taglio (OCT) per circa 30 minuti.
- Bloccare i campioni di lobi accessorio incorporati in OCT in azoto liquido usando criomaglie. Posizionare la superficie più grande del lobo parallela alla parte inferiore dello stampo.
- Preparare un totale di tre sezioni di 10 μm di spessore per ciascun campione durante la crizione per l'analisi istologica. Scartare il primo 1 mm di tessuto, raccogliere una sezione di 10 μm di spessore, scartare 0,5 mm di tessuto, raccogliere un'altra sezione, scartare 0,5 mm di tessuto e raccogliere la terza sezione (finale).
- Aria asciugare le sezioni per 1 ora prima di eseguire la colorazione H & E.
- Effettuare la colorazione H & E
- Lavare le sezioni in 3 - 4 cambi di acqua di rubinetto e poi macchia le sezioni in fresco ematoxilina per 2 min; Sciacquare la sezione sotto l'acqua corrente del rubinetto; Immergere la sezione due volte in una soluzione 1% HCl-70% di etanolo per rimuovere l'ematoxilina in eccesso.
- Macchiare la sezione in eosin fresco per 3 min; Deidratare le sezioni con due successive lavaggi a 30 s in etanolo al 95% e due lavaggi a 30 s con etanolo al 100%; Chiudere le sezioni in xilene per 30 s, ripetere la fase di compensazione una volta in xilene fresco; Montare le diapositive con il supporto di montaggio usando le copertine di vetro.
5. Quantificazione di MLI
- Acquisire immagini digitali delle sezioni Lobe accessorio macchiate H & E (ingrandimento 20X) utilizzando un microscopio a campo luminoso.
- Per quantificare il MLI, selezionare un totale di 15 viste non sovrapposte (1.000 μm x 1.000 μm) in modo casuale dalle aree adattate (senza arterie e vene, vie respiratorie principali e condotti alveolari) di 3 sezioni.
- Inserire una griglia con 10 linee verticali distribuite uniformemente e 10 linee orizzontali distribuite equamente distribuite di lenGth (1.000 μm) sulle aree di vista prescelte usando uno strumento di righello; Ogni linea è così distanziata da 100 μm di distanza ( Figura 4B ).
- Definire il valore di una intercetta come la lunghezza lineare tra due epiteli alveolari adiacenti. Misurare i valori di tutte le intercettazioni lungo ciascuna linea di lunghezza di 1000 μm.
- Per ciascuna griglia, quantificare i valori di tutte le intercetta tra le 10 lunghezze orizzontali di lunghezza 1.000 μm e le 10 lunghezze verticali di 1.000 μm.
NOTA: MLI è il valore medio delle lunghezze di intercettazione da un totale di 15 griglie analizzate tra le tre sezioni predisposte per ciascuno dei lobi accessori.
6. Calcolo dell'ISA
- Calcola l'ISA utilizzando l' equazione 1 (vedi Introduzione ). Fare riferimento alla sezione 3 per la misura di ILV e fare riferimento alla sezione 5 per la quantificazione di MLI.
Access restricted. Please log in or start a trial to view this content.
Risultati
Abbiamo eseguito qui un esperimento con un gruppo trattato con PNX e un gruppo di protesi (impianto protesico). Questi raggruppamenti sono gli stessi dei raggruppamenti utilizzati in uno studio precedentemente pubblicato dal nostro gruppo di ricerca 14 .
Le mostre PNX e le protesi di protesi sono mostrate in Figura 2 . 8 settimane vecchi topi maschi CD-1 vengono utili...
Access restricted. Please log in or start a trial to view this content.
Discussione
In questo protocollo forniamo descrizioni dettagliate sulla misura dei parametri polmonari dopo il polmone a sinistra del polmone PNX e l'impianto di protesi. L'ISA è ora considerata una metrica chiave per la valutazione della funzione respiratoria in molte malattie polmonari e nella rigenerazione alveolare indotta da lesioni. Tuttavia, sebbene la comunità di ricerca polmonare sia d'accordo sull'utilità dell'ISA come metrica utile, fino ad oggi non è stata presa in considerazione la standardizzaz...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno niente da rivelare.
Riconoscimenti
Gli autori vorrebbero riconoscere all'Istituto Nazionale di Scienze Biologiche di Pechino per l'assistenza. Questo lavoro è stato sostenuto da Beijing Municipal Natural Science Foundation (numero Z17110200040000).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 mL Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
Riferimenti
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. Morphometry of the Human Lung. , Springer-Verlag. Berlin Heidelberg. (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318(2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon