Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
One-pot asistida por microondas conversión de ésteres de nitrato anomérico en Trichloroacetimidates
En este artículo
Resumen
Un 2-azido-1-nitrato-éster se puede convertir en el correspondiente 2-azido-1-trichloroacetimidate en un procedimiento one-pot. El objetivo del manuscrito es demostrar la utilidad del reactor de microondas en la síntesis de hidratos de carbono.
Resumen
El objetivo de este procedimiento es proporcionar una demostración de la conversión de un pote de un 2-azido-1-nitrato-éster a un donante de glicosil trichloroacetimidate. Después de azido-nitración de un glycal, puede hidrolizar el éster 2-azido-1-nitrato de producto bajo irradiación de microondas-asistida. Esta transformación se logra utilizando reactivos fuertemente nucleofílico y prolongado tiempo de reacción. Irradiación de microondas induce la hidrólisis, en la ausencia de reactivos, tiempos de reacción cortos. Tras Desnitruración, el alcohol intermedio anomérico se convierte, en la misma olla, a la 2-azido-1-trichloroacetimidate correspondiente.
Introducción
Debido a su ubicuidad en biología molecular, hidratos de carbono han sido objetivos de larga data para síntesis química. 1 , 2 , 3 en la base de cualquier campaña sintético es el correcto despliegue de reacciones de glicosilación para construir la cadena de oligosacáridos. 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 no es de extrañar, hay un gran número de métodos para instalar enlaces glucosídicos. 13 , 14 Koenigs-Knorr el método es uno de los procedimientos lo más temprano posible conocidos e implica una glicosil cloruro o bromuro de acoplamiento con un componente alcohólico, generalmente bajo activación de metales pesados (mercurio o plata). 15 fluoruros glycosyl relacionados primero fueron introducidos como donantes en 1981 por el grupo de Mukaiyama y han encontrado uso extenso debido a su mayor estabilidad térmica y química. 16 en el extremo opuesto del espectro de reactividad son glicosil yoduros, que son mucho más reactivos que los otros halides. Mayor reactividad se acompaña de stereocontrol creciente, particularmente cuando formando α-linked oligosacáridos. 17 además de "haloglycosides", thioglycosides han encontrado gran utilidad, en parte, debido a su facilidad de formación, estabilidad a una multitud de condiciones de reacción y la activación con los reactivo electrofílico. 18
Los métodos descritos anteriormente foco sobre la conversión de un alcohol anomérico a un "sin oxígeno" que contiene, latente dejando el grupo que está activado y finalmente desplazada por un alcohol de una molécula aceptora. Activación de oxígeno anomérico descrito por la escuela Schmidt, se centra en convertir el oxígeno de C1, a un grupo dejando. 19 este método es el más potente y ampliamente utilizado en las reacciones químicas glicosilación. Los donantes Trichloroacetimidate se preparan fácilmente de un azúcar reductor y trichloroacetonitrile en presencia de una base como el carbonato de potasio (K2CO3) o 1, 8-Diazabiciclo [5.4.0] undéc-7-eno (DBU). Estas especies se activan utilizando ácidos de Lewis. 20
Recientemente, nos han informado que los donantes 2-azido-1-trichloroacetimidate se pueden preparar directamente de glycals. El proceso implica una reacción en dos, uno de otro procedimiento de los ésteres de 2-azido-1-nitrato. 21 este protocolo detallado está diseñado para ayudar a los profesionales para completar con éxito la transformación de alto rendimiento. De particular interés es el primer paso de la secuencia, que se centra en térmica Desnitruración en microondas - asistida por calefacción. También esperamos proporcionar un tutorial visual en el empleo de reactores de microondas en síntesis orgánica.
Protocolo
1. representante de microonda-asistida Desnitruración
- Coloque el éster de nitrato azido (1.0 equiv, 0,2 mmol) en un frasco de reacción de microondas de 8 mL. La magnitud de la reacción se puede aumentar a varios mmol sin ningún efecto adverso sobre el progreso de la reacción.
- El éster de azido-nitrato en acetona al 20% AQ (0,1 M, 2,0 mL) se disuelven. Añadir piridina (5,0 equivalente, 0,08 mL, 1,0 mmol) en el recipiente de la reacción. La tapa del frasco de irradiación de microondas y colocar el recipiente de la reacción en una cavidad de reactor de microondas.
- Irradiar la solución a 120 ° C durante 15 min con agitación y con un tiempo de espera fijo. El tiempo de espera representa cuánto se producirá la irradiación a la temperatura señalada y la presión resultante. Calentar todas las reacciones a la temperatura divulgada durante un período de rampa de 2 minutos. Controlar la temperatura con un sensor incorporado IR.
- Después de 15 min, analizar la mezcla de reacción mediante cromatografía en capa fina (TLC) para confirmar el consumo de material de partida. Utilizar acetato de etilo/hexanes 1:1 como eluyente.
- Visualizar la placa de TLC mediante tinción de molybate de amonio cérico. Rf del reactivo y del producto variarán, pero el alcohol reducción es generalmente 0.05 a 0.1 menor Rf que el reactivo.
2. formación de la trichloroacetimidate
- Tras consumo completo de material de partida, se evapora el disolvente a un volumen reducido con una línea aérea. Luego diluir con (diclorometano) CH2Cl2 (1,0 mL) y utilizar una jeringa para eliminar la capa de agua. Una vez retirada la capa de agua, enfriar la mezcla de reacción a 0 ° C usando un baño de agua helada.
- A continuación, añadir DBU (eq 10, 0.3 mL, 1,9 mmol) y 2,2,2-trichloroacetonitrile (50 eq, 1,0 mL, 10 mmol) en el recipiente de la reacción. Se añaden dos reactivos en exceso y se necesita un mínimo de 1 equivalente de base y 1 equivalente de 2,2,2-trichloroacetonitrile.
- Deje que la mezcla de reacción agitar y calentar a temperatura ambiente. Vigilar la reacción por el TLC para confirmar el consumo de material de partida.
- Utilizar acetato de etilo/hexanes 1:1 como eluyente. Visualizar la placa de TLC mediante tinción de molybate de amonio cérico. Rf del reactivo y del producto variará.
- Después de la consumición completa del material de partida, transferir la mezcla de reacción a un matraz de recuperación y concentrar la mezcla en vacío a 30 ° C. Evaporación del disolvente proveerá un crudo amarillo pálido a marrón aceite.
- Purifique el producto crudo por cromatografía de columna de gel de silicona con una columna de cromatografía de 1,5 cm y de 1:4 acetato de etilo/hexanes como eluyente. La forma física de la imidate variará de molécula a molécula.
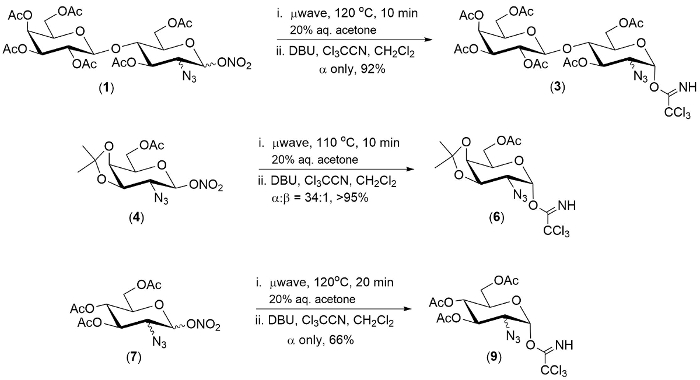
Figura 1. Ejemplos representativos de la conversión de un pote de ésteres de 2-azido-1-nitrato al 2-azido-1-trichloroimidates. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
La tecnología descrita fue demostrada en un grupo de tres ésteres de 2-azido-1-nitrato. En cada caso el primer paso de la reacción era completado dentro de 20 minutos.
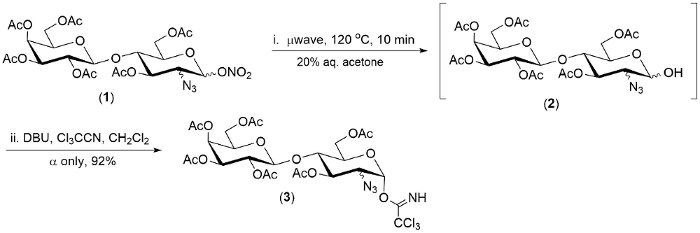
Figura 2. Ejemplo de hidrólisis (1 ->2) y la conversión de un pote de ester 2-azido-1-nitrato de 1 (
Discusión
El protocolo descrito en este tutorial proporciona un método para convertir ésteres de nitrato a la funcionalidad útil, reactiva. En un sentido más amplio, empleando un reactor de microondas para completar maniobras específicas en el transcurso de una síntesis de hidratos de carbono tiene el potencial para hacer transformaciones difíciles fáciles y rutinarias. Nuestro objetivo en este tutorial es demostrar cómo manejar los hidratos de carbono en el contexto de la irradiación de microondas.
Divulgaciones
Los autores tienen intereses financieros que compiten.
Agradecimientos
Los autores desean reconocer la Universidad de Vanderbilt y el Instituto de Biología química para apoyo financiero. Sr. Ellis de Berkley y Prof. John McLean son reconocidos por análisis espectral de masa de alta resolución.
Materiales
| Name | Company | Catalog Number | Comments |
| 230 400 mesh silica gel | SiliCycle Inc | R10030B | |
| TLC plates | SiliCycle Inc | TLG-R10014B-527 | |
| Ceric ammonium molybdate | Sigma-Aldrich | A1343 | |
| Solvent Still | Mbraun | MB-SPS-800 | |
| Infared spectrometer | Thermo | Thermo Electron IR100 | |
| Nuclear Magnetic Resonance | Bruker | 400, 600 MHz | |
| LC/MS | Thermo/Dionex | Single quad, ESI | |
| HRMS | Agilent | Synapt G2 S HDMS | |
| Microwave reactor | Anton Parr | Anton Parr G10 Monowave 200 | |
| DBU | Sigma-Aldrich | 139009 | |
| CCl3CN | Sigma-Aldrich | T53805 | |
| Pyridine | Sigma-Aldrich | 270970 | |
| Acetone | Fisher Scientific | A18-20 | Tech. grade |
| Phase separator | Biotage | 120-1901-A | |
| Rotary evaporator | Buchi | R-100 |
Referencias
- Nicolaou, K. C., Mitchell, H. J. Adventures in Carbohydrate Chemistry: New Synthetic Technologies, Chemical Synthesis, Molecular Design, and Chemical Biology A list of abbreviations can be found at the end of this article. Telemachos Charalambous was an inspiring teacher at the Pancyprian Gymnasium, Nicosia, Cyprus. Angew. Chem. Int. Ed. Engl. 40 (9), 1576-1624 (2001).
- Danishefsky, S. J., Allen, J. R. From the laboratory to the clinic: A retrospective on fully synthetic carbohydrate-based anticancer vaccines. Angew. Chem. Int. Ed. Engl. 39 (5), 836-863 (2000).
- Nicolaou, K. C., Hale, C. R. H., Nilewski, C., Ioannidou, H. A. Constructing molecular complexity and diversity: total synthesis of natural products of biological and medicinal importance. Chemical Society Reviews. 41 (15), 5185-5238 (2012).
- Zhu, X., Schmidt, R. R. New principles for glycoside-bond formation. Angew. Chem. Int. Ed. Engl. 48 (11), 1900-1934 (2009).
- Danishefsky, S. J., Bilodeau, M. T. Glycals in organic synthesis: The evolution of comprehensive strategies for the assembly of oligosaccharides and glycoconjugates of biological consequence. Angew. Chem. Int. Ed. Engl. 35 (13-14), 1380-1419 (1996).
- Bongat, A. F., Demchenko, A. V. Recent trends in the synthesis of O-glycosides of 2-amino-2-deoxysugars. Carbohydr. Res. 342 (3-4), 374-406 (2007).
- Feizi, T., Fazio, F., Chai, W. C., Wong, C. H. Carbohydrate microarrays - a new set of technologies at the frontiers of glycomics. Curr. Opin. Struct. Biol. 13 (5), 637-645 (2003).
- Palmacci, E. R., Plante, O. J., Seeberger, P. H. Oligosaccharide synthesis in solution and on solid support with glycosyl phosphates. Eur. J. Org. Chem. (4), 595-606 (2002).
- Stallforth, P., Lepenies, B., Adibekian, A., Seeberger, P. H. 2009 Claude S. Hudson Award in Carbohydrate Chemistry. Carbohydrates: a frontier in medicinal chemistry. J. Med. Chem. 52 (18), 5561-5577 (2009).
- Danishefsky, S. J., Mcclure, K. F., Randolph, J. T., Ruggeri, R. B. A Strategy for the Solid-Phase Synthesis of Oligosaccharides. Science. 260 (5112), 1307-1309 (1993).
- Demchenko, A. V. Stereoselective chemical 1,2-cis O-glycosylation: From 'sugar ray' to modern techniques of the 21st century. Synlett. (9), 1225-1240 (2003).
- Fraserreid, B., Wu, Z. F., Udodong, U. E., Ottosson, H. Armed-Disarmed Effects in Glycosyl Donors - Rationalization and Sidetracking. J. Org. Chem. 55 (25), 6068-6070 (1990).
- Bohe, L., Crich, D. A propos of glycosyl cations and the mechanism of chemical glycosylation; the current state of the art. Carbohydr. Res. 403, 48-59 (2015).
- Toshima, K., Tatsuta, K. Recent Progress in O-Glycosylation Methods and Its Application to Natural-Products Synthesis. Chem. Rev. 93 (4), 1503-1531 (1993).
- Koenigs, W., Knorr, E. Ueber einige Derivate des Traubenzuckers und der Galactose. Chem. Ber. 34 (1), 957-981 (1901).
- Mukaiyama, T., Murai, Y., Shoda, S. An Efficient Method for Glucosylation of Hydroxy Compounds Using Glucopyranosyl Fluoride. Chem. Lett. (3), 431-432 (1981).
- Meloncelli, P. J., Martin, A. D., Lowary, T. L. Glycosyl iodides. History and recent advances. Carbohydrate Research. 344 (9), 1110-1122 (2009).
- Lian, G., Zhang, X., Yu, B. Thioglycosides in carbohydrate research. Carbohydr. Res. 403, 13-22 (2015).
- Schmidt, R. R., Kinzy, W. Anomeric-Oxygen Activation for Glycoside Synthesis - the Trichloroacetimidate Method. Advances in Carbohydrate Chemistry and Biochemistry. 50, 21-123 (1994).
- Schmidt, R. R., Toepfer, A. Glycosylation with highly reactive glycosyl donors: efficiency of the inverse procedure. Tetrahedron Lett. 32 (28), 3353-3356 (1991).
- Keith, D. J., Townsend, S. D. Direct, microwave-assisted substitution of anomeric nitrate-esters. Carbohydr. Res. 442, 20-24 (2017).
- Bukowski, R., et al. Synthesis and Conformational Analysis of the T-Antigen Disaccharide(B-D-Gal-(1->3)-a-D-GalNAc-OMe). Eur. J. Org. Chem. 14, 2697-2705 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados