É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um pot-assistida por microondas conversão de nitrato anomérico-ésteres de Trichloroacetimidates
Neste Artigo
Resumo
2-azido-1-nitrato-éster pode ser convertido para o correspondente 2-azido-1-trichloroacetimidate em um procedimento de um pote. O objetivo do manuscrito é demonstrar a utilidade do reator do microondas na síntese de carboidratos.
Resumo
O objetivo do procedimento a seguir é fornecer uma demonstração da conversão um pote de um 2-azido-1-nitrato-éster de um doador de glycosyl trichloroacetimidate. Na sequência de azido-nitração de um glycal, o éster de 2-azido-1-nitrato de produto pode ser hidrolisado sob irradiação de microondas-assistida. Essa transformação é normalmente conseguida usando reagentes fortemente nucleofílicos e tempos de reação prolongados. Irradiação de microondas induz a hidrólise, na ausência de reagentes, com curtos tempos de reação. Após denitration, o álcool intermediário anomérico é convertido, na mesma panela, com o correspondente 2-azido-1-trichloroacetimidate.
Introdução
Devido sua onipresença em biologia molecular, hidratos de carbono têm sido alvos de longa data por síntese química. 1 , 2 , 3 no núcleo de qualquer campanha sintético bem sucedida é a implantação correta de reacções de glicosilação para construir a cadeia de oligossacarídeo. 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 não surpreendentemente, há um grande número de métodos para instalar glucosídicas. 13 , 14 Koenigs-Knorr o método é um dos procedimentos mais antigos conhecidos e envolve um glycosyl cloreto ou brometo de acoplamento com um componente alcoólica, geralmente sob ativação de metais pesados (mercúrio ou prata). 15 glycosyl relacionados fluoretos foram introduzidos como doadores em 1981 pelo grupo Mukaiyama e encontraram aplicação generalizada devido à sua maior estabilidade térmica e química. 16 na extremidade oposta do espectro de reatividade são glycosyl iodetos, que são muito mais reativos que os outros haletos. Aumento da reatividade é acompanhada de aumento stereocontrol, particularmente quando formando oligossacarídeos ligados α. 17 além de "haloglycosides", thioglycosides ter encontrado ampla utilidade, em parte, devido a sua facilidade de formação, estabilidade a uma multiplicidade de condições da reação e ativação com reagentes eletrofílicos. 18
Os métodos descritos acima o foco sobre a conversão de um álcool anomérico para um "não-oxigênio" que contém, latente, deixando o grupo que é ativado e, finalmente, deslocado por um álcool de uma molécula aceitadora. Ativação de oxigênio anomérico conforme descrito pela escola Schmidt, centra-se em converter o oxigênio de C1 em si, a um grupo lábil. 19 . este método é o mais poderoso e amplamente utilizado em reações químicas de glicosilação. Trichloroacetimidate doadores são prontamente preparados com um açúcar redutor e trichloroacetonitrile na presença de uma base tal como o carbonato de potássio (K2CO3) ou 1,8-diazabiciclo [5.4.0] undec-7-ene (DBU). Estas espécies são então ativadas usando ácidos de Lewis. 20
Recentemente, informamos que os doadores azido-trichloroacetimidate-1-2 podem ser preparados diretamente do glycals. O processo envolve uma reação de dois, um pot-procedimento de ésteres 2-azido-1-nitrato. 21 este protocolo detalhado destina-se a ajudar os profissionais em concluir com sucesso a transformação em alto rendimento. De particular interesse é a primeira etapa da sequência, que se concentra na denitration térmica sob microondas - assistida aquecimento. Também esperamos proporcionar um tutorial visual na empregando reatores de microondas em síntese orgânica.
Protocolo
1. o representante microondas-assistida Denitration
- Coloque o éster de nitrato azido (1.0 equiv., 0,2 mmol) em um frasco de reação de microondas de 8 mL. A escala da reação pode ser aumentada para várias mmol sem qualquer efeito adverso sobre o progresso da reação.
- Dissolva o éster de azido-nitrato em 20% aquosa de acetona (0,1 M, 2,0 mL). Adicione piridina (5,0 equiv, 0,08 mL, 1,0 mmol) para o recipiente de reação. Tampa do frasco de irradiação de microondas e coloque o recipiente de reação em uma cavidade do reator de microondas.
- Irradiar a solução a 120 ° C por 15 min com agitação e com um tempo de preensão fixo. O tempo de espera representa quanto tempo a irradiação ocorrerá no designado de temperatura e pressão resultante. Aqueça todas as reacções à temperatura relatada em um período de subida de 2 minutos. Monitore a temperatura por um sensor builtin IR.
- Depois de 15 min, analise a mistura de reação usando cromatografia de camada fina (TLC) para confirmar o consumo das matérias-primas. Use 1:1 acetato de etila/hexanos como eluente.
- Visualize o prato de TLC com mancha de molybate de amônio cério. A Rf de reagente e do produto irá variar, mas o álcool redução é geralmente de 0,05 a 0,1 inferior Rf do que o reagente.
2. formação da trichloroacetimidate
- Após completo consumo das matérias-primas, evapore o solvente para um volume reduzido usando uma companhia aérea. Em seguida, diluir com (diclorometano) CH2Cl2 (1,0 mL) e use uma seringa para remover a camada de água. Uma vez que a camada de água é removido, arrefecer a mistura de reação de 0 ° C, utilizando um banho de gelo.
- Em seguida, adicione DBU (10 eq, 0,3 mL, 1,9 mmol) e 2, 2,2-trichloroacetonitrile (50 eq, 1,0 mL, 10 mmol) para o recipiente de reação. Ambos os reagentes são adicionados em excesso e um mínimo de 1 equivalente de base e 1 equivalente de 2, 2,2-trichloroacetonitrile são necessários.
- Permita que a mistura de reação a se mexer enquanto o aquecimento até à temperatura ambiente. Monitore a reação do TLC para confirmar o consumo das matérias-primas.
- Use 1:1 acetato de etila/hexanos como eluente. Visualize o prato de TLC com mancha de molybate de amônio cério. A Rf de reagente e do produto irá variar.
- Após o consumo total do material começar, transfira a mistura de reação para um frasco de recuperação e concentrar-se a mistura no vácuo a 30 ° C. Evaporação do solvente fornecerá um bruto amarelo pálido ao óleo marrom.
- Purifica o produto bruto por cromatografia em coluna de sílica gel com uma coluna de cromatografia de 1,5 cm e 1:4. acetato de etila/hexanos como eluente. A forma física do imidate irá variar de molécula a molécula.
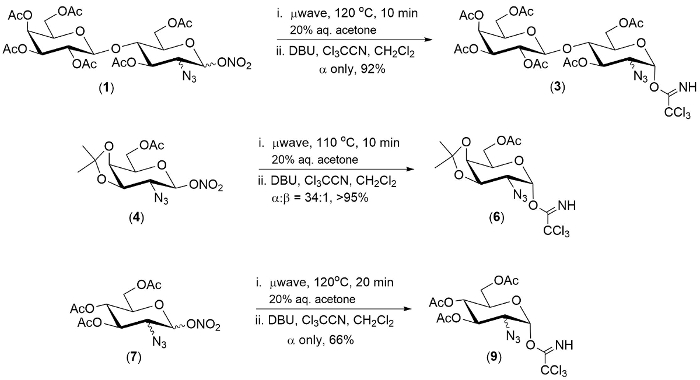
Figura 1. Exemplos representativos de um pot-conversão dos ésteres 2-azido-1-nitrato ao 2-azido-1-trichloroimidates. Clique aqui para ver uma versão maior desta figura.
Resultados
A tecnologia descrita neste documento foi demonstrada em um pool de três ésteres 2-azido-1-nitrato. Em cada caso, o primeiro passo da reação foi completo dentro de 20 minutos.
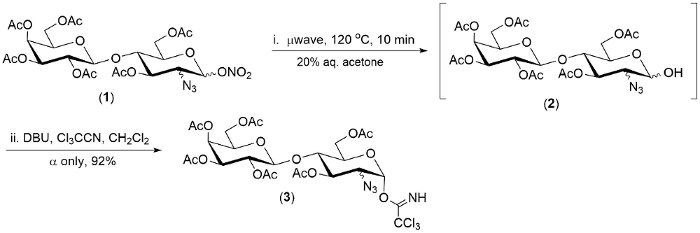
Figura 2. Um exemplo representativo de hidrólise (1 ->2) e um pot-conversão do éster 2-azido-1-nitrato de
Discussão
O protocolo descrito neste tutorial fornece um método para converter nitrato ésteres para funcionalidade útil, reativa. Em um sentido mais amplo, empregar um reator de microondas para completar manobras específicas ao longo de uma síntese do hidrato de carbono tem o potencial para fazer transformações difícil facile e rotina. Nosso objetivo neste tutorial é demonstrar como lidar com os hidratos de carbono no contexto da irradiação de microondas.
No caso da reação do pai, esforços...
Divulgações
Os autores têm sem interesses financeiros concorrentes.
Agradecimentos
Os autores gostaria de reconhecer Vanderbilt University e o Instituto de biologia química para apoio financeiro. Sr. Berkley Ellis e Prof John McLean são reconhecidos pela análise espectral de massa de alta resolução.
Materiais
| Name | Company | Catalog Number | Comments |
| 230 400 mesh silica gel | SiliCycle Inc | R10030B | |
| TLC plates | SiliCycle Inc | TLG-R10014B-527 | |
| Ceric ammonium molybdate | Sigma-Aldrich | A1343 | |
| Solvent Still | Mbraun | MB-SPS-800 | |
| Infared spectrometer | Thermo | Thermo Electron IR100 | |
| Nuclear Magnetic Resonance | Bruker | 400, 600 MHz | |
| LC/MS | Thermo/Dionex | Single quad, ESI | |
| HRMS | Agilent | Synapt G2 S HDMS | |
| Microwave reactor | Anton Parr | Anton Parr G10 Monowave 200 | |
| DBU | Sigma-Aldrich | 139009 | |
| CCl3CN | Sigma-Aldrich | T53805 | |
| Pyridine | Sigma-Aldrich | 270970 | |
| Acetone | Fisher Scientific | A18-20 | Tech. grade |
| Phase separator | Biotage | 120-1901-A | |
| Rotary evaporator | Buchi | R-100 |
Referências
- Nicolaou, K. C., Mitchell, H. J. Adventures in Carbohydrate Chemistry: New Synthetic Technologies, Chemical Synthesis, Molecular Design, and Chemical Biology A list of abbreviations can be found at the end of this article. Telemachos Charalambous was an inspiring teacher at the Pancyprian Gymnasium, Nicosia, Cyprus. Angew. Chem. Int. Ed. Engl. 40 (9), 1576-1624 (2001).
- Danishefsky, S. J., Allen, J. R. From the laboratory to the clinic: A retrospective on fully synthetic carbohydrate-based anticancer vaccines. Angew. Chem. Int. Ed. Engl. 39 (5), 836-863 (2000).
- Nicolaou, K. C., Hale, C. R. H., Nilewski, C., Ioannidou, H. A. Constructing molecular complexity and diversity: total synthesis of natural products of biological and medicinal importance. Chemical Society Reviews. 41 (15), 5185-5238 (2012).
- Zhu, X., Schmidt, R. R. New principles for glycoside-bond formation. Angew. Chem. Int. Ed. Engl. 48 (11), 1900-1934 (2009).
- Danishefsky, S. J., Bilodeau, M. T. Glycals in organic synthesis: The evolution of comprehensive strategies for the assembly of oligosaccharides and glycoconjugates of biological consequence. Angew. Chem. Int. Ed. Engl. 35 (13-14), 1380-1419 (1996).
- Bongat, A. F., Demchenko, A. V. Recent trends in the synthesis of O-glycosides of 2-amino-2-deoxysugars. Carbohydr. Res. 342 (3-4), 374-406 (2007).
- Feizi, T., Fazio, F., Chai, W. C., Wong, C. H. Carbohydrate microarrays - a new set of technologies at the frontiers of glycomics. Curr. Opin. Struct. Biol. 13 (5), 637-645 (2003).
- Palmacci, E. R., Plante, O. J., Seeberger, P. H. Oligosaccharide synthesis in solution and on solid support with glycosyl phosphates. Eur. J. Org. Chem. (4), 595-606 (2002).
- Stallforth, P., Lepenies, B., Adibekian, A., Seeberger, P. H. 2009 Claude S. Hudson Award in Carbohydrate Chemistry. Carbohydrates: a frontier in medicinal chemistry. J. Med. Chem. 52 (18), 5561-5577 (2009).
- Danishefsky, S. J., Mcclure, K. F., Randolph, J. T., Ruggeri, R. B. A Strategy for the Solid-Phase Synthesis of Oligosaccharides. Science. 260 (5112), 1307-1309 (1993).
- Demchenko, A. V. Stereoselective chemical 1,2-cis O-glycosylation: From 'sugar ray' to modern techniques of the 21st century. Synlett. (9), 1225-1240 (2003).
- Fraserreid, B., Wu, Z. F., Udodong, U. E., Ottosson, H. Armed-Disarmed Effects in Glycosyl Donors - Rationalization and Sidetracking. J. Org. Chem. 55 (25), 6068-6070 (1990).
- Bohe, L., Crich, D. A propos of glycosyl cations and the mechanism of chemical glycosylation; the current state of the art. Carbohydr. Res. 403, 48-59 (2015).
- Toshima, K., Tatsuta, K. Recent Progress in O-Glycosylation Methods and Its Application to Natural-Products Synthesis. Chem. Rev. 93 (4), 1503-1531 (1993).
- Koenigs, W., Knorr, E. Ueber einige Derivate des Traubenzuckers und der Galactose. Chem. Ber. 34 (1), 957-981 (1901).
- Mukaiyama, T., Murai, Y., Shoda, S. An Efficient Method for Glucosylation of Hydroxy Compounds Using Glucopyranosyl Fluoride. Chem. Lett. (3), 431-432 (1981).
- Meloncelli, P. J., Martin, A. D., Lowary, T. L. Glycosyl iodides. History and recent advances. Carbohydrate Research. 344 (9), 1110-1122 (2009).
- Lian, G., Zhang, X., Yu, B. Thioglycosides in carbohydrate research. Carbohydr. Res. 403, 13-22 (2015).
- Schmidt, R. R., Kinzy, W. Anomeric-Oxygen Activation for Glycoside Synthesis - the Trichloroacetimidate Method. Advances in Carbohydrate Chemistry and Biochemistry. 50, 21-123 (1994).
- Schmidt, R. R., Toepfer, A. Glycosylation with highly reactive glycosyl donors: efficiency of the inverse procedure. Tetrahedron Lett. 32 (28), 3353-3356 (1991).
- Keith, D. J., Townsend, S. D. Direct, microwave-assisted substitution of anomeric nitrate-esters. Carbohydr. Res. 442, 20-24 (2017).
- Bukowski, R., et al. Synthesis and Conformational Analysis of the T-Antigen Disaccharide(B-D-Gal-(1->3)-a-D-GalNAc-OMe). Eur. J. Org. Chem. 14, 2697-2705 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados