Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Один горшок Микроволновая печь помощь преобразование Anomeric нитрат-эфиры Trichloroacetimidates
В этой статье
Резюме
2-azido-1-нитрат Эстер может быть преобразован в соответствующий 2-azido-1-trichloroacetimidate в один горшок процедуры. Рукопись призвана продемонстрировать полезность микроволновой реактора в синтезе углеводов.
Аннотация
Следующая процедура призвана обеспечить демонстрацию Однореакторный преобразования 2-azido-1-нитрат Эстер trichloroacetimidate glycosyl донора. После azido азотирования Енозы Эстер 2-azido-1-нитрата продукт может гидролизованный под облучением при содействии Микроволновая печь. Это преобразование обычно достигается с помощью сильно нуклеофильных реагентов и длительного времени реакции. Микроволновая печь облучение вызывает гидролиз, в отсутствие реагентов, с коротким временем реакции. После денитрация промежуточные anomeric алкоголя преобразуется в том же банке, чтобы соответствующий 2-azido-1-trichloroacetimidate.
Введение
Из-за их вездесущность в молекулярной биологии углеводы были давней цели для химического синтеза. 1 , 2 , 3 основой любой успешной кампании синтетических является правильное развертывание гликозилирования реакций для создания цепи олигосахариды. 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 не удивительно, существует большое количество методов установки гликозидных связей. 13 , 14 Кёнигс-Knorr метод является одним из первых известных процедур и включает в себя муфты glycosyl хлорид или бромид с алкогольных компонентом, обычно под тяжелых металлов (ртути или серебро) активации. 15 фториды связанные glycosyl впервые были введены как доноров в 1981 году группой Мукаяма и нашли широкое применение из-за их повышенной тепловой и химической стабильности. 16 на противоположном конце спектра реактивности являются glycosyl йодиды, которые являются гораздо более реактивен, чем другие галогениды. Увеличение реактивности сопровождается повышенной stereocontrol, особенно когда формирования олигосахариды, α-связаны. 17 в дополнение к «haloglycosides», тиогликозид нашли широкий Утилита, отчасти, из-за их легкости формирования, стабильности на множество условий реакции и активация с электрофильное реагентов. 18
Методы, описанные выше фокус на преобразование anomeric спирт «не кислород», содержащие, скрытые покидает группу, которая активируется и в конечном счете, перемещенных в результате спирта от акцепторные молекулы. Активации кислорода Anomeric как описано в школе Шмидт, фокусируется на преобразования C1 кислорода, сам, чтобы покинуть группу. 19 этот метод является наиболее мощным и широко используется в химической гликозилирования реакций. Trichloroacetimidate доноры готовятся легко от снижения сахара и trichloroacetonitrile присутствии основания например карбонат калия (K2CO3) или 1,8-diazabicyclo [5.4.0] undec-7-Ен (дБ). Эти виды затем активируются с помощью кислоты Льюиса. 20
Недавно мы сообщили, что 2-azido-1-trichloroacetimidate доноров может быть непосредственно подготовлен от glycals. Этот процесс включает в себя две реакции, процедура один горшок из эфиров 2-azido-1-нитрата. 21 этот подробный протокол предназначен для оказания помощи практиков в успешном завершении преобразования в высокой доходности. Особый интерес представляет первый шаг в последовательности, которая фокусируется на тепловой денитрация под Микроволновая печь - при содействии Отопление. Мы также надеемся обеспечить визуальный учебник на использование микроволновой реакторов в органическом синтезе.
протокол
1. Представитель Микроволновая печь-помощь денитрация
- Место azido нитрата Эстер (1.0 экв, 0,2 ммоль) в 8 мл флаконе реакции Микроволновая печь. Масштаб реакции может быть увеличена до нескольких ммоль без каких-либо неблагоприятного влияния на прогресс реакции.
- Растворите Эстер azido нитрата в 20% собственн ацетон (0,1 М, 2.0 мл). Добавьте пиридина (5.0 экв, 0,08 мл, 1.0 ммоль) в реакционный сосуд. Колпачок флакона облучения микроволновой и реакционный сосуд в полость реактора Микроволновая печь.
- Облучение раствора на 120 ° C в течение 15 мин с перемешиванием и с фиксированной провести время. Время представляет, как долго облучения будет происходить на назначенный температуры и результирующая давления. Тепло все реакции на сообщения о температуре в течение 2-х минутах наращивает. Мониторинг температуры встроенный инфракрасный датчик.
- После 15 минут анализируйте реакционную смесь, используя тонкий слой хроматографии (ТСХ) для подтверждения потребление исходного материала. Качестве элюента используйте этиловый ацетат/гексаны 1:1.
- Визуализируйте TLC пластину, используя Серик аммония molybate пятно. Rf реагент и продукта будут отличаться, но сокращение алкоголя является как правило от 0,05 до 0,1 ниже Rf чем реагент.
2. формирование trichloroacetimidate
- После полного потребления исходного материала испарения растворителя для уменьшения объема с помощью авиакомпании. Затем разбавить (дихлорметаном) CH2Cl2 (1,0 мл) и использовать шприц для удаления слоя воды. После удаления слоя воды, холодная реакционную смесь до 0 ° C, с помощью льда водяной бане.
- Далее добавьте дБу (10 eq, 0,3 мл, 1,9 ммоль) и 2,2,2-trichloroacetonitrile (50 eq, 1,0 мл, 10 ммоль) в реакционный сосуд. Необходимы как минимум 1 эквивалент базы и 1 эквивалент 2,2,2-trichloroacetonitrile и оба реагенты добавляются в избытке.
- Разрешить смесь реакции перемешивать пока потепление температуры окружающей среды. Контролировать реакцию TLC для подтверждения потребление исходного материала.
- Качестве элюента используйте этиловый ацетат/гексаны 1:1. Визуализируйте TLC пластину, используя Серик аммония molybate пятно. Rf реагент и продукта будут меняться.
- После полного потребления исходного материала передача смеси реакции восстановления колбу и концентрации смеси в вакууме при температуре 30 ° C. Испарение растворителя обеспечит сырой бледно-желтый коричневый нефти.
- Очищайте сырой продукт, силикагель колоночной хроматографии со столбцом хроматография 1,5 см и 1:4 этиловый ацетат/гексаны как элюента. Физическая форма imidate будет варьироваться от молекулы в молекуле.
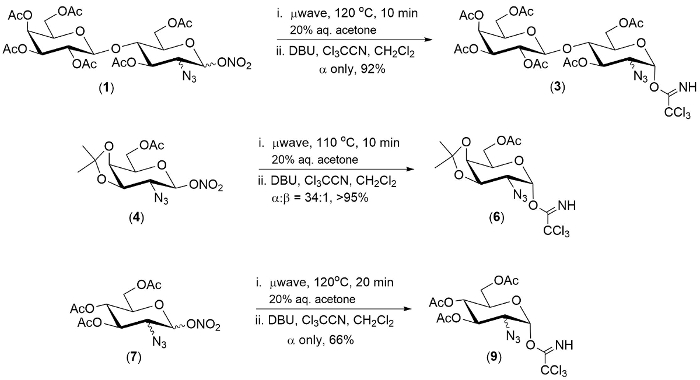
Рис. 1. Типичные примеры преобразования Однореакторный эфиров 2-azido-1-нитрата 2-azido-1-trichloroimidates. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Результаты
Технологии, описанные здесь была продемонстрирована на совокупность трех эфиров 2-azido-1-нитрата. В каждом случае первым шагом реакции был полностью в течение 20 минут.
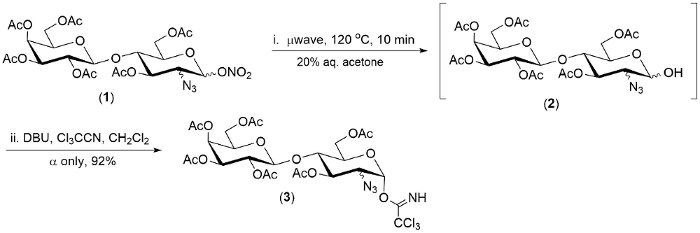
Рисунок 2. Типи...
Обсуждение
Протокол, описанные в данном руководстве предоставляет метод для преобразования нитрата эфиры полезным, реактивной функциональность. В более широком смысле использование микроволновой реактора для завершения определенных маневров в течение синтеза углеводов имеет потенциал, чтобы ...
Раскрытие информации
Авторы имеют без финансовых интересов.
Благодарности
Авторы хотели бы признать Университет Вандербильта и Институт химической биологии для финансовой поддержки. Г-н Эллис Беркли и профессор Джон Маклин признал высокоразрешающей массы спектрального анализа.
Материалы
| Name | Company | Catalog Number | Comments |
| 230 400 mesh silica gel | SiliCycle Inc | R10030B | |
| TLC plates | SiliCycle Inc | TLG-R10014B-527 | |
| Ceric ammonium molybdate | Sigma-Aldrich | A1343 | |
| Solvent Still | Mbraun | MB-SPS-800 | |
| Infared spectrometer | Thermo | Thermo Electron IR100 | |
| Nuclear Magnetic Resonance | Bruker | 400, 600 MHz | |
| LC/MS | Thermo/Dionex | Single quad, ESI | |
| HRMS | Agilent | Synapt G2 S HDMS | |
| Microwave reactor | Anton Parr | Anton Parr G10 Monowave 200 | |
| DBU | Sigma-Aldrich | 139009 | |
| CCl3CN | Sigma-Aldrich | T53805 | |
| Pyridine | Sigma-Aldrich | 270970 | |
| Acetone | Fisher Scientific | A18-20 | Tech. grade |
| Phase separator | Biotage | 120-1901-A | |
| Rotary evaporator | Buchi | R-100 |
Ссылки
- Nicolaou, K. C., Mitchell, H. J. Adventures in Carbohydrate Chemistry: New Synthetic Technologies, Chemical Synthesis, Molecular Design, and Chemical Biology A list of abbreviations can be found at the end of this article. Telemachos Charalambous was an inspiring teacher at the Pancyprian Gymnasium, Nicosia, Cyprus. Angew. Chem. Int. Ed. Engl. 40 (9), 1576-1624 (2001).
- Danishefsky, S. J., Allen, J. R. From the laboratory to the clinic: A retrospective on fully synthetic carbohydrate-based anticancer vaccines. Angew. Chem. Int. Ed. Engl. 39 (5), 836-863 (2000).
- Nicolaou, K. C., Hale, C. R. H., Nilewski, C., Ioannidou, H. A. Constructing molecular complexity and diversity: total synthesis of natural products of biological and medicinal importance. Chemical Society Reviews. 41 (15), 5185-5238 (2012).
- Zhu, X., Schmidt, R. R. New principles for glycoside-bond formation. Angew. Chem. Int. Ed. Engl. 48 (11), 1900-1934 (2009).
- Danishefsky, S. J., Bilodeau, M. T. Glycals in organic synthesis: The evolution of comprehensive strategies for the assembly of oligosaccharides and glycoconjugates of biological consequence. Angew. Chem. Int. Ed. Engl. 35 (13-14), 1380-1419 (1996).
- Bongat, A. F., Demchenko, A. V. Recent trends in the synthesis of O-glycosides of 2-amino-2-deoxysugars. Carbohydr. Res. 342 (3-4), 374-406 (2007).
- Feizi, T., Fazio, F., Chai, W. C., Wong, C. H. Carbohydrate microarrays - a new set of technologies at the frontiers of glycomics. Curr. Opin. Struct. Biol. 13 (5), 637-645 (2003).
- Palmacci, E. R., Plante, O. J., Seeberger, P. H. Oligosaccharide synthesis in solution and on solid support with glycosyl phosphates. Eur. J. Org. Chem. (4), 595-606 (2002).
- Stallforth, P., Lepenies, B., Adibekian, A., Seeberger, P. H. 2009 Claude S. Hudson Award in Carbohydrate Chemistry. Carbohydrates: a frontier in medicinal chemistry. J. Med. Chem. 52 (18), 5561-5577 (2009).
- Danishefsky, S. J., Mcclure, K. F., Randolph, J. T., Ruggeri, R. B. A Strategy for the Solid-Phase Synthesis of Oligosaccharides. Science. 260 (5112), 1307-1309 (1993).
- Demchenko, A. V. Stereoselective chemical 1,2-cis O-glycosylation: From 'sugar ray' to modern techniques of the 21st century. Synlett. (9), 1225-1240 (2003).
- Fraserreid, B., Wu, Z. F., Udodong, U. E., Ottosson, H. Armed-Disarmed Effects in Glycosyl Donors - Rationalization and Sidetracking. J. Org. Chem. 55 (25), 6068-6070 (1990).
- Bohe, L., Crich, D. A propos of glycosyl cations and the mechanism of chemical glycosylation; the current state of the art. Carbohydr. Res. 403, 48-59 (2015).
- Toshima, K., Tatsuta, K. Recent Progress in O-Glycosylation Methods and Its Application to Natural-Products Synthesis. Chem. Rev. 93 (4), 1503-1531 (1993).
- Koenigs, W., Knorr, E. Ueber einige Derivate des Traubenzuckers und der Galactose. Chem. Ber. 34 (1), 957-981 (1901).
- Mukaiyama, T., Murai, Y., Shoda, S. An Efficient Method for Glucosylation of Hydroxy Compounds Using Glucopyranosyl Fluoride. Chem. Lett. (3), 431-432 (1981).
- Meloncelli, P. J., Martin, A. D., Lowary, T. L. Glycosyl iodides. History and recent advances. Carbohydrate Research. 344 (9), 1110-1122 (2009).
- Lian, G., Zhang, X., Yu, B. Thioglycosides in carbohydrate research. Carbohydr. Res. 403, 13-22 (2015).
- Schmidt, R. R., Kinzy, W. Anomeric-Oxygen Activation for Glycoside Synthesis - the Trichloroacetimidate Method. Advances in Carbohydrate Chemistry and Biochemistry. 50, 21-123 (1994).
- Schmidt, R. R., Toepfer, A. Glycosylation with highly reactive glycosyl donors: efficiency of the inverse procedure. Tetrahedron Lett. 32 (28), 3353-3356 (1991).
- Keith, D. J., Townsend, S. D. Direct, microwave-assisted substitution of anomeric nitrate-esters. Carbohydr. Res. 442, 20-24 (2017).
- Bukowski, R., et al. Synthesis and Conformational Analysis of the T-Antigen Disaccharide(B-D-Gal-(1->3)-a-D-GalNAc-OMe). Eur. J. Org. Chem. 14, 2697-2705 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены