Method Article
Medida flexible de reporteros bioluminiscentes con un automatizado Luciferase Longitudinal imagen optimizada de Gas y temperatura grabadora (cocodrilo)
En este artículo
Resumen
Luciferase genéticamente codificado es un popular reportero no invasivo de la expresión génica. Uso de un automatizado luciferase longitudinal imagen optimizada de gas y temperatura grabadora (cocodrilo) permite la grabación longitudinal de células bioluminiscentes bajo una amplia gama de condiciones. Aquí mostramos cómo cocodrilo puede utilizarse en el contexto de la investigación de los ritmos circadianos.
Resumen
Reporteros de luciferasa basado de la expresión génica celular son de uso generalizado para ambos longitudinal y punto final ensayos de actividad biológica. En la investigación de los ritmos circadianos, por ejemplo, fusiones de genes reloj con luciferasa de luciérnaga dan lugar a ritmos robustos en bioluminiscencia celular que persisten durante muchos días. Limitaciones técnicas asociadas con los tubos de fotomultiplicador (PMT) o métodos convencionales basados en la microscopía para la cuantificación de la bioluminiscencia han exigido normalmente que las células y los tejidos se mantenga en condiciones absolutamente fisiológico durante grabación, con una relación inversa entre la sensibilidad y rendimiento. Aquí, Divulgamos un refinamiento de métodos anteriores que permite imágenes de bioluminiscencia a largo plazo con alta sensibilidad y rendimiento que apoya una amplia gama de condiciones de cultivo, incluyendo gas variable y control de humedad, y que acepta muchas diferentes platos y placas de cultivo de tejidos. Este luciferase longitudinal automatizada optimizada de gas y temperatura grabadora (cocodrilo) la proyección de imagen también permite la observación de las variaciones espaciales en la expresión de luciferasa en una monocapa de células o tejido, que no puede ser observado fácilmente por el tradicional métodos. Destacamos cómo el cocodrilo proporciona flexibilidad mucho mayor para la detección de actividad de luciferasa en comparación con los métodos existentes.
Introducción
El uso de luciferasas como reporteros de expresión génica y actividad de la proteína se ha convertido en una técnica popular en la investigación de la biología molecular y celular. Esto es cierto en el campo circadiano, siendo particularmente idóneo para informar los cambios longitudinales en la expresión génica que ocurren durante el ciclo circadiano h aproximadamente 24 la cinética de inactivación catalítica y de síntesis de luciferasa de luciérnaga. Como tal, luciferasa se emplea como un reportero circadiano a través de una amplia gama de microorganismos, incluyendo hongos, plantas, moscas y mamíferos1,2,3,4.
Cuando la cuantificación de la expresión de genes circadianos en vitro, un tubo fotomultiplicador (PMT) se utiliza comúnmente para grabar la señal bioluminiscente. Medidas basadas en el PMT es limitada flexibilidad sin embargo, generalmente se limita a un determinado tamaño de plato o plato. También no es posible recabar toda la información espacial de las muestras monitoreadas usando un PMT, que puede conducir a una pérdida de información cuando las muestras que indican variación espacial en la expresión de la luciferasa de la proyección de imagen. Además, como el PMT y el asociado son propensos a un mal funcionamiento cuando se expone al ambiente humidificado de una incubadora de cultivo de célula estándar, grabación longitudinal luciferase usando PMT se realiza siempre en incubadoras no humidificado. En consecuencia, platos de cultivo celular deben sellarse herméticamente para evitar la pérdida de humedad por evaporación y los medios de cultivo por lo tanto debe ser protegido con 3-(N- morfolino) el ácido propanesulfonic (MOPS) o 4-(2-hidroxietil) -1- -1-ácido ácido (HEPES), más que el CO2/bicarbonate buffering sistema que funciona en vivo y se utiliza rutinariamente en cultivo de tejidos de mamífero.
Como resultado de estas limitaciones, medición de bioluminiscencia por PMTs generalmente impone restricciones apretadas sobre las condiciones bajo las cuales las células se mantienen durante los experimentos. Para superar estos problemas y también para aumentar el rango de condiciones experimentales, utilizamos una estándar CO2/N2 170 L cultivo de tejidos incubadora que ha sido adaptada por la adición de una agua fría electrón-multiplicar dispositivo de carga acoplada (EMCCD) cámara con ópticas antiniebla y control digital de temperatura y gas. Esto ha sido denominado un automatizado la proyección de imagen de Luciferase Longitudinal Gas y grabadora de Temperature-Optimized o cocodrilo. El cocodrilo permite flexibilidad substancialmente creciente de imágenes bioluminiscentes, tanto para la proyección de imagen de alto rendimiento de las placas de cultivo de tejidos estándar (hasta 6 x 96 o 384-bien placas al mismo tiempo) y también para los sistemas de cultivo de tejidos no estándar, tales como perfusión células cultivadas en dispositivos microfluídicos. Este instrumento también permite la proyección de imagen para ocurrir bajo condiciones humidificadas y con control variable de tanto CO2 y presión parcial de O2 así como temperatura.
El protocolo a continuación describe un método para la grabación bioluminiscente de células de mamífero y sistemas de cultivo de tejidos con un caimán (en adelante referido como 'incubadora' de bioluminiscencia). Sin embargo, cabe señalar que el sistema sería idóneo para la proyección de imagen bioluminiscente y también, con alguna modificación, fluorescente de la proyección de imagen, en un número de otros sistemas biológicos y contextos.
Protocolo
1. siembra y arrastre de la temperatura de las células
Nota: Este protocolo ha sido rigurosamente probado usando fibroblastos de ratón primaria e inmortalizado expresando la de proteína de fusión PERIOD2::LUCIFERASE (PER2::LUC)4. Ajustes pueden necesitar que se hagan experimentos con otras líneas celulares.
- Antes de comenzar el cultivo celular, colocar en un baño de agua de 37 ° C para calentar el siguiente: tampón fosfato salino PBS (PBS) (pH 7.4), suplementado con ácido etilendiaminotetracético de 0,68 mM, pH 7.2 (PBS + EDTA), medios de cultivo celular adecuado, por ejemplo, Medium (DMEM modificado Eagle de Dulbecco) suplementado con 10% suero bovino fetal (FBS), 100 U/mL de penicilina y estreptomicina 100 de μg/mL y solución al 0.25% tripsina.
- Diluir con solución de PBS + EDTA con tripsina 1:3 y volver al baño de agua.
- Tomar un matraz de 125 cm2 de células de expresión de luciferasa que son 70-90% confluente. Aspire los medios de comunicación. Añadir 10 mL PBS precalentada.
- Aspire el PBS. Añadir 2,5 mL con tripsina-EDTA y regrese el frasco a una incubadora de 37 ° C durante 5 minutos.
- Eliminar las células de la incubadora y ver bajo un microscopio. Una vez que la mayoría de las células ha desprendido de la parte inferior del frasco, continúe al siguiente paso. Si la mayoría de las células permanece adherida a la parte inferior del frasco, devuélvalo a la incubadora hasta que mayoría de las células en suspensión.
- Añadir 7,5 mL de medio de cultivo celular estándar más en el matraz. Opcionalmente, extraiga 1 mL de esta para otro paso de las células, según sea necesario.
- Contar la densidad de las células restantes utilizando un hemocitómetro y trypan blue. Diluir las células más lejos, como apropiado para esa línea celular.
Nota: Para los experimentos siguientes, PERIOD2::LUC fibroblastos fueron sembrados entre 6 x 103 células/cm2 y 1 x 104 células/cm2 en placas de 96 pocillos, platos de 35 mm o transparencias de canal. - Células de semilla en el cultivo de tejidos platos o placas que se utilizarán para la grabación.
Nota: Recomienda utilizar negro echado a un lado, con fondo claro las placas ya que esto permite cultura salud evaluarse antes de comienzan a grabaciones, reduciendo interferencia entre pozos durante la grabación. Donde bioluminiscencia niveles son extremadamente bajos, platos/placas blancas debe utilizarse para maximizar la detección de luz, aunque por favor tenga en cuenta que la fosforescencia puede conducir a mayor señal de fondo que persiste por varias horas. - Devolver las placas en la incubadora y permiten monocapas llegar a la confluencia del 100% (aproximadamente 7 días).
Nota: Una vez confluentes, líneas de células que inhiben el contacto pueden mantenerse hasta tres semanas antes de la experimentación siempre que los medios de comunicación se actualizan regularmente (cada 5-7 días). - Una vez confluentes, sincronizar ritmos celulares usando ciclos de temperatura aplicada (12 h a 32 ° C, 12 h a 37 ° C) durante un mínimo de 72 h inmediatamente antes de la experimentación5,6 (utilizando una incubadora ciclo previamente programada, controlado por un ordenador conectado a la incubadora a través de un puerto serie RS-232).
Nota: El número de ciclos de temperatura necesaria para la sincronización de los ritmos celulares puede variar entre las líneas de las células y por lo tanto deban ser optimizados para otras líneas celulares. Estimulación farmacológica aguda con forskolin o dexametasona se ha utilizado anteriormente para sincronizar ritmos celular7,8.
2. NS21 preparación
Nota: NS21 es un suplemento libre de suero para el mantenimiento de cultivos de células neuronales y otros. Es un refinamiento de un suplemento similar conocido como B27, que está comercialmente disponible y puede ser utilizado como un reemplazo de suero durante el circadiano bioluminiscencia grabaciones9. Cualquier suplemento puede utilizarse indistintamente en los medios de grabación de los protocolos experimentales que se describen a continuación. Es bastante factible y rentable para hacer NS21 interno, como en Chen et al. 10y como se describe aquí.
- Equilibrar todos los componentes descritos en la tabla 1 a temperatura ambiente durante 1 h antes de empezar.
- Disuelva el albúmina bovina 50 g en medio basal de 324 mL (por ejemplo, neurobasal) en hielo. Revolver la mezcla lo menos posible.
- Añadir todos los otros componentes, como mínimo revolviendo después de cada componente pero todavía asegurándose la mezcla completa. Pretenden disolver todos los componentes de 90 min de empezar.
- Alícuota de la mezcla final y almacenar a-20 ° C hasta que se. Evitar ciclos de congelación y descongelación repetida.
Nota: La mezcla es demasiado viscosa para filtrar en esta etapa, pero será estéril filtrado diluyendo con los medios de comunicación antes de agregar a las células.
3. registro preparación de medios de comunicación
Nota: Una ventaja principal de la incubadora de bioluminiscencia sobre otros equipos para la grabación longitudinal bioluminiscencia es que, en virtud de ser capaz de humectar la incubadora y variar la presión parcial de O2 y CO2, es posible utilizar una gama más amplia de las condiciones de los medios de comunicación de bioluminescence de grabación, incluyendo las condiciones que más estrechamente aproximan el fisiológico nicho ocupado por células diferentes tipos en vivo. A continuación se describe la formulación de grabación de medios adaptados de Hastings et al. 9, que hemos utilizado rutinariamente con fibroblastos cultivados y otros tipos de células. La primera es para condiciones de cultivo cerrado (sin intercambio de gases), y la segunda es para condiciones fisiológicamente relevantes y puede usarse bajo condiciones humidificadas con 5% CO2.Muchas otras variaciones son posibles y convenientes, dependiendo de la aplicación exacta y tipo de la célula.
- Preparación de medios de glucosa alta tamponado con MOPS
Nota: Archivo de solución (1 L): polvo DMEM (8,3 g/L), glucosa de 5 mg/mL de bicarbonato de sodio, de 0,35 mg/mL, Lampazos de 0.02 M, 100 U/mL de penicilina, estreptomicina μg/mL 100.- Disolver 8,3 g DMEM polvo en 900 mL de agua ultrapura en una probeta de 1000 mL y agitar durante 30 minutos hasta que se disuelvan todas las partículas.
- Añadir 50 mL de solución de glucosa (100 g/L), 20 mL de mopas (1 M, pH 7.6), 10 mL de 100 x solución de pluma/strep y revuelva por un 10 min más.
- Agregue una solución de bicarbonato de sodio de 7.5% 4,7 mL y agitar durante un minuto 5 más.
- Ajustar el pH de los medios de comunicación a 7,6 (si a temperatura ambiente) o 7.4 (37 ° C) con HCl/NaOH.
- Añadir agua ultrapura para producir un volumen final de 1000 mL.
- Esterilizar por filtración a través de un 0,22 μm filtro y almacenar a 4 ° C hasta que se.
- Antes de la experimentación, suplemento de un volumen apropiado de solución madre con 10% de suero, 2 mM L-Alanil-L-glutamina, luciferin NS21 el 2% y 1 mM para hacer una bolsa de trabajo. Pasar esta población a través de un filtro estéril de 0,22 μm.
- Medir la osmolalidad de los medios de comunicación utilizando un osmómetro.
- Encienda el osmómetro.
- Calibrar el osmómetro, primero con agua ultrapura. Añadir 50 μl de agua a la parte inferior de un recipiente de medición. Asegúrese de que hay no hay burbujas en el líquido. Enganche el vaso sobre la sonda. Pulse 'Cero' y baje con cuidado el brazo de osmómetro al punto más bajo. Espere hasta que la lectura es completa y verde 'resultado' se enciende antes de levantar el brazo y retirar el buque.
- Repita el procedimiento para calibrar el osmómetro a 300 mOsmol/kg usando el estándar de calibración de 50 μl. Presione 'Cal' antes de bajar el brazo.
- Medir la osmolalidad de la muestra mediante la adición de 50 μl de los medios de comunicación a la parte inferior de un buque y medida como la anterior medición. Pulse 'muestra' antes de bajar el brazo del osmómetro.
- Ajustar la osmolalidad a 350 mOsmol ClNa 5 M.
- HCO3-tampón preparación de medios (media de perfusión) glucosa baja
Nota: Archivo de solución (1 L): polvo DMEM (8,3 g/L), 3,7 mg/mL bicarbonato de sodio, glucosa 1 mg/mL, 100 U/mL de penicilina, estreptomicina 100 de μg/mL.- Disolver 8,3 g DMEM polvo en 900 mL de agua ultrapura en una probeta de 1000 mL y agitar durante 30 minutos hasta que se disuelvan todas las partículas.
- Añadir 50 mL de solución de glucosa (100 g/L), 10 mL de solución de pluma/strep x 100 y agitar durante un minuto 10 más.
- Agregue una solución de bicarbonato de sodio de 7.5% 49,4 mL y agitar durante un minuto 5 más.
- Ajustar el pH de los medios de comunicación a 7,6 (a temperatura ambiente) o 7.4 (37 ° C) con HCl/NaOH.
- Añadir agua ultrapura para dar un volumen final de 1000 mL.
- Pasar la solución a través de un 0,22 μm filtro estéril y conservar a 4 ° C hasta su uso.
- Antes de la experimentación, suplemento de un volumen apropiado de solución con 2% de suero, 2 mM L-Alanil-L-glutamina, 2% NS21 y luciferin de 1 mM para hacer una bolsa de trabajo. Pasar esta población a través de un filtro estéril de 0,22 μm.
- Medir y ajustar la osmolalidad a 350 mOsmol ClNa 5 M, en cuanto a los medios de comunicación tamponado con MOPS.
Nota: Luciferin concentración debe determinarse empíricamente para cada tipo de célula y el contexto. Para más información véase Feeney et al. 11 suero y NS21 (o B27 si usa) las concentraciones pueden variar dependiendo de la aplicación. Sin embargo, aconsejamos que, a menos que empíricamente probados para demostrar lo contrario, suero y NS21 suplemento alternativo libre de suero) puede usar (o, como estos promueven apego y supervivencia celular. En líneas celulares que no tienen contacto con inhibir así, puede ser necesario reducir la concentración sérica en los medios de grabación para evitar confusión efectos de proliferación, que es promovido también por el suero.
4. grabación
- Antes de comenzar la grabación, coloque el stock de medios de trabajo adecuados (del paso 3.1 o 3.2 según el experimento) en un baño de agua de 37 ° C para calentar.
- Mientras que los medios de comunicación se está calentando, enfoque la cámara en la incubadora de la bioluminiscencia.
- Desenroscar el filtro de densidad neutra agua impermeable, caliente y reservar.
- Configure el software para grabar un video con una tasa de adquisición alto. Haga clic en "adquisición | Configuración de la adquisición". Establecer 'Tiempo de exposición' en 0,2 s y tiempo de ciclo cinético de 0.3 segundos. Asegúrese de que ganancia EM está apagada.
- Cerrar la ventana de 'Configuración de adquisición' y haga clic en el icono "tomar video".
- Usando el cilindro de enfoque, gire el lente de la cámara hasta artículos en el estante a la altura para ser grabada claramente en foco en el video.
- Parar el vídeo haciendo clic en el icono 'stop video'.
- Atornille el filtro de densidad neutra climatizada en posición; no hacerlo resultará en daños a la cámara EM-CCD o empaña el objetivo debido a la condensación.
- Establezca O2, CO2y temperatura en las condiciones experimentales deseadas usando el panel de control en el frente de la incubadora de la bioluminiscencia.
Nota: En caso de perfusión cultivo celular proceda directamente a la sección 5 en esta etapa. - Eliminar las células de la incubadora de cultivo de tejidos y aspirado de los medios de comunicación. Sustituir los medios de comunicación con stock de trabajo.
- Si la incubadora de la bioluminiscencia no humidificado durante el experimento, luego selle los platos y placas con un sello de gas impermeable.
Nota: La humidificación se logra llenando la bandeja de agua en la base de la incubadora.
- Haga clic en "adquisición | Configuración de la adquisición".
- En el panel de 'Configuración de la cámara', establece: 'Modo de adquisición' para 'Cinética'; 'Tiempo de exposición a deseado tiempo de exposición, en segundos (ver nota más abajo); 'Acumulaciones' 1; 'Longitud de serie cinética' al número de ciclos de adquisición deseada; 'Tiempo de ciclo cinético' intervalo imagen deseada (Asegúrese de que esta es mayor que el tiempo de exposición); Cambio de velocidad a 4,33 µsecs; 'Ganar' a 1; y em ganar ' la nivel (ver nota más abajo)
- En el panel de 'Guardado', defina el tipo de archivo .sif o .tif. Proporcionar un nombre de archivo y apropiado guardar ubicación.
- En el panel de 'Cola', defina el tipo de archivo a BMP. Proporcionar un nombre de archivo y apropiado guardar ubicación. Cierre la ventana de configuración de la adquisición.
Nota: Como la incubadora de la bioluminiscencia puede ser utilizada para un gran número de diferentes células y tipos de tejidos, los cuales tendrán diferentes niveles de bioluminiscencia, el tiempo de exposición necesario para recoger una señal bioluminiscente adecuada variará entre experimentos. También es posible variar la ganancia (EM) multiplicación de electrones de la imagen con el fin de aumentar la magnitud de la señal recogida. Para nuevas aplicaciones de brillo desconocido, sugerimos en primer lugar tomar una sola imagen con un tiempo de exposición relativamente corto (alrededor de 10 minutos) sin aumento de EM y posteriormente ajustar el tiempo de exposición y EM aumento hasta que las condiciones de grabación deseado han sido alcanzado. En la mayoría de los casos, una señal promedio de 10-20% de la intensidad máxima posible píxeles de la cámara es un buen nivel para apuntar para. Una vez que se ha alcanzado un conjunto de parámetros de grabación, iniciar longitudinal adquisición de imágenes, como se describe anteriormente.
5. perfusión cultivo de tejidos (opcional)
Nota: Como se describe en la introducción, la incubadora de la bioluminiscencia es adecuada para la proyección de imagen de los sistemas de cultivo de tejidos no estándar. Esto se ejemplifica en el desarrollo de un sistema de cultivo celular perfundidos.
- Semilla de las células en un canal se desliza con conectores tipo Luer con una profundidad de canal de 0,6 o 0,8 mm, en DMEM con 10% FBS y pluma/strep, tal como se describe en la sección 1. Hacer los medios de perfusión como se describe en el paso 3.2.
- Antes de la grabación, preparar la tubería para el sistema de perfusión requiere con 1 mm de diámetro interno (I.D.) Tubería de ETFE y tubo de silicona de 1 mm de diámetro interior, codo, hombre y mujer accesorios Luer, como se muestra en la figura 2A.
Nota: La mayoría de la longitud de la tubería es tubería de ETFE, con secciones de 2 cm de tubo de silicona para conectar la tubería de ETFE los accesorios Luer, que posteriormente en las correderas de canal. - Esterilizar el tubo por lavado con etanol al 70%, seguido de PBS estéril.
- Eliminar los cultivos celulares en portaobjetos de canal de la incubadora. Aspire los medios de comunicación y reemplazar con medios de perfusión previamente calentado.
- Llene una jeringa de 20 mL con los medios de comunicación con la perfusión.
- Conecte la tubería al buffer de diapositiva (ver figura 2) pero no a la diapositiva que contiene el celular y al ras del tubo y deslice con medios de perfusión (3-5 mL).
- Conectar la diapositiva que contiene la célula y eliminar todo el sistema con un 1 mL adicional de medios de comunicación para eliminar las posibles burbujas de aire.
- Transferencia de todo el sistema a la incubadora de la bioluminiscencia.
- Ajuste las jeringas llenas de medios a la jeringa de la bomba sin desconectar el tubo y enjuague 1 mL más de los medios de comunicación a través de todo el sistema usando la bomba para asegurar allí son ningunas burbujas de aire en el sistema.
- Establecer el diámetro de la bomba para la jeringa que se utiliza.
Nota: Para las jeringas de 20 mL utilizadas aquí, el diámetro es de 19,13 mm. - Fijar el caudal de la bomba a 50 μl/h y empieza funcionando.
- Asegúrese de que no hay burbujas en la tubería antes del comienzo de la grabación, ni diapositivas ya estas influenciará la expresión de luciferasa cuando pasan a través de la monocapa celular. Si es necesario, enjuague más medios de comunicación a través de las células para lograrlo.
- Cerrar la puerta de la incubadora de bioluminiscencia y continuar como en el paso 4.7 para comenzar a grabar.
6. el tratamiento durante la grabación
Nota: A veces es deseable para el tratamiento de la mitad de las células a través de una grabación, ya sea con agentes hormonales o farmacológicos. En tales casos, es imprescindible que las células se tratan con cuidado para evitar la oscilación celular de reajuste durante el tratamiento. Por esta razón, es de especial importancia que las células se mantienen a una temperatura constante, ya que es un gran cue arrastra para celular circadiano5,6.
- Preparar todos los componentes del tratamiento antes de detener la grabación.
- Preparar una almohadilla química isotérmica a 37 ° C.
- Detener la grabación del dispositivo, retire los platos a tratar y colocar sobre la almohadilla de calor isotérmica.
- Tratar a las culturas como necesarios y retorno a la incubadora de la bioluminiscencia en la misma posición que antes.
- Vuelva a iniciar la grabación.
7. Análisis
Nota: La incubadora de bioluminiscencia produce datos en forma de una serie de imágenes individuales.Utilizamos principalmente Fiji12 para manejar estas imágenes y luego exportar los datos de intensidad de píxeles promedio para cada región de interés (ROI) para su posterior análisis.
- Abra la pila imagen en Fiji y ajustar el brillo y el contraste haciendo clic en "imagen | Ajustar | Brillo/contraste"y el ajuste de las barras de desplazamiento hasta imágenes dentro de un rango apropiado para la visualización de la señal bioluminiscente.
- Seleccionar áreas de interés mediante el administrador de retorno de la inversión en "analizar | Herramientas | ROI Manager".
- Señal promedio de exportación del área seleccionada haciendo clic en "Administrador de ROI | Más | Cualquier".
- Copiar los datos en el software de análisis.
- Ajustar manualmente la base de tiempo de datos para el intervalo de tiempo de la proyección de imagen (es decir, 15, 30 o 60 min intervalos, descritos como 0.25, 0.5, 1 h) en lugar del número de la imagen proporcionada por Fiji.
Nota: El análisis adicional puede ahora realizarse, como determinación del período. Para esto, la siguiente ecuación se utiliza para realizar análisis de regresión no lineal:

donde y es la señal, x el tiempo correspondiente, m es la pendiente de la línea de tendencia, c es el intercepto y de la línea de tendencia, amplitud es la altura del pico de la onda por encima de la línea de tendencia, k es la constante de decaimiento o la tasa de amortiguación (tal que 1k es el Half-Life), la fase es el cambio en x de la onda coseno, y el período es el tiempo tomado para que un ciclo completo producir13. Valor de R2 se utiliza como indicador de la bondad de ajuste. También son posibles otros métodos de análisis. Las primeras 24 h de la adquisición deben ser excluida del análisis, como celular bioluminesence puede presentar cambios transitorios, no circadiano durante este tiempo. Este es el resultado de una respuesta aguda a cambio de los medios de comunicación.
Resultados
Este artículo describe un protocolo para la proyección de imagen bioluminiscente de las células mamíferas usando un cocodrilo (incubadora de bioluminiscencia). Esta técnica permite flexibilidad de configuración física y condiciones extracelulares cuando proyección de imagen sistemas bioluminiscentes. Se describen métodos para cultivo de células inundado (figura 2, 2 de Video suplementaria) y simple cultura estática del tejido (figura 1, 1 de Video suplementaria), pero muchas otras configuraciones podrían ser reflejadas mediante este sistema. Todos los datos fueron cuantificados mediante los métodos descritos en la sección 7.
Figura 1A se muestra un ejemplo video de una bioluminiscencia grabación de placas 6 x 96 pocillos que contienen fibroblastos PER2::LUC4. Los pozos exteriores no contienen células como éstos no fueron necesarios para este experimento. Las células han sufrido arrastre diferencial de temperatura, por el que se someten a cualquier ciclo de temperatura de 12 h a 32 ° C, seguida por 12 h 37 ° C por 72 h o converse (12 h, a 37 ° C seguida por 12 h, a 32 º C durante 72 h), antes recluidos en constante de 37 ° C para la grabación. exposiciones de 60 min fueron tomadas cada hora. Dos de estas condiciones se cuantifican en la figura 1B.
Figura 2A muestra un esquema de la instalación de un sistema de cultivo de tejidos perfundido. Esto consiste en dos muestras de canal conectados con la tubería. Los medios de comunicación es conducido a través de las células por una bomba de jeringa. La primera de estas diapositivas actúa como una trampa de burbuja permeable al gas (diapositiva de buffer) y no contiene ninguna célula, con el segundo que contiene las células que se registra la bioluminiscencia. Un representante de grabación de video de este sistema se muestra en la figura 2B. exposiciones de 15 minutos fueron tomadas cada 15 minutos. Aquí, las células se mantienen en condiciones de perfusión estándar o en presencia de inhibidor de la quinasa de la caseína PF670462, que se ha demostrado previamente para alargar período circadiano y reducir la amplitud de ritmos de expresión de genes reloj en cultivo las células mamíferas14. El efecto sobre la expresión de PER2::LUC se muestra en la figura 2 (panel superior) contra las células tratadas con la misma concentración de droga bajo condiciones de cultivo de célula estática estándar que se muestra en la figura 2 (panel inferior), con cuantificación de período se muestra en la Figura 2D. Es claro de esto que el tratamiento con PF670462 influye en la expresión de PER2::LUC en ambos grupos de condiciones. Sin embargo, mientras que las células trataron con PF670462 bajo condiciones perfundidas Mostrar alargamiento período de aproximadamente 3 h (3 h ±0.9), las células en condiciones estáticas tratadas con el fármaco mostraron alargamiento período sustancialmente mayor a un periodo de > 48 h. Esto puede caber por un coseno amortiguado, como se describe en la sección 7, (extra suma de cuadrados F prueba frente a una línea recta, p < 0.0001). Curiosamente, la magnitud del alargamiento período bajo perfusión es mucho más cercana al observado en vivo14.
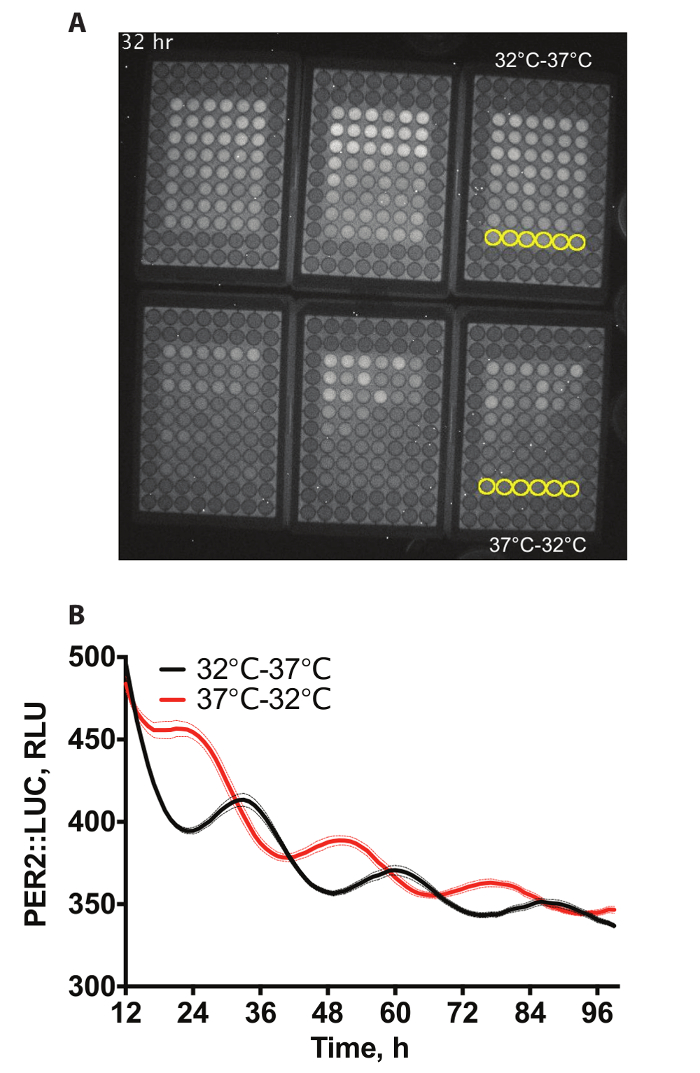
Figura 1: ejemplo de datos. (A) ejemplo video snapshot de bioluminescence de PER2::LUC inmortalizado en 6 x 96 bien las placas en la incubadora de la bioluminiscencia. Pozos para cuantificar se han destacado en amarillo en el Video complementario 1. (B) cuantificación de bioluminiscencia A. Dos juegos de 3 placas de células fueron atrapados con los ciclos de temperatura (12 h a 32 ° C, 12 h, a 37° C) que eran anti-fásicos entre sí para producir frente a fases de expresión de la proteína PER2 (n = 6, media ± SEM). Haga clic aquí para ver una versión más grande de esta figura.
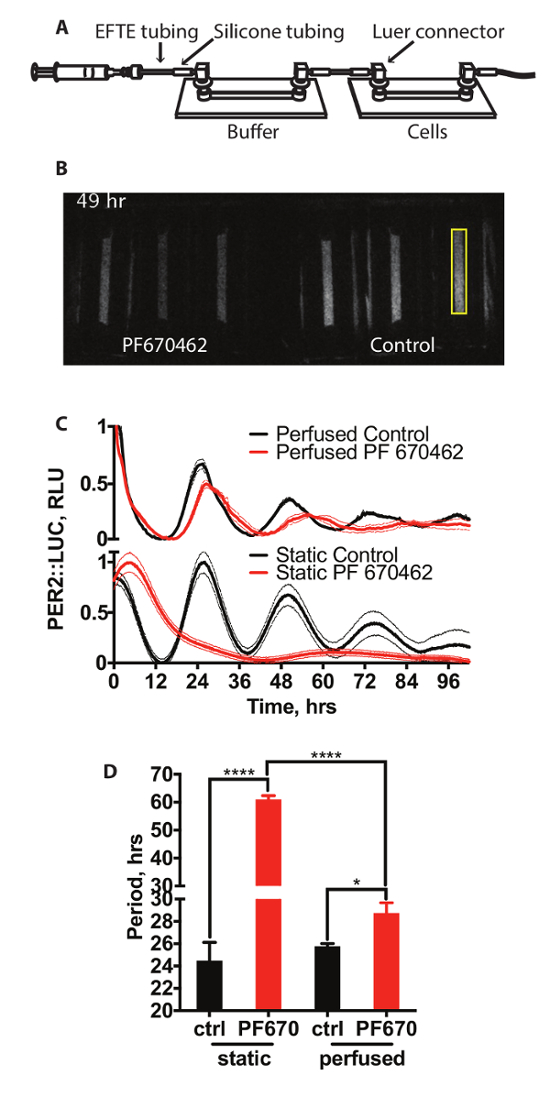
Figura 2: perfusión con inhibidores de la CK1δ. (A) diagrama esquemático del sistema de perfusión. (B) ejemplo de vídeo instantánea de una bioluminiscencia grabación de PER2::LUC de las células bajo perfusión. Un área de muestra de cuantificación es resaltada en amarillo. (C) cuantificación de bioluminescence de los fibroblastos PER2::LUC en perfusión y en condiciones estáticas con y sin inhibidor de CK1 de 3 μm PF670462 (n = 3, media ± SEM). Bioluminiscencia ha sido normalizada a los valores mínimos y máximos. (D) análisis de período (ANOVA de dos vías, test de comparaciones múltiples de Holm-Sidak).Haga clic aquí para ver una versión más grande de esta figura.
| Componente | Concentración media final (μM) | Valores (mg/mL) | Para 400 mL NS21 |
| Albúmina bovina | 37 | - | 50 g |
| Catalasa | 0.01 | - | 50 mg |
| Glutatión | 3.2 | - | 20 mg |
| Insulina | 0.6 | 10 | 8 mL |
| Superóxido dismutasa | 0.077 | - | 50 mg |
| Holo-transferrina | 0,062 | - | 100 mg |
| T3 (triyodotiroacético-L-tironina) | 0.0026 | 2 | 20 ΜL |
| L-carnitina | 12 | - | 40 mg |
| Etanolamina | 16 | Líquido (1 g/ml) | 20 ΜL |
| D (+)-galactosa | 83 | - | 300 mg |
| Putrescina | 183 | - | 322 mg |
| Selenito de sodio | 0.083 | 1 | 280 ΜL |
| Corticosterona | 0.058 | 2 | 0,2 mL |
| Ácido linoleico | 3.5 | 100 | 0,2 mL |
| Ácido linolénico | 3.5 | 100 | 0,2 mL |
| Ácido lipoico | 0.2 | 4.7 | 0,2 mL |
| Progesterona | 0.02 | 3.2 | 0,04 mL |
| Acetato de retinol | 0.2 | 20 | 0,1 mL |
| Retinol, todo el transporte | 0.3 | 10 | 0,2 mL |
| D, L-alfa-tocoferol | 2.3 | 100 | 0. 2 mL |
| D, L-alfa-tocoferol acetato | 2.1 | 100 | 0,2 mL |
Tabla 1: NS21 preparación.
1 Video complementario: video ejemplo de bioluminiscencia de las placas bien. Captura video de ejemplo de bioluminiscencia de PER2::LUC inmortalizado en placas bien 6 x 96 en la incubadora de la bioluminiscencia. Pozos para cuantificar se resaltan en amarillo. Haga clic aquí para descargar este archivo.
2 Video complementario: captura video de ejemplo de una bioluminiscencia grabación de PER2::LUC de las células bajo perfusión. Un área de muestra de cuantificación es resaltada en amarillo. Haga clic aquí para descargar este archivo.
Discusión
El protocolo descrito aquí es para cultura de células de mamífero, tanto bajo condiciones de perfusión y estática. Sin embargo, el cocodrilo puede ser fácilmente adaptado a otros sistemas modelo. De hecho, ya se ha demostrado para proporcionar una excelente plataforma para la monitorización simultánea de locomoción, el sueño y ritmos de expresión periférica gene en Drosophila melanogaster mantenida en oscuridad constante15. También se observa que, dependiendo de la aplicación, tipo de cámara que no sea mencionado aquí puede ser apropiado. Prevemos que con los filtros adecuados, una versión modificada de la actual configuración podría en principio utilizar para la cuantificación de la fluorescencia.
Las aplicaciones sólo para que el cocodrilo no sería apropiado son los que se requiere, como proyección de imagen de la organización espacio-temporal de la expresión PER2::LUC en rodajas organotypic de los mamíferos particularmente alta resolución espacial núcleo supraquiasmático, u otros sectores pequeños de tejido.
El cocodrilo permite muchos experimentos a realizar que hasta ahora no han sido fácilmente alcanzables por técnicas de grabación convencional. En comparación con los métodos actuales para la medición de la bioluminiscencia, el caimán ofrece mayor flexibilidad en el tipo de placa de cultivo celular o diapositiva que puede ser utilizado, las condiciones de medios externos, sensibilidad y procesividad.
Esto es particularmente relevante en un momento cuando hay un alejamiento de los modelos de cultura estándar celular 2D a 3D organoides y el flujo de los sistemas de cultivo. Como tal, se prevé que el caimán proporcionará un método adaptable que puede medirse bioluminiscencia durante muchos días bajo una amplia gama de condiciones.
Divulgaciones
No hay conflictos de intereses existentes.
Agradecimientos
Nos gustaría agradecer a Cairn investigación por trabajar con nosotros para desarrollar este sistema, en especial Mark Henson, Jeremy Graham y Joao Correia. También agradecemos a David Welsh y Akhilesh Reddy valiosa discusión durante la fase de diseño, así como Peter Laskey (antes de Hamamatsu) para organizar el préstamo de una cámara de demo y David Wong por su aporte crítico al manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| DMEM (1x) + GlutaMAX | Gibco | 31966-021 | |
| Hyclone FetalClone III Serum | GE Healthcare | SH30109.03 | |
| Neurobasal medium | Thermofisher | 21103049 | basal medium |
| Bovine Serum Albumin | Sigma | A4919 | |
| Catalase | Sigma | C40 | |
| Glutathione | Sigma | G6013 | |
| Insulin | Sigma | I1882 | |
| Superoxide Dismutase | Sigma | S5395 | |
| Holo-transferrin | Calbiochem | 616424 | |
| T3 (triiodo-L-thyronine | Sigma | T6397 | |
| L-Carnitine | Sigma | C7518 | |
| Ethanolamine | Sigma | E9508 | |
| D (+)-Galactose | Sigma | G0625 | |
| Putrescine | Sigma | P5780 | |
| Sodium Selenite | Sigma | S9133 | |
| Corticosterone | Sigma | C2505 | |
| Linoleic Acid | Sigma | L1012 | |
| Linolenic Acid | Sigma | L2376 | |
| Lipoic Acid | Sigma | T1395 | |
| Progesterone | Sigma | P8783 | |
| Retinol Acetate | Sigma | R7882 | |
| Retinol, all trans | Sigma | 95144 | |
| D,L-alpha-Tocopherol | Sigma | 95240 | |
| D,L-alpha-Tocopherol acetate | Sigma | T3001 | |
| Sodium Bicarbonate Solution | Sigma | S8761-100ML | |
| GlutaMAX (100x) | Gibco | 35050-038 | |
| Penicillin-Streptomycin | Sigma | P4333 | |
| Galaxy 170R incubator | Eppendorf | CO17301001 | |
| Luciferin | Biosynth | L-8220 | |
| D -(+)-Glucose solution | Sigma | G8644-100ML | |
| DMEM powder | Sigma | D5030 | |
| MOPS | Sigma | PHG0007 | |
| 1 mm I.D. silicone tubing | GE Healthcare | 19-4692-01 | |
| Elbow luer connector | Ibidi | 10802 | |
| Male luer fittings | Ibidi | 10826 | |
| Female luer fittings | Ibidi | 10825 | |
| µ-slide luer I 0.6 | Ibidi | 80196 | |
| BD plastipak 20ml syringe | Becton Dickinson | 300613 | |
| 1mm I.D. ETFE tubing | GE Healthcare | 18-1142-38 | |
| PF670462 | Sigma | SML0795 | |
| B27 Supplement (50x) | ThermoFisher | 17504044 | |
| iXon Ultra EMCCD camera | Andor | iXon 888 | |
| Fiji | ImageJ | N/A | |
| Prism 7.0 | Graphpad Software | N/A | |
| Trypan blue | Sigma | T8154 | |
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Heated neutral density filter | Cairn Research | Custom item | |
| Osmomat 030 | Gonotech | Discontinued | |
| 300 mOsmol/kg calibration standard | Gonotech | 30.9.0020 | |
| Measuring vessel | Gonotech | 30.9.0010 | |
| Focusing cylinder | Cairn Research | Custom item | |
| NE-1600 programmable syringe pump | Pump Systems inc. | NE-1600 | |
| Andor Solis Software | Andor | N/A |
Referencias
- Morgan, L. W., Greene, A. V., Bell-Pedersen, D. Circadian and light-induced expression of luciferase in Neurospora crassa. Fungal Genet. and Biol. 38 (3), 327-332 (2003).
- Millar, A. J. A Novel Circadian Phenotype Based on Firefly Luciferase Expression in Transgenic Plants. Plant Cell Online. 4 (9), 1075-1087 (1992).
- Yu, W., Hardin, P. E. Use of Firefly Luciferase Activity Assays to Monitor Circadian Molecular Rhythms In Vivo and In Vitro. Circadian Rhythms: Methods and Protocols. , 465-480 (2007).
- Yoo, S. -. H., et al. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proc Natl Acad Sci. 101 (15), 5339-5346 (2004).
- Buhr, D. E., Yoo, S. -. H., Takahashi, J. S. Temperature as a universal resetting cue for mammalian circadian oscillators. Science. 330 (6002), 379-385 (2010).
- Brown, S. A., Zumbrunn, G., Fleury-Olela, F., Preitner, N., Schibler, U. Rhythms of mammalian body temperature can sustain peripheral circadian clocks. Current Biology. 12 (18), 1574-1583 (2002).
- Balsalobre, A., et al. Resetting of circadian time in peripheral tissues by glucocorticoid signaling. Science. 289 (5488), 2344-2347 (2000).
- Balsalobre, A., Marcacci, L., Schibler, U. Multiple signaling pathways elicit circadian gene expression in cultured Rat-1 fibroblasts. Curr. Biol. CB. 10 (20), 1291-1294 (2000).
- Hastings, M. H., Reddy, A. B., McMahon, D. G., Maywood, E. S. Analysis of circadian mechanisms in the suprachiasmatic nucleus by transgenesis and biolistic transfection. Methods Enzymol. 393, 579-592 (2005).
- Chen, Y., Stevens, B., Chang, J., Milbrandt, J., Ba Barres, ., Hell, J. W. NS21: re-defined and modified supplement B27 for neuronal cultures. J. Neurosci Methods. 171 (2), 239-247 (2008).
- Feeney, K. A., Putker, M., Brancaccio, M., ONeill, J. S. In-depth Characterization of Firefly Luciferase as a Reporter of Circadian Gene Expression in Mammalian Cells. J. Biol. Rhythms. 31 (6), 540-550 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Hirota, T., Lewis, W. G., Liu, A. C., Lee, J. W., Schultz, P. G., Kay, S. A. A chemical biology approach reveals period shortening of the mammalian circadian clock by specific inhibition of GSK-3beta. Proc Natl Acad Sci. 105 (52), 20746-20751 (2008).
- Meng, Q., Maywood, E. S., Bechtold, D. A., Lu, W., Li, J., Gibbs, J. E. Entrainment of disrupted circadian behavior through inhibition of casein kinase 1 ( CK1 ) enzymes. Proc Natl Acad Sci. 1, 1-6 (2010).
- Khabirova, E., Chen, K. -. F., O'Neill, J. S., Crowther, D. C. Flyglow: Single-fly observations of simultaneous molecular and behavioural circadian oscillations in controls and an Alzheimer's model. Sci. Rep. 6, 33759 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados