Method Article
Flexible Messung der Biolumineszenz Reporter mit einer automatisierten längs Luciferase Imaging-Gas - und Temperatur-optimierte Recorder (ALLIGATOR)
In diesem Artikel
Zusammenfassung
Genetisch codierte Luciferase ist eine beliebte nicht-invasive Reporter der Genexpression. Eine automatisierte längs Luciferase imaging-Gas - und Temperatur-optimierte Recorder (ALLIGATOR) können längs Aufnahme von Biolumineszenz Zellen unter den unterschiedlichsten Bedingungen. Hier zeigen wir, wie ALLIGATOR im Rahmen des circadianen Rhythmus Forschung verwendet werden können.
Zusammenfassung
Luciferase-basierte Reporter der zellulären Genexpression sind weit verbreitet für beide längs- und Endpunkt assays biologischer Aktivität. In der zirkadianen Rhythmen Forschung entstehen z. B. Uhr gen Fusionen mit Firefly Luciferase robuste Rhythmen in zellulären Biolumineszenz, die über viele Tage hinweg beibehalten. Technische Einschränkungen verbunden mit Photomultiplier Tubes (PMT) oder konventionellen Mikroskopie-basierte Methoden zur Quantifizierung der Biolumineszenz haben in der Regel gefordert, dass Zellen und Gewebe ganz physiologischen Bedingungen während beibehalten werden Aufnahme mit einem Kompromiss zwischen Empfindlichkeit und Durchsatz. Hier berichten wir über eine Verfeinerung der vorherigen Methoden, die ermöglicht langfristige Biolumineszenz Bildgebung mit hoher Empfindlichkeit und Durchsatz die unterstützt eine breite Palette von Kulturbedingungen, einschließlich variabler Gas und Feuchtigkeitskontrolle, und akzeptiert, dass viele verschiedene Gewebekultur und Geschirr. Diese automatisierte längs Luciferase imaging-Gas - und Temperatur-optimierte Recorder (ALLIGATOR) auch ermöglicht die Beobachtung von räumlichen Variationen in Luciferase Ausdruck über eine Zelle Monolage oder Gewebe, das leicht durch herkömmliche beobachtet werden können Methoden. Wir heben hervor, wie der ALLIGATOR erheblich erhöhte Flexibilität für die Erkennung der Luciferase-Aktivität im Vergleich mit bisherigen Verfahren bietet.
Einleitung
Die Verwendung von Luciferases als Reporter der Genexpression und Proteinaktivität ist eine populäre Technik in der molekularen und zellulären Biologie Forschung geworden. Dies gilt im circadianen Bereich, wo die Kinetik der Firefly Luciferase Synthese und katalytische Inaktivierung sind besonders gut geeignet zur Berichterstattung der longitudinalen Veränderungen der Genexpression, die über die ca. 24 h circadiane Zyklus auftreten. Als solche wird Luciferase als circadiane Reporter in verschiedensten Organismen, einschließlich Pilze, Pflanzen, fliegen und Säugetiere1,2,3,4eingesetzt.
Wenn zirkadiane Gene Expression in Vitrozu quantifizieren, ist ein Photomultiplier Schlauch (PMT) verbreitet die biolumineszente Signal aufzeichnen. PMT-basierten Messungen haben jedoch eingeschränkt in der Regel auf einer vorher festgelegten Platte oder Schüssel Größe beschränkt. Es ist auch nicht möglich, alle räumlichen Informationen zu sammeln, aus Proben mit einem PMT, die führen kann zu einem Verlust von Informationen beim Proben abbilden, die räumliche Variation in Luciferase Ausdruck zeigen überwacht. Darüber hinaus wie die PMT und zugehörigen Elektronik anfällig für Fehlfunktionen bei der feuchte Umgebung eine Standardzelle Kultur Inkubator ausgesetzt sind, erfolgt längs Luciferase-Aufnahme mit PMTs stets in Inkubatoren nicht befeuchtet. In der Folge Zelle Kultur Gerichte müssen dicht sein Luft-um Feuchtigkeitsverlust durch Verdunstung zu verhindern und die Nährmedien müssen daher mit 3 - gepuffert werden (N- Morpholino) Propanesulfonic Säure (MOPS) oder 4-(2-Hydroxyethyl)-1- Piperazineethanesulfonic Säure (HEPES), anstatt die CO2/bicarbonate Pufferung System, das funktioniert in Vivo und wird routinemäßig in Säugetieren Gewebekultur verwendet.
Aufgrund dieser Beschränkungen schränkt Messung der Biolumineszenz von PMTs in der Regel engen auf die Bedingungen, unter denen Zellen während der Experimente gewahrt sind. Um diese Probleme zu überwinden, und auch zur Erhöhung der Reichweite der experimentellen Bedingungen, verwenden wir einen standard CO2/n2 170 L Gewebekultur-Inkubator, der durch die Zugabe von einem Wasser-gekühlten Elektron-Multiplikation angepasst wurde – Coupled Ladegerät (EMCCD) Kamera mit Antibeschlag-Optik und die digitale Steuerung von Temperatur und Gas. Dies ist eine automatisierte längs Luciferase Imaging Gas- und Temperature-Optimized Recorder oder ALLIGATOR bezeichnet worden. Der ALLIGATOR ermöglicht eine wesentlich höhere Flexibilität der Biolumineszenz imaging, sowohl für Hochdurchsatz-Bildgebung der standard Gewebekultur Platten (bis zu 6 X 96 oder 384-Well-Platten gleichzeitig) und auch für nicht standardmäßige Gewebekultur-Systeme, so als perfundierten Zellen in mikrofluidischen Geräte angebaut. Dieses Instrument ermöglicht auch imaging zu feuchte Bedingungen und Variable Steuerung der CO2 und O2 Partialdruck sowie Temperatur auftreten.
Das folgende Protokoll beschreibt eine Methode für die Biolumineszenz Aufzeichnung von Säugetierzellen und Gewebekultur Systeme mit einem ALLIGATOR (im folgenden als "Biolumineszenz Inkubator" bezeichnet). Es sei jedoch darauf hingewiesen, dass das System gut geeignet zur Biolumineszenz Bildgebung und auch mit einigen Änderungen, Leuchtstofflampen, imaging, in einer Reihe von anderen biologischen Systemen und Kontexte wäre.
Protokoll
(1) Aussaat und Temperatur Mitnahme von Zellen
Hinweis: Dieses Protokoll wurde rigoros getestet mit Primär- und verewigt Maus-Fibroblasten mit dem Ausdruck PERIOD2::LUCIFERASE (PER2::LUC) Fusion Protein4. Anpassungen können für Experimente mit anderen Zelllinien vorgenommen werden müssen.
- Vor Beginn der Zellkultur, legen Sie die folgenden in einem 37 ° C Wasserbad erwärmen: Phosphat-gepufferte Kochsalzlösung (PBS) (pH-Wert 7,4), PBS ergänzt mit 0,68 mM Ethylenediaminetetraacetic Säure, pH 7,2 (PBS + EDTA), entsprechende Zellkulturmedien, z.B. Dulbeccos geändert Eagle Medium (DMEM) mit 10 % fetalen bovine Serum (FBS), 100 U/mL Penicillin und 100 µg/mL Streptomycin und 0,25 % Trypsin Lösung ergänzt.
- Trypsin-1:3 mit vorgewärmten PBS + EDTA Lösung verdünnen und ins Wasserbad.
- Nehmen Sie ein 125 cm2 Fläschchen von Luciferase exprimierenden Zellen, die 70-90 % sind, konfluierende. Aspirieren Sie die Medien. Fügen Sie 10 mL vorgewärmten PBS.
- Aspirieren Sie die PBS. Fügen Sie 2,5 mL vorgewärmten Trypsin-EDTA und den Kolben in einem Inkubator 37 ° C für 5 min zurück.
- Entfernen Sie die Zellen aus dem Inkubator und Ansicht unter dem Mikroskop. Sobald der Großteil der Zellen von der Unterseite des Kolbens getrennt haben, weiterhin die nächste Schritt. Wenn die meisten Zellen nicht auf den Boden des Kolbens wegziehen lassen, zu den Inkubator zurückkehren Sie, bis die meisten Zellen in der Schwebe sind.
- Fügen Sie eine weitere 7,5 mL standard Zellkulturmedium in den Kolben. Entfernen Sie gegebenenfalls 1 mL davon für weitere Passage der Zellen, je nach Bedarf.
- Zählen Sie die Dichte der verbleibenden Zellen mit einem Hemocytometer und Trypan blau. Verdünnen Sie die Zellen weiter, je nach Bedarf für die Zell-Linie.
Hinweis: Für die folgenden Experimente wurden PERIOD2::LUC Fibroblasten zwischen 6 x 103 Zellen/cm2 und 1 x 104 Zellen/cm2 in 96-Well Platten, 35 mm Schalen oder Kanal Folien ausgesät. - Samenzellen auf die Gewebekultur Gerichte oder Platten, die für die Aufnahme verwendet werden.
Hinweis: Schwarze doppelseitig, klar-die Talsohle Platten wird empfohlen dies erlaubt Kultur Gesundheit geprüft werden, bevor Aufzeichnungen beginnen und Interferenzen zwischen Brunnen während der Aufnahme zu verringern. Wo Biolumineszenz extrem niedrig sind, sollten weiße Gerichte/Platten Lichterkennung, maximieren verwendet, obwohl bitte Hinweis, die Phosphoreszenz zu Hintergrundsignal erhöht, die für mehrere Stunden anhält. - Die Platten in den Inkubator zurück und lassen Sie Monolagen, 100 % Zusammenfluss (ca. 7 Tage) zu erreichen.
Hinweis: Sobald konfluierende, Zelllinien, die Kontakt zu hemmen können beibehalten werden bis zu drei Wochen vor dem Experimentieren unter der Voraussetzung, dass die Medien regelmäßig aktualisiert werden (alle 5-7 Tage). - Sobald konfluierende, synchronisieren Sie zellulare Rhythmen mit angewandter Temperaturzyklen (12 h bei 32 ° C, 12 h bei 37 ° C) für ein Minimum von 72 h unmittelbar vor dem Experimentieren5,6 (mit einer vorprogrammierten Radsport Inkubator, gesteuert durch eine Computer verbunden in den Inkubator über eine serielle RS-232-Schnittstelle).
Hinweis: Die Anzahl der Temperaturzyklen erforderlich für die Synchronisierung von zellulären Rhythmen variieren zwischen Zelllinien und kann daher für andere Zelllinien optimiert werden müssen. Akute pharmakologische Stimulation mit Forskolin oder Dexamethason hat auch früher, zellulare Rhythmen7,8zu synchronisieren.
2. NS21-Vorbereitung
Hinweis: NS21 ist eine serumfreien Ergänzung für die Wartung von neuronalen und anderen Zellkulturen. Es ist eine Verfeinerung des ähnlichen Ergänzung bekannt als B27, die im Handel erhältlich und kann als Ersatz für Serum während der circadianen Biolumineszenz Aufnahmen9verwendet werden. Entweder Ergänzung kann in dem Aufnahmemedium für die experimentelle Protokolle beschrieben werden austauschbar. Es ist durchaus möglich und kostengünstig zu NS21 im eigenen Haus, wie Chen Et al. 10, und wie hier beschrieben.
- Equilibrate alle Komponenten, die bei Raumtemperatur 1 Stunde vor Beginn in Tabelle 1 beschrieben.
- Lösen Sie 50 g bovine Albumin in 324 mL basal Medium (z.B. Neurobasal) auf dem Eis. Rühren Sie die Mischung so wenig wie möglich.
- Fügen Sie alle anderen Komponenten, rühren minimal nach jeder Komponente aber gleichzeitig gründliches Mischen. Ziel ist, alle Komponenten innerhalb von 90 Minuten ab aufzulösen.
- Aliquoten die endgültige Mischung und Store bei-20 ° C bis erforderlich. Vermeiden Sie wiederholte Frost-Tau-wechseln.
Hinweis: Die Mischung ist zu zäh, zu diesem Zeitpunkt zu filtern, sondern werden steril gefiltert, wenn mit Medien verdünnt, bevor Sie Zellen hinzufügen.
3. Aufnahme Medien Vorbereitung
Hinweis: Ein Hauptvorteil des Inkubators Biolumineszenz über andere Geräte zur Erfassung von längs-Biolumineszenz ist, dass aufgrund des Seins in der Lage, den Inkubator zu befeuchten und die Partialdrücke der O2 und CO2variieren, es ist möglich ist, verwenden Sie ein breiteres Spektrum von Medien-Bedingungen für die Aufnahme Biolumineszenz – einschließlich der Bedingungen, die ungefähre mehr eng die physiologischen Nische besetzt durch andere Zelle Arten in Vivo. Im folgenden beschreiben wir die Formulierung der Aufnahmemedien adaptiert von Hastings Et al. 9, die wir routinemäßig mit kultivierten Fibroblasten und andere Zelltypen verwendet haben. Die erste ist für versiegelte Kulturbedingungen (ohne Gasaustausch), und die zweite ist für physiologisch relevanten Bedingungen und sollte unter Feuchte Bedingungen mit 5 % CO2verwendet werden.Viele andere Varianten sind möglich und ratsam, abhängig von der genauen Anwendung und Zelltyp.
- MOPS-gepufferte hohe Glukose Medien Vorbereitung
Hinweis: Lager-Lösung (1 L): DMEM Pulver (8,3 g/L), 0,35 mg/mL Natriumbicarbonat, 5 mg/mL Glukose, 0,02 M MOPS, 100 U/mL Penicillin, 100 µg/mL Streptomycin.- Lösen Sie 8,3 g DMEM Pulver 900 mL Reinstwasser in ein 1.000 mL Messzylinder auf und für 30 min. Rühren Sie, bis alle Teilchen gelöst sind.
- 50 mL Glucoselösung (100 g/L), 20 mL MOPS (1 M, pH 7,6), 10 mL 100 x Pen/Strep Lösung hinzufügen und weitere 10 Minuten köcheln.
- 4,7 mL 7,5 % Natriumbicarbonat Lösung hinzufügen und weitere 5 min köcheln.
- Passen Sie den Medien pH 7.6 (bei Raumtemperatur) oder 7,4 (37 ° C) mit HCl/NaOH.
- Fügen Sie Reinstwasser zu einem Endvolumen von 1.000 mL zu produzieren.
- Sterilisieren Sie durch Filtration durch einen 0,22 µm Filter und Speicher bei 4 ° C bis erforderlich.
- Vor dem Experimentieren ergänzen Sie eine entsprechende Volumen der Stammlösung mit 10 % Serum, 2 mM L-Alanyl-L-Glutamin, 2 % NS21 und 1 mM Luciferin, eine funktionierende Lager zu machen. Ein Sterilfilter 0,22 µm durchlaufen Sie dieses Lager.
- Osmolalität der Medien mit einer XR zu messen.
- Schalten Sie die XR.
- Die XR, zuerst mit Reinstwasser zu kalibrieren. Eine Messung Behälterboden 50 µL Wasser hinzufügen. Sicherzustellen Sie, dass keine Luftblasen in der Flüssigkeit. Befestigen Sie das Schiff auf die Sonde. Drücken Sie "Null" und setzen Sie vorsichtig den XR-Arm bis zum tiefsten Punkt. Warten Sie, bis Lesung abgeschlossen ist und grüne 'Ergebnis' leuchtet vor den Arm anheben und entfernen das Schiff.
- Wiederholung der XR auf 300 50er/kg mit 50 µL Kalibrierung Standard zu kalibrieren. Drücken Sie "Cal" vor dem Absenken des Arms.
- Messen der Probe Osmolalität durch Zugabe von 50 µL der Medien an der Unterseite eines Mess Schiff und Maßnahme wie oben beschrieben. Drücken Sie die "Probe" vor dem Absenken des XR-Arms.
- Anpassen der Osmolalität zu 350 50er mit 5 M NaCl.
- HCO3-gepuffert niedrige Glukose Medien (Perfusion Medium) Vorbereitung
Hinweis: Lager-Lösung (1 L): DMEM Pulver (8,3 g/L), Natriumbicarbonat 3,7 mg/mL, 1 mg/mL Glukose, 100 U/mL Penicillin, 100 µg/mL Streptomycin.- Lösen Sie 8,3 g DMEM Pulver 900 mL Reinstwasser in ein 1.000 mL Messzylinder auf und für 30 min. Rühren Sie, bis alle Teilchen gelöst sind.
- 50 mL Glucoselösung (100 g/L), 10 mL 100 X Pen/Strep-Lösung zugeben und weitere 10 Minuten köcheln.
- 49,4 mL 7,5 % Natriumbicarbonat Lösung hinzufügen und weitere 5 min köcheln.
- Passen Sie den Medien pH 7.6 (bei Raumtemperatur) oder 7,4 (37 ° C) mit HCl/NaOH.
- Fügen Sie Reinstwasser zu einem Endvolumen von 1.000 mL geben.
- Übergeben Sie die Lösung durch einen 0,22 µm Sterilfilter und bei 4 ° C bis zur Verwendung.
- Vor dem Experimentieren ergänzen Sie eine entsprechende Volumen der Stammlösung mit 2 % Serum, 2 mM L-Alanyl-L-Glutamin, 2 % NS21 und 1 mM Luciferin, eine funktionierende Lager zu machen. Ein Sterilfilter 0,22 µm durchlaufen Sie dieses Lager.
- Messen und Einstellen der Osmolalität zu 350 50er mit 5 M NaCl für die MOPS-gepufferte Medien.
Hinweis: Luciferin Konzentration sollte für jeden Zelltyp und Zusammenhang empirisch bestimmt werden. Weitere Informationen finden Sie unter Feeney Et al. 11 Serum und NS21 (oder B27 wenn verwendet) Konzentrationen können je nach Anwendung variiert werden. Jedoch empfehlen wir, dass, wenn empirisch getestet, um zu zeigen, ansonsten, Serum und NS21 (oder alternative serumfreien Ergänzung) verwendet werden, da diese Zelle überleben und Anlage fördern. In Zell-Linien, die nicht zu kontaktieren hemmen auch, es kann erforderlich sein, niedrigere Serum-Konzentration in der Aufnahmemedien, verwirrende Effekte der Proliferation, zu verhindern, auch von Serum gefördert wird.
(4) Aufnahme
- Legen Sie vor Beginn der Aufzeichnung die entsprechenden Arbeiten bestand (aus Schritt 3.1 oder 3.2 je nach dem Experiment) im Wasserbad 37 ° C zu erwärmen.
- Während die Medien erwärmt, fokussieren Sie die Kamera in den Inkubator Biolumineszenz.
- Schrauben Sie die wasserundurchlässigen, beheizten Graufilter und beiseite stellen.
- Festlegen der Software um ein Video mit einem hohen Erfassungsrate aufzunehmen. Klicken Sie auf "Übernahme | Übernahme-Setup". Legen Sie "Belichtungszeit" auf 0,2 s und kinetische Zykluszeit auf 0,3 Sekunden. Stellen Sie sicher, dass EM Gewinn ausgeschaltet ist.
- Schließen Sie das Fenster "Übernahme-Setup" und klicken Sie auf "video zu nehmen".
- Mit der Fokussierung Zylinder, drehen Sie das Objektiv der Kamera bis Elemente auf dem Regal auf der Höhe zu erfassenden klar im Fokus im Video sind.
- Stoppen Sie das Video durch Anklicken des Symbols "stop Video".
- Die beheizten Graufilter Schraube wieder in Position; Nichtbeachtung führt zu Schäden EM-CCD-Kamera und/oder Beschlagen des Ziels durch Kondensation.
- Stellen Sie O2, CO2und Temperatur auf die gewünschte experimentellen Bedingungen über das Bedienfeld auf der Vorderseite des Inkubators Biolumineszenz ein
Hinweis: Wenn perfundierten Durchführung Zellkultur fahren Sie direkt mit Abschnitt 5 in diesem Stadium. - Entfernen Sie die Zellen aus der Gewebekultur Inkubator und Absaugen aus den Medien. Ersetzen Sie die Medien mit vorgewärmten arbeiten bestand.
- Wenn die Biolumineszenz Inkubator nicht während des Experiments befeuchtet werden, dann versiegeln der Schalen und Platten mit einer Gas-undurchlässige Dichtung.
Hinweis: Befeuchtung wird erreicht, füllen Sie den Wasserbehälter an der Basis des Inkubators.
- Klicken Sie auf "Übernahme | Übernahme-Setup".
- Legen Sie im Bereich "Kamera-Setup": "Acquisition Mode", "Kinetische"; "Belichtungszeit" bis gewünschte Belichtungszeit Sekunden (siehe Hinweis unten); "Ansammlungen" auf 1; "Kinetic Serie Länge" zum Erwerb Zyklenzahl gewünscht; "Kinetic Zykluszeit" zur gewünschten bildgebenden Intervall (stellen Sie sicher, dass dies größer als die Belichtungszeit ist); "Shift-Geschwindigkeit" zu 4,33 µsecs; 'Gewinnen Sie', 1; und EM gewinnen "auf die gewünschte Ebene (siehe Hinweis unten)
- Im Bereich "Autosave" soll den Dateityp SIF oder TIF. Geben Sie einen Dateinamen und speichern Lage angemessen.
- Legen Sie im Bereich "Spooling" den Dateityp tiff. Geben Sie einen Dateinamen und speichern Lage angemessen. Die Übernahme-Setup-Fenster zu schließen.
Hinweis: Da die Biolumineszenz Inkubator kann, für eine große Anzahl von verschiedenen Zell- und Gewebetypen verwendet werden, die verschiedene Ebenen der Biolumineszenz haben wird, die Belichtungszeit erforderlich, um ein entsprechendes Signal Biolumineszenz sammeln variiert zwischen Experimente. Es ist auch möglich, die Elektron-Multiplikation (EM) Verstärkung von imaging-um das Ausmaß des erfassten Signals erhöhen variieren. Für neue Anwendungen von unbekannten Helligkeit empfehlen wir zuerst unter einem einzigen Bild mit einer relativ kurzen Belichtungszeit (ca. 10 min) ohne EM-Gewinn und anschließend Anpassung der Belichtungszeit und EM gewinnen, bis die gewünschte Aufnahmebedingungen gewesen sein erreicht. In den meisten Fällen ist eine mittlere Signal von 10-20 % der maximal möglichen Pixel Intensität für die Kamera ein gutes Niveau zu streben. Entsprechende Fahrgast-/der Aufnahmeparameter angekommen, beginnen Sie längs Erwerb von Bildern, wie oben beschrieben.
5. perfundierten Gewebekultur (Optional)
Hinweis: Wie in der Einleitung beschrieben, eignet sich der Biolumineszenz-Inkubator für die Darstellung von nicht standardmäßigen Gewebekultur Systeme. Dies ist in der Entwicklung eines Systems zur perfundierten Zellkultur beispielhaft dargestellt.
- Samen der Zellen auf Einkanal gleitet mit Luer-Anschlüsse mit einer Kanaltiefe von 0,6 oder 0,8 mm, in DMEM mit 10 % FBS und Pen/Strep, wie in Abschnitt 1 beschrieben. Die Perfusion Medien zu machen, wie in Schritt 3.2 beschrieben.
- Bereiten Sie vor der Aufnahme, Schläuche für die erforderliche Perfusion System mit 1 mm Innendurchmesser (ID) ETFE-Schlauch und 1 mm I.D. Silikonschlauch, Ellenbogen, männlichen und weiblichen Luer Armaturen, wie in Abbildung 2Agezeigt.
Hinweis: Der Großteil der Länge des Schlauches ist ETFE-Schlauch, mit 2 cm Abschnitte der Silikonschlauch zum Verbinden des ETFE-Schlauch mit Luer-Armaturen, die anschließend in der Kanal-Folien verbinden. - Sterilisieren Sie die Schläuche durch Spülen mit 70 % Ethanol, gefolgt von sterilen PBS.
- Entfernen Sie die Zellkulturen auf Kanal Folien aus dem Inkubator. Aspirieren Sie die Medien und durch vorgewärmte Perfusion Medien ersetzen.
- Füllen Sie eine 20 mL Spritze mit den vorgewärmten Perfusion Medien.
- Verbinden Sie den Schlauch auf den Puffer schieben (siehe Abbildung 2) aber nicht zur Zelle-haltige Folie, und spülen Sie den Schlauch und Folie mit Perfusion Medien (3-5 mL).
- Verbinden Sie die Zelle-haltige Folie und spülen Sie das ganze System mit einem weiteren 1 mL der Medien, um Luftblasen zu entfernen.
- Übertragen Sie das gesamte System auf die Biolumineszenz Inkubator.
- Die Medien-gefüllte Spritzen an der Spritze Pumpe ohne Schlauch trennen und spülen eine weitere 1 mL der Medien durch das gesamte System mit der Pumpe um zu gewährleisten gibt es passen keine Luftblasen im System.
- Geben Sie den Durchmesser an der Pumpe mit der Spritze verwendet wird.
Hinweis: Für die 20 mL Spritzen hier verwendet, ist der Durchmesser 19,13 mm. - Der Volumenstrom der Pumpe bis 50 µL/h eingestellt und laufen zu starten.
- Sicherzustellen Sie, dass keine Luftblasen in Folien oder Schläuche vor Beginn der Aufzeichnung, da diese Luciferase Ausdruck beeinflussen werden, wenn sie über die Zelle Monolage übergeben. Bei Bedarf spülen Sie weitere Medien über die Zellen, dies zu erreichen.
- Die Biolumineszenz Inkubator Tür schließen und weiter wie in Schritt 4.7 mit der Aufnahme beginnen.
6. Behandlung während der Aufnahme
Hinweis: Manchmal ist es wünschenswert, Zellen in der Mitte durch eine Aufnahme zu behandeln es mit pharmakologischen oder hormonellen Mitteln sein. In solchen Fällen ist es unerlässlich, dass die Zellen mit Sorgfalt, um zu verhindern, dass die zelluläre Schwingung von zurücksetzen während der Behandlung behandelt werden. Aus diesem Grund ist es von besonderer Bedeutung, dass die Zellen bei einer konstanten Temperatur eingehalten werden da dies einen großen entraining Cue für zelluläre Tagesrhythmus5,6.
- Bereiten Sie alle Komponenten der Behandlung vor der Aufnahme zu stoppen.
- Bereiten Sie eine chemische Isotherme Pad bei 37 ° C.
- Die Gerät-Aufzeichnung beenden, entfernen Sie die Gerichte behandelt werden und legen Sie auf die isothermen Wärmekissen.
- Behandeln Sie der Kulturen als erforderlich und Rückkehr in den Inkubator Biolumineszenz an der gleichen Stelle wie vor.
- Neustarten der Aufzeichnung.
7. Analyse
Hinweis: Die Biolumineszenz Inkubator produziert Daten in Form von einer Reihe von Einzelbildern.Wir in erster Linie Fidschi12 verwenden, um diese Bilder zu verwalten und exportieren dann die mittlere Intensität Pixeldaten für jede Region of Interest (ROI) für die weitere Analyse.
- Öffnen Sie den Bildstapel in Fidschi und Anpassen von Helligkeit und Kontrast, indem er "Bild | Anpassen | Helligkeit/Kontrast"und Anpassung der gleitenden Bars bis Bilder sind in einem geeigneten Bereich für die Anzeige der biolumineszenten Signals.
- Wählen Sie Bereiche von Interesse mit dem ROI-Manager finden Sie unter "Analyze | Werkzeuge | ROI-Manager".
- Export bedeutet Signal für den ausgewählten Bereich durch Klicken auf "ROI-Manager | Mehr | MultiMeasure".
- Kopieren Sie die resultierenden Daten in Analyse-Software.
- Manuell anpassen die Zeitbasis Daten an das Zeitintervall der Bildgebung (d. h., 15, 30 oder 60 min Abständen, beschrieben als 0.25, 0.5 oder 1 h), anstatt die Bild-Nummer zur Verfügung gestellt von Fidschi.
Hinweis: Weitere Analysen kann nun, wie Festlegung des Zeitraums durchgeführt werden. Hierzu wird die folgende Gleichung verwendet, um nicht-lineare Regressionsanalyse ausführen:

wo y ist das Signal X die entsprechende Zeit, m ist die Steigung der Trendlinie, c ist der y-Achsenabschnitt der Trendlinie, Amplitude ist die Höhe des Peaks der Wellenform über die Trendlinie, k ist die konstante Zerfall oder die Dämpfung (so, dass 1 /k ist die Halbwertszeit), Phase ist die Verschiebung in x der Kosinus Welle und der Zeitraum ist die Zeit für einen kompletten Zyklus13auftreten. 2 -R-Wert dient als Indikator für die Güte der Anpassung. Andere Methoden sind ebenfalls möglich. Die erste 24 h des Erwerbs sollte aus Analyse, zelluläre Bioluminesence vergänglich, nicht zirkadianen Änderungen während dieser Zeit aufweisen kann ausgeschlossen werden. Dies ist das Ergebnis einer akuten Antwort auf Medienwechsel.
Ergebnisse
Dieser Artikel beschreibt ein Protokoll für die Biolumineszenz Bildgebung von Säugerzellen mit einem ALLIGATOR (Biolumineszenz Brutkasten). Diese Technik ermöglicht eine Flexibilität der physische Aufbau und extrazelluläre Bedingungen beim biolumineszente Systeme abbilden. Methoden für einfache statische Gewebekultur (Abbildung 1, ergänzende Video 1) und perfundierten Zellkultur (Abbildung 2, ergänzende Video 2) beschrieben, aber viele andere Setups konnte mit diesem System abgebildet werden. Alle Daten wurden mit Hilfe der in Abschnitt 7 beschriebenen Methoden quantifiziert.
Abbildung 1A zeigt ein Beispiel video von einer Aufnahme von 6 x 96-Well-Platten mit PER2::LUC Fibroblasten4Biolumineszenz. Die Regionen in äußerster Brunnen enthalten keine Zellen, da diese nicht erforderlich für dieses Experiment. Zellen haben Differenztemperatur Entrainment, wobei sie entweder Temperatur-Zyklus von 12 h, bei 32 ° C, gefolgt von 12 h 37 ° C für 72 h oder das Gegenteil (12 h bei 37 ° C, gefolgt von 12 h, bei 32 ° C für 72 h), unterziehen bevor statt bei konstant 37 ° C für die Aufnahme unterzogen. 60 min Aufnahmen wurden stündlich genommen. Zwei von diesen Bedingungen sind in Abbildung 1 bquantifiziert.
Abbildung 2A zeigt eine schematische Darstellung der Einrichtung eines Systems zur perfundierten Gewebekultur. Diese besteht aus zwei Kanal Folien mit Schläuchen verbunden. Medien wird über die Zellen über eine Spritzenpumpe angetrieben. Die erste dieser Folien fungiert als eine durchlässige Blase Gassammelraum (Puffer Folie) und enthält keine Zellen, mit dem zweiten die Zellen auf dem Biolumineszenz aufgenommen. Ein Vertreter Videoaufnahme von diesem System ist in Abb. 2 bdargestellt. 15 min Aufnahmen wurden alle 15 Minuten. Hier werden Zellen gepflegt, standard Perfusion Bedingungen oder im Beisein von Kasein-Kinase-Inhibitor PF670462, das zuvor gezeigt worden ist, zu verlängern zirkadianen Periode und reduzieren die Amplitude der Uhr gen Ausdruck Rhythmen in kultivierten Säugerzellen14. Abbildung 2 (obere Abdeckung) zeigt die Auswirkung auf PER2::LUC Ausdruck gegen Zellen mit der gleichen Konzentration des Arzneimittels unter statischen Standardzelle Kulturbedingungen, dargestellt in Abbildung 2 (Bodenplatte) mit Quantifizierung der Zeitraum behandelt in Abb. 2Ddargestellt. Es ist daraus klar, dass die Behandlung mit PF670462 PER2::LUC Ausdruck unter beide Bedingungen beeinflusst. Während Zellen mit PF670462 behandelt unter perfundierten Bedingungen zeigen Periode Verlängerung von ca. 3 h (3 ±0.9 h), Zellen unter statischen Bedingungen mit dem Medikament behandelt zeigen jedoch deutlich mehr Zeit Verlängerung auf einen Zeitraum von > 48 h. Dies kann durch eine gedämpfte Kosinus, fit sein, wie in Abschnitt 7 beschrieben (zusätzliche Summe der Quadrate F testen im Vergleich zu einer geraden Linie, p < 0,0001). Interessanterweise ist das Ausmaß der Periode Verlängerung unter Perfusion viel näher an, die in Vivo14beobachtet.
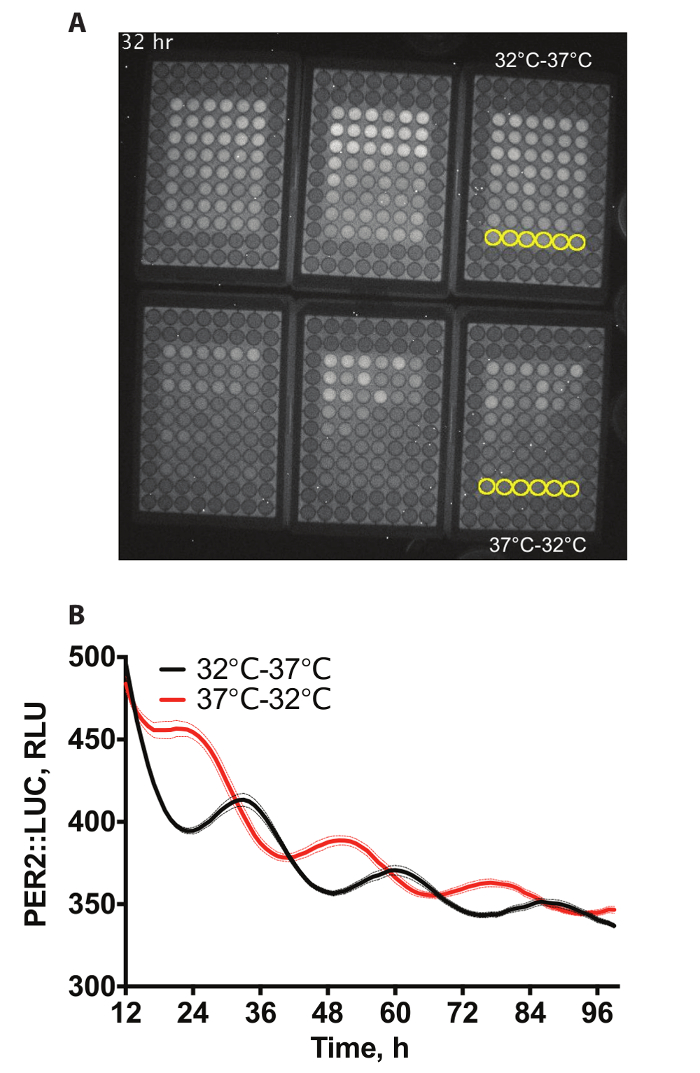
Abbildung 1: Daten Beispiel. (A) Beispiel, das video-Schnappschuss der Biolumineszenz von verewigt PER2::LUC 6 x 96 auch im Inkubator Biolumineszenz Platten. Brunnen zu quantifizierenden wurden in der ergänzenden Video 1gelb hervorgehoben. (B) Quantifizierung der Biolumineszenz von A. Zwei Sätze von 3 Platten Zellen wurden mitgerissen mit Temperaturzyklen (12 h, bei 32 ° C; 12 h bei 37° C), die Anti-phasisch einander gegenüber Phasen der Proteinexpression PER2 produzieren waren (n = 6, bedeuten ± SEM). Bitte klicken Sie hier für eine größere Version dieser Figur.
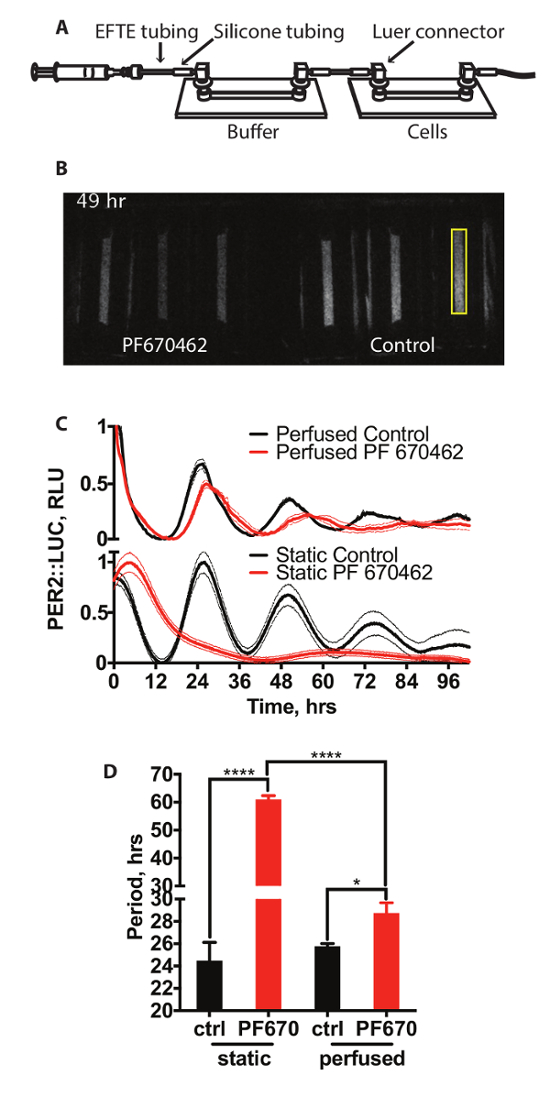
Abbildung 2: Perfusion mit CK1δ Inhibitoren. (A) schematische Darstellung der Perfusion System. (B) Beispiel video-Schnappschuss von einer Biolumineszenz, die Aufnahme von PER2::LUC unter Perfusion Zellen. Ein Probe-Bereich der Quantifizierung ist gelb markiert. (C) Quantifizierung der Biolumineszenz von PER2::LUC Fibroblasten unter Perfusion und unter statischen Bedingungen mit und ohne 3 µM CK1 Inhibitor PF670462 (n = 3, bedeuten ± SEM). Biolumineszenz ist auf minimalen und maximalen Werte normalisiert. (D) Analyse der Periode (Two-Way ANOVA, Holm-Sidak multiple Vergleiche-Test).Bitte klicken Sie hier, um eine größere Version dieser Figur.
| Komponente | Mittlere Endkonzentration (μM) | Lager (mg/mL) | Für 400 mL NS21 |
| Bovine Albumin | 37 | - | 50 g |
| Katalase | 0,01 | - | 50 mg |
| Glutathion | 3.2 | - | 20 mg |
| Insulin | 0,6 | 10 | 8 mL |
| Superoxid-dismutase | 0.077 | - | 50 mg |
| Holo-transferrin | 0,062 | - | 100 mg |
| T3 (Triiodo-L-Thyronine) | 0.0026 | 2 | 20 ΜL |
| L-Carnitin | 12 | - | 40 mg |
| Ethanolamin | 16 | Flüssigkeit (1 g/ml) | 20 ΜL |
| (+) D-Galactose | 83 | - | 300 mg |
| Putrescin | 183 | - | 322 mg |
| Natriumselenit | 0.083 | 1 | 280 ΜL |
| Corticosteron | 0.058 | 2 | 0,2 mL |
| Linolsäure | 3.5 | 100 | 0,2 mL |
| Linolensäure | 3.5 | 100 | 0,2 mL |
| Liponsäure | 0,2 | 4.7 | 0,2 mL |
| Progesteron | 0.02 | 3.2 | 0,04 mL |
| Retinol Acetat | 0,2 | 20 | 0,1 mL |
| Retinol, alle trans | 0,3 | 10 | 0,2 mL |
| D, L-Alpha-Tocopherol | 2.3 | 100 | 0. 2 mL |
| D, L-Alpha-Tocopherol Acetat | 2.1 | 100 | 0,2 mL |
Tabelle 1: NS21 Vorbereitung.
Ergänzende Video 1: Beispielvideo der Biolumineszenz von well-Platten. Beispiel video-Schnappschuss der Biolumineszenz von verewigt PER2::LUC in 6 x 96-well-Platten im Inkubator Biolumineszenz. Brunnen zu quantifizierenden sind gelb markiert. Bitte klicken Sie hier, um diese Datei herunterladen.
Ergänzende Video 2: Beispiel-video-Schnappschuss von einer Biolumineszenz, die Aufnahme von PER2::LUC Zellen unter Perfusion. Ein Probe-Bereich der Quantifizierung ist gelb markiert. Bitte klicken Sie hier, um diese Datei herunterladen.
Diskussion
Das hier beschriebene Protokoll ist für Säugetier-Zellkultur, beide perfundierten und statischen Bedingungen. Der ALLIGATOR kann jedoch leicht auf andere Modellsysteme angepasst. In der Tat hat sich bereits gezeigt, eine hervorragende Plattform bieten für die gleichzeitige Überwachung der Fortbewegung, Schlaf und peripheren gen Ausdruck Rhythmen in Drosophila Melanogaster unter ständige Dunkelheit15. aufrechterhalten Es wird darauf hingewiesen, dass je nach Anwendung, Kamera-Typen als die hier erwähnten geeignet sein können. Wir uns vorstellen, dass mit den entsprechenden Filtern, eine modifizierte Version des aktuellen Setups im Prinzip für die Fluoreszenz-Quantifizierung verwendet werden könnte.
Die einzigen Anwendungen, für die der ALLIGATOR möglicherweise nicht geeignet, sind diejenigen, für die besonders hoher räumlicher Auflösung erforderlich, z. B. Bildgebung der räumlich-zeitliche Organisation der PER2::LUC Ausdruck in den Säugetieren organotypischen Scheiben suprachiasmatischen Kern, oder andere kleine Gewebe-Scheiben.
Der ALLIGATOR ermöglicht viele Experimente durchgeführt werden, die bisher nicht durch konventionelle Aufnahmetechniken leicht erreichbar gewesen. Im Vergleich mit aktuellen Methoden zur Messung der Biolumineszenz, bietet der ALLIGATOR mehr Flexibilität bei der sowohl die Art der Zelle Kulturschale oder Folie, die verwendet werden kann, die externen Medien Bedingungen, Empfindlichkeit und Processivity.
Dies gilt insbesondere in einer Zeit wenn es eine Abkehr von der standard 2D Kultur Zellmodelle in Richtung 3D organoide und Flow-Kultur-Systeme ist. Als solche wird davon ausgegangen, dass der ALLIGATOR eine anpassungsfähige Methode zur Verfügung stellt, mit der Biolumineszenz über viele Tage und Wochen unter den unterschiedlichsten Bedingungen gemessen werden kann.
Offenlegungen
Keine Interessenkonflikte bestehen.
Danksagungen
Wir möchte Cairn-Forschung danken für die Arbeit mit uns dieses System vor allem Mark Henson, Jeremy Graham und Joao Correia zu entwickeln. Wir danken auch David Welsh und Akhilesh Reddy für wertvolle Diskussion während der Entwurfsphase, sowie Peter Laskey (früher von Hamamatsu) für die Vermittlung des Darlehens eines Demo-Kamera und David Wong für seine kritische Eingabe des Manuskriptes.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM (1x) + GlutaMAX | Gibco | 31966-021 | |
| Hyclone FetalClone III Serum | GE Healthcare | SH30109.03 | |
| Neurobasal medium | Thermofisher | 21103049 | basal medium |
| Bovine Serum Albumin | Sigma | A4919 | |
| Catalase | Sigma | C40 | |
| Glutathione | Sigma | G6013 | |
| Insulin | Sigma | I1882 | |
| Superoxide Dismutase | Sigma | S5395 | |
| Holo-transferrin | Calbiochem | 616424 | |
| T3 (triiodo-L-thyronine | Sigma | T6397 | |
| L-Carnitine | Sigma | C7518 | |
| Ethanolamine | Sigma | E9508 | |
| D (+)-Galactose | Sigma | G0625 | |
| Putrescine | Sigma | P5780 | |
| Sodium Selenite | Sigma | S9133 | |
| Corticosterone | Sigma | C2505 | |
| Linoleic Acid | Sigma | L1012 | |
| Linolenic Acid | Sigma | L2376 | |
| Lipoic Acid | Sigma | T1395 | |
| Progesterone | Sigma | P8783 | |
| Retinol Acetate | Sigma | R7882 | |
| Retinol, all trans | Sigma | 95144 | |
| D,L-alpha-Tocopherol | Sigma | 95240 | |
| D,L-alpha-Tocopherol acetate | Sigma | T3001 | |
| Sodium Bicarbonate Solution | Sigma | S8761-100ML | |
| GlutaMAX (100x) | Gibco | 35050-038 | |
| Penicillin-Streptomycin | Sigma | P4333 | |
| Galaxy 170R incubator | Eppendorf | CO17301001 | |
| Luciferin | Biosynth | L-8220 | |
| D -(+)-Glucose solution | Sigma | G8644-100ML | |
| DMEM powder | Sigma | D5030 | |
| MOPS | Sigma | PHG0007 | |
| 1 mm I.D. silicone tubing | GE Healthcare | 19-4692-01 | |
| Elbow luer connector | Ibidi | 10802 | |
| Male luer fittings | Ibidi | 10826 | |
| Female luer fittings | Ibidi | 10825 | |
| µ-slide luer I 0.6 | Ibidi | 80196 | |
| BD plastipak 20ml syringe | Becton Dickinson | 300613 | |
| 1mm I.D. ETFE tubing | GE Healthcare | 18-1142-38 | |
| PF670462 | Sigma | SML0795 | |
| B27 Supplement (50x) | ThermoFisher | 17504044 | |
| iXon Ultra EMCCD camera | Andor | iXon 888 | |
| Fiji | ImageJ | N/A | |
| Prism 7.0 | Graphpad Software | N/A | |
| Trypan blue | Sigma | T8154 | |
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Heated neutral density filter | Cairn Research | Custom item | |
| Osmomat 030 | Gonotech | Discontinued | |
| 300 mOsmol/kg calibration standard | Gonotech | 30.9.0020 | |
| Measuring vessel | Gonotech | 30.9.0010 | |
| Focusing cylinder | Cairn Research | Custom item | |
| NE-1600 programmable syringe pump | Pump Systems inc. | NE-1600 | |
| Andor Solis Software | Andor | N/A |
Referenzen
- Morgan, L. W., Greene, A. V., Bell-Pedersen, D. Circadian and light-induced expression of luciferase in Neurospora crassa. Fungal Genet. and Biol. 38 (3), 327-332 (2003).
- Millar, A. J. A Novel Circadian Phenotype Based on Firefly Luciferase Expression in Transgenic Plants. Plant Cell Online. 4 (9), 1075-1087 (1992).
- Yu, W., Hardin, P. E. Use of Firefly Luciferase Activity Assays to Monitor Circadian Molecular Rhythms In Vivo and In Vitro. Circadian Rhythms: Methods and Protocols. , 465-480 (2007).
- Yoo, S. -. H., et al. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proc Natl Acad Sci. 101 (15), 5339-5346 (2004).
- Buhr, D. E., Yoo, S. -. H., Takahashi, J. S. Temperature as a universal resetting cue for mammalian circadian oscillators. Science. 330 (6002), 379-385 (2010).
- Brown, S. A., Zumbrunn, G., Fleury-Olela, F., Preitner, N., Schibler, U. Rhythms of mammalian body temperature can sustain peripheral circadian clocks. Current Biology. 12 (18), 1574-1583 (2002).
- Balsalobre, A., et al. Resetting of circadian time in peripheral tissues by glucocorticoid signaling. Science. 289 (5488), 2344-2347 (2000).
- Balsalobre, A., Marcacci, L., Schibler, U. Multiple signaling pathways elicit circadian gene expression in cultured Rat-1 fibroblasts. Curr. Biol. CB. 10 (20), 1291-1294 (2000).
- Hastings, M. H., Reddy, A. B., McMahon, D. G., Maywood, E. S. Analysis of circadian mechanisms in the suprachiasmatic nucleus by transgenesis and biolistic transfection. Methods Enzymol. 393, 579-592 (2005).
- Chen, Y., Stevens, B., Chang, J., Milbrandt, J., Ba Barres, ., Hell, J. W. NS21: re-defined and modified supplement B27 for neuronal cultures. J. Neurosci Methods. 171 (2), 239-247 (2008).
- Feeney, K. A., Putker, M., Brancaccio, M., ONeill, J. S. In-depth Characterization of Firefly Luciferase as a Reporter of Circadian Gene Expression in Mammalian Cells. J. Biol. Rhythms. 31 (6), 540-550 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Hirota, T., Lewis, W. G., Liu, A. C., Lee, J. W., Schultz, P. G., Kay, S. A. A chemical biology approach reveals period shortening of the mammalian circadian clock by specific inhibition of GSK-3beta. Proc Natl Acad Sci. 105 (52), 20746-20751 (2008).
- Meng, Q., Maywood, E. S., Bechtold, D. A., Lu, W., Li, J., Gibbs, J. E. Entrainment of disrupted circadian behavior through inhibition of casein kinase 1 ( CK1 ) enzymes. Proc Natl Acad Sci. 1, 1-6 (2010).
- Khabirova, E., Chen, K. -. F., O'Neill, J. S., Crowther, D. C. Flyglow: Single-fly observations of simultaneous molecular and behavioural circadian oscillations in controls and an Alzheimer's model. Sci. Rep. 6, 33759 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten